虾青素对脓毒症小鼠器官功能及炎症因子的影响及作用
2018-01-10张靖垚毕建斌张思敏崔瑞霞西安交通大学第一附属医院肝胆外科外科ICU陕西西安7006
张靖垚,毕建斌,张思敏,崔瑞霞,刘 昌(西安交通大学第一附属医院:. 肝胆外科;2. 外科ICU,陕西西安 7006)
虾青素对脓毒症小鼠器官功能及炎症因子的影响及作用
张靖垚1,2,毕建斌1,张思敏1,崔瑞霞1,刘 昌1,2
(西安交通大学第一附属医院:1. 肝胆外科;2. 外科ICU,陕西西安 710061)
目的观察虾青素(astaxanthin, ASX)预处理对脓毒症小鼠器官功能及死亡率的影响。方法采用小鼠盲肠结扎穿孔(cecal ligation and puncture, CLP)法诱导脓毒症。小鼠按随机数字表法分为空白对照组、脓毒症组(CLP组)及虾青素预处理组[CLP+ASX组,CLP造模前以剂量60 mg/(kg·d)ASX连续灌胃14 d]。观察各组小鼠CLP术后:①72 h(术后每天仍以上述剂量灌胃)的存活率;②24 h统计各组小鼠的临床评分,处死小鼠后取小鼠的血液标本检测血清中谷丙转氨酶(ALT)、血尿素氮(BUN)、肿瘤坏死因子-α(TNF-α)及白介素-6(IL-6)的水平,取小肠、肺脏、肝脏及肾脏组织用以检测各主要脏器的功能及病理变化。结果与CLP组比较,CLP+ASX组小鼠的72 h死亡率显著降低(P=0.020 2)。CLP造模24 h后,CLP+ASX组小鼠的临床评分明显低于CLP组(10.78±0.79vs.13.67±0.44,P=0.005)。通过血清生化指标及组织的病理学分析,CLP+ASX组小鼠的小肠[小鼠肠绒毛的高度:(390.67±14.58)μmvs. (326.67±10.31)μm,P=0.005]、肺脏(肺组织的湿重/干重比:4.75±0.24vs.5.05±0.22,P=0.047 6)、肝脏[血清ALT:(105.0±10.53)U/Lvs. (174.8±9.289)U/L,P=0.000 6]及肾脏组织[BUN:(54.50±3.57)mg/dLvs. (69.17±3.33)mg/dL,P=0.013 2]的功能及病理损伤明显轻于CLP组。同时ASX也可以显著抑制脓毒症时炎症因子TNF-α[(258.06±16.21)pg/mLvs. (538.17±30.80)pg/mL,P<0.000 1]及IL-6[(5.90±0.80)ng/mLvs. (12.56±0.55)ng/mL,P<0.000 1]的释放。结论ASX预处理能够显著降低脓毒症小鼠的死亡率,抑制炎症因子的释放并对重要器官功能具有保护作用。
虾青素;脓毒症;器官功能;炎症因子
脓毒症 (sepsis)是感染引起的宿主反应失调所导致的致命性器官功能障碍,是创伤、烧伤、休克、感染、大手术等临床急危重患者的致死性并发症之一[1]。全世界范围内每年约有一百万脓毒症患者,其死亡率高达25%以上[2]。机体炎症反应失控是脓毒症进展与恶化的主要原因之一[3-4]。目前针对脓毒症的临床治疗策略主要包括抗炎策略和液体管理,然而这些方法的临床效应并未取得突破性的进展,因此寻找新的治疗方法十分重要。虾青素(astaxanthin, ASX),又名虾黄质、龙虾壳色素,属于叶黄素家族,经类胡萝卜素氧化而得到的一种色素。其广泛存在于多种海洋生物中,尤以虾、蟹、鱼、藻体、酵母和鸟类的羽毛中含量为高。近年来,大量基础及临床研究证实ASX具有强大的抗氧化、抗炎、抗癌等活性,在提高机体免疫力,预防肿瘤、心血管疾病、糖尿病等慢性疾病的进展以及延缓衰老等方面均具有良好的作用[5-6]。本研究利用盲肠结扎穿孔(cecal ligation and puncture, CLP)方法制成小鼠的脓毒症模型,观察ASX预处理对脓毒症所致器官功能损害的保护作用及抑制炎症因子释放方面的潜力,以期为脓毒症治疗寻找新的途径。
1 材料与方法
1.1实验动物4~6周龄C57BL/6小鼠,雄性,体质量20~26 g,由西安交通大学医学部实验动物中心提供。
1.2脓毒症小鼠模型的制备按照LILLEY等[7]报道的方法行CLP术,制成腹腔感染所致脓毒症的小鼠模型。术前将小鼠称重,编号,并禁食12 h,自由饮水。小鼠麻醉后固定,消毒,铺无菌巾。沿腹正中线切口,暴露盲肠并于根部结扎,用21号穿刺针贯通穿刺盲肠并挤出少量粪便。将盲肠还纳腹腔,逐层缝合切口,术毕皮下注射1 mL生理盐水,术后自由饮水。
1.3动物分组及给药
1.3.1实验一 将实验小鼠随机分为空白对照组(n=20)、脓毒症组(CLP组,n=20)和虾青素预处理组(CLP+ASX组,n=20)。CLP组在CLP造模前给予小鼠生理盐水30 mg/(kg·d)灌胃,连续14 d;CLP+ASX组在CLP造模前给予小鼠ASX 30 mg/(kg·d)灌胃,连续14 d。术后仍按照上述程序每天灌胃处理,观察各组小鼠72 h生存情况。
1.3.2实验二 将实验小鼠随机分为空白对照组(n=15)、脓毒症组(CLP组,n=15)和虾青素预处理组(CLP+ASX组,n=15)。术前给药时间及剂量同上,术后仍按照上述程序灌胃处理1 d。CLP造模24 h 后对各组小鼠进行临床评分并取血液、小肠、肺脏、肾脏和肝脏组织标本,评估脓毒症的严重程度。
1.4脓毒症小鼠临床得分的评估按照WEBER等[8]报道的方法统计脓毒症小鼠的临床评分。具体如下:a外观:正常(0),缺乏梳理(1),立毛(2),弯腰驼背(3),眼睛半睁至不睁(4);b静息状态行为改变:正常(0),轻微改变(1),孤僻(2),烦躁不安(3);外界刺激行为改变:反应灵敏(0),有反应(1),反应迟钝(2),无反应(3);c临床体征:正常呼吸速率(0),轻微的变化(1),呼吸次数减少与腹式呼吸(2),显著腹式呼吸和发绀(3);d是否脱水:正常(0),脱水(5)。评分越高,小鼠状况越差。
1.5组织病理学观察将切取的部分小肠、肺脏、肾脏和肝脏组织,用40 g/L中性甲醛固定,常规HE染色,光学显微镜下进行病理组织学观察。
1.6炎症相关因子的测定根据 ELISA 检测试剂盒说明书指示,测定血清TNF-α及IL-6含量。

2 结 果
2.1ASX对脓毒症小鼠72h生存率的影响与空白对照组相比,CLP组及CLP+ASX组小鼠经过脓毒症造模后72 h生存率都显著降低,但CLP+ASX组小鼠术后72 h生存率明显高于脓毒症组(P=0.020 2,图1)。
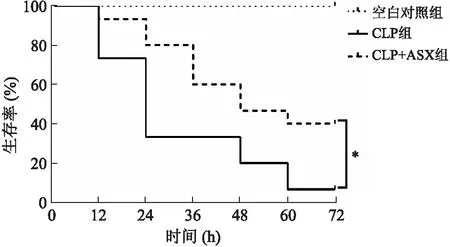
图1ASX预处理对CLP小鼠死亡率的影响
Fig.1 Astaxanthin pretreatment ameliorated mortality of mice with CLP-induced sepsis
使用Kaplan-Meier法进行72 h生存分析。CLP组:脓毒症组;CLP+ASX组:虾青素预处理组。与CLP组比较,*P<0.05。
2.2ASX对脓毒症小鼠临床症状的影响经过CLP造模后,CLP组及CLP+ASX组小鼠均表现出不同程度的精神萎靡、毛发潮湿、立毛、反应迟钝、活动减少、呼吸次数减少、腹式呼吸增多以及不同程度的脱水等临床表现。根据临床评分统计,发现CLP组小鼠术后24 h时的临床评分显著高于CLP+ASX组(图2)。
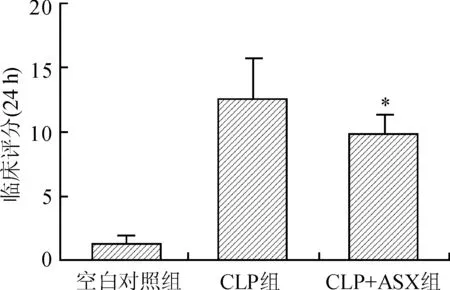
图2ASX预处理对CLP小鼠临床评分的影响
Fig.2 Astaxanthin pretreatment reduced clinical score of mice with CLP-induced sepsis
CLP组:脓毒症组;CLP+ASX组:虾青素组预处理。与CLP组比较,*P<0.05。
2.3ASX对脓毒症小鼠的小肠、肺脏、肝脏及肾脏损伤的影响
2.3.1小肠损伤 小鼠处死后取距离回盲部约5 cm处的末端回肠,去除肠内容物后行HE染色。HE染色结果显示,CLP组小鼠小肠绒毛出现破损明显,上皮部分或者完全脱落,大量炎性细胞聚集;而CLP+ASX组小鼠肠黏膜结构相对完整,少量上皮细胞脱落。在光学显微镜下计量各组小鼠小肠绒毛的长度,发现CLP+ASX组小鼠肠绒毛的高度明显高于CLP组,差异有统计学意义(P=0.005)。说明ASX可以明显保护脓毒症下小肠黏膜的完整性(图3)。
2.3.2肺脏损伤 各组小鼠处死后开胸取左肺,用滤纸吸干,称量湿重,再用60 ℃烘烤24 h后,称量干重,计算肺组织的湿重/干重(W/D)。与空白对照组相比,CLP组小鼠肺组织出现显著出血、充血、水肿及炎性细胞浸润等病理变化,W/D显著升高;而与CLP组比较,CLP+ASX组的W/D则显著降低(P=0.047 6)。各组小鼠肺组织的HE染色可见,空白对照组肺泡组织形态正常;CLP组肺泡及间质组织内可见大量炎性细胞浸润,肺泡内出血,毛细血管淤血及肺实变非常严重;CLP+ASX组也可见少量炎性细胞浸润及肺泡内出血,部分肺泡壁充血、增厚,但肺实变及肺部损伤较CLP组显著减轻(图4)。
2.3.3肝脏损伤 CLP造模后通过内眦静脉取得血液标本。检测血清谷丙转氨酶(ALT)水平,结果显示,CLP造模后ALT水平明显升高,而CLP+ASX组的ALT水平明显低于CLP组。通过HE染色的光学显微镜观察,发现CLP组小鼠的肝组织内可见大量出血,弥漫性分布的空泡变性样肝细胞,肝窦内多发炎症细胞浸润,大量的肝细胞坏死;而CLP+ASX组小鼠的肝组织切片可见少量炎症细胞浸润,未见脓肿和坏死,肝细胞形态基本正常,小叶结构相对完整清晰(图5)。
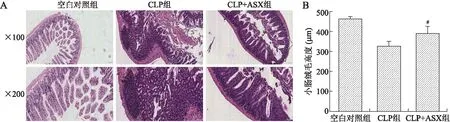
图3ASX预处理对小鼠CLP术后24h小肠损伤的影响
Fig.3 Astaxanthin pretreatment alleviated the intestinal injury at 24 h after CLP
A:各组小鼠的小肠组织病理学改变(HE,×100、×200);B:各组小鼠的小肠组织绒毛高度的比较。CLP组:脓毒症组;CLP+ASX组:虾青素预处理组。与CLP组比较,#P<0.05。
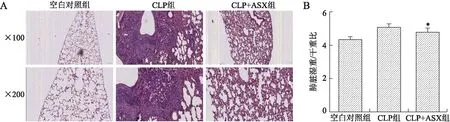
图4ASX预处理对小鼠CLP术后24h肺损伤的影响
Fig.4 Astaxanthin pretreatment alleviated lung injury at 24 h after CLP
A:各组小鼠的肺脏组织病理学改变(HE,×100、×200);B:各组小鼠的肺脏湿重/干重比的比较。CLP组:脓毒症组;CLP+ASX组:虾青素预处理组。与CLP组比较,*P<0.05。

图5ASX预处理对小鼠CLP术后24h肝损伤的影响
Fig.5 Astaxanthin pretreatment alleviated liver injury at 24 h after CLP
A:各组小鼠的肝组织病理学改变(HE,×100、×200);B:各组小鼠的血清ALT水平的比较。CLP组:脓毒症组;CLP+ASX组:虾青素预处理组。与CLP组比较,#P<0.05。
2.3.4肾脏损伤 检测CLP造模后血清中血尿素氮(BUN)水平,结果显示,CLP+ASX组小鼠的BUN水平明显低于CLP组。病理结果显示,空白对照组小鼠的肾组织切片无明显病理改变;CLP组小鼠肾组织中肾小球局灶节段性嗜中性粒细胞浸润,可见球囊扩张,肾小管上皮浊肿、空泡变性;CLP+ASX组小鼠肾小球及肾小管形态大致正常,少量炎性细胞浸润(图6)。
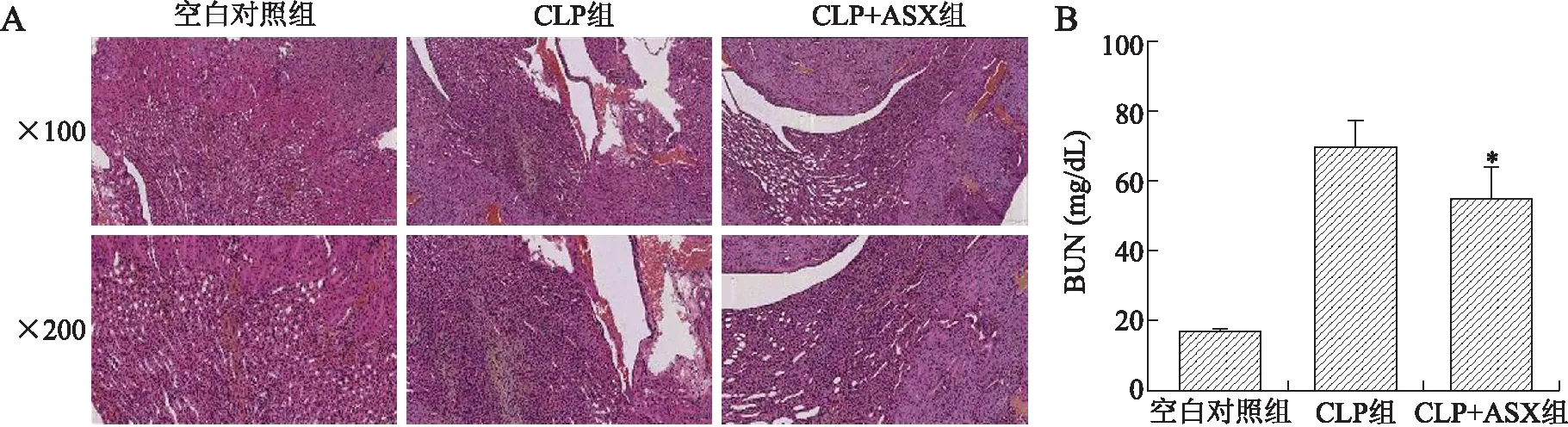
图6ASX预处理对小鼠CLP术后24h肾损伤的影响
Fig.6 Astaxanthin pretreatment alleviated kidney injury at 24 h after CLP
A:各组小鼠的肝组织病理学改变(HE,×100、×200);B:各组小鼠的血清BUN水平的比较。CLP组:脓毒症组;CLP+ASX组:虾青素预处理组。与CLP组比较,*P<0.05。
2.4ASX对脓毒症小鼠的炎症因子水平的影响用ELISA法检测了各组小鼠的肿瘤坏死因子-α(TNF-α)及白介素-6(IL-6)的水平,结果显示,CLP造模后血清中炎症因子的水平均明显升高,相较于CLP组,ASX预处理可以明显减轻炎症因子的释放(图7)。
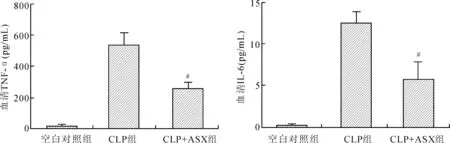
图7ASX预处理对小鼠CLP术后血清TNF-α和IL-6水平的影响
Fig.7 Astaxanthin pretreatment alleviated TNF-α and IL-6 levels in CLP-induced sepsis in mice
CLP组:脓毒症组;CLP+ASX组:虾青素预处理组。与CLP组比较,#P<0.05。
3 讨 论
近年来对脓毒症的认识有了重大突破,脓毒症的理念也已升级至sepsis 3.0,拯救脓毒症的集束化方案也得到不断更新,但其病死率仍居高不下。脓毒症的治疗十分困难,越来越受到基础及临床医学工作者的关注[9]。总的来说,脓毒症的发展与革兰阴性细菌产生的内毒素所启动的炎症反应密切相关[10]。近年来研究显示,脓毒症表现为炎性因子过度表达、分泌失控,导致多器官功能障碍[11]。本课题通过小鼠模型研究,发现ASX可以多方面、多层次保护和改善组织器官功能,抑制炎症反应,有效降低脓毒症小鼠的死亡率。
脓毒症是细菌感染的严重阶段,涉及到多种炎性因子的释放,主要的炎症介质有TNF-α,IL-6、IL-1β等[12]。TNF-α是重要的炎症启动因子和免疫调节因子,在炎症瀑布反应中起核心作用,导致其它炎性介质“瀑布样”级联反应释放,早期可以刺激单核巨噬细胞产生IL-1β、IL-6等炎症因子,晚期则是促进HMGB1等具有放大炎症反应的介质释放。而IL-6是急性期损伤的诱导物,是炎性反应的促发剂,是细胞因子释放第二高潮期中的主要因子[13-14]。从机制上看,TNF-α能促进血小板活化因子释放、生成白三烯和氧自由基、诱导一氧化氮合成,导致组织细胞的水肿、充血、甚至坏死,细胞间紧密连接受损,直接造成组织损伤。另一方面,TNF-α又能刺激单核和巨噬细胞分泌IL-6、IL-8、CRP等炎性介质,以及刺激中性粒细胞脱颗粒,释放各种蛋白酶和其他水解酶及氧自由基、粘附因子、可溶性免疫反应抑制因子等,间接导致组织器官的损伤[15]。本研究结果提示,与空白对照组相比,脓毒症小鼠血清中各种炎性因子水平均显著升高,CLP+ASX组中TNF-α及IL-6的水平均显著降低。表明ASX不仅可以抑制炎症级联反应的上游,也可以抑制其下游,减少对组织有直接损伤作用的炎症因子的释放。
ASX是一种红色天然类胡萝卜素,广泛存在于海产甲壳类动物和鱼类,是一种强抗氧化剂,其清除氧自由基的能力比维生素E高100~500倍,是安全无害的是食品添加剂[16]。研究证实,ASX具有强大的抗氧化、抗炎、抗衰老等作用[17]。裴凌鹏等[18]研究证实虾青素可以通过调节促炎性因子、抗炎因子的释放以及拮抗氧化应激,对脂多糖(LPS)所致的小鼠急性肺损伤产生保护作用。本课题组前期研究亦证实,ASX能通过抑制氧化应激及炎症反应来减轻药物性肝损伤的严重程度[19]。本实验结果显示,通过ASX灌胃预处理可使脓毒症小鼠72 h的死亡率明显降低,表明在内毒素对小鼠机体所致的损害中,ASX可起到保护作用。ASX干预后血液中的炎症因子水平亦显著低于CLP组;而通过对小肠、肺脏、肝脏及肾脏组织的病理学及生化指标检测,也发现ASX可以明显改善脓毒症时的器官功能障碍。这些结果均提示ASX可能通过抑制脓毒症时的炎症反应进而减轻各组织器官的功能损伤。
综上,本实验表明,ASX预处理能明显抑制脓毒症时的炎症反应并改善各组织器官的功能障碍。本实验只是针对脓毒症发生前给予ASX预处理时的器官保护作用进行研究,而关于脓毒症发生后的抢救治疗中的作用未予涉及,这将是下一步的研究方向。
[1] SINGER M, DEUTSCHMAN CS, SEYMOUR CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8):801-810.
[2] RHODES A, EVANS LE, ALHAZZANI W, et al. Surviving sepsis campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016[J]. Intensive Care Med, 2017, 43(3):304-377.
[3] HOTCHKISS RS, MOLDAWER LL, OPAL SM, et al. Sepsis and septic shock[J]. Nat Rev Dis Primers, 2016, 2:16045.
[4] 陈涛,丁岚. 脓毒症炎症调控的研究进展[J]. 实用临床医学, 2015, 16(6):104-107.
[5] AMBATI RR, PHANG SM, RAVI S, et al. Astaxanthin: Sources, extraction, stability, biological activities and its commercial applications—A review[J]. Mar Drugs, 2014, 12(1):128-152.
[6] VISIOLI F, ARTARIA C. Astaxanthin in cardiovascular health and disease: mechanisms of action, therapeutic merits, and knowledge gaps[J]. Food Funct, 2017, 8(1):39-63.
[7] LILLEY E, ARMSTRONG R, CLARK N, et al. Refinement of animal models of sepsis and septic shock[J]. Shock, 2015, 43(4):304-316.
[8] WEBER GF, CHOUSTERMAN BG, HE S, et al.Interleukin-3 amplifies acute inflammation and is a potential therapeutic target in sepsis[J]. Science, 2015, 347(6227):1260-1265.
[9] VINCENT JL.The Clinical Challenge of Sepsis Identification and Monitoring[J]. PLoS Med, 2016, 13(5):e1002022.
[10] STEARNS-KUROSAWA DJ, OSUCHOWSKI MF, VALENTINE C, et al. The pathogenesis of sepsis[J]. Annu Rev Pathol, 2011, 6:19-48.
[11] 屈纪富,梁华平,重庆. 炎症调控与脓毒症研究进展[J]. 创伤外科杂志, 2012, 14(5):459-463.
[12] CHONG DL, SRISKANDAN S. Pro-inflammatory mechanisms in sepsis[J]. Contrib Microbiol, 2011, 17:86-107.
[13] BAGHEL K, SRIVASTAVA RN, CHANDRA A, et al. TNF-α, IL-6, and IL-8 cytokines and their association with TNF-α-308 G/A polymorphism and postoperative sepsis[J]. J Gastrointest Surg, 2014, 18(8):1486-1494.
[14] 张柳,安友仲. 脓毒症的阶段性生物标志物[J]. 中国危重病急救医学, 2011, 23(8):509-512.
[15] 李卫,刘佳,白家媛,等. α肿瘤坏死因子的研究进展[J]. 动物医学进展, 2010, 31(12):108-111.
[16] MERCKE ODEBERG J, LIGNELL A, PETTERSSON A, et al. Oral bioavailability of the antioxidant astaxanthin in humans is enhanced by incorporation of lipid based formulations[J]. Eur J Pharm Sci, 2003, 19(4):299-304.
[17] 邹堂斌,李华文. 虾青素生物活性及作用机制的研究进展[J]. 广东医学院学报, 2014, 32(6):873-875.
[18] 裴凌鹏. 虾青素对脂多糖诱导小鼠急性肺损伤的保护作用[J]. 中国老年学杂志, 2009, 29(8):937-940.
[19] ZHANG J, ZHANG S, BI J, et al. Astaxanthin pretreatment attenuates acetaminophen-induced liver injury in mice[J]. Int Immunopharmacol, 2017, 45:26-33.
Astaxanthinpretreatmentimprovessepsis-inducedorgandysfunctionandinhibitsinflammatoryfactorsreleaseinmice
ZHANG Jing-yao1,2, BI Jian-bin1, ZHANG Si-min1, CUI Rui-xia1, LIU Chang1,2
(1. Department of Hepatobiliary Surgery; 2. Department of SICU,the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
ObjectiveTo investigate the therapeutic role and potential mechanisms of astaxanthin (ASX) pretreatment on cecal ligation and puncture (CLP)-induced sepsis in mice.MethodsSepsis was induced by CLP in male mice, which were then randomly divided into saline control group, sepsis model group (CLP group), and CLP+ASX group (mice
60 mg/(kg·d) ASX dissolved in olive oil via oral gavage for 14 consecutive days before CLP operation). ① The mice were monitored to assess 72-hour survival rate. ② Clinical scores of mice in the three groups were calculated 24 h after CLP to determine the severity of sepsis. Blood samples were collected at 24 h after CLP modeling to determine the serum ALT, BUN, TNF-α and IL-6 levels. The intestine, lung, liver and kidney tissues were collected to assess organ functions and pathological changes.ResultsThe results showed that mice in CLP group had a significantly lower survival rate at 72 h than those in CLP+ASX group (P=0.020 2). CLP+ASX sepsis group had a lower clinical score than CLP sepsis group(10.78±0.79vs. 13.67±0.44,P=0.005). The tissue histopathology and biochemical analysis revealed that ASX markedly alleviated histological examination damage in the intestines [villus height: (390.67±14.58)μmvs. (326.67±10.31)μm,P=0.005], lung (lung wet/dry ratio: 4.75±0.24vs. 5.05±0.22,P=0.047 6), liver [ALT: (105.0±10.53)U/Lvs. (174.8±9.289)U/L,P=0.000 6] and kidney [BUN: (54.50±3.57)mg/dLvs. (69.17±3.33)mg/dL,P=0.013 2] tissues in sepsis. Moreover, significant lower levels of TNF-α [(258.06±16.21)pg/mLvs. (538.17±30.80)pg/mL,P<0.0001] and IL-6 [(5.90±0.80)ng/mLvs. (12.56±0.55)ng/mL,P<0.000 1] were discovered in the CLP+ASX sepsis group in contrast to the CLP sepsis group.ConclusionASX can significantly lower the mortality of mice with CLP-induced sepsis by improving organ functions and inhibiting the release of inflammatory factors.
astaxanthin; sepsis; organ function; inflammatory factor
2017-03-14
2017-07-31
陕西省重点科技创新团队项目(No.2013KCJ-23);国家自然科学基金资助项目(No.81601672);中央高校基本科研业务费专项资金资助项目(No.1191320114)
Supported by the Project of Innovative Research Team for Key Science and Technology in Shaanxi Province (No.2013KCJ-23), the National Natural Science Foundation of China (No.81601672), and the Fundamental Research Funds for the Central Universities (No.1191320114)
刘昌,教授,主任医师. E-mail: liuchangdoctor@163.com
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171219.1932.004.html(2017-12-19)
R631,R365
A
10.7652/jdyxb201801011
(编辑 卓选鹏)
