姜黄油的抗炎镇痛及体外抗氧化活性
2018-01-08卢彩会牟德华
卢彩会,牟德华*
(河北科技大学生物科学与工程学院,河北 石家庄 050000)
姜黄油的抗炎镇痛及体外抗氧化活性
卢彩会,牟德华*
(河北科技大学生物科学与工程学院,河北 石家庄 050000)
目的:探讨姜黄油的抗炎、镇痛及体外抗氧化作用。方法:采用二甲苯致小鼠耳肿胀并用角叉菜胶致小鼠足肿胀,综合评价姜黄油的抗炎效果;对小鼠连续灌胃给药后,观察热板痛阈值及冰醋酸致小鼠的扭体次数来评价其镇痛效果;通过测定清除1,1-二苯基-2-三硝基苯肼自由基、超氧阴离子自由基,总抗氧化能力及对油脂的保护能力,评价姜黄油及姜黄油胃肠消化液的体外抗氧化效果。结果表明:不同剂量的姜黄油表现出不同程度的抗炎、镇痛效果;同时姜黄油及姜黄油的胃肠消化液均具有良好的抗氧化效果,并且与剂量成依赖关系。姜黄油总的抗氧化效果最好,其半最大效应质量浓度为0.75 mg/mL,但经胃肠液消化后的姜黄油的抗氧化效果要高于姜黄油。
姜黄油;抗炎;镇痛;体外抗氧化
姜黄油为姜科属多年生草本植物姜黄的主要成分之一,姜黄油所含成分极其复杂,一般有数十种至数百种组分[1]。主要为萜类化合物、芳香族化合物,如姜黄烯、倍半萜烯、姜黄酮等物质[2]。姜黄油具有抗氧化、抗癌、抗炎、抑菌、止咳等功能[3-4]。Złotek等[5]研究莴苣精油的抗氧化及抗炎镇痛活性,发现其对小鼠具有良好的抗炎镇痛活性,并具有很强的体外抗氧化活性。Monteiro等[6]测定拉皮亚树叶精油的抗氧化及抗炎活性,也证明了精油具有良好的抗炎镇痛及体外抗氧化活性。
姜黄油的主要成分多为倍半萜类物质,并含有大量的酚类物质[7]。对于挥发油的抗氧化活性机理,目前鲜见相关研究,有报道指出,酚类化合物及萜类化合物是植物精油发挥抗氧化活性的主要参与者[8]。权美平等[9]研究茜草精油的抗氧化性发现,茜草精油的抗氧化活性与其所含酚类物质的含量有关,酚类物质含量越高,其抗氧化性能越强。萜类物质也具有显著的体外抗氧化性和抗炎镇痛活性,Sepahvand等[10]发现倍半萜类物质的精油具有良好的抗氧化性能,同时萜类物质能抑制磷脂酶A并阻断花生四烯酸的代谢能力,抑制炎症的发生[11]。
通过对实验室自制姜黄油主要成分进行分析,发现其主要成分为酚类及倍半萜类物质[12]。利用动物实验验证其抗炎镇痛活性,并对姜黄油进行体外模拟消化,检测其体外抗氧化活性,以期为开发姜黄油的生物学活性提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
昆明小鼠,SPF级,体质量22~26 g,雌性,由河北医科大学提供,许可证号SCXK(冀)2013-1-003,实验动物质量合格证号1705021。动物分组分笼饲养于12 h明暗交替的环境中,温度18~21 ℃,相对湿度为(50±5)%,标准饲料喂养,可自由摄食、饮水。
姜黄油为实验室自制。
吲哚美辛、阿司匹林、α-淀粉酶(酶活力≥2 000 U/g)、胃蛋白酶(酶活力≥3 000 U/g)、胰酶(酶活力≥4 000 U/g)、牛胆盐、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、VE 上海宝曼生物科技有限公司;二甲苯、VC、2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT) 天津市永大化学试剂有限公司;冰乙酸、Tris、邻苯三酚、钼酸铵均为分析纯。
1.2 仪器与设备
EPOCH2全波长酶标仪 美国博腾仪器有限公司;7HZ-82A水浴恒温振荡器 常州荣华仪器制造有限公司;Adventurer分析电子天平 美国奥豪斯仪器有限公司;DEL7A320 pH计 上海展仪仪器设备有限公司;YLS-6B智能热板仪 安徽濉溪正华教学实验器械厂;YLS-Q4耳肿打孔器 山东医学科学院设备站。
1.3 方法
1.3.1 样品及模拟消化液的制备
姜黄油制备:采用离子液体[BMIM]PF6酶法辅助提取姜黄油,其中离子液体添加量为18%、纤维素酶添加量1.4%、料液比1∶10(m/V)、酶解温度50 ℃。提取得到的姜黄油为橙黄色透明液体,具有典型的姜黄气味。
模拟唾液制备:溶解2.3 8 g N a2H P O4、0.19 g K2HPO4、8 g NaCl于1 L去离子水中,调节pH值为6.75,加入α-淀粉酶,使其活力为200 U/mL。
模拟胃液制备:将胃蛋白酶加入到电解质(0.33% NaCl、0.11% KCl、0.15% CaCl、0.07% MgCl、0.05% KH2PO4)中,使其活力为300 U/mL。
模拟肠液制备:将胰酶与牛胆盐加入到电解质中,使胰酶活力为200 U/mL,牛胆盐质量浓度为10 mg/mL。
1.3.2 姜黄油、VE胃肠消化液的制备
姜黄油胃消化液的制备:取5.25 g姜黄油加入3 mL模拟唾液和3 mL去离子水,混匀后37 ℃水浴恒温振荡器内消化10 min。5 mol/L HCl溶液调节pH值至1.2,加入9 mL模拟胃液中混匀,在37 ℃水浴恒温振荡器内消化1 h,得到姜黄油胃消化液。
姜黄油胃肠消化液的制备:0.1 mol/L NaHCO3调节pH值至6。取2 mL姜黄油胃消化液,加入9 mL模拟肠液中,以1 mol/L NaOH溶液调节pH值至7,加入3 mL生理盐水,混合均匀,37 ℃水浴恒温振荡器内消化2 h,迅速从摇床中取出并放置在冷水槽内充分冷却,得到姜黄油胃肠消化液。
在姜黄油胃消化液和姜黄油胃肠消化液中添加0.06%的蔗糖甘酯、0.06%单甘酯,并用高速乳化机对其进行乳化,将乳化后的样品置于-20 ℃冰箱内备用。
VE胃消化液和胃肠消化液的制备方法同上。
1.3.3 姜黄油毒性实验
将小鼠随机分为6 组,每组10 只,分别设空白对照组(生理盐水)、姜黄油组(灌胃剂量分别为2.5、5.0、10.0、20.0、40.0 μL/g,以体质量计)。采用灌胃方式给药,每天一次,连续给药5 d,观察小鼠的生命体征。以小鼠状态良好、与空白对照组无差异记为无毒性剂量,由此来确定后续实验中姜黄油灌胃剂量。
1.3.4 姜黄油对小鼠耳肿胀的影响
选昆明小鼠50 只,随机分为5 组,每组10 只。分别设空白对照组(生理盐水)、阳性对照组(0.005 mg/g吲哚美辛)、姜黄油低、中、高剂量组(1.25、2.50、4.00 μL/g)。采用灌胃方式给药,每天一次,连续给药5 d。末次给药40 min后,将50 μL二甲苯均匀涂布在小鼠右耳内外侧,左耳涂以相同体积的蒸馏水作为对照,40 min后脱颈处死小鼠。沿耳廓基线剪下双耳,用直径8 mm的打孔器分别在两耳同一部位打下圆耳片,迅速用分析天平称量耳片质量。小鼠耳廓肿胀度以左、右耳质量的差值表示。耳肿胀抑制率根据式(1)计算。
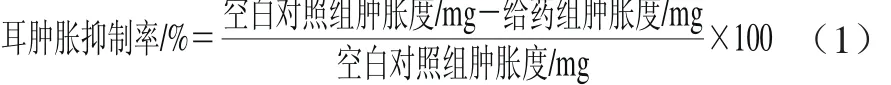
1.3.5 姜黄油对小鼠足趾肿胀及组织中炎症递质的影响
小鼠分组及灌胃方式同1.3.4节。末次给药后1 h,在每只小鼠左后足皮下至踝关节处注射0.01 mL 含0.1%角叉菜胶的生理盐水溶液致炎,致炎后4 h处死小鼠。自踝关节剪下小鼠后足,并迅速称量左、右足质量,小鼠足趾肿胀度以左、右足质量的差值表示。足趾肿胀抑制率根据式(2)计算。

通过测定炎症反应的重要介质——前列腺素E2(prostaglandin E2,PGE2)的含量,反映姜黄油对角叉菜胶所致小鼠肿胀足组织中PGE2释放的影响。将剪下的小鼠足部皮肤划破,浸入2.5 mL生理盐水中并不断振荡。2 h后弃足,将浸泡液于3 000 r/min离心15 min,取上清液0.15 mL,加入0.5 mol/L KOH-甲醇溶液2 mL,50 ℃温浴20 min。加入2.5 mL甲醇,于278 nm波长处测定吸光度,以每克炎性组织相当的吸光度表示PGE2相对含量。
1.3.6 冰醋酸致小鼠扭体实验
小鼠分组及灌胃方式同1.3.4节。其中,阳性对照组以等量阿司匹林代替吲哚美辛。末次给药前12 h禁食,不禁水。末次给药后1 h,以0.1 mL/10 g mb向小鼠腹腔注射0.6%冰醋酸溶液,30 min后采用摄像设备记录小鼠20 min内扭体次数,作为痛反应指标。疼痛抑制率根据式(3)计算。

1.3.7 小鼠热板实验
将小鼠置于热板上,热刺激小鼠足部产生痛反应,即舔足反应,以小鼠出现舔足的时间记为潜伏期。预选50 只在30 s内有舔足反应的小鼠,重复操作2 次,每次间隔5 min。预选50 只小鼠的分组及灌胃方式同1.3.4节。分别在第一次给药前30 min和末次给药前30 min测定小鼠潜伏期,作为小鼠的正常痛阈值,均重复测定3 次,取平均值。测定小鼠在末次给药后0.5、1.0、2.0、3.0 h的潜伏期。若小鼠在60 s内无痛反应,立即取出,按60 s计算。小鼠痛阈提高率根据式(4)计算。

1.3.8 DPPH自由基清除能力测定
将姜黄油、VC、BHT、姜黄油胃消化液、姜黄油胃肠消化液、VE胃消化液、VE胃肠消化液分别稀释成10、20、30、40、50 mg/mL备用。吸取2.00 mL上述待测液于试管中,加入2.00 mL 0.02 mmol/L DPPH溶液,摇匀,室温放置30 min后于517 nm波长处测定吸光度,记为A样品。用2.00 mL 95%乙醇代替上述待测液,测定517 nm波长处吸光度,记为A空白。DPPH自由基清除率根据式(5)计算。

1.3.9 总抗氧化能力测定
将姜黄油、VC、BHT、姜黄油胃消化液、姜黄油胃肠消化液、VE胃消化液、VE胃肠消化液分别稀释成0.5、0.6、0.7、0.8、0.9、1.0 mg/mL备用。取4 mL磷钼试剂(0.6 mol/L硫酸、28 mmol/L磷酸钠、4 mmol/L钼酸铵),加入0.4 mL上述待测液,95 ℃恒温水浴90 min,于695 nm波长处测定吸光度。吸光度越高,其总抗氧化能力越强。
1.3.10 超氧阴离子自由基清除作用测定
将0.05 mol/L Tris-HCl溶液(pH 8.2)预热20 min,分别加入质量浓度为0、10、20、30、40、50 mg/mL的待测样品溶液1 mL,立即加入0.5 mL 3 mmol/L的邻苯三酚溶液,振荡使之充分反应4 min后,1 mL 3 mol/L的HCl溶液终止反应,并于325 nm波长处测定吸光度,记为A样品;用与样品相同质量浓度的HCl溶液代替待测液,记为A空白。超氧阴离子自由基(·)清除率根据式(6)计算。

1.3.11 对食用油脂的抗氧化性测定
取50 g油样放入100 mL烧杯中,敞口放置,各加入不同量的样品溶液(其中姜黄油添加量为0.04%、0.08%、0.10%、0.20%、0.60%、1.00%,VE与BHT的添加量分别0.08%),混合均匀,将油样放入(60.0±0.5)℃恒温箱中强化保存,每隔24 h搅拌一次,并交换其在恒温箱中的位置,每隔1 d测定油样的过氧化值,保存15 d。过氧化值测定参考GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》。
1.4 数据统计分析
用SPSS 17.0软件进行统计分析,组间数据比较采用单因素方差分析(One-way ANOVA),以P<0.05表示差异有统计学意义,结果以±s表示。
2 结果与分析
2.1 姜黄油对二甲苯诱导小鼠耳肿胀的影响

表1 姜黄油对小鼠耳廓肿胀的影响Table 1 Inhibitory effect of turmeric oil on mouse ear swelling
二甲苯通过促进小鼠耳血管扩张和增加血管通透性引起耳肿胀[13]。由表1可知,各组均可见二甲苯致小鼠耳肿胀。灌胃吲哚美辛极显著抑制了二甲苯所致的小鼠耳肿胀(P<0.01),炎症抑制率达到51.02%,与中剂量组小鼠的抑制率相当。高剂量组小鼠对二甲苯致肿胀的抑制率效果最为明显,能够极显著地降低实验组小鼠的右耳肿胀度,抑制率最高为91.84%。二甲苯诱发耳肿胀,可能涉及炎症介质如组胺、5-羟色胺和缓激肽的释放,其中炎性介质是介导炎性反应及产生疼痛的内源性化学物质。姜黄油有较好的抗炎作用,可能是因为姜黄油能够抑制这些炎症介质的释放,进而抑制了由二甲苯引起的小鼠耳肿胀。
2.2 姜黄油对小鼠足趾肿胀及组织中炎症递质的影响

表2 姜黄油对小鼠足趾肿胀的影响Table 2 Inhibitory effect of turmeric oil on mouse paw swelling
由表2可知,吲哚美辛、姜黄油低、中、高剂量组均对小鼠的足趾肿胀度有显著的抑制作用(P<0.05,P<0.01),其中阳性对照组与姜黄油高剂量组对小鼠足趾肿胀度有极显著的抑制作用(P<0.01),足趾肿胀抑制率分别为67.51%和65.02%。据报道,由角叉菜胶引起的水肿形成分为两个阶段:第一阶段为角叉菜胶注射后第一小时,涉及5-羟色胺、组胺和缓激肽的释放;第二阶段为注射2~5 h,水肿增加,涉及PGE2的释放[14],其中PGE2是炎症反应的重要介质。

表3 姜黄油对角叉菜胶致炎小鼠血清及炎性组织中PGE2相对含量的影响Table 3 Effect of turmeric oil on the relative content of PGE2 in serum and inf l ammatory tissue of carrageenan-induced mice
由表3也可以看出,灌胃姜黄油的小鼠足趾中PGE2的相对含量明显降低,并且与姜黄油剂量成正比,中剂量组的小鼠PGE2含量与吲哚美辛效果相同,且致炎足小鼠的PGE2含量要高于未致炎足。
2.3 姜黄油对冰醋酸致小鼠扭体的影响

表4 姜黄油对冰醋酸致小鼠扭体的抑制作用Table 4 Effect of turmeric oil on the number of writhing responses induced by acetic acid in mice
由表4可知,姜黄油各剂量组均对小鼠扭体有明显的抑制作用,可以通过提高小鼠的痛阈,延长小鼠对痛刺激反应的潜伏时间,减少痛刺激引起的扭体次数。其中,中、高剂量组的姜黄油对抑制小鼠扭体具有极显著的抑制作用(P<0.01)。高剂量组小鼠的提高率为62.71%,与阳性对照组的提高率相当。姜黄油对扭体的显著抑制表明其外周介导的止痛活性[15]。同时有研究表明,小鼠卷曲次数的减少,与前列腺素的含量有关,即腹膜液中PGE2和前列腺素F2α水平升高以及脂氧合酶产生的水平。
2.4 姜黄油对热刺激痛的镇痛作用
热板法是用于评估药物或化合物的中枢镇痛作用最常见的热伤害感受模型。药物或化合物对此疼痛模型有影响,表明其具有对中枢作用的抗伤害感受活性[16]。

表5 姜黄油对小鼠热敏感抑制作用Table 5 Inhibitory effect of turmeric oil on heat sensitivity in mice
由表5可以看出,空白对照组小鼠的基础痛阈与其他剂量组的基础痛阈并没有显著性差异(P>0.05)。与空白对照组相比,阳性对照组、姜黄油高剂量组小鼠在连续给药5 d后的舔足反应时间明显延长,且对小鼠痛阈的提高呈时间依赖关系。样品组小鼠对热刺激疼痛实验模型中刺激并不敏感,表明姜黄油的镇痛在外周神经产生作用,而对中枢神经并不敏感[17]。
2.5 姜黄油对DPPH自由基的清除能力

图1 姜黄油对DPPH自由基的清除作用Fig. 1 Scavenging effect of turmeric oil on DPPH radicals
如图1所示,7 种样品对DPPH自由基的清除率都随着样品质量浓度的增加而升高。其中BHT的清除率最高,姜黄油的清除率最低,其中姜黄油对DPPH自由基的清除效果可能主要源于其含有高浓度的萜类物质[18]。但姜黄油胃消化液与VE胃肠消化液在50 mg/mL时的DPPH自由基清除率与VC相近,分别为89.73%和88.76%。姜黄油在分别经胃肠液消化后,对DPPH自由基的清除能力都有所提高,其中姜黄油胃消化液的效果要比姜黄油胃肠消化液要好,可能是因为姜黄油在经胃肠液消化时,经历了pH值从1.2到7.0的剧烈变化,使姜黄油的成分发生了变化,降低了其对DPPH自由基的清除作用[19]。
2.6 姜黄油总抗氧化能力

图2 姜黄油总抗氧化能力Fig. 2 Total antioxidant capacity of turmeric oil
由图2可知,7 种样品随着质量浓度的增加,总抗氧化能力也随之增强。其中总抗氧化性大小顺序为VC>BHT>姜黄油胃肠消化液>姜黄油>姜黄油胃消化液>VE胃肠消化液>VE胃消化液。经消化后的姜黄油胃肠消化液的总抗氧化性高于消化后VE的总抗氧化性,且经肠液消化的效果要比经胃液消化的效果好。
2.7 姜黄油对·的清除作用

图3 姜黄油对O-2•的清除作用Fig. 3 Scavenging effect of turmeric oil on O2-·
2.8 姜黄油对食用油的抗氧化性
油脂的自动氧化是自由基的链式反应,分链引发(诱导期)、链传递和链终止3 个主要阶段进行。在诱导期产生自由基,需要的活化能较高,因此较缓慢,过氧化值变化不明显,诱导期过后,进入链传递阶段,此阶段需要的能量要低得多,同时由于大量游离自由基的存在,使反应迅速加快,过氧化值明显升高[20]。

图4 姜黄油对食用油脂的抗氧化性Fig. 4 Inhibitory effect of turmeric oil on edible oil oxidation
由图4可以看出,姜黄油对大豆油具有抗氧化作用,且在前11 d姜黄油对大豆油的抗氧化能力有一定的剂量效应关系,随着姜黄油加入量的增大,其抑制大豆油生成过氧化物的能力提高,对大豆油的抗氧化作用增强。但当姜黄油添加量增加到1.00%时,对大豆油的抗氧化性却随之降低。其中在前11 d,BHT对大豆油的抗氧化性最高,0.60%姜黄油与VE的效果相近。另外,空白对照处理的诱导期比较短,而其他处理的诱导期比较长,这也进一步说明了姜黄精油具有抗氧化作用。但在11 d后,除BHT、VE和0.6%姜黄油外,其他样品的过氧化值都呈减小的趋势。这可能是在发展的后期,其产生的过氧化物发生了分解,在分解期间油脂氧化速率小于分解速率,导致过氧化值呈下降趋势[21]。
表6 DPPH自由基清除率、总抗氧化能力和·清除率的EC50 Table 6 EC50 of turmeric oil for DPPH and· scavenging and total antioxidant activity

表6 DPPH自由基清除率、总抗氧化能力和·清除率的EC50 Table 6 EC50 of turmeric oil for DPPH and· scavenging and total antioxidant activity
注:—.表示样品EC50在拟合曲线外,没有数值。
胃肠消化液 VE胃消化液 VE胃肠消化液DPPH自由基清除率 5.460±0.031 5.320±0.015 31.500±1.410 9.340±0.034 7.640±0.021 8.170±0.026 9.670±0.042总抗氧化能力 0.250±0.006 0.350±0.002 0.750±0.005 0.750±0.007 0.750±0.001 — 1.000±0.006 O2指标EC50/(mg/mL)VC BHT 姜黄油 姜黄油胃消化液姜黄油-•清除率 66.360±2.010 — — 8.680±0.056 15.330±0.073 8.500±0.023 8.730±0.051
由表6可以看出,姜黄油的总抗氧化性能力的半最大效应质量浓度(concentration for 50% of maximal effect,EC50)为0.750 mg/mL,对•的清除效果最差。BHT对DPPH自由基的清除作用最强,(EC50为5.320 mg/mL);VE胃液对•的清除作用最强(EC50为8.500 mg/mL),其次为姜黄油胃液(EC50为8.680 mg/mL)。
3 讨 论
本实验结果证明,姜黄油能够明显抑制小鼠的耳及足趾肿胀度,中剂量组姜黄油就有极显著的抗炎活性;同时能够减少小鼠因冰醋酸所致扭体次数,延长小鼠在热板上的时间,中、高剂量的姜黄油具有极显著的镇痛活性。同时姜黄油具有良好的体外抗氧化活性,其中姜黄油的总抗氧化效果最好,且经胃肠液消化后的姜黄油抗氧化效果要明显高于未经消化的姜黄油。可能是由于经消化后的姜黄油释放的酚类及萜类物质含量增加,增强了姜黄油的抗氧化效果。
Avanço等[22]测定姜黄油的主要成分,检测了姜黄油的体外抗氧化性,发现其对2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸自由基、DPPH自由基具有很好的清除效果。魏娟等[23]也证明了姜黄油具有良好的体外抗氧化活性,并且在细胞内也具有良好的抗氧化效果。Lantz等[24]证明了姜黄油具有明显的抗炎镇痛活性,能够抑制PGE2的活性,抑制环氧化酶-2的表达。
姜黄油的抗氧化和抗炎作用,一般是通过淬灭自由基增加抗氧化防御力或抑制促炎介质的释放。Chou等[25]发现香草根精油的抗炎活性与抗氧化活性的相关性,与其脂多糖降低超氧化物和丙二醛的水平有关。精油能显著调节基因的表达和改变信号传导途径,影响了炎症和抗氧化过程中信号的传导[26]。姜黄油的抗炎镇痛及抗氧化性主要归因于其主要成分和其各成分的协同作用。Park等[27]发现芳姜黄酮能显著抑制MMP-9、一氧化氮合酶和环氧化酶-2的表达和活化,还降低了细胞中肿瘤坏死因子-α、白细胞介素-1β、白介素-6和单核细胞趋化蛋白-1的产生;并且芳姜黄酮还能显著抑制活性氧簇的产生。Lee等[28]也发现了姜黄油中的倍半萜类物质,尤其是芳姜黄酮能够抑制PGE2的产生,产生抗炎镇痛的效果。
[1] MONTON C, CHAROENCHAI L, SUKSAEREE J, et al. Quantitation of curcuminoid contents, dissolution prof i le, and volatile oil content of turmeric capsules produced at some secondary government hospitals[J]. Journal of Food and Drug Analysis, 2016, 24(3): 493-499.DOI:10.1016/j.jfda.2016.01.007.
[2] GOUNDER D K, LINGAMALLU J. Comparison of chemical composition and antioxidant potential of volatile oil from fresh, dried and cured turmeric (Curcuma longa) rhizomes[J]. Industrial Crops and Products, 2012, 38: 124-131. DOI:10.1016/j.indcrop.2012.01.014.
[3] CARVALHO P I N, OSORIO-TOBÓN J F, ROSTAGNO M A, et al.Techno-economic evaluation of the extraction of turmeric (Curcuma longa L.) oil and ar-turmerone using supercritical carbon dioxide[J].The Journal of Supercritical Fluids, 2015, 105: 44-54. DOI:10.1016/j.supf l u.2015.03.020.
[4] LERTSUTTHIWONG P, NOOMUN K, JONGAROONNGAMSANG N, et al. Preparation of alginate nanocapsules containing turmeric oil[J]. Carbohydrate Polymers, 2008, 74(2): 209-214. DOI:10.1016/j.carbpol.2008.02.009.
[5] ZłOTEK U, MICHALAK-MAJEWSKA M, SZYMANOWSKA U.Effect of jasmonic acid elicitation on the yield, chemical composition,and antioxidant and anti-inflammatory properties of essential oil of lettuce leaf basil (Ocimum basilicum L.)[J]. Food Chemistry, 2016,213: 1-7. DOI:10.1016/j.foodchem.2016.06.052.
[6] MONTEIRO M V B, DE MELO LEITE A K R, BERTINI L M,et al. Topical anti-inflammatory, gastroprotective and antioxidant effects of the essential oil of Lippia sidoides Cham. leaves[J]. Journal of Ethnopharmacology, 2007, 111(2): 378-382. DOI:10.1016/j.jep.2006.11.036.
[7] CARVALHO P I N, OSORIO-TOBON J F, ROSTAGNO M A, et al.Techno-economic evaluation of the extraction of turmeric (Curcuma longa L.) oil and ar-turmerone using supercritical carbon dioxide[J].The Journal of Supercritical Fluids, 2015, 105: 44-54. DOI:10.1016/j.supf l u.2015.03.020.
[8] 赵晨. 植物挥发油抗氧化活性的研究[J]. 中国调味品, 2008, 33(11):40-43. DOI:10.3969/j.issn.1000-9973.2008.11.007.
[9] 权美平, 郑翠平, 马婷婷, 等. 茜草精油抗氧化及抗癌活性研究[J]. 中国粮油学报, 2016, 31(4): 89-93; 99. DOI:10.3969/j.issn.1003-0174.2016.04.018.
[10] SEPAHVAND R, DELFAN B, GHANBARZADEH S, et al.Chemical composition, antioxidant activity and antibacterial effect of essential oil of the aerial parts of Salvia sclareoides[J]. Asian Pacif i c Journal of Tropical Medicine, 2014, 7: 491-496. DOI:10.1016/S1995-7645(14)60280-7.
[11] POPOOLA T D, AWODELE O, OMISANYA A, et al. Three indigenous plants used in anti-cancer remedies, Garcinia kola Heckel(stem bark), Uvaria chamae P. Beauv. (root) and Olax subscorpioidea Oliv. (root) show analgesic and anti-inf l ammatory activities in animal models[J]. Journal of Ethnopharmacology, 2016, 194: 440-449.DOI:10.1016/j.jep.2016.09.046.
[12] 卢彩会, 牟德华. 离子液体[BMIM]PF6酶法辅助提取姜黄挥发油工艺优化及成分分析[J]. 食品科学, 2017, 38(10): 264-271.DOI:10.7506/spkx1002-6630-201710043.
[13] CARLSON R P, CHANG J, LEWIS A J. Modulation of mouse ear edema by cyclooxygenase and lipoxygenase inhibitors and other pharmacologic agents[J]. Agents and Actions, 1985, 17(2): 197-204.DOI:10.1007/BF01966592.
[14] LAJILI S, AZOUAOU S A, TURKI M, et al. Anti-inflammatory,analgesic activities and gastro-protective effects of the phenolic contents of the red alga, Laurencia obtusa[J]. European Journal of Integrative Medicine, 2016, 8(3): 298-306. DOI:10.1016/j.eujim.2015.12.006.
[15] ZAKARIA Z A, GHANI Z D F A, NOR R N S R M, et al.Antinociceptive, anti-inflammatory, and antipyretic properties of an aqueous extract of Dicranopteris linearis, leaves in experimental animal models[J]. Journal of Natural Medicines, 2008, 62(2): 179-187.DOI:10.1007/s11418-007-0224-x.
[16] HASSAN F I, ZEZI A U, YARO A H, et al. Analgesic, antiinflammatory and antipyretic activities of the methanol leaf extract of Dalbergia saxatilis Hook. F in rats and mice[J].Journal of Ethnopharmacology, 2015, 166: 74-78. DOI:10.1016/j.jep.2015.03.007.
[17] 邓琪, 黄美景, 郭丽冰, 等. 三丫苦抗炎镇痛作用及机制研究[J]. 中国实验方剂学杂志, 2011, 17(4): 125-128. DOI:10.3969/j.issn.1005-9903.2011.04.038.
[18] DE LIMA V T, VIEIRA M C, KASSUVA C A L, et al. Chemical composition and free radical-scavenging, anticancer and antiinflammatory activities of the essential oil from Ocimum kilimandscharicum[J]. Phytomedicine, 2014, 21(11): 1298-1302.DOI:10.1016/j.phymed.2014.07.004.
[19] 彭梦雪, 从彦丽, 刘冬. 模拟胃肠消化评价苹果多酚, 黄酮及抗氧化活性的相关性[J]. 现代食品科技, 2016, 32(1): 122-128; 296.DOI:10.13982/j.mfst.1673-9078.2016.1.020.
[20] 魏文毅, 牛广财, 崔素萍, 等. 大蒜精油和姜精油对大豆油的抗氧化活性研究[J]. 中国食品添加剂, 2011(1): 105-109. DOI:10.3969/j.issn.1006-2513.2011.01.014.
[21] 周彤, 郑为完, 石燕, 等. 西藏酥油及其粉末油脂在贮存期间过氧化值的变化[J]. 食品研究与开发, 2010, 31(2): 177-180. DOI:10.3969/j.issn.1005-6521.2010.02.051.
[22] AVANÇO G B, FERREIRA F D, BOMFIM N S, et al. Curcuma longa L.essential oil composition, antioxidant effect, and effect on Fusarium verticillioides and fumonisin production[J]. Food Control, 2017, 73:806-813. DOI:10.1016/j.foodcont.2016.09.032.
[23] 魏娟, 苏海兰, 张溪桐, 等. 姜黄精油的抗氧化活性研究[J].食品工业科技, 2016, 37(10): 141-144; 149. DOI:10.13386/j.issn1002-0306.2016.10.019.
[24] LANTZ R C, CHEN G J, SOLYOM A M, et al. The effect of turmeric extracts on inflammatory mediator production[J]. Phytomedicine,2005, 12(6/7): 445-452. DOI:10.1016/j.phymed.2003.12.011.
[25] CHOU S T, LAI C P, LIN C C, et al. Study of the chemical composition, antioxidant activity and anti-inflammatory activity of essential oil from Vetiveria zizanioides[J]. Food Chemistry, 2012,134(1): 262-268. DOI:10.1016/j.foodchem.2012.02.131.
[26] HAN X, PARKER T L. Anti-inflammatory, tissue remodeling,immunomodulatory, and anticancer activities of oregano (Origanum vulgare) essential oil in a human skin disease model[J]. Biochimie Open, 2017, 4: 73-77. DOI:10.1016/j.biopen.2017.02.005.
[27] PARK S Y, JIN M L, KIM Y H, et al. Anti-inf l ammatory effects of aromatic-turmerone through blocking of NF-κB, JNK, and p38 MAPK signaling pathways in amyloid β-stimulated microglia[J]. International Immunopharmacology, 2012, 14(1): 13-20. DOI:10.1016/j.intimp.2012.06.003.
[28] LEE S K, HONG C H, HUH S K, et al. Suppressive effect of natural sesquiterpenoids on inducible cyclooxygenase (COX-2) and nitric oxide synthase (iNOS) activity in mouse macrophage cells[J]. Journal of Environmental Pathology, Toxicology and Oncology, 2002, 21(2):141-148. DOI:10.3346/jkms.2002.17.1.141.
Antiinf l ammatory, Analgesic and in Vitro Antioxidant Activities of Turmeric Oil
LU Caihui, MOU Dehua*
(College of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang 050000, China)
Objective: To investigate the antiinf l ammatory, analgesic and in vitro antioxidant effects of turmeric oil. Methods:Xylene-induced mouse ear swelling and carrageenan-induced mouse paw swelling tests were used to comprehensively evaluate the antiinflammatory effect. The analgesic effect of continuous intragastric administration of turmeric oil was evaluated by hot plate pain threshold and the number of writhing responses induced by acetic acid. The in vitro antioxidant activity was investigated by determining the scavenging capacity against 1,1-diphenyl-2-picrylhydrazyl (DPPH) and superoxide anion free radicals, total antioxidant capacity and inhibitory effect on lipid peroxidation. Results: Turmeric oil at different doses showed different antiinf l ammatory and analgesic effects. At the same time, both gastrointestinally digested and native turmeric oil had good antioxidant effect in a dose-dependent manner. Total antioxidant capacity of turmeric oil was better with a half maximal effect (EC50) of 0.75 mg/mL. Overall, however, the antioxidant effect of gastrointestinally digested turmeric oil was better than that of its untreated counterpart.
turmeric oil; antiinf l ammatory activity; analgesic activity; in vitro antioxidant activity
10.7506/spkx1002-6630-201801037
TS201.4
A
1002-6630(2018)01-0243-07
卢彩会, 牟德华. 姜黄油的抗炎镇痛及体外抗氧化活性[J]. 食品科学, 2018, 39(1): 243-249.
10.7506/spkx1002-6630-201801037. http://www.spkx.net.cn
LU Caihui, MOU Dehua. Antiinf l ammatory, analgesic and in vitro antioxidant activities of turmeric oil[J]. Food Science,2018, 39(1): 243-249. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801037. http://www.spkx.net.cn
2017-06-30
卢彩会(1992—),女,硕士研究生,研究方向为农产品加工。E-mail:2269984137@qq.com
*通信作者简介:牟德华(1960—),男,教授,学士,研究方向为农产品加工。E-mail:dh_mou@163.com
