1株黑曲霉固态发酵豆渣生产纤维素酶及淀粉酶工艺的优化
2018-01-06高大响黄小忠
高大响+黄小忠
摘要: 以豆渣为主要原料,利用黑曲霉为产酶菌株,在29 ℃下,通过固态发酵法生产纤维素酶和淀粉酶。单因子和正交试验结果表明,产纤维素酶的最佳条件为:15 g干豆渣、含水量55%、黑曲霉接种量1.7 mL、培养时间84 h;产淀粉酶的最佳条件为:15 g干豆渣、含水量60%、黑曲霉接种量1.5 mL、培养时间60 h。在此条件下,纤维素酶活力达 475 U/g,淀粉酶活力为198 U/g。说明利用黑曲霉对豆渣进行固体发酵产酶是可行的,具有良好的应用前景。
关键词: 豆渣;黑曲霉;固态发酵;纤维素酶;淀粉酶;工艺优化
中图分类号: S188+.4 文献标志码: A
文章编号:1002-1302(2017)22-0218-03
豆渣是大豆制品加工中的副产物,主要成分是纤维素和蛋白质,还含有维生素以及钙、镁、钾、铁等矿物质,其口感粗糙,有豆腥味。国外多采用酶解法处理豆渣,直接用微生物发酵法处理豆渣的研究较少。国内多利用微生物发酵豆渣来生产糖化菌粉、核黄素[1]和蛋白酶[2],利用微生物发酵豆渣来生产纤维素酶和淀粉酶的研究尚未见报道。
纤维素酶是开发纤维素转变成能源和其他资源的一种高效、安全的生物方法,其生产方法有液体发酵法和固体发酵法[3]。纤维素酶生产菌多为木霉、曲霉及少数细菌,木霉是目前公认较好的纤维素酶生产菌[4]。淀粉酶广泛用于食品、纺织、造纸及医药等方面,主要产酶菌株为杆菌、黑曲霉和米曲霉[5]。本试验利用1株黑曲霉固态发酵豆渣生产纤维素酶和淀粉酶,以实现资源的有效利用。
1 材料与方法
1.1 试验材料
菌种为黑曲霉(Aspergillus niger),由笔者所在实验室筛选和保存。
豆渣,市售。
培养基:(1)斜面培养基为PDA培养基,配方为300 g马铃薯、20 g 葡萄糖、20 g琼脂、1 000 mL自来水,pH值自然;(2)固态发酵培养基,配方为适量干豆渣、2 g玉米秸秆粉、2 g麸皮、0.1 g(NH4)2SO4、0.1 mL 吐温-80、适量水,pH值自然。
1.2 试验方法
1.2.1 孢子悬浮液的制备
将保存的黑曲霉菌种接至PDA培养基上,置于30 ℃恒温培养箱内培养4 d得到成熟的孢子,加入已灭菌的去离子水,用接种环刮下孢子,倒入已灭菌的装有玻璃珠(直径3 mm,5~6粒)的三角瓶中,于 180 r/min 下振荡5~10 min得孢子悬浮液,用去离子水将其D560 nm调至0.1(孢子悬浮液浓度约为1×106个/mL)备用[6]。所有操作均在无菌操作台内进行。
1.2.2 固态培养物的制备
在250 mL锥形瓶中装入固态发酵培养基,121 ℃灭菌30 min,冷却后接入孢子悬浮液,用无菌玻璃棒打碎并搅拌均匀,于29 ℃恒温培养,培养期每天翻曲1~2次。
1.2.3 粗酶液制备
参照文献[7]制备粗酶液,并略作改动。取5 g固态培养物于三角瓶中,加入50 mL蒸馏水,在 40 ℃ 水浴中浸提1 h。然后用脱脂棉过滤,滤液即为粗酶液,4 ℃保存,24 h内使用。
1.2.4 纤维素酶活力测定
滤纸酶活力测定方法参照文献[8],并略有改动。取0.2 mL粗酶液,加入1.8 mL 0.1 mol/L、pH值为4.8的醋酸缓冲液,水浴至50 ℃,加入 50 mg(1 cm×6 cm)新华滤纸条,保温60 min,以不加底物为对照。加入1.5 mL 3,5-二硝基水杨酸试剂(DNS试剂),沸水浴5 min,冷却,用蒸馏水定容至25 mL,测定其D520 nm。
纤维素酶活力定义:在50 ℃、pH值为4.8时,1 min水解滤纸释放1 μmol葡萄糖所需的酶量为1个酶活力单位,以 1 g 固体培养物所含的酶活力单位(U/g)表示。
1.2.5 淀粉酶活力测定
采用DNS法[9]测定淀粉酶的活力。淀粉酶活力定义:在60 ℃下,5 min内降解1 mg/mL可溶性淀粉溶液生成1 μmol还原糖(以葡萄糖计)所需的酶量为1个酶活单位,以1 g固体培养物所含的酶活力单位(U/g)表示。
1.2.6 正交试验设计
在单因素试验基础上,选用L9(34)正交试验表确定最优产酶条件。
2 结果与分析
2.1 葡萄糖标准曲线
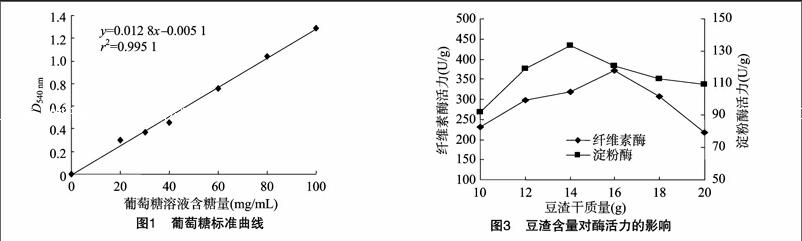
如图1所示,以标准葡萄糖溶液含糖量为横坐标,D540 nm为纵坐标,经统计分析得线性回归方程为y=0.012 8x-0.005 1,r2=0.995 1。曲线线性良好,可信度较高。
2.2 单因子对固态发酵豆渣产酶的影响
2.2.1 培养温度对产酶的影响
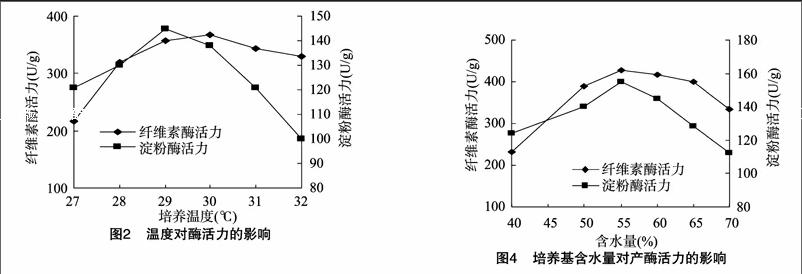
对固体发酵而言,培养温度是首要因素。固态发酵培养基中加入14 g粉碎的干豆渣,调节含水量为50%,接入1 mL孢子悬浮液,分别于27、28、29、30、31、32 ℃下培养60 h。由图2可知,在29 ℃时淀粉酶活力最高,在30 ℃时纤维素酶活力最高,综合考虑确定培养温度为29 ℃。
2.2.2 豆渣干质量对产酶的影响
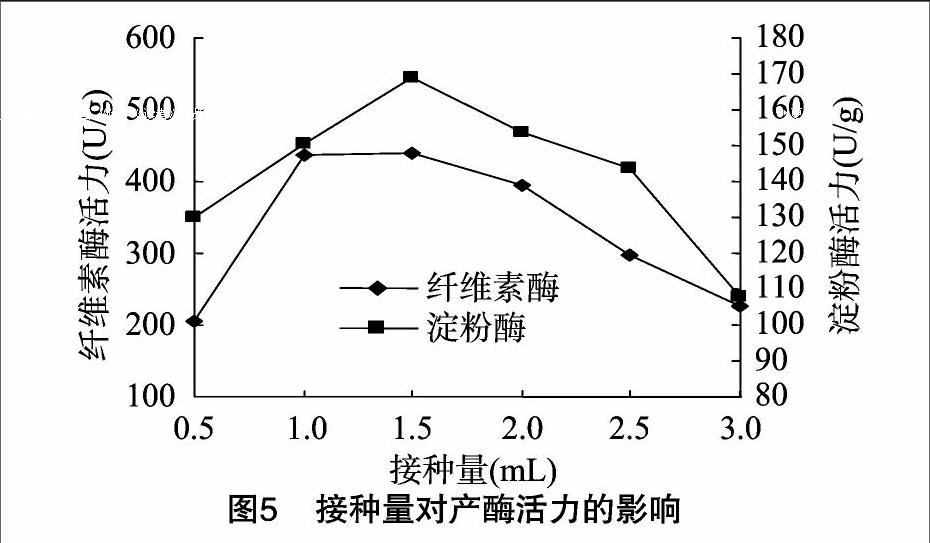
分别称取10、12、14、16、18、20 g粉碎的干豆渣,加入到固态发酵培养基中,调节含水量为50%,接入1 mL孢子悬浮液,29 ℃条件下培养60 h。由图3可知,纤维素酶和淀粉酶的活力均随豆渣干质量的增加而增大。当豆渣干质量为14 g时,淀粉酶活力最大,为 133 U/g;豆渣干质量为16 g时,纤维素酶活力最大,为 370 U/g,表明适当增加豆渣干质量有利于酶活力的提高。可能因为豆渣中含有蛋白质、多种微量元素和矿物质等营养成分供菌种利用产酶,其中含量占干物质总量一半以上的纤维素对纤维素酶的产生具有诱导作用,使纤维素酶大量生成,含量较高的矿物质(钙、镁、钾等)和维生素有利于淀粉酶的积累[10]。之后豆渣干質量增加,纤维素酶和淀粉酶的活力均随之下降。酶活力下降的原因可能是豆渣干质量过高,培养基中含水量不足,影响产酶效果。固体培养基中添加了少量的麸皮,麸皮中含有促进微生物生长的营养因子,有利于初始阶段菌株对碳源的有效利用,能够提高酶活力[11]。endprint
2.2.3 培養基初始含水量对产酶的影响
在固态发酵培养中,培养基的含水量对菌体生长和产酶极其重要,控制好培养基含水量是发酵过程的重要环节[12]。分别在含15 g干豆渣、接种量为1 mL的固体发酵培养基中加入去离子水,使其含水量分别为40%、50%、55%、60%、65%、70%,29 ℃下培养 60 h。由图4可知,当培养基中含水量上升时, 2个酶活力均
随之升高。当含水量为55%时,纤维素酶和淀粉酶的活力均达到最大值,分别为426、155 U/g。培养基含水过多时,两者酶活力随着含水量的增加而减少。培养基含水量过低,无法满足微生物生长对水分的需要,同时随着培养时间的延长,培养基的水分会减少,从而影响微生物的生长及产酶情况;而含水量太高,培养基松散性和透气性变差,也影响了微生物的生长和产酶情况[13]。因此,选择培养基含水量为55%时为最佳的培养条件。
2.2.4 接种量对产酶的影响
分别在含15 g干豆渣的固体发酵培养基中接入0.5、1.0、1.5、2.0、2.5、3.0 mL孢子悬液,在含水量为55%、29 ℃条件下培养60 h。由图5知,开始时接种量较小,纤维素酶和淀粉酶的活力随接种量的增加而增加;当接种量达到1.5 mL时,淀粉酶和纤维素酶的活力均最高;之后酶活力随接种量的增加而下降。
接种量过小,菌体生长较弱,发酵周期延长,影响产酶;接种量过大,菌体生长较快,营养消耗过度,产酶期营养供应不足。另外,菌体大量生长造成供氧不足,产热多,曲内温度升高,从而进一步影响菌丝的生长和酶的产生[14]。综合考虑,选择接种量为1.5 mL时为最佳的接种条件。
2.2.5 培养时间对产酶的影响
培养基加入15 g干豆渣,含水量为55%,接种量为1.5 mL,在29 ℃条件下分别发酵36、48、60、72、84、96 h。由图6可知,培养36 h时,纤维素酶和淀粉酶已经产生,此时黑曲霉处于缓慢增长阶段,固体培养基的内部和表面有少量的白色菌丝形成;36~60 h是纤维素酶和淀粉酶快速形成时期,酶活力较高。淀粉酶活力在72 h时达到最大,为188 U/g。而纤维素酶活力在84 h时达到 462 U/g,以后继续增加但增加量不大。由于60 h淀粉酶活力达到最大以后快速下降,而纤维素酶活力在84 h时继续缓慢增加。因此,应根据不同产酶目的,选取适宜的培养时间。
2.3 最优产酶条件的确定
在单因素试验基础上,选用豆渣含量、黑曲霉接种量、培养基含水量、培养时间进行正交试验。采用L9(34)正交试验确定最优产酶条件,其因素及水平选取情况如表1所示。
在单因素试验结果的基础上,由表2中的极差R可知,对纤维素酶和淀粉酶活力影响最大的因素是培养基含水量,4个因素对纤维素酶的影响力大小表现为C>A>B>D,对淀粉酶的影响力大小表现为C>D>B>A。生产纤维素酶的最佳条件是A2B3C2D3,而产淀粉酶的最佳条件是A2B2C3D1,即在 29 ℃ 条件下,生产纤维素酶的最佳条件是在固态培养基中加入15 g干豆渣、含水量为55%、接种量为1.7 mL、培养84 h,而生产淀粉酶的最佳条件是在固态培养基中加入15 g干豆渣、含水量为60%、接种量为1.5 mL、培养60 h。
经验证,该优化条件下所得纤维素酶和淀粉酶的活力分别为475、198 U/g。
3 结论
培养基含水量对产酶影响最为显著,培养基中含水量过高时,培养基黏度增加,易结块,透气性差,氧气供应减少,影响产酶,2种酶的活力均迅速下降。
黑曲霉菌株产酶活力较高,因此,利用固态发酵豆渣产纤维素酶和淀粉酶是可行的,这是一种很有应用前景的制备方法。以豆渣作为微生物发酵产酶的良好原料,不仅扩大了产酶的来源和途径,也使豆渣这一资源得到了充分利用,实现了
可持续发展。
参考文献:
[1] 戴小阳,罗泽民. 豆渣的有效利用[J]. 湖南农业科学,1996(1):28-29.
[2]易嘉玲. 豆渣在食品工业中的利用[J]. 武汉食品工业学院学报,1994(1):17-20.
[3]翁佩芳,吴祖芳. 复合菌固态发酵啤酒糟培养基优化的研究[J]. 酿酒科技,2003(2):67-69.
[4]Bhat M K. Cellulases and related enzymes in biotechnology[J]. Biotechnology Advances,2000,18(5):355-383.
[5]喻凤香,陈 煦,林亲录,等. 根霉淀粉酶的分离纯化及部分性质研究[J]. 酿酒,2006,33(4):51-53.
[6]李爱华,岳思君,马海滨. 真菌孢子三种计数方法相关性的探讨[J]. 微生物学杂志,2006,26(2):107-110.
[7]张 帅,陈 懿,董 基. 黑曲霉固态发酵橘皮生产纤维素酶及淀粉酶[J]. 食品科学,2012,33(11):190-193.
[8]张 辉,桑 青. 响应面法优化黑曲霉HQ-1产纤维素酶固体发酵条件[J]. 中国酿造,2011(7):17-22.
[9]周传云. 食品微生物学实验技术[M]. 长沙:湖南农业大学出版社,1999.
[10] 苏小军,熊兴耀,谭兴和,等. 黑曲霉AF-1固态发酵生产生淀粉酶的条件优化[J]. 湖南农业大学学报(自然科学版),2009,35(2):208-212.
[11]苏香萍,龚大春,陈国华,等. 混合菌固态发酵产纤维素酶条件的研究[J]. 时珍国医国药,2010,21(12):3330-3332.
[12]Gervais P,Molin P. The role of water in solid-state fermentation[J]. Biochemical Engineering Journal,2003,13(2/3):85-101.
[13]李 蕾,张 力,乔 梁,等. 混菌固态发酵产纤维素酶条件的优化[J]. 河南农业科学,2014,43(10):150-155.
[14]Theodorosh V,Sevastianos R,Ioanniss A. Glucoamylases production of Aspergillus niger in solid state fermentation using a continuous counter-current reactor[J]. International Journal of Food Science & Technology,2010,43(7):1159-1168.endprint
