RP-HPLC同时测定射干9种活性成分含量
2017-12-27尤献民邹桂欣邸子真李国信
尤献民,邹桂欣,邸子真,李国信
辽宁省中医药研究院,辽宁 沈阳 110034
RP-HPLC同时测定射干9种活性成分含量
尤献民,邹桂欣,邸子真,李国信
辽宁省中医药研究院,辽宁 沈阳 110034
目的 建立RP-HPLC同时测定射干药材中芒果苷、射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素B、鸢尾甲黄素A、野鸢尾黄素、白射干素及次野鸢尾黄素共9种成分含量的方法。方法 采用LeapsilTMC18色谱柱(100 mm×2.1 mm,3 µm),流动相为乙腈-0.1%甲酸水溶液梯度洗脱,检测波长265 nm,流速0.5 mL/min,柱温40 ℃。结果 芒果苷、射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素B、鸢尾甲黄素A、野鸢尾黄素、白射干素、次野鸢尾黄素的线性范围分别为0.214 0~2.568 µg(r=0.999 5)、0.437 0~5.244 µg(r=0.999 3)、0.460 0~5.520 µg(r=0.999 9)、0.078 40~0.940 8 µg(r=0.999 6)、0.138 0~1.656 µg(r=0.999 3)、0.051 00~0.612 0 µg(r=0.997 5)、0.113 0~1.356 µg(r=0.999 9)、0.051 63~0.619 6 µg(r=0.999 8)、0.151 0~1.812 µg(r=0.999 9),平均加样回收率分别为97.73%、96.81%、97.78%、97.55%、96.86%、98.60%、97.77%、98.04%、97.89%,RSD分别为0.7%、1.1%、2.3%、2.1%、1.3%、1.4%、2.3%、1.6%、1.9%。应用该方法测定了5批射干药材中9种成分的含量。结论 该方法准确、可靠,可为射干药材的质量控制提供参考依据。
射干;活性成分;反相高效液相色谱法;含量测定
射干是鸢尾科射干属植物射干Belamcanda chinensis(L.)DC.的干燥根茎,具有清热解毒、利咽消痰、散血消肿的功效,是治疗喉痹咽痛常用药,被历版《中华人民共和国药典》收载。射干中主要含有异黄酮类化合物、醌类、酚类、二环三萜类化合物、甾类化合物及一些微量成分[1],其中黄酮类成分具有显著的镇痛、止咳、抗炎抑菌[2-3]和抗病毒[4]等多种药理作用。据文献报道,鸢尾苷和鸢尾黄素对大鼠腹腔巨噬细胞中前列腺素E2产物和环氧合酶-2诱导具有抑制作用[5],野鸢尾黄素对巨噬细胞内一氧化氮和前列腺素E2产物具有抑制作用[6],从射干药材中分离得到的鸢尾甲黄素B、鸢尾黄素、次野鸢尾黄素及野鸢尾黄素对脂多糖诱导的小鼠巨噬细胞产生的一氧化氮均有抑制作用[7]。射干苷、野鸢尾苷的抗炎作用虽然不如其相应的苷元,但胃肠吸收动力学试验表明,射干苷、野鸢尾苷在体内可以转化为相应苷元而发挥药理作用[8]。
2015年版《中华人民共和国药典》射干项下仅对次野鸢尾黄素的含量进行了测定[9],目前亦有报道射干药材中多种成分的含量测定方法[10-12]。本试验同时对射干中9种活性成分含量进行测定,为进一步完善射干药材的质量控制方法提供参考。
1 仪器与试药
Agilent 1100高效液相色谱仪,配备在线脱气机、四元梯度泵、自动进样器、柱温箱、DAD检测器、Chemstation色谱工作站,美国Agilent公司;KQ-250 DB数控超声波清洗器,昆山市超声仪器有限公司。
对照品芒果苷(批号111607-200402)、射干苷(批号111632-200501)、次野鸢尾黄素(批号111557-200602)购于中国食品药品检定研究院,野鸢尾苷(批号13030803)、野鸢尾黄素(批号为13051402)购于成都普瑞法科技有限公司,鸢尾黄素(批号12081808)购于成都生物科技有限公司,鸢尾甲黄素A(批号20140724)、鸢尾甲黄素B(批号20140616)、白射干素(批号20140621)购于江苏永健医药科技有限公司。甲酸、乙腈、DMSO均为色谱纯(Dikma Technologies Inc.),重蒸水(自制)。所购射干药材经辽宁中医药大学李峰教授鉴定,均为鸢尾科射干属植物射干Belamcanda chinensis(L.)DC.的干燥根茎,其来源及鉴定结果见表1。

表1 射干药材来源及鉴定结果
2 方法与结果
2.1 溶液的制备
2.1.1 混合对照品贮备液 精密称取对照品芒果苷、射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素B、鸢尾甲黄素A、野鸢尾黄素、白射干素及次野鸢尾黄素适量,用DMSO分别配制成浓度为2.140、4.370、4.600、0.784 0、1.380、1.020、2.260、0.516 3、1.510 g/L的对照品贮备液。精密量取鸢尾甲黄素A及野鸢尾黄素各0.5 mL,其余7种对照品各1 mL,置于同一10 mL量瓶中,用DMSO稀释至刻度,摇匀,即得混合对照品贮备液(芒果苷214.0 mg/L、射干苷437.0 mg/L、野鸢尾苷460.0 mg/L、鸢尾黄素78.40 mg/L、鸢尾甲黄素B 138.0 mg/L、鸢尾甲黄素A 51.00 mg/L、野鸢尾黄素113.0 mg/L、白射干素51.63 mg/L、次野鸢尾黄素151.0 mg/L)。
2.1.2 供试品溶液 取射干药材粉末(过40目筛)约1 g,精密称定。置100 mL具塞锥形瓶中,精密加入70%乙醇25 mL,密塞,称定质量,超声提取(250 W,50 kHz)30 min,冷却,称定质量,用70%乙醇补足减失的质量,摇匀,滤过,用0.22 µm微孔滤膜过滤,取续滤液作为供试溶液。
2.2 色谱条件
色谱柱:LeapsilTMC18(100 mm×2.1 mm,3 µm);流动相:0.1%甲酸水溶液(A)和乙腈(B),梯度洗脱(0~10 min,95%~90%A;10~15 min,90%~86%A;15~90 min,86%~86%A;90~95min,86%~81%A;95~155 min,81%~81%A;155~160 min,81%~5%A);流速0.5 mL/min;柱温:40 ℃;程序进样:吸取供试液5~20 µL,然后吸取水(含10% DMSO)90 µL,混合10次,等待0.2 min后进样分析。在上述色谱条件下,芒果苷、射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素B、鸢尾甲黄素A、野鸢尾黄素、白射干素及次野鸢尾黄素与相邻色谱峰的分离度均符合要求,理论塔板数按野鸢尾黄素峰计算不低于6000,色谱图见图1。
2.3 线性关系考察
分别精密量取混合对照品贮备液1.0、2.0、4.0、8.0、10、12 µL,进样分析,以溶液的进样质量为横坐标,以峰面积(A)为纵坐标,进行线性回归,分别得到射干中9种成分的回归方程、相关系数及线性范围,见表2。
2.4 精密度试验
精密吸取同一混合对照品溶液,连续进样6次,程序进样,测得芒果苷、射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素B、鸢尾甲黄素A、野鸢尾黄素、白射干素及次野鸢尾黄素峰面积的RSD分别为1.2%、2.8%、1.3%、0.3%、2.1%、1.2%、2.0%、2.4%、1.4%,表明精密度良好。
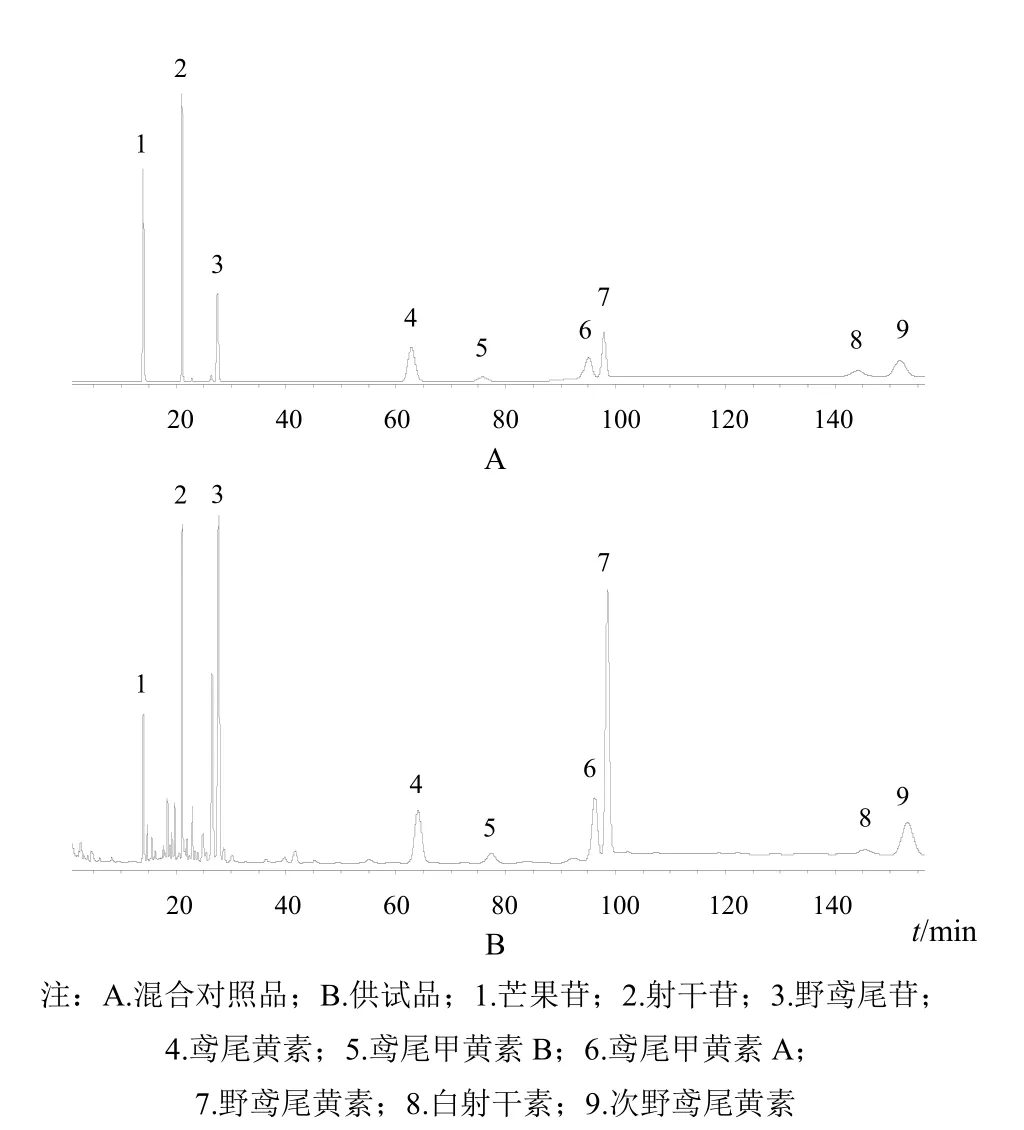
图1 射干中9种活性成分HPLC图
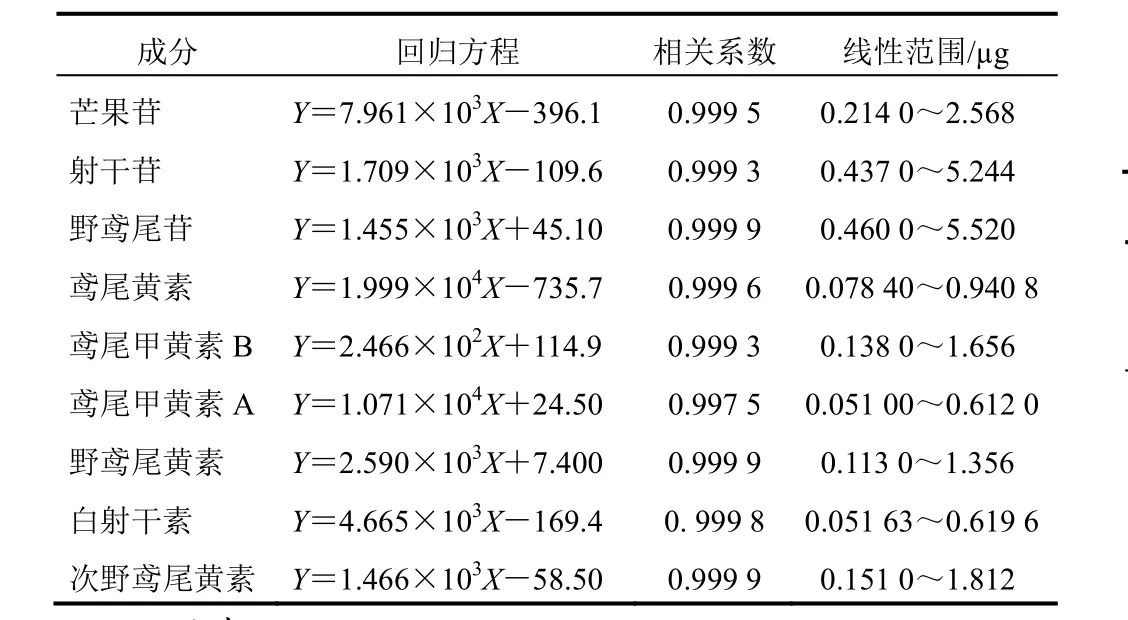
表2 射干中9种成分线性关系考察结果
2.5 重复性试验
取同一批射干药材粉末(1号),按“2.1.2”项下方法平行制备供试品溶液6份,在“2.2”项色谱条件下分别进样分析,测得芒果苷、射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素B、鸢尾甲黄素A、野鸢尾黄素、白射干素及次野鸢尾黄素含量分别为4.17、1.90、1.356、1.639、0.211、0.974、1.042、1.197、0.859 mg/g,RSD分别为2.2%、2.6%、2.8%、2.1%、2.9%、2.7%、2.7%、2.5%、2.9%,表明方法重复性良好。
2.6 稳定性试验
取新制备的供试品溶液,室温放置,分别于0、3、6、9、24、96 h程序进样,芒果苷、射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素B、鸢尾甲黄素A、野鸢尾黄素、白射干素及次野鸢尾黄素含量的RSD分别为0.18%、0.25%、0.21%、0.24%、0.23%、1.4%、0.25%、2.8%、2.6%,表明供试品溶液室温放置96 h内稳定。
2.7 加样回收率试验
精密称取已测知含量的射干药材粉末(1号)9份,每份约0.5 g,精密称定,分别精密加入含9种对照品的混合溶液1.2、1.0、0.8 mL(芒果苷2.099 g/L、射干苷0.927 0 g/L、野鸢尾苷0.688 0 g/L、鸢尾黄素0.839 0 g/L、鸢尾甲黄素B 0.107 0 g/L、鸢尾甲黄素A 0.489 0 g/L、野鸢尾黄素0.524 0 g/L、白射干素0.599 0 g/L、次野鸢尾黄素0.432 0 g/L),每一质量浓度制备3份。按“2.1.2”项下方法制备所需溶液,分别进样分析,结果见表3~表11。
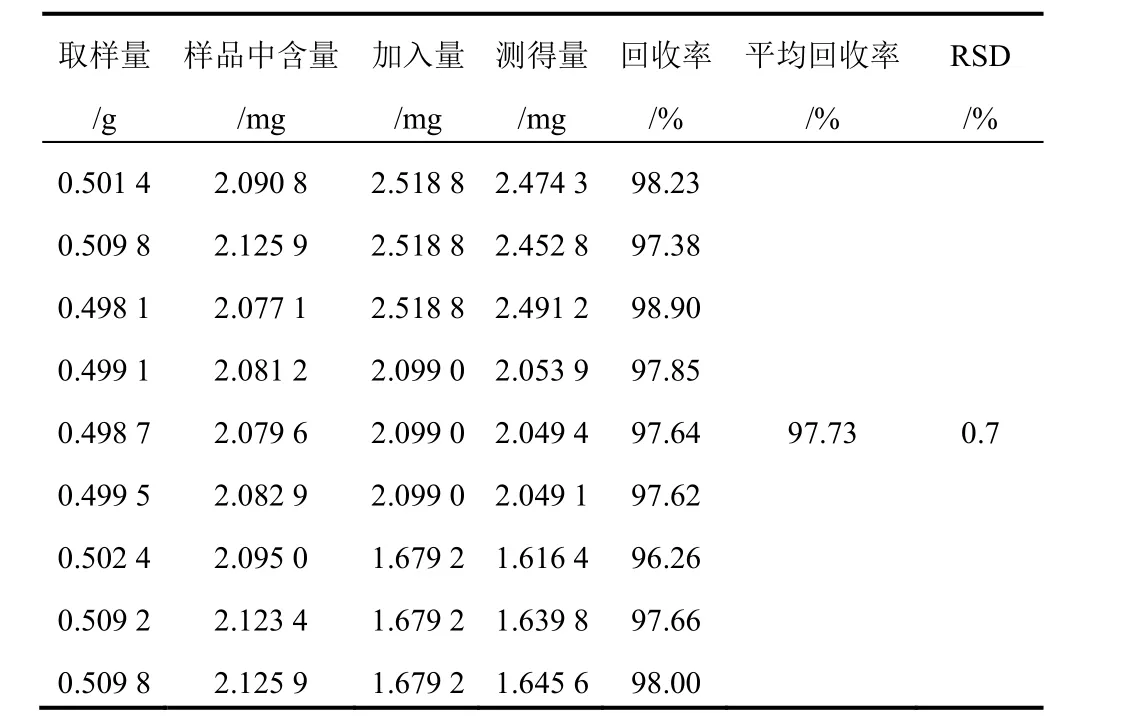
表3 射干中芒果苷加样回收率试验
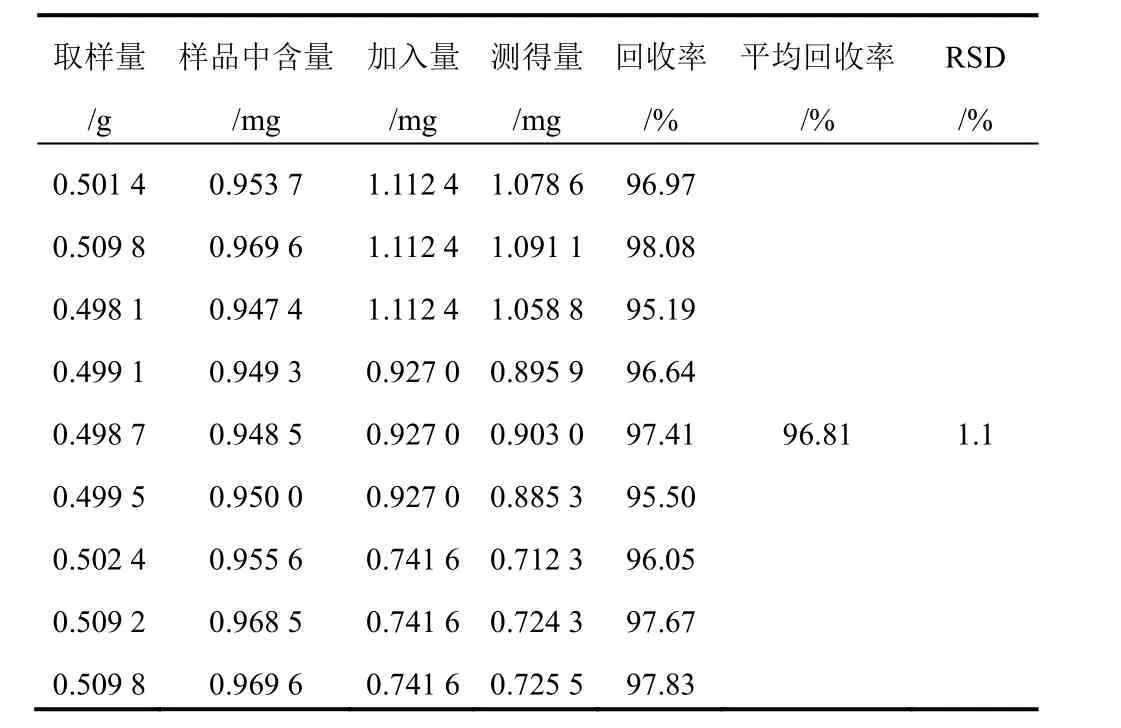
表4 射干中射干苷加样回收率试验
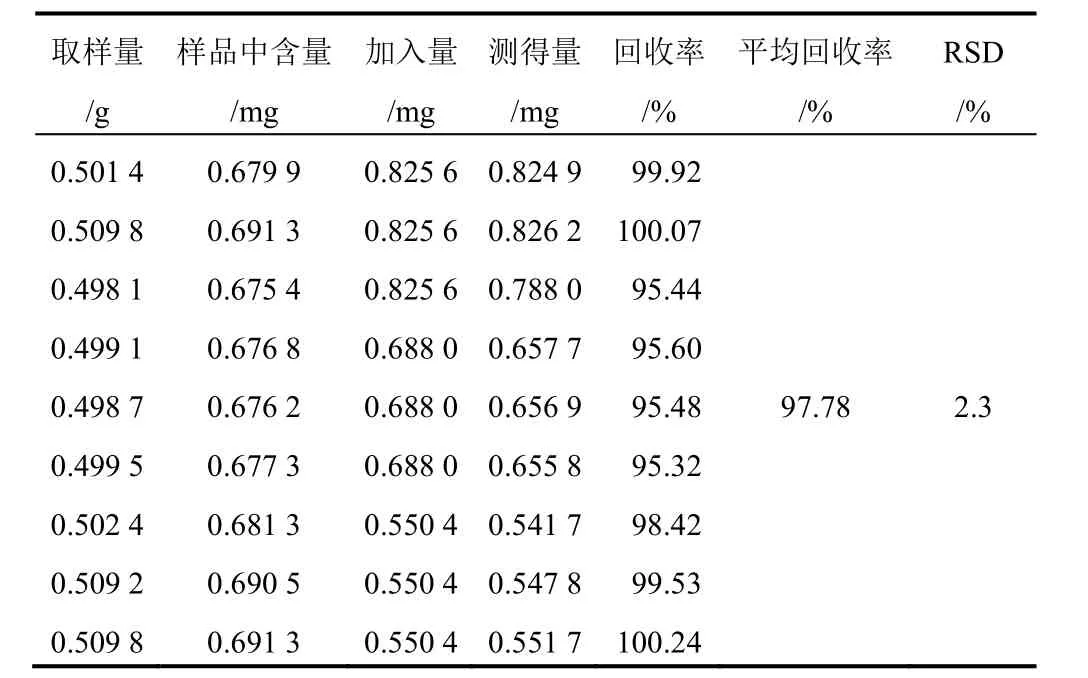
表5 射干中野鸢尾苷加样回收率试验
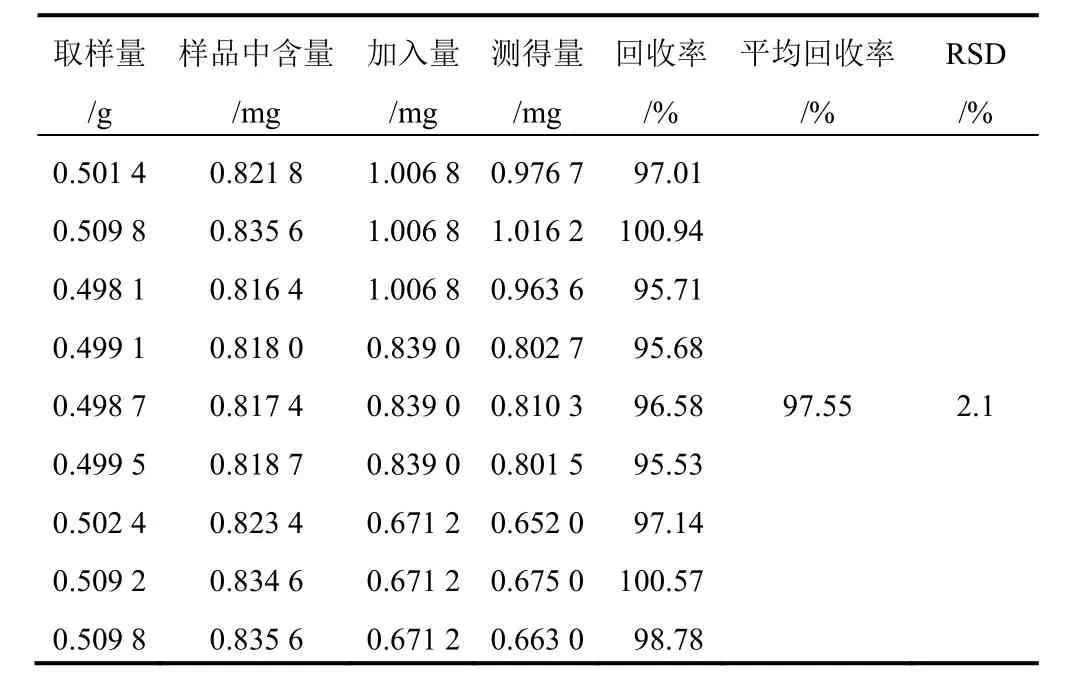
表6 射干中鸢尾黄素加样回收率试验

表7 射干中鸢尾甲黄素B加样回收率试验
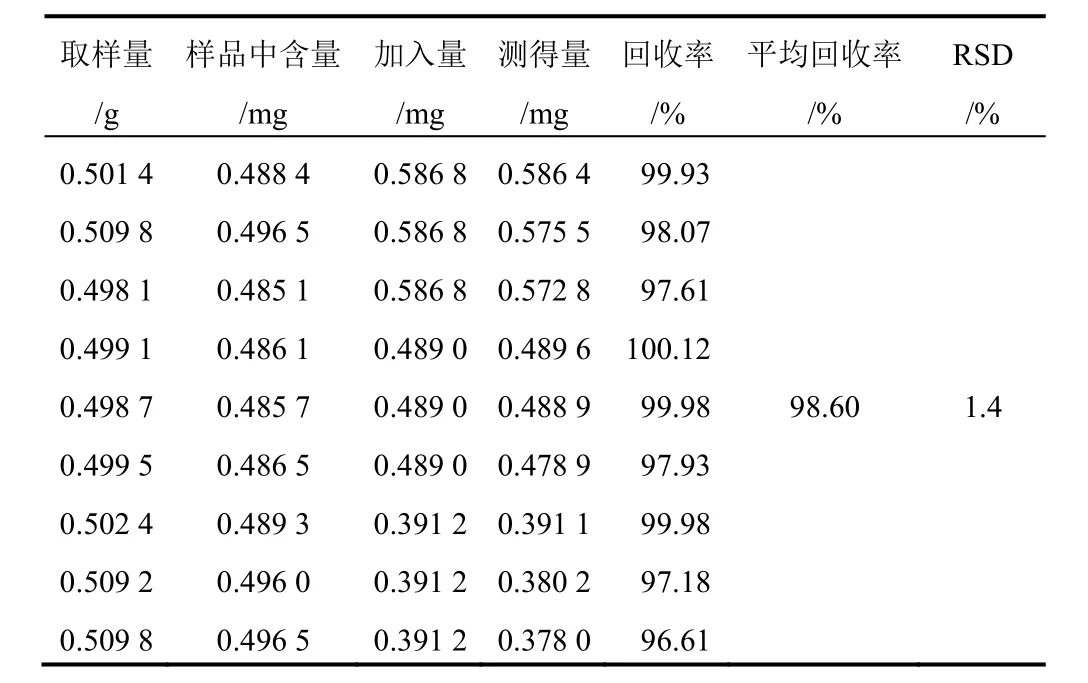
表8 射干中鸢尾甲黄素A加样回收率试验
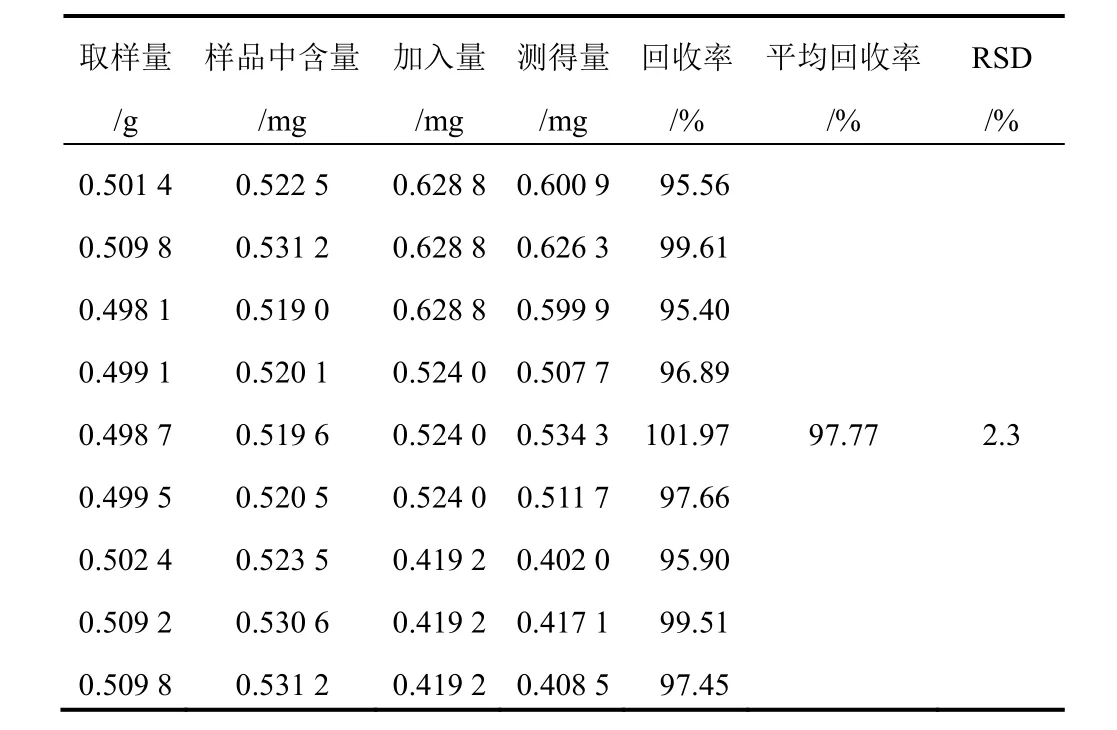
表9 射干中野鸢尾黄素加样回收率试验
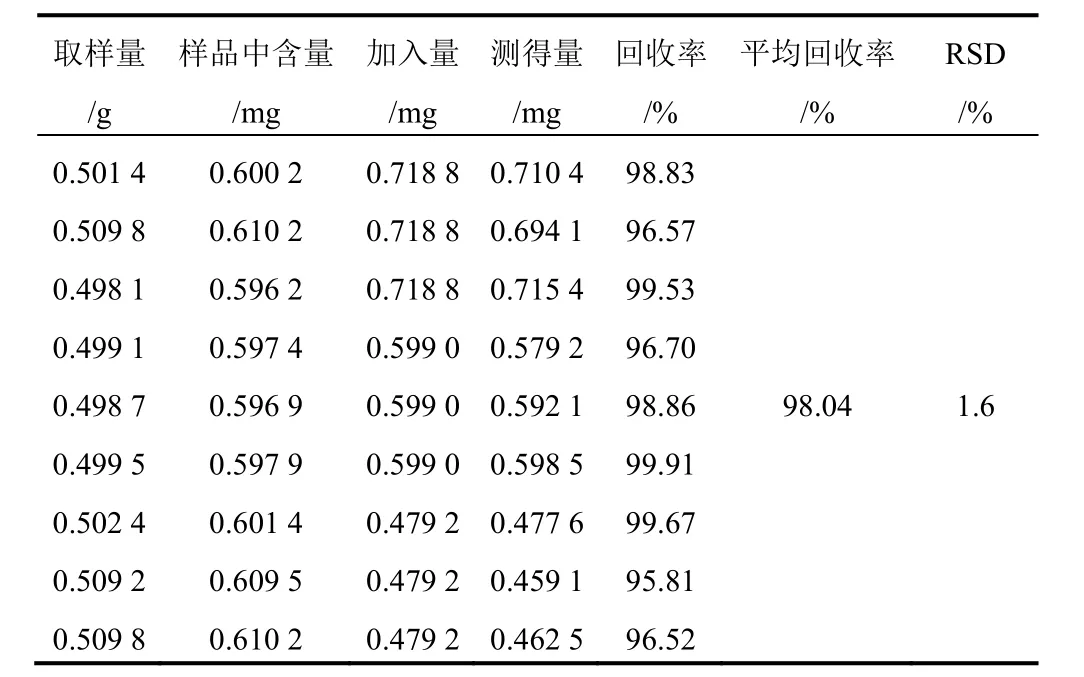
表10 射干中白射干素加样回收率试验

表11 射干中次野鸢尾黄素加样回收率试验
2.8 样品含量测定
取不同产地的5批射干药材粉末,按“2.1.2”项下方法制备供试品溶液,在“2.2”项色谱条件下进行分析,用外标法计算芒果苷、射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素B、鸢尾甲黄素A、野鸢尾黄素、白射干素及次野鸢尾黄素的含量,结果见表12。
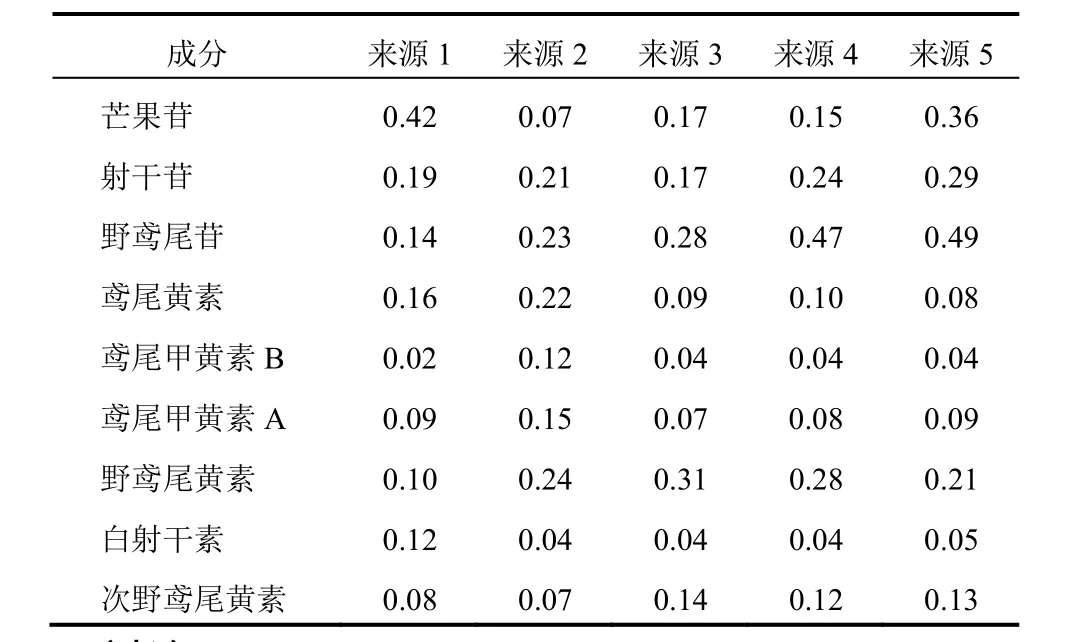
表12 不同来源射干药材中9种活性成分含量(%)
3 讨论
射干所含9种成分中除芒果苷外,其他均为异黄酮成分,化学结构相近,较难分离,其中鸢尾甲黄素A与野鸢尾黄素结构仅差一个甲氧基,色谱行为非常接近,色谱峰很难分开。本研究从色谱柱粒径、流动相比例、柱温、流速、检测波长等多方面进行考察,对色谱条件进行优化,并采用程序进样对供试品溶液的离子强度与流动相进行匹配,使各成分色谱峰得到良好分离,最终实现了9个色谱峰的准确测定。
选择色谱柱时曾采用Agilent ZORbax SB-Aq、Welch Ultimate XB-C18、Phenomenex Polar-BP等多种填料的色谱柱进行分离,除鸢尾甲黄素A与野鸢尾黄素不能分开外,其他7种成分分离较好。当柱粒径为5 µm、色谱柱内径为4.6 mm时,调整色谱柱类型、柱温、流动相种类及比例均无法使鸢尾甲黄素A与野鸢尾黄素2个峰分开。当柱粒径为3 µm、色谱柱内径为2.1 mm时,分离效果良好,因此确定采用LeapsilTMC18色谱柱(100 mm×2.1 mm,3 µm)。
在LeapsilTMC18色谱柱(100 mm×2.1 mm,2.7 µm)柱上,野鸢尾黄素与鸢尾甲黄素A、白射干素与次野鸢尾黄素分离度较差;在经过多次试验后发现,当乙腈的体积分数为14%,且在0.5 mL/min运行75 min左右,野鸢尾黄素与鸢尾甲黄素A分离度可以达到定量要求;当乙腈体积分数为19%且在0.5 mL/min运行60 min左右,次野鸢尾黄素与白射干素色谱峰分离度可以达到定量要求;再考虑极性较大的芒果苷、射干苷、野鸢尾苷等分离需要,最终确定了最佳流动相梯度。
由于色谱柱的内径及粒径均较小,1.0 mL/min流速使柱压过高,升高柱温和降低流速既降低柱压又可获得良好的分离效果,因此确定流速为0.5 mL/min,柱温为40 ℃。
由于同时进行测定的9个成分的极性差异较大,经过筛选,采用70%乙醇可以使各成分得到良好的溶出,因此确定用70%乙醇为提取溶媒,但芒果苷、射干苷及野鸢尾苷的色谱峰由于供试品溶液溶剂离子强度远大于分离时流动相离子强度,因此色谱峰变形,难以准确积分,经过反复试验,将供试品溶液用水稀释20倍左右,才能获得良好结果,但会使进样量加大,同样导致色谱峰变形,采用Agilent1100液相色谱仪提供的程序进样功能,可以较好地解决这个问题。另外,由于样品中的射干异黄酮苷元的脂溶性较强,直接用水稀释会使样品中这些成分的含量降低,因此,在水中加入了一定比例的DMSO,最终确定了最佳进样程序参数。
样品测定结果表明,本研究所收集到的5批样品中,芒果苷含量为0.07%~0.42%,射干苷含量为0.17%~0.29%,野鸢尾苷含量为0.14%~0.49%,鸢尾黄素含量为0.08%~0.22%,鸢尾甲黄素B含量为0.02%~0.12%,鸢尾甲黄素A含量为0.07%~0.15%,野鸢尾黄素含量为0.10%~0.31%,白射干素含量为0.04%~0.12%,次野鸢尾黄素含量为0.07%~0.14%。从生长环境看,安徽野生射干中芒果苷和白射干素含量比栽培高,其他成分含量比栽培低,而辽宁野生射干除芒果苷略低于栽培外,其他8种成分含量非常接近,3个产地的射干中各成分含量规律性不强,可能是样品批次较少的原因。
[1] 冯超.射干异黄酮类成分质量控制方法研究[D].上海:第二军医大学, 2009.
[2] 李国信,秦文艳,齐越,等.射干提取物抗炎及镇痛药理实验研究[J].实用中医内科杂志,2008,22(1):3-4.
[3] 秦文艳,赵金明,齐越,等.射干提取物体内体外抑菌作用的研究[J].中国实验方剂学杂志,2011,17(4):147-150.
[4] 赵金明,孟莉,陈贺,等.射干有效成分抗病毒主要药效学实验研究[J].实验动物科学,2010,27(6):9-12.
[5] KIM Y P, YAMADA M, LIM S S, et al. Inhibition by tectorigenin and tectoridin of prostaglandin E2production and cyclooxygenase-2 induction in rat peritoneal macrophages[J]. Biochim Biophys Acta, 1999,1438(3):399-407.
[6] AHNA K S, NOBE E J, CHAC K H. et al. Inhibitory effects of Irigenin from the rhizomes of Belamcanda chinensis on nitric oxide and prostaglandin E2production in murinemacrophage RAW 264.7 cells[J]. J Life Sciences,2006,78:2336-2342.
[7] LEE J W, LEE C, JIN Q, et al. Chemical constituents from Belamcanda chinensis and their inhibitory effects on nitric oxide production in RAW 264.7 macrophage cells[J]. Arch Pharm Res,2015, 38(6):991-997.
[8] BAE E A, HAN M J, LEE K T, et al. Metabolism of 6”-O-xylosyltectoridin and tectoridin by human intestinal bacteria and their hypoglycemic and in vitro cytotoxic activities[J]. Biol & Pharm Bull,1999,22(12):1314-1318.
[9] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:285.
[10] 张婧涵,张晓瑞,李国信,等.线性回归色谱峰定位法在射干中药材多组分同时测定中的应用[J].药物分析杂志,2014,34(7):1149-1154.
[11] 邹桂欣,尤献民,李国信.射干中芒果苷反相高效液相色谱测定[J].辽宁中医杂志,2010,37(10):2002-2003.
[12] 邹桂欣,尤献民,李国信.HPLC测定射干不同部位中的4种药用成分[J].华西药学杂志,2011,26(2):170-171.
Simultaneous Determination of Nine Active Ingredients in Belamcandae Rhizoma by RP-HPLC
YOU Xian-min, ZOU Gui-xin, DI Zi-zhen, LI Guo-xin (Liaoning Academy of Chinese Medicine,
Shenyang 110034, China)
Objective To develop an RP-HPLC method for simultaneous determination of mangiferin, tectoridin, iridin, tectorigenin, iristectorigenin B, iristectorigenin A, irigenin, dichotomin and irisflorentin in Belamcandae Rhizoma. Methods Separation was carried out on an LeapsilTMC18 column (100 mm×2.1 mm, 3 µm) with an isocratic mobile phase consisting of acetonotrile and formic acid at a flow rate of 0.5 mL/min; The detection wavelength was set at 265 nm; the column temperature was 40 ℃. Results The linear ranges of mangiferin, tectoridin, iridin, tectorigenin, iristectorigenin B, iristectorigenin A, irigenin, dichotomin and irisflorentin were 0.214 0–2.568 µg (r=0.999 5), 0.437 0–5.244 µg (r=0.999 3), 0.460 0–5.520 µg (r=0.999 9), 0.078 40–0.940 8 µg (r=0.999 6), 0.138 0–1.656 µg (r=0.999 3), 0.051 00–0.612 0 µg (r=0.997 5), 0.113 0–1.356 µg (r=0.999 9), 0.051 63–0.619 6 µg (r=0.999 8) and 0.151 0–1.812 µg (r=0.999 9), respectively. The average recoveries were 97.73%, 96.81%, 97.78%, 97.55%, 96.86%, 98.60%, 97.77%, 98.04% and 97.89%, respectively; the relative standard deviations were 0.70%, 1.1%, 2.3%, 2.1%, 1.3%, 1.4%, 2.3%, 1.6% and 1.9%, respectively. This method was used to determine the contents of nine active ingrients in 5 batches of Belamcandae Rhizoma. Conclusion The method is accurate and reliable, which can be used for the quality control of Belamcandae Rhizoma.
Belamcandae Rhizoma; active ingredients; RP-HPLC; content determination
10.3969/j.issn.1005-5304.2017.01.020
R284.1
A
1005-5304(2017)01-0082-05
2016-02-13)
(
2016-03-09;编辑:陈静)
国家自然科学基金(81273927);国家临床重点专科建设项目(2013年);国家中医药管理局临床中药学重点学科(2009年);辽宁中医药大学杏林学者青蓝工程(2013年)
李国信,E-mail:zou650430@126.com
