温度对波纹龙虾消化酶活力的影响
2017-12-25黄东科梁华芳温崇庆廖永岩
黄东科, 梁华芳, 温崇庆, 廖永岩
(1 广西北部湾海洋生物多样性养护重点实验室,钦州学院,广西 钦州,5350091;2 广东海洋大学水产学院,广东 湛江 5240881)
温度对波纹龙虾消化酶活力的影响
黄东科1,2, 梁华芳2, 温崇庆2, 廖永岩1
(1 广西北部湾海洋生物多样性养护重点实验室,钦州学院,广西 钦州,5350091;2 广东海洋大学水产学院,广东 湛江 5240881)
研究了波纹龙虾温度对不同消化器官中消化酶活力的影响,为人工饲料科学配制依据。用酶学分析方法,设计6个温度梯度(20℃、25℃、30℃、35℃、40℃和45℃),分别测定波纹龙虾胃、肠和肝胰脏的类胃蛋白酶、胰蛋白酶、淀粉酶和脂肪酶的活力。结果显示:在反应温度20℃~45℃范围内,波纹龙虾胃、肠、肝胰脏内的消化酶均随着温度的升高表现为先升后降趋势;不同消化器官中胃蛋白酶活力值出现拐点的温度不一样,胃、肠和肝胰脏的胃蛋白酶活力最大的温度分别是30℃、35℃和40℃;不同消化器官胃蛋白酶的活力有显著差异(P<0.05),大小依次为胃>肠>肝胰脏;波纹龙虾不同消化器官的类胰蛋白酶出现最大酶活力的温度相同,为40℃,但胃的类胰蛋白酶活力明显较肠和肝胰脏的低(P<0.05),差值最大可达40 U/mg;波纹龙虾胃、肠和肝胰脏的淀粉酶活力在25℃均出现最大值;在消化器官中,肠道淀粉酶活力最大,与胃和肝胰脏的酶活力有显著性差异(P<0.05);波纹龙虾胃、肠和肝胰脏内的脂肪酶活力最大的温度为30℃,活力最高的是肝胰脏,胃内的脂肪酶活力明显的比肠和肝胰脏的要低(P<0.05)。
波纹龙虾;温度;消化酶;活力
环境温度对变温动物代谢的影响贯穿于其整个生命过程。水温影响虾蟹类的新陈代谢、摄食和饲料转化率等,从而影响其生长发育和存活[1-2]。在虾蟹对食物的消化、吸收过程中,消化酶起着关键作用,其中的蛋白酶、淀粉酶、脂肪酶等活力受到温度、pH等因素影响,在十多种虾蟹类中都得到证明[3-5]。研究不同消化酶的反应条件十分必要。波纹龙虾(Panulirushomarus)隶属十足目(Decapoda)、龙虾科(Palinuridae),龙虾属(Panulirus),以其经济价值高、生长速度快、抗病力强、耐低氧、种苗易获得等优点而成为主要龙虾养殖品种之一[6-7]。波纹龙虾养殖投喂的都是动物性饵料,如虾蟹类、鱼类和贝类等[8-9],尚无人工配合饲料供应,养殖成本高,发展受到制约,急需开发人工配合饲料。目前对龙虾的消化生理研究较少,国内外关于温度对龙虾消化酶影响的研究极少,而温度对中国龙虾(Panulirusstimpsoni)、眼斑龙虾(Panulirusargus)和日本龙虾(Panulirusjaponicus)消化酶影响报道较多[10-12]。本文就温度对波纹龙虾消化酶活力影响开展研究,旨在为波纹龙虾消化生理研究以及研制人工配合饲料配伍提供参考。
1 材料与方法
1.1 材料
试验在广东海洋大学东海岛生物研究基地进行。使用经沉淀、砂滤的自然海区海水,盐度28~30,pH 8.0~8.2。波纹龙虾(50~60 g)来自海南省琼海青葛海湾,在20 m3的水泥池中养殖50 d左右,投喂褶牡蛎和虾等优质饵料。养殖达到试验规格(95~100 g/尾)后,解剖取出消化器官进行试验。福林一酚试剂、酪蛋白、酪氨酸、麦芽糖、橄榄油等均由南京建成生物工程研究所提供。
1.2 方法
1.2.1 消化器官解剖处理
波纹龙虾平均体质量(97.28±8.26) g,以5尾为1组,解剖后取出胃、肠和肝胰脏,提取消化酶,放在6个温度梯度(20℃、25℃、30℃、35℃、40℃和45℃)中反应,分别测定胃蛋白酶、类胰蛋白酶、淀粉酶活力和脂肪酶的活力。用恒温水浴锅调节反应温度。每个温度梯度设3个平行组,结果取平均值。
具体操作过程:在冰盘中活体解剖,取出胃、肠和肝胰脏,剥离附着物,剖开,用4℃双蒸水将消化道内容物冲洗干净,用滤纸吸干水分,分别称重后剪碎,加入10倍体积的预冷双蒸水(4℃),用匀浆器在冰面上进行匀浆,取部分匀浆液直接用于测定脂肪酶活力,其余用高速冷冻离心机离心30 min(4℃,4000 r/min),取上清液(即粗酶液)用于测定龙虾的胃蛋白酶、类胰蛋白酶和淀粉酶活力。
1.2.2 酶活力测定
参照姜永华等[10]和刘玉梅等[13]的方法,用考马斯亮蓝法G-250,以0.1mg/mL牛血清蛋白溶液为标准物,测定蛋白质浓度。酶活力用比活力表示,定义为每毫克蛋白所含酶活力单位(U/mg)。
(1)胃蛋白酶活力测定。参考潘鲁青等[14]的方法 采用以1%酸性酪蛋白(pH2.6)为底物的福林一酚试剂显色法,以1 mg/mL酪氨酸溶液制作标准曲线。胃蛋白酶活力的定义:在各温度梯度、pH2.0的条件下,单位粗酶液每分钟水解干酪素产生1 mg酪氨酸为一个活力单位(U/mg)。
(2)类胰蛋白酶活力测定。参照姜永华等[10]方法,采用以1%碱性酪蛋白为底物的福林一酚试剂显色法,标准曲线和酶活力定义同胃蛋白酶,pH9.0。
(3)淀粉酶活力测定。采用以1%可溶性淀粉为底物的3,5-二硝基水杨酸显色法测定淀粉酶的活力[10],以1 mg/mL麦芽糖溶液制作标准曲线。淀粉酶活力的定义:在各温度梯度及pH6.9的条件下,单位粗酶液每分钟水解淀粉产生1 mg麦芽糖为一个活力单位U(mg/min)。
(4)脂肪酶活力测定。采用以25%聚乙烯醇橄榄油为底物的标准氢氧化钠溶液滴定法[13]。三角烧瓶中加入0.025 M磷酸缓冲液(pH 7.5 ) 5毫升,25%聚乙烯醇橄榄油乳化液4 mL,置于40℃水浴中预热5 min,然后加入酶液,保温30 min,立即加入95 %乙醇15 mL,终止酶反应。用1%麝香草酚酞做指示剂,标准氢氧化钠滴定。脂肪酶活力的定义:在各温度梯度及pH7.5的条件下,单位粗酶液每分钟水解橄榄油产生1mg脂肪酸为一个活力单位U(mg/min)。
1.2.3 数据处理及统计
数据整理使用Excel 2010。用统计软件 SPSS17.0进行单因素方差分析及多重比较,各处理平均数之间用邓肯(Duncan)方法进行差异显著性比较,以P<0.05为差异显著,以P<0.01为差异极显著。
2 结果
2.1 温度对胃蛋白酶活力的影响
温度对波纹龙虾胃、肠、肝胰脏内的胃蛋白酶活力均有显著影响(P<0.05)。在反应温度20℃~45℃范围内,波纹龙虾胃、肠和肝胰脏的胃蛋白酶均随着温度的升高表现为先升后降趋势,但在不同的部位出现拐点的温度不一样。胃蛋白酶活力最大时的温度分别为30℃、35℃和40℃。在最适温度下,不同消化器官的胃蛋白酶活力也有显著差异(P<0.05),胃的最高53.10 U/mg,其次是肠的,最低是肝胰脏42.63 U/mg(表1)。
表1反应温度对蛋白酶活力的影响
Tab.1 Effects of different reaction temperatures on pepsin enzyme activities in the panulirus homarus

温度胃/(U/mg)肠/(U/mg)肝胰脏/(U/mg)20℃24 41±1 27F18 93±0 71G23 79±0 52F25℃29 83±0 97E33 95±0 48DE27 73±0 36EF30℃53 10±0 29A42 67±0 68C30 64±1 22E35℃51 18±0 63A46 98±3 28B36 65±1 03D40℃31 36±0 14E41 81±2 58C42 63±0 49BC45℃16 82±2 02G28 81±1 13E33 57±0 78DE
注:同列字母不同,表示差异显著(P<0.05);同列字母相同表示差异不显著。
2.2 温度对类胰蛋白酶活力的影响
温度对波纹龙虾胃、肠和肝胰脏的类胰蛋白酶活力均有显著影响(P<0.05)。在20℃~45℃范围内,波纹龙虾胃、肠和肝胰脏的类胰蛋白酶均随着温度的升高表现为先升后降趋势,不同的消化器官出现最大酶活力的温度一致,均为40℃。其中,胃的类胰蛋白酶活力明显较肠和肝胰脏的低(P<0.05),差值最大可达40 U/mg(表2)。
表2反应温度对类胰蛋白酶活力的影响
Tab.2 Effects of different reaction temperatures on tryptase enzyme activities in the panulirus homarus
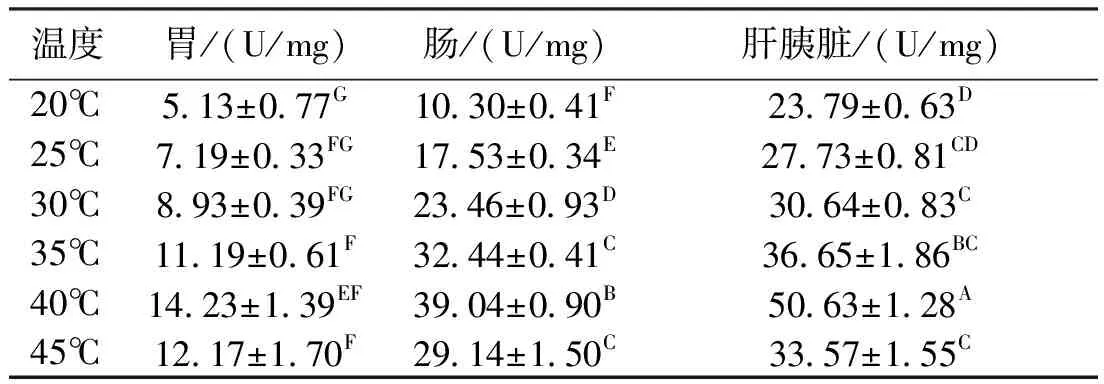
温度胃/(U/mg)肠/(U/mg)肝胰脏/(U/mg)20℃5 13±0 77G10 30±0 41F23 79±0 63D25℃7 19±0 33FG17 53±0 34E27 73±0 81CD30℃8 93±0 39FG23 46±0 93D30 64±0 83C35℃11 19±0 61F32 44±0 41C36 65±1 86BC40℃14 23±1 39EF39 04±0 90B50 63±1 28A45℃12 17±1 70F29 14±1 50C33 57±1 55C
注:同列字母不同,表示差异显著(P<0.05);同列字母相同表示差异不显著。
2.3 温度对淀粉酶活力的影响
温度对波纹龙虾胃、肠、肝胰脏内的淀粉酶活力均有显著影响(P<0.05)(表3)。在反应温度20℃~45℃范围内,波纹龙虾胃、肠、肝胰脏内的淀粉酶出现最大酶活力的温度一致,为25℃,较蛋白酶的温度低;其中20℃~35℃各组淀粉酶的活力没有显著性差异。肠的淀粉酶活力最大,与胃和肝胰脏的酶活有显著性差异(P<0.05)。
表3反应温度对淀粉酶活力的影响
Tab.3 Effects of different reaction temperatures on amylase activities in the panulirus homarus

温度胃/(U/mg)肠/(U/mg)肝胰脏/(U/mg)20℃6 03±1 34BC16 70±0 83A7 33±1 05BC25℃7 52±0 83BC18 61±0 53A8 77±0 64B30℃7 10±1 02BC17 33±0 74A8 16±1 65B35℃6 05±1 04BC14 07±0 66A7 20±1 01BC40℃6 21±0 62BC9 80±0 64B6 50±1 12BC45℃4 78±0 73C8 62±0 55B4 45±1 17C
注:同列字母不同,表示差异显著(P<0.05);同列字母相同表示差异不显著。
2.4 温度对脂肪酶活力的影响
温度对波纹龙虾胃、肠和肝胰脏内的脂肪酶活力均有显著影响(P<0.05)(表4)。在反应温度20℃~45℃范围内,波纹龙虾胃、肠和肝胰脏的脂肪酶出现最大酶活力的温度都是30℃;胃的脂肪酶活力明显比肠和肝胰脏的要低(P<0.05);脂肪酶活力最高的部位是肝胰脏。
表4反应温度对脂肪酶活力的影响
Tab.4 Effects of different reaction temperatures on lipase activities in the panulirus homarus

温度胃/(U/mg)肠/(U/mg)肝胰脏/(U/mg)20℃2 72±1 18C4 61±0 92C6 57±1 12B25℃4 44±0 52C6 81±0 80B11 02±0 65A30℃4 93±0 72C8 09±0 33B12 53±1 23A35℃4 80±0 63C7 69±0 92B10 88±1 02AB40℃3 15±1 02C4 90±1 10C8 17±0 92B45℃2 00±0 52C2 82±0 83C4 98±1 06C
注:同列字母不同,表示差异显著(P<0.05);同列字母相同表示差异不显著。
2.5 淀粉酶/蛋白酶比值
在最适温度条件下对4种主要消化酶活力进行比较(表5)并以大小顺序排列,胃蛋白酶活力:胃>肠>肝胰脏;类胰蛋白酶活力:肝胰脏>肠>胃;淀粉酶活力:肝胰脏>肠>胃;脂肪酶活力:肝胰脏>肠>胃。以淀粉酶/蛋白酶(A/P) 比值作为动物食性和营养状况的一个指标。A/ P1比值和A/ P2比值均远小于1,说明肝胰脏、肠道、胃中淀粉酶的比活力均小于蛋白酶的比活力,蛋白酶占主导地位。

表5 不同器官主要消化酶活性比较及A/P值分析
注:同列字母不同,表示差异显著(P<0.05);同列字母相同表示差异不显著。
3 讨论
3.1 关于蛋白酶活力
胃蛋白酶和类胰蛋白酶是甲壳动物幼体的 2 种主要蛋白水解酶,在对虾幼体发育过程中,后者是一种最占优势的消化酶[14,16]。中国明对虾、日本囊对虾、三疣梭子蟹(Portunustrituberculatus)和中华绒螯蟹(Eriocheirsinensis)4种甲壳动物幼体的相关研究结果表明,类胰蛋白酶比胃蛋白酶活力大,约为1.2~2.8 倍[14,17],但在中国龙虾[10]和本研究的波纹龙虾中,类胰蛋白酶并不是优势酶,在胃和肠中类胰蛋白酶比胃蛋白酶活力小。可见,在虾的不同发育阶段,其消化酶活力随着食性转变和营养需求不同而发生变化。
动物的消化能力决定了其对营养物质消化吸收的效率,消化酶活力的高低直接影响动物对营养物质的消化能力从而影响生长。酶促反应受到温度的影响,本试验结果表明,反应温度对波纹龙虾蛋白酶活力有显著影响。波纹龙虾胃蛋白酶的最适反应温度为30℃~40℃,与中国龙虾的最适反应温度(31℃~47℃)[10]和克氏原螯虾(Procambarusclarkia)的最适温度(35℃)相近,但远低于凡纳滨对虾的50℃~65℃和中国明对虾的45℃~55℃[19-20],以及眼斑龙虾[11]和日本龙虾[12]的60℃。另外,本试验结果表明,波纹龙虾类胰蛋白酶的最适反应温度均为40℃,与中国龙虾类胰蛋白酶的最适反应温度39℃的结果相似[10],而与眼斑龙虾类胰蛋白酶的最适反应温度60℃和中国明对虾的47℃有较大差异[11,20]
3.2 关于脂肪酶活力
本试验表明,温度对脂肪酶活力有较大影响。波纹龙虾各消化器官的脂肪酶活力在30℃时最高,但中国龙虾[10]不同消化器官的脂肪酶最适反应温度不同,肠和肝胰脏的均为31℃,与波纹龙虾接近,但胃的脂肪酶活力在23℃时最高,低于波纹龙虾的30℃,而这两种龙虾的脂肪酶最适反应温度比眼斑龙虾[11]的40℃低得多。不同种类的虾,其最适反应温度也不相同。如:克氏原螯虾脂肪酶活力在肝胰脏、肠道、胃的最适温度分别为 25℃、35℃和25℃[18],而凡纳滨对虾的最适温度均为 37℃[19]。据报道,胃、肝胰脏和肠道脂肪酶的最适温度分别为 50℃、30℃和 40℃[21];中国明对虾与日本囊对虾脂肪酶最适温度均为 35℃~40℃[20]。它们间的差异除了种类不同外,还可能与其栖息环境密切相关,如波纹龙虾和中国龙虾分布区重叠,最适温度相近,而与眼斑龙虾地理分布(美国东海岸、加勒比海和墨西哥湾)相距甚远,最适温度相差较大。
3.3 关于淀粉酶活力
波纹龙虾淀粉酶最适反应温度为25℃,与中国龙虾[10]的23℃较为接近,但与眼斑龙虾的最适温度50℃相差较大[11],进一步说明了地理分布不同可能是造成消化酶活力差异的原因。另外,波纹龙虾淀粉酶最适反应温度也与日本囊对虾的25℃~30℃相近,但低于凡纳滨对虾[19]、中国明对虾[20]的30℃~35℃,克氏原螯虾的35℃~40℃[18]和三疣梭子蟹[22]的55℃~65℃,其栖息环境与淀粉酶反应温度或多或少有点负相关。
3.4 关于龙虾食性偏向性
波纹龙虾的4种消化酶活性表现为胃蛋白酶活力最高,类胰蛋白酶次之,脂肪酶最小。Biesiot等[23]提出采用淀粉酶/胃蛋白酶(A/ P1) 比值和淀粉酶/ 胰蛋白酶(A/ P2) 比值作为食性和营养状况的指标,当比值高于1时为植物食性或偏植物食性,比值低于1时为动物食性或偏动物食性。如对虾类的幼体,溞状幼体期的A/P>1,与其以单胞藻为食的植物食性相符,而幼体发育到糠虾期时,其A/P<1,转变为动物食性[3,14-15,24-25]。本试验发现,波纹龙虾的A/ P1和A/ P2比值在胃、肠和肝胰脏中都小于1。根据以上推论,波纹龙虾的食性应为动物食性或偏动物食性,这与事实相符。可见,用A/P比值作为判断甲壳动物食性的指标是可行的。
4 结论
波纹龙虾不同的消化器官,其消化酶活力也不同。胃蛋白酶活力大小依次为胃>肠>肝胰脏,类胰蛋白酶活力依次为肝胰脏>肠>胃,淀粉酶活力依次为肠>肝胰脏≈胃,脂肪酶活力依次为肝胰脏>肠>胃。温度对波纹龙虾消化酶活力有较大影响,在反应温度20℃~45℃范围内,胃、肠和肝胰脏内的消化酶均随着温度的升高表现为先升后降趋势。波纹龙虾消化酶最适反应温度在不同消化器官中有差异,胃、肠和肝胰脏胃蛋白酶的最适反应温度分别为30℃、35℃和40℃,而胃、肠、肝胰脏3个消化器官的类胰蛋白酶活力最大的反应温度均为40℃,在胃、肠、肝胰脏中淀粉酶最反应温度都是25℃,脂肪酶最适反应温度为30℃。通过淀粉酶和蛋白酶比值(A/P<1)为动物食性或偏动物食性分析,对比波纹龙虾的偏动物食性习性和本研究结果,认为用A/P比值作为判别甲壳动物食性指标是可行的。
□
[1] 黄东科,梁华芳,张志.温度对波纹龙虾存活、摄食、蜕壳和生长的影响[J].生态学报,2017,37(18): 5973-5980.
[2] 张龙岗,钟君伟,朱永安.温度对克氏原螯虾苗种生长和存活的影响[J].河北渔业,2015(1):4-5.
[3] 潘鲁青,刘泓宇,肖国强.甲壳动物幼体消化酶研究进展[J].中国水产科学,2006,13(3):492-501.
[4] LUO W,ZHAO Y L,ZHOU Z L,et.al.Digestive enzyme activity and mRNA level of trypsin in embryonic red claw crayfish,Cherax quadricarnatus[J].Chinese Journal of Oceanology and Limnology,2008,26(1):62-68.
[5] 姜鹤,孔繁东,刘兆芳.温度、pH及金属离子对大连虾蛄消化酶活性的影响[J].保鲜与加工,2016,16(4):84-88.
[6] 梁华芳,赵运添,黄东科.波纹龙虾耗氧率和窒息点的研究[J].水产养殖.2012(4):1-4.
[7] KEMP J O,BRITZ P J.The effect of temperature on the growth,survival and food consumption of the east coast rock lobster Panulirus homarus rubellus[J].Aquaculture ,2008,280:227-231.
[8] 沈铭辉,符芳霞,范薇.不同饵料对波纹龙虾生长影响的研究[J].热带农业科学,2011,31(7):55-59.
[9] 沈铭辉,范薇.波纹龙虾工厂化养殖技术[J].中国水产,2008(5):52,59.
[10] 姜永华,颜素芬.反应温度对中国龙虾消化酶活力的影响[J].集美大学学报(自然科学版),2009(1):14-19.
[11] ERICK PERERA,MOYANO F J,DAZ M,et.al.Polymorphism and partial characterization of digestive enzymes in the spiny lobster Panulirus argus[J].Comparative Biochemistry and Physiology,Part B ,2008,150(3):247-254.
[12] GALGANI F,NAGAYAMA F.Digestive proteinases in the Japanese spiny lobster Panulirus japonicus[J].Comparative Biochemistry and Physiology Part B: Comparative Biochemistry,1987,87(4):889-893.
[13] 刘玉梅,朱谨钊.对虾消化酶的研究[J].海洋科学,1984(5):46-50.
[14] 刘玉梅,朱谨钊.中国对虾幼体和仔虾消化酶活力及氨基酸组成的研究[J].海洋与湖沼,1991,22(6):571-575.
[15] 潘鲁青,王克行.中国对虾幼体消化酶活力的实验研究[J].水产学报,1997,21(1):26-31.
[16] TSAI I H,CHUANG K L ,CHUANG J L.Chymotrypsins in digestive tracts of crustacean decapods(shrimps) [J].Comp Biochem Physiol,1986,85:235-240.
[17] 潘鲁青.四种虾蟹类幼体消化酶活力的比较研究[J].青岛海洋大学学报,1997,27(3): 313-318.
[18] 祝尧荣,寿建昕,沈文英.温度对克氏原螯虾消化酶活性的影响[J].浙江农业学报,2009,21(3): 238-240.
[19] 沈文英,胡洪国,潘雅娟.温度和pH值对南美白对虾(Penaeusvannmei)消化酶活性的影响[J].海洋与湖沼,2004,35(6): 543-548.
[20] 吴垠,孙建明,周遵春.温度对中国对虾、日本对虾主要消化酶活性的影响[J].大连水产学院学报,1997,12(2):15-22.
[21] 黄燕华,王国霞,刘襄河,等.温度和pH对南美白对虾主要消化酶活性的影响[J].华南农业大学学报,2008,29(4):87-90,94.
[22] 胡毅,潘鲁青.三疣梭子蟹消化酶的初步研究[J].中国海洋大学学报(自然科学版),2006,36(4): 621-626.
[23] BIESIOT P M,CAPUZZO J M.Changes in digestive enzyme activities during early development of the American lobster Homarus americanus Milne Edwards [J].Journal of Experimental Marine Biology and Ecology,1990,136(2): 107-122.
[24] 朱春华,李广丽,文海翔.南美白对虾早期幼体消化酶活力的研究[J].海洋科学,2003,27(5):54-57.
[25] 潘鲁青,王伟.日本对虾幼体几种消化酶活力的研究[J].海洋湖沼通报,1997(2):15-18.
Effectsofdifferenttemperaturesonthedigestiveenzymeactivitiesinthepanulirushomarus
HUANGDongke1,2,LIANGHuafang2,WENChongqing2,LIAOYongyan2
(1GuangxiKeyLaboratoryofBeibuGulfMarineBiodiversityConservation,QinzhouUniversity,Qinzhou535009,China;2FisheriescollegeofGuangdongOceanUniversity,Zhanjiang524088,China)
To provide an basis for scientific formula of artificial diets,the effects of different temperatures on the digestive enzyme activities in the panulirus homarus were investigated.Using enzymatic analysis method,the four enzymes,including pepsin,trypase,amylase and lipase,were determined in the digestive organs of stomach,intestines,hepatopancreas in the panulirus homarus at temperatures of 20℃,25℃,30℃,35℃,40℃ and 45℃.All activities of the four kinds of digestive enzymes presented a trend of first increasing and then decreasing with temperatures ranging from 20℃to 45℃.The highest reaction temperature differed for pepsin reaching the turning point in different digestive organs,with values of 30℃,35℃,40℃ corresponded to stomach,intestines and hepatopancreas,respectively.And there were significant differences(P<0.05)in pepsin among the three tissues,of which stomach presented the maximum level,while hepatopancreas had the lowest one.The temperature for the presentation of the maximal activity of trypsase in different digestive organs were same at 40℃,and level of trypsase in stomach was significantly lowerP<0.05)than those in intestines and hepatopancreas,with the interval was up to 40 U/mg.The amylase activity exhibited maximal in intestine,which differed significantly(P<0.05) from those in other two organs,but the highest reaction temperature for activity of amylase in all three digestive organs were 25℃.The activities of lipase in all digestive organs had the same optimal reaction temperature of 30℃,when the activity of lipase was highest in hepatopancreas,whereas stomach presented a lower lipase activity(P<0.05).
panulirus homarus;temperature;digestive enzyme;activity
10.3969/j.issn.1007-9580.2017.06.006
2017-09-06
广西北部湾海洋生物多样性养护重点实验室(钦州学院)开放课题(2015KB03);广东省科技厅农业攻关项目(2013B020308009)
黄东科(1988-),男,硕士,研究方向:水产养殖技术。E-mail: 522865834@qq.com
梁华芳(1965—),男,教授,研究方向:甲壳动物生物学及养殖技术。E-mail:hfliang@126.com
S968.22
A
1007-9580(2017)06-032-06
