檀香紫檀苗木炭疽病病原菌分离鉴定
2017-12-22张少平徐呈祥李超群郑福庆
张少平,徐呈祥,李超群,郑福庆
(肇庆学院生命科学学院,广东 肇庆 526061)
檀香紫檀苗木炭疽病病原菌分离鉴定
张少平,徐呈祥,李超群,郑福庆
(肇庆学院生命科学学院,广东 肇庆 526061)
在檀香紫檀引种繁育中,发现其温室中的苗木冬春时节发生一种较严重的叶部病害,但病害名称、病原菌种类未见报道。以感染该病害的18月龄苗木为试材,分离纯化后获得病原菌株,采用形态学与分子生物学相结合的方法对其进行鉴定。根据分离到的该菌株菌落形态特征、分生孢子形态特征及病原菌rDNA-ITS 序列测试分析结果,确定分离到的菌株为胶孢炭疽菌(Colletotrichum gloeosporioides);致病性试验结果表明,胶孢炭疽菌是导致檀香紫檀叶片该种病害的病原菌,但属非典型炭疽病。讨论了檀香紫檀苗木炭疽病的防控。
檀香紫檀;叶部病害;病原菌;分离鉴定;胶孢炭疽菌
珍贵用材树种,特别是红木树种及其森林资源,已经成为国家重要战略资源和国际木材市场的竞争焦点[1]。檀香紫檀(Pterocarpus santalinus)是蝶形花科紫檀属树种,别名小叶紫檀,自然分布于热带原始森林,木材以印度迈索尔地区和缅甸北部地区出产的最著名,是真正被称为“紫檀木”的红木木材,在红木中最为珍稀,品质和售价远高于“花梨木”[2]。檀香紫檀原产地不在中国,中国是引种栽培国,但50多年的引种实践表明中国热带和南亚热带地区对该树种的引种是成功的,表现优良[3]。在紫檀属各树种中檀香紫檀抗寒性相对最强,在纬度更高地区引种推广潜力更大,但迄今该种紫檀仅在海南省儋州、尖峰岭有少量成年大树,苗木稀缺,繁育技术尚不成熟[4-5]。在实生繁殖中,我们发现温室中培育的檀香紫檀苗木叶部常发生一种侵染性病害,严重抑制生长,可致整株落叶甚至死亡。该树种叶部病害,露地栽培的檀香紫檀苗木也有发生,但危害程度轻微。目前,檀香紫檀繁育及栽培文献稀少,未见有其病害及防控的研究,该病害的名称、病原菌种类尚不清楚。为此,我们进行了本项研究。
1 材料与方法
檀香紫檀种子引种自海南热带植物园,播种繁育成18月龄苗木。病害主要发生在冬春时节,早期主要是在叶片先端出现水渍状病斑,继之中心部位失水干枯、呈同心轮纹状扩大,后期叶片基部也发生病害,蔓延速度很快,发病重时导致整个叶片干枯、脱落,甚至整株枯死(图1)。

图1 檀香紫檀苗木叶片病害发病症状
病原菌分离纯化及形态学鉴定:在具有明显染病症状的病叶组织病健交界处剪取5mm×5mm病组织,表面消毒后置于PDA平板培养基上,28℃培养,培养3 d后,对菌落进行纯化并单孢分离,选取代表性菌株移接置PDA平板上,28℃黑暗培养6 d后,记录菌落形态学特征,并对病原菌分生孢子进行显微形态观测、拍照[6-7]。
病原菌致病性检测:选取无机械损伤,无病虫害、长势强健、未离体叶片做致病力检测材料,在无菌操作室环境中,用无菌水冲洗叶片3次,然后,将分离获得的菌株孢子用微量注射器针刺接种到健康叶片上,以灭菌蒸馏水为对照。接种病原菌的檀香紫檀苗木,在无菌室中培养、观察,自然光照。
病原菌DNA提取:按1.0 g样品加入4 mL(65℃)2% CTAB提取液。加入等体积酚/氯仿/异戊醇(25∶24∶1)。转移上清液,加入等体积氯仿/异戊醇,12 000 r/min 离心10 min(4℃,重复操作)。向上清中加入2倍体积无水乙醇(可加入1/10 体积 3 mol/L NaAc(pH5.2)),充分混匀,使 DNA 析出,12 000 r/min离心 20 m,弃上清后加入500 μL70℅乙醇,12 000 r/min离心5 min后再用500 μL70%乙醇洗涤,-20℃保存[8]。
病原菌rDNA-ITS序列PCR扩增:选择真菌rDNA-ITS通用引物。ITS1:5′-TCC GTA GGT GAACCT GCG G-3′;ITS4 :5′-TCC TCC GCT TATTGA TAT GC-3′。反应体系如下:ddH2O 16.5 μL,10×PCR Buffer 2.5 μL,dNTP 2 μL,ITS1和 ITS4各 1 μL,Taq 酶 1μL,模板DNA1.0 μL,总体积25 μL。PCR反应条件:94℃预热 5 min,94℃ 30 s,51℃ 30 s,72℃ 50 s,重复30个循环,最后72℃延伸10 min。PCR产物测序由广州华大基因有限公司完成[9]。
病原菌rDNA-ITS序列分析与系统发育树构建:将DNA序列测序结果提交到NCBI网站进行BLAST数据分析,利用ClustalX和MEGA5.1软件对所得序列及选取的参比菌株的rDNA-ITS 基因进行同源性分析、并构建系统发育树[10]。
2 结果及分析
2.1 病原菌的致病性
将纯化后的病原菌接种到健康、无机械损伤的檀香紫檀苗木叶片上,接种7 d内叶片表现出感病症状即与田间栽培植株的相同。接种后不同时间叶片病症:接种1 d:接种病原菌处的伤口出现黄褐色斑点;接种3 d:接种口周围黄褐色斑点数量增多;接种5 d:黄褐色斑点面积明显增大,各个斑点逐渐连接成片;接种7 d:黄褐色色斑除接种部位外基本感染叶片整个边缘部分;接种9 d:黄褐色色斑从叶片边缘向叶片中央扩展,相邻未接种叶片出现类似症状;接种12 d:距黄褐色色斑较远的叶片,从叶缘开始产生与被接种叶片相似的黄褐色斑块;接种15 d:被接种叶片整片变为黄褐色,被感染的未接种病原菌叶片类似症状加重。在接种15 d内,对照叶片的接种口及其周围无任何显著变化(图2)。这些结果表明,纯化得到的菌株与实际侵染的病菌一致,且病原菌致病性强、蔓延很快。用发病的病斑进行常规分离,再次获得与原分离菌一致的病原菌,根据柯赫氏法则,证明接种菌即为檀香紫檀苗木叶片病害的病原菌。

图2 檀香紫檀叶片接种分离出病原菌 (L1)后的症状
2.2 病原菌的形态
分离纯化到的病原菌株,初生菌丝为白色,比较疏松,生长3~4 d后加粗;菌落呈圆形,边缘较整齐,浅褐色或黑褐色;菌落背面边缘灰白色,中间深灰色,菌丝疏水性极强。生长10~15 d,菌丝转为鼠灰色,产生黑色颗粒,培养基背面呈黑褐色。分生孢子盘初期多为圆形、黑褐色,后期可由若干个小分生孢子盘联合成大型分生孢子盘,有时也产生单个近球状的大型分生孢子盘,无色有隔菌丝。分生孢子圆形或长椭圆形,单胞无色,在PDA培养基上,产孢量低(图3)。根据这些形态特征判断,致病病原菌可能属于炭疽菌属(Colletotrichum Corda)真菌。

图3 分离纯化后获得的病原菌(L1)显微形态
2.3 病原菌 rDNA-ITS序列同源性分析及进化树构建
由图4(左)的DNA凝胶电泳图谱可见,条带清晰,表明成功提取了病原菌的DNA组,获得的DNA质量符合后续研究要求。以所得DNA为模板,进行rDNA-ITS PCR扩增的结果见图4(右)。经测序,所得rDNA-ITS序列的长度为550 bp。将获得的核酸序列提交到NCBI核酸数据库进行BLAST在线分析和序列同源性比较,将菌株L1 rDNA-ITS序列与GenBank中已有的 DNA序列进行同源性比较,发现GenBank中的胶孢炭疽菌(Colletotrichum gloeosporioides)ITS序列同源性均为100%,从GenBank 数据库中下载炭疽菌模式菌株ITS序列作为参考序列,以C. hippeastri ICMP17920、C. boninensen ICMP10338为外群参考序列,利用MEGA5.1构建了不同种炭疽菌的系统发育树[7-8],聚类分析结果表明病原菌株rDNA-ITS的序列与胶孢炭疽菌模式菌株C. gloeosporioides ICMP18738,C. gloeosporioides ICMP17821位于系统发育树的同一分支,自展支持率为95%(图5),而与其他炭疽菌遗传距离较远。根据病原菌菌落和分生孢子的形态特征以及 ITS 序列同源性比较的结果,确定檀香紫檀叶部病害的病原菌为胶孢炭疽菌(C. gloeosporioides)。
图4 病原菌(L1)基因组DNA电泳结果(左)及rDNA-ITS 序列PCR扩增结果(右)
3 讨论
胶孢炭疽菌是重要病原菌,侵染危害多种树木[11]。对炭疽菌的分类较为困难,其菌丝和菌落在不同种类培养基及环境条件下形态差异大[12-13]。形态学鉴定与分子生物学相结合在炭疽菌分类中具重要作用。基于rDNA基因编码序列将真菌种群间的亲缘关系从遗传进化角度加以区分,较能反映真菌间的遗传关系。本研究以病原菌形态特征和生物学特征以及寄主范围,并结合rDNA-ITS序列进行分析和比对,对檀香紫檀一种严重的叶部病害的病原菌进行了分离、鉴定,证明其为炭疽菌属胶孢炭疽菌,这在檀香紫檀上系首次报道,对其繁育和栽培有突出意义。但是,从苗圃地及接种后的病症图片看,该病害应属非典型的炭疽病症状。由于胶孢炭疽菌是一个很大的类群,我们计划对该分离物进行更多植物种类的致病性分析。
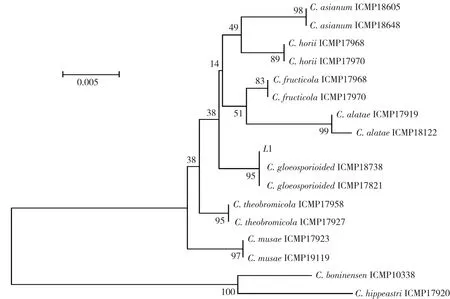
图5 基于炭疽菌rDNA-ITS序列的病原菌株(L1)系统发育树
环境条件,包括气候因子和管理措施,与树木炭疽病菌发生和危害密切相关[14]。我们对檀香紫檀叶片胶胞炭疽病菌生物学特性的试验研究表明,其在温度为26~30℃、相对湿度为90%~95%的环境中蔓延最迅速,表现规律同这种病害在室内外的差异一致,启示其幼龄苗木在温室或塑料大棚中越冬应首先注意调控环境条件以使育苗设施中有良好的光照和通气状况以及较低的相对湿度。目前,防治胶孢炭疽病菌主要用百菌清、多菌灵、代森锰锌、甲基托布津,但易产生抗药性[15]。我们对导致檀香紫檀叶片发生严重病害的胶孢炭疽菌适宜的化防农药进行试验,前述4种药剂均具有良好防效,且越早防治效果越好,但0.225 g/L咪鲜胺锰盐防效更好。
[1] 黎云昆. 论我国珍贵用材树种资源的培育[J].绿色中国,2005(8):24-28.
[2] 徐呈祥. 中国红木树种引种栽培研究进展[J].世界林业研究,2011,24(6):65-71.
[3] Xu C X,Zeng J,Ma Y P,et al. Introduction,growth performance and ecological adaptability of Hongmu tree species(Pterocarpus Spp.)in China[J]. Journal of Tropical Forest Science,2016,28(3):260-267.
[4] 马艳萍. 中国紫檀研究的文献计量学分析[J].农业图书情报学刊,2013,25(6):49-51.
[5] 马艳萍,徐呈祥,崔铁成,等. 红木和红木树种生物学研究文献分析[J]. 热带林业,2015,43(3):46-49.
[6] 徐成楠,王亚南,胡同乐,等. 蓝莓炭疽病病原菌鉴定及致病性测定[J]. 中国农业科学,2014,47(20):3992-3998.
[7] 陈汝,王金政,薛晓敏,等. 红富士苹果果实炭疽病病菌的分离与鉴定[J]. 江苏农业科学,2017,45(11):79-81.
[8] 吴良庆,朱立武,衡伟,等. 砀山梨炭疽病病原鉴定及其抑菌药剂筛选[J]. 中国农业科学,2010,43(18):3750-3758.
[9] 张颖慧,魏东盛,邢来君,等. 一种改进的丝状真菌DNA提取方法[J]. 微生物学通报,2008,35(3):466-469.
[10] Chen L S,Chu C,Liu C D,et al. PCR-based detection and differentiation of anthracnose pathogens,Colletotrichum gloeosporioides and C. truncatum,from vegetable soybean in Taiwan[J]. Journal of Phytopathology,2006,154(12):654-662.
[11] Liu F,Damm U,Cai L,et al. Species of the Colletotrichum gloeosporioides complex associated with anthracnose diseases of Proteaceae[J].Fungal Diversity,2013,61(1):89-105.
[12] 朱辉,覃伟权,付登强,等. 海南油茶炭疽病病原鉴定及生物学特性研究[J]. 广东农业科学,2015,42(16):54-59.
[13] Gupta V K,Pandey A,Kumar P,et al. Genetic character-ization of mango anthracnose pathogen Colletotrichum gloeosporioides Penz. by random amplified polymorphic DNA analysis[J].African Journal of Biotechnology,2010,9(26):4009-4013.
[14] 宋丹丹,张伊莹,张琳婧,等. 杨树炭疽病菌对多菌灵及3种DMIs杀菌剂的敏感性[J]. 农药学学报,2016,18(5):567-574.
[15] 欧雄常,柳凤,昝丽梅. 热带水果采后炭疽病生物防治研究进展[J]. 中国农学通报,2013,29(5):74-79.
Pathogen isolation and identification of a leaf disease of red sandalwood (Pterocarpus santalinus) seedlings
ZHANG Shao-ping,XU Cheng-xiang,LI Chao-qun,ZHENG Fu-qing
(College of Life Sciences,Zhaoqing University,Zhaoqing 526061,China)
In the introduction and propagation of red sandalwood (Pterocarpus santalinus),we found a serious leaf disease of its seedlings in winter and spring seasons,but the name of the disease and its pathogen species have not been reported. The pathogen isolated from infected leaves of 18-month-old seedlings was identified as Colletotrichum gloeosporioides by morphological characteristics of colony and conidium,and analysis results of rDNA- internal transcribed spacer sequence (ITS) of the strain. Pathogenicity test results further confirmed that C. gloeosporioides was the pathogen responsible for the infected leaves symptoms of red sandalwood,however,the disease belongs to an atypical anthracnose. Control of the leaf diseases of red sandalwood seedlings was discussed.
red sandalwood (Pterocarpus santalinus);leaf disease;pathogen;isolation and identification;Colletotrichum gloeosporioides
S763.15
A
1004-874X(2017)08-0085-05
张少平,徐呈祥,李超群,等. 檀香紫檀苗木炭疽病病原菌分离鉴定[J].广东农业科学,2017,44(8):85-89.
2017-06-01
国家自然科学基金(31270674);肇庆学院创新强校重点研究平台(CQ201607)
张少平(1976-),男,博士,讲师,E-mail:zzsspp2001@163.com
徐呈祥(1963-),男,博士,教授,E-mail:xucx2013@163.com
(责任编辑 杨贤智)
