CO一步法C. autoethanogenum 发酵产乙醇的工艺研究
2017-12-20徐惠娟梁翠谊许敬亮何敏超袁振宏陈小燕
徐惠娟,梁翠谊,许敬亮※,何敏超,袁振宏,陈小燕,张 宇
CO一步法发酵产乙醇的工艺研究
徐惠娟1,2,梁翠谊1,许敬亮1,2※,何敏超1,袁振宏1,2,陈小燕1,张 宇1
(1. 中国科学院广州能源研究所,中国科学院可再生能源重点实验室,广州 510640; 2. 广东省新能源和可再生能源研究开发与应用重点实验室,广州 510640)
合成气/CO发酵制备燃料乙醇是一项具有吸引力的新技术,为促进在该技术中的应用,对的乙醇发酵工艺及过程参数进行了研究。结果表明,代谢木糖的产物以乙酸为主,只产生少量乙醇;与无机氮源相比较,在含有机氮源的培养基中生长迅速,菌体浓度高。在3 L发酵罐中进行的批式发酵试验,采用木糖生长-CO发酵两步法,乙醇主要在CO发酵阶段产生,最高乙醇质量浓度为1.71 g/L;发酵罐经改进之后,采用CO一步法发酵,虽然得到的菌体浓度降低了,但是发酵时间延长,最高乙醇质量浓度达到7.36 g/L,而乙酸质量浓度在整个发酵过程中均低于1.1 g/L。此外,研究发现发酵液的pH值和氧化还原电位ORP与乙酸/乙醇产物分布密切相关,尤其是pH值。上述研究结果可为发酵CO生产乙醇的中试放大提供参考。
乙醇;发酵;一氧化碳;合成气发酵;乙酸;
0 引 言
随着世界人口增长与现代工业的发展,人类对能源的需求日益增加。开发新能源,实现低碳减排,是世界各国共同关注的热点问题。乙醇具有含氧,无水,高辛烷值等特点,既可直接作为液体燃料,又能作为添加剂与汽油混合使用[1]。乙醇可以代替传统的汽油添加剂甲基叔丁基醚(MTBE),从而避免因使用MTBE对地下水造成的污染[2]。汽油中乙醇的添加量不超过15%时,对车辆的行驶性没有明显影响,但汽车尾气中碳氢化合物、NOx和CO的含量明显降低。燃料乙醇作为一种清洁、可再生的能源,可减少国家对化石能源的依赖,维持社会与经济的可持续发展。
第一代燃料乙醇技术是以糖质或淀粉质作物为原料生产乙醇,其工艺已经非常成熟,但是存在着“与民争粮,与农争地”的问题。第二代燃料乙醇技术是以农林废弃物等木质纤维素为原料,经过预处理、酶解等步骤将原料分解为可发酵性糖,再进行乙醇发酵[3],该技术存在着纤维素酶成本高、木质素不能利用等缺陷,因而距离产业化仍有一段距离。合成气发酵是20世纪90年代发展起来的一项新技术,它以生物质、有机废物等的气化合成气为原料,利用特定的厌氧微生物进行发酵,产物包括乙酸、乙醇、2,3-丁二醇,丁酸和丁醇等[4-5]。合成气的主要成分为CO、H2和CO2,能够利用它的微生物被称为产乙酸菌,其中[6],[7],[8],[9],[10]以及[4]等菌株已用于合成气发酵产乙醇/丁醇的研究。气化过程可以将原料中的全部组分定向转化为合成气,因而木质素等一些难降解物质也能得到利用,而且合成气发酵具有反应条件温和、产物简单易于分离纯化等特点,因此它在生物质与有机废物的利用方面极具应用前景[11-12]。
是从兔粪中分离得到的一株严格厌氧菌,可以利用CO作为唯一的碳源和能源,也能利用H2/CO2及一些简单的碳水化合物,它的代谢产物主要是乙酸和乙醇。本实验室利用封闭的培养系统(气袋)研究了的合成气代谢,发现在发酵CO产乙醇方面具有较大潜力[13]。为了进一步开发的乙醇发酵工艺,本文对乙醇发酵的过程参数展开研究,探索其发酵规律及影响因素。
1 材料与方法
1.1 材料
1.1.1 菌株
试验菌株DSM 10061购自德国菌种保藏中心(DSMZ,Braunschweig,Germany),由本实验室驯化后保藏。
1.1.2 培养基
生长培养基在DSMZ640培养基[14]和Rajagopalan培养基[15]的基础上进行了改良,成分如下(1 L):10 mL无机盐溶液,10 mL微量元素溶液,10 mL维生素溶液,1.0 g酵母膏,2.0 g蛋白胨,0.5 g半胱氨酸盐酸,5.0 g吗啉乙磺酸,1.0 mL 0.1%刃天青,5.0 g木糖,pH值6。其中,无机盐溶液组成:NaCl 80 g/L,NH4Cl 100 g/L,KCl 10 g/L,KH2PO410 g/L,MgSO4·7H2O 20 g/L,CaCl2·2H2O 4 g/L;微量元素溶液组成:次氮基三乙酸2 g/L,MnCl2·4H2O 1.3 g/L,CoCl2·6H2O 0.2 g/L,ZnSO4·7H2O 0.2 g/L,FeCl3·6H2O 0.4 g/L,CuCl2·2H2O 0.02 g/L,NiCl2·6H2O 0.02 g/L,Na2MoO4·2H2O 0.02 g/L,Na2WO4·2H2O 0.025 g/L;维生素溶液组成:生物素2 mg/L叶酸2 mg/L,维生素B610 mg/L,维生素B15 mg/L,核黄素5 mg/L,烟酸5 mg/L,泛酸钙5 mg/L,维生素B125 mg/L,对氨基苯甲酸5 mg/L。
发酵培养基:不含木糖和蛋白胨,其余组分同生长培养基,pH值6。
1.2 分析方法
发酵液于4 ℃、12 000 r/min离心10 min,取上清。乙醇与乙酸含量采用Agilent 7 890A气相色谱仪检测,载气Ar,DB-FFAP毛细柱(30 m×0.25 mm×0.25m),FID检测器,进样口250 ℃,检测器温度300 ℃,色谱柱先在40 ℃保持5 min,然后以20 ℃/min的速度升至140 ℃,保持3 min,继续以40 ℃/min的速度升至250 ℃,再保持3 min,柱流量1 mL/min,载气流率30 mL/min,分流比l∶50。
发酵液中残糖采用HPLC Waters 2498检测,柱子为Shodex sugar SH1011,以0.005 mol/L H2SO4为流动相,流量0.5 mL/min,柱温50 ℃,UV-RI检测器,检测器温度为50 ℃。样品需要预先离心(12 000 r/min,10 min)并以0.22m滤膜过滤。
气体组分检测采用Agilent 7890A气相色谱仪,Agilent 5A分子筛柱(8 ft×1/8”×2 mm,60~80目)和Agilent Hayesep Q柱(6 ft×1/8”×2 mm,80~100目),进样器温度200 ℃, 分流比20∶1,柱流量3 mL/min,TCD检测器温度200 ℃,柱子在60 ℃保持3 min,再以15 ℃/ min的速率升到250 ℃。
通过检测波长600 nm下菌液的OD值来测量菌体密度,再根据OD值与干质量的计量关系计算得到细胞干质量。
1.3 试验方法
1.3.1 木糖浓度的影响
反应在100 mL厌氧瓶中进行,培养基50 mL。所有接种及取样等操作均在厌氧箱(DWS A35, 英国)中完成。
配制木糖质量浓度分别为2、4、5、6、8及10 g/L的生长培养基,配制好的培养基于121 ℃高压蒸汽灭菌20 min后从灭菌锅中取出,立即放入厌氧操作箱中(N285%,H210%,CO25%),待培养基显示无色后加塞密封。体积分数7%接种至上述培养基中,37 ℃培养箱静置培养14 d,取样检测OD600值、产物浓度及糖含量。
1.3.2 氮源的影响
反应在100 mL厌氧瓶中进行,培养基50 mL。培养基制备及接种、取样等操作同1.3.1。
配制含不同氮源的生长培养基,分别是:原始生长培养基(含1.0 g/L酵母膏,2.0 g/L蛋白胨和1.0 g/L NH4Cl),酵母膏培养基(含1.0 g/L酵母膏和1.0 g/L NH4Cl),以及分别含1.0、2.0、3.0和4.0 g/L NH4Cl的生长培养基(不含酵母膏和蛋白胨)。体积分数3%接种于上述培养基中,37 ℃静置培养,定时取样检测OD600值,培养时间为18 d,培养结束后检测残糖及产物浓度。
1.3.3 木糖生长-CO发酵试验
试验在3 L玻璃发酵罐(BIOTECH,上海保兴生物设备有限公司)中进行。
配制2.5 L生长培养基(不含蛋白胨,木糖2 g/L)于发酵罐中,121 ℃灭菌20 min,之后通冷却水降温并连续通入无菌N2(200 mL/min)以除去培养基中的残余氧气。待培养基的氧气除尽后(培养基显示浅黄色),接种200 mL预先在不含蛋白胨的生长培养基中培养至对数期的,37 ℃培养,继续通无菌N2以保持发酵罐的无氧环境,定时取样检测OD600、残糖、产物浓度及出口气体组成。待培养基中木糖耗尽后将无菌N2换成无菌CO(60 mL/min),继续培养,定时取样检测OD600,产物浓度以及出口气体组成。发酵过程中一直监测发酵液的pH值和氧化还原电位(ORP)的变化。
1.3.4 CO一步法发酵试验
试验在改进的3 L玻璃发酵罐(BIOTECH,上海保兴生物设备有限公司)中进行,与原设备相比,该发酵罐增加了一个保压装置。
配制2.5 L发酵培养基于发酵罐中,灭菌、降温及除氧操作同1.3.3,然后接种200 mL预先在发酵培养基中(CO为唯一的碳源)培养至对数期的,连续通入无菌CO(10 mL/min),37 ℃培养,搅拌转速300 r/min,罐压保持0.035 MPa,pH值控制在5.1~6.0之间,定时取样检测OD600和产物浓度。
2 结果与分析
2.1 木糖浓度对C. autoethanogenum生长的影响
木糖是生长的优良碳源[16-17],本试验考察木糖浓度对生长及产物合成的影响,结果如图1所示。从图1可以看出,经过较长时间(14 d)的培养,初始木糖质量浓度低于6 g/L的培养液中木糖已经耗尽或基本耗尽,当初始木糖质量浓度达到8 g/L及以上时,培养液中检测到大于20%的残糖。初始木糖质量浓度由2 g/L增加到4 g/L,菌体浓度显著增长,之后增长速度变缓,木糖质量浓度大于6 g/L后,菌体浓度基本恒定;代谢产物乙醇的浓度变化类似,木糖质量浓度低于6 g/L时,随着木糖的增加,乙醇浓度少量递增,当木糖质量浓度大于6 g/L后,乙醇浓度也基本不变。以上结果表明,用于生长的木糖质量浓度在5~6 g/L之间比较合适,浓度过高菌体不能完全利用,因为生长过程中产生的代谢物积累,反过来又抑制了菌体的生长,如大量乙酸的生成会使得培养基的pH值大大降低。此外,尽管以木糖为碳源生长良好,它代谢木糖产乙醇的能力却不高,培养14 d后初始木糖质量浓度8~10 g/L的培养液中得到的乙醇质量浓度小于0.75 g/L,而另一产物乙酸的质量浓度在2.4 g/L以上。
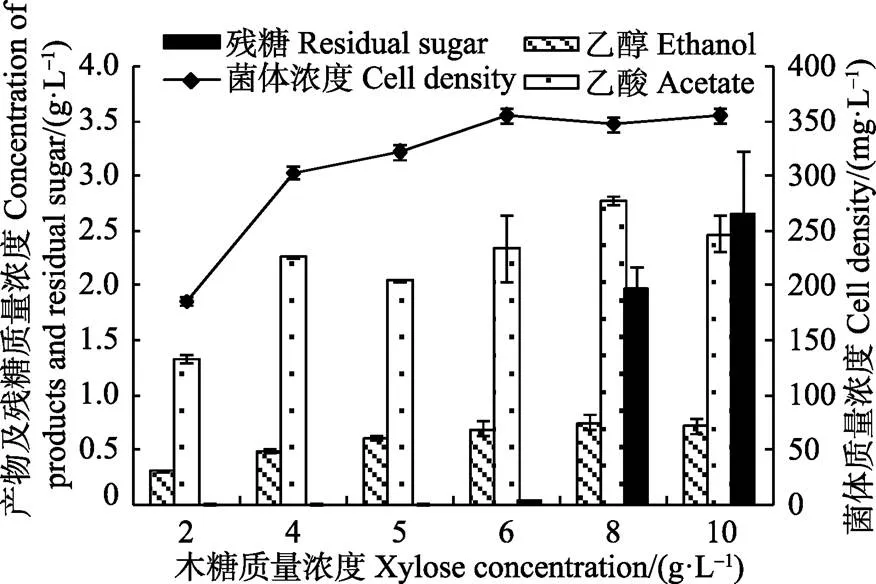
图1 木糖浓度对C. autoethanogenum生长及代谢产物的影响
2.2 氮源的影响
本试验考察了在不同氮源条件下的生长与木糖代谢情况,结果如图2和图3所示。从图2可以看出,在原始生长培养基(YP)中生长最快最旺盛,在酵母膏培养基(Y)中次之,将氮源换成无机氮源NH4Cl之后,不仅菌株生长的延滞期大大延长(近1周后才观测到生长),而且最终收获的菌体浓度较低。这是因为有机氮源含有丰富的蛋白质、肽类、游离的氨基酸及少量的生长因子,更有利于微生物的生长,而原始生长培养基既含有机氮源酵母膏和蛋白胨,又含无机氮源NH4Cl,营养最为丰富。在仅含无机氮源NH4Cl的培养基上也能生长,但NH4Cl浓度并非越高越好,培养基中含1.0 g/L NH4Cl时菌株生长最缓慢,可是最终得到的菌体浓度却相对较高,而NH4Cl质量浓度为4.0 g/L时得到的菌体浓度最低,其残糖分析显示培养结束后还有约0.81 g木糖没有被利用(图3),此外,含3.0 g/L NH4Cl的培养基中也检测到少量木糖残留。在原始生长培养基(YP)和酵母膏培养基(Y)中,菌株的生长基本是同步的,其代谢产物乙醇和乙酸的浓度也接近(图3),只是酵母膏培养基(Y)中得到的菌体浓度稍低一点。酵母膏培养基相比原始生长培养基少了蛋白胨这一成分,而两者的培养效果差别不大,因此在的大规模培养时可以用酵母膏培养基代替原始生长培养基以降低培养基的成本。图3显示,与无机氮源相比较,培养基中含有机氮源时菌株代谢产物乙酸的含量较高,但是另一产物乙醇的浓度差别不大,可能是因为乙酸是生长偶联型产物,而乙醇是非生长偶联型产物[18]。

图2 氮源对C. autoethanogenum生长的影响
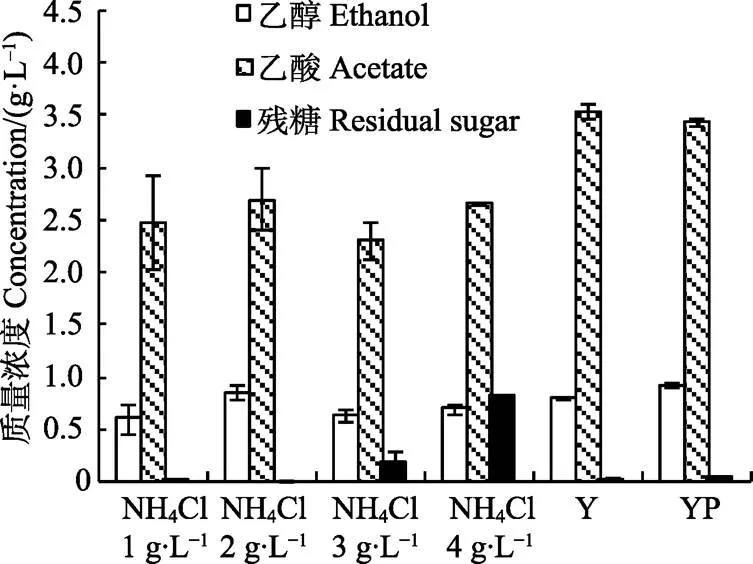
图3 氮源对C. autoethanogenum代谢产物及木糖利用的影响
2.3 木糖生长-CO发酵试验
试验由2个阶段组成:第1阶段,以少量的木糖为碳源实现快速增殖和菌体富集;第2阶段,以CO为唯一的碳源进一步合成代谢产物。如图4a所示,菌体的生长主要发生在木糖为碳源阶段,乙酸的生成也在这一阶段,当培养基中木糖耗尽,碳源换成了CO,之后随着发酵的进行,乙酸浓度逐渐降低,乙醇浓度却逐步上升,这是因为CO不仅可以用作碳源,在H2缺乏的条件下它还能被CO脱氢酶催化氧化产生还原电子,该电子可将乙酸还原为乙醇[19-20]。图4a显示大部分乙醇在CO发酵阶段产生,发酵192 h时得到最高乙醇质量浓度1.71 g/L。氧化还原电位(ORP)可以反映水溶液中所有物质表现出来的宏观氧化-还原性,氧化还原电位越高,氧化性越强,电位越低,氧化性越弱。对厌氧梭菌而言,ORP越低越好,研究发现,培养基的ORP高于-150 mV时会加速菌体的死亡。图4a和4b显示,随着菌株生长和乙酸生成,发酵液的pH值和ORP迅速降低,在乙酸浓度最高时ORP可低至-300 mV以下,而随着乙酸减少、乙醇含量增加,pH值逐渐上升,ORP也呈上升趋势,说明产酸过程使发酵液的还原性增强,而生成乙醇使得发酵液的还原性降低。发酵后期ORP增长较迅速可能是因为长时间培养过程中微量氧气渗入发酵液,导致其氧化-还原性发生了改变。降低pH值有利于合成气发酵菌株的产醇代谢[21-22],因而当发酵液pH值上升至5以上时加酸(HCl)调节pH至4.4,但由于发酵后期菌株的活力降低,乙醇生成没有得到明显的促进。

图4 C. autoethanogenum的木糖生长-CO发酵曲线
图4c显示的是发酵尾气的组成变化。木糖生长阶段通入的气体是100% N2,尾气中可以检测到少量的CO2,而且在菌体浓度最高的时候CO2的体积分数也达到最高值0.32%,CO发酵阶段通入的气体换成100% CO,出口尾气仍然可检测到CO2,说明无论在生长还是发酵阶段,CO2都是的一个主要代谢产物。发酵阶段出口尾气中CO的体积分数在96%~98%之间,说明只有少量的CO被利用,而这一阶段菌体基本没有生长,因此推测消耗的CO被用于产物的合成。本试验中CO利用率低主要是因为反应器不够理想。试验采用的是一个搅拌罐式反应器,出于安全考虑,采用了较低的CO通气速率,同时因为罐体不能保压,开启搅拌会加速发酵液中氧气的渗入,所以发酵过程中没有使用搅拌装置,仅以鼓泡的方式通入CO,气泡直径较大,而反应器的高径比又较小,气泡在发酵液中的停留时间短,因而气液传质速率低,限制了CO的利用。此外,试验中发现,在通入CO之后,出口尾气中可检测到微量的H2,可能是CO氧化释放的电子在氢酶的作用下将H+还原而产生H2。
2.4 CO一步法发酵试验
图5为的CO发酵曲线,由于CO是整个生长发酵过程唯一的碳源和能源,因而与碳源为木糖相比较(图4),菌株生长较缓慢,且最终得到的菌体浓度较低。图5显示,发酵12 d后,菌体浓度开始下降,但是产物乙醇的浓度一直呈上升趋势,最高乙醇质量浓度达到7.36 g/L,是文献报道[14, 23-25]最高浓度的8倍多。因为改进的发酵罐能够使发酵过程维持在一定的正压,有利于保持上层空间的厌氧环境,在开启搅拌之后,CO的气泡被搅拌器破碎分散,气液传质面积增大,同时发酵罐上层空间的正压一方面使得气液传质的推动力增大,另一方面增加了CO气泡在液相中的停留时间,从而促进了CO的利用,因此相比木糖生长-CO发酵试验,尽管CO的流量和菌体浓度都降低了,发酵所得乙醇浓度却提高了3倍以上,而且发酵时间由原来的9 d延长至24 d。此外,整个发酵过程中另一产物乙酸的浓度都处于较低的水平(小于1.1 g/L),即使在菌体生长阶段也是如此。原因可能有2个:1)菌株以CO为唯一的碳源时生长不够旺盛,产乙酸较少;2)发酵过程中持续通入的CO可将部分乙酸还原为乙醇,表现为随着乙醇浓度的上升,pH值升高。
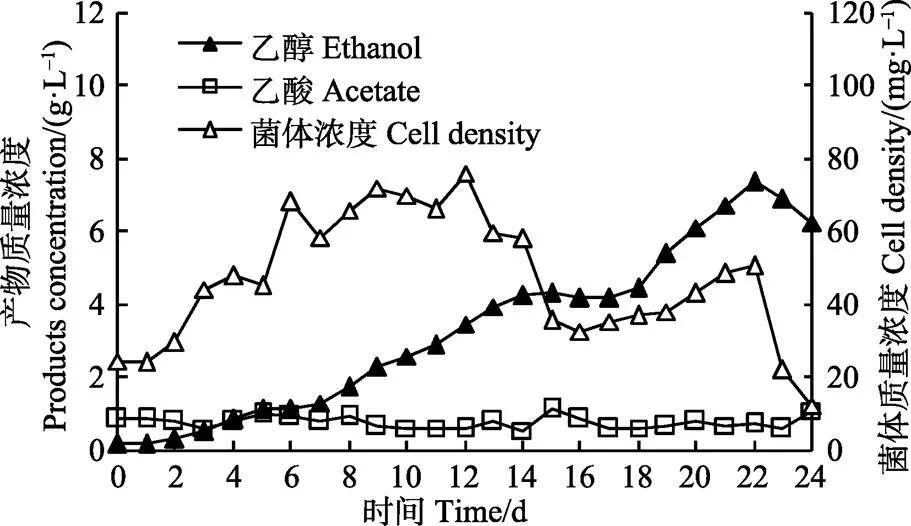
图5 C. autoethanogenum的CO发酵曲线
3 结 论
代谢木糖的产物以乙酸为主,只产生少量乙醇。在含有机氮源的培养基中生长迅速,菌体浓度高,在仅含无机氮源NH4Cl的培养基上生长缓慢,菌体浓度较低。
在小型罐式反应器中进行的批式发酵,结果显示发酵过程中pH值及ORP的变化与代谢产物乙醇和乙酸的分布密切相关。采用木糖生长-CO发酵两步法,乙醇主要在CO发酵阶段产生;以CO为生长及发酵阶段的唯一碳源,虽然得到的菌体浓度降低了,但是反应器经改进之后发酵时间得以延长,CO的利用增加,发酵所得的乙醇浓度比两步法提高了3倍以上,远远高于文献报道的数值,而另一产物乙酸的浓度在整个发酵过程中一直处于较低的水平。
[1] Balat M, Balat H, Öz C. Progress in bioethanol processing[J]. Progress in Energy & Combustion Science, 2008, 34(5): 551-573.
[2] Olson E S, Aulich T R, Sharma R K, et al. Ester fuels and chemicals from biomass[J]. Applied Biochemistry and Biotechnology, 2003, 108(1): 843-851.
[3] Kumar P, Barrett D M, Delwiche M J, et al. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production[J]. Industrial & Engineering Chemistry Research, 2009, 48(8): 3713-3729.
[4] Daniell J, Köpke M, Simpson S D. Commercial biomass syngas fermentation.[J]. Energies, 2012, 5(12): 5372-5417.
[5] Henstra A M, Sipma J, Rinzema A, et al. Microbiology of synthesis gas fermentation for biofuel production[J]. Current Opinion in Biotechnology, 2007, 18(3): 200-206.
[6] Klasson K T, Ackerson M D, Clausen E C, et al. Biological conversion of coal and coal-derived synthesis gas[J]. Fuel, 1993, 72(12): 1673-1678.
[7] Grethlein A J, Worden R M, Jain M K, et al. Continuous production of mixed alcohols and acids from carbon monoxide[J]. Applied Biochemistry and Biotechnology, 1990, 24/25(1): 875-884.
[8] Liou J S, Balkwill D L, Drake G R, et al.sp. nov., a solvent-producing clostridium isolated from an agricultural settling lagoon, and reclassification of the acetogenstrain SL1 assp. nov.[J]. International Journal of Systematic & Evolutionary Microbiology, 2005, 55(5): 2085-2091.
[9] Abrini J, Naveau H, Nyns E J.sp. nov., an anaerobic bacterium that produces ethanol from carbon monoxide[J]. Archives of Microbiology, 1994, 161(4): 345-351.
[10] Saxena J, Tanner R S. Effect of trace metals on ethanol production from synthesis gas by the ethanologenic acetogen,[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(4): 513-521.
[11] Huber G W, Iborra S, Corma A. Synthesis of transportation fuels from biomass: Chemistry, catalysts, and engineering[J]. Chemical Reviews, 2006, 106(9): 4044-4098.
[12] Kasteren J M N V. Co-gasification of wood and polyethylene with the aim of CO and H2production[J]. Journal of Material Cycles and Waste Management, 2006, 8(2): 95-98.
[13] Xu H, Liang C, Yuan Z, et al. A study of CO/syngas bioconversion bywith a flexible gas-cultivation system.[J]. Enzyme & Microbial Technology, 2017, 101: 24.
[14] Cotter J L, Chinn M S, Grunden A M. Influence of process parameters on growth ofandon synthesis gas. [J]. Enzyme & Microbial Technology, 2009, 44(5): 281-288.
[15] Datar R P, Rajagopalan S, Lewis R S. Formation of ethanol from carbon monoxide via a new microbial catalyst[J]. Biomass & Bioenergy, 2002, 23(6): 487-493.
[16] 徐惠娟,梁翠谊,许敬亮,等. 合成气发酵梭菌的生长特性与CO发酵性能[J]. 华南理工大学学报:自然科学版,2014,42(11):136-142. Xu Huijuan, Liang Cuiyi, Xu Jingliang, et al. Growth characteristics and carbon monoxide fermentation performance of[J]. Journal of South China University of Technology: Natural Science Edition, 2014, 42(11): 136-142. (in Chinese with English abstract)
[17] Cotter J L, Chinn M S, Grunden A M. Ethanol and acetate production byandusing resting cells.[J]. Bioprocess and Biosystems Engineering, 2009, 32(3): 369-380.
[18] Klasson K T, Ackerson M D, Clausen E C, et al. Bioconversion of synthesis gas into liquid or gaseous fuels[J]. Enzyme & Microbial Technology, 1992, 14(8): 602-608.
[19] Abubackar H N, Veiga M C, Kennes C. Biological conversion of carbon monoxide: Rich syngas or waste gases to bioethanol[J]. Biofuels Bioproducts & Biorefining, 2011, 5(1): 93-114.
[20] Hurst K M, Lewis R S. Carbon monoxide partial pressure effects on the metabolic process of syngas fermentation[J]. Biochemical Engineering Journal, 2010, 48(2): 159-165.
[21] Phillips J R, Klasson K T, Clausen E C, et al. Biological production of ethanol from coal synthesis gas[J]. Applied Biochemistry & Biotechnology, 1993, 39/40(1): 559-571.
[22] Worden R M, Grethlein A J, Zeikus J G, et al. Butyrate production from carbon monoxide by[J]. Applied Biochemistry & Biotechnology, 1989, 20/21(1): 687-698.
[23] Abubackar H N, Veiga M C, Kennes C. Carbon monoxide fermentation to ethanol byin a bioreactor with no accumulation of acetic acid[J]. Bioresource Technology, 2015, 186: 122-127.
[24] Guo Y, Xu J, Zhang Y, et al. Medium optimization for ethanol production withwith carbon monoxide as sole carbon source[J]. Bioresource Technology, 2010, 101(22): 8784.
[25] Abubackar H N, Veiga M C, Kennes C. Biological conversion of carbon monoxide to ethanol: Effect of pH, gas pressure, reducing agent and yeast extract[J]. Bioresource Technology, 2012, 114(2): 518.
徐惠娟,梁翠谊,许敬亮,何敏超,袁振宏,陈小燕,张 宇. CO一步法发酵产乙醇的工艺研究[J]. 农业工程学报,2017,33(23):246-251. doi:10.11975/j.issn.1002-6819.2017.23.032 http://www.tcsae.org
Xu Huijuan, Liang Cuiyi, Xu Jingliang, He Minchao, Yuan Zhenhong, Chen Xiaoyan, Zhang Yu.Study on one-step ethanol production from CO by[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(23): 246-251. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2017.23.032 http://www.tcsae.org
Study on one-step ethanol production from CO by
Xu Huijuan1,2, Liang Cuiyi1, Xu Jingliang1,2※, He Minchao1, Yuan Zhenhong1,2, Chen Xiaoyan1, Zhang Yu1
(1.510640,; 2.510640,)
Fuel ethanol has been recognized as a kind of potential alternative fuel as well as an additive to gasoline because of its oxygenated and high octane characteristics. Syngas fermentation, a novel route for ethanol production, is getting more and more attention. Syngas can be generated from a lot of organic materials including biomass. Gasification technology is used to convert the biomass into a mixture of gases (consisting mainly of CO, CO2and H2), which is subsequently fermented to ethanol by means of anaerobic microbial catalysts known as homoacetogens. As a homoacetogen,is able to metabolize syngas/CO and synthesize ethanol, but limited work has been accomplished with it and ethanol concentration achieved was low. In order to improve its ethanol production, fermentation process and some factors affecting cell growth or product formation were studied. Although xylose is an easily-used carbon source for, results showed that the primary end product in xylose metabolism was acetate, while ethanol remained in a low level even with high level of xylose (8-10 g/L).grew rapidly in the medium containing xylose and organic nitrogen source, and high cell density was achieved. When nitrogen source was switched to NH4Cl,grew much slowly and the overall cell density diminished. However, nitrogen source didn’t have much influence on ethanol production if xylose was used as the carbon source. Two-step fermentation, i.e., growing on xylose (first stage) and then fermenting with CO (second stage), was performed in a 3 L bioreactor to study the batch fermentation of. Results indicated that cell growth and acetate production occurred in the first stage, whereas ethanol was primarily produced in the second stage when xylose was exhausted and CO became the sole carbon source. Fermentation curves showed that pH value and oxidation-reduction potential (ORP) dropped with cell growth and acetate production, while ethanol production was accompanied by the decrease of acetate concentration and the rise of pH value and ORP. CO2evolution was observed in both growth and fermentation stages, and a small amount of H2was detected in the outlet gas during the CO fermentation stage. But due to the limitations of bioreactor and operating conditions, gas-liquid mass transfer in the bioreactor was poor, which resulted in the low efficiency of CO utilization, and only 1.71 g/L ethanol was obtained. To eliminate the limitations, the bioreactor was modified and equipped with a specific device which could keep a constant pressure in the headspace. One-step fermentation was carried out in the modified bioreactor using CO as the sole carbon and energy source. In spite of reduced growth rate and cell density,produced more ethanol than it did in two-step fermentation. The maximum ethanol concentration obtained was 7.36 g/L, much greater than that reported in the previous studies. Moreover, during the whole fermentation process, acetate concentration remained lower than 1.1 g/L. Summarily, the results suggest thatis a promising strain in ethanol production from CO, and this study presents a reference for the scale-up of CO fermentation to ethanol with
ethanol; fermentation; carbon monoxide; syngas fermentation; acetate;
10.11975/j.issn.1002-6819.2017.23.032
Q815
A
1002-6819(2017)-23-0246-06
2017-07-31
2017-11-09
国家高技术研究发展计划(2015AA020202);广州市科技计划项目(2014J4100220)
徐惠娟,女,博士,副研究员,主要从事燃料乙醇生物合成研究。Email:xuhj@ms.giec.ac.cn
许敬亮,男,博士,研究员,主要从事生物质能生化转化研究。Email:xjl@ms.giec.ac.cn
