131I-B2-S22-AFA对HER-2高表达乳腺癌细胞的杀伤作用
2017-12-19李亚梅关晏星陈学忠张青张庆章梦芝
李亚梅 关晏星 陈学忠 张青 张庆 章梦芝
131I-B2-S22-AFA对HER-2高表达乳腺癌细胞的杀伤作用
李亚梅 关晏星 陈学忠 张青 张庆 章梦芝
(南昌大学第一附属医院核医学科 南昌 330006)
人类表皮生长因子受体2 (Human Epidermal Growth Factor Receptor 2, HER-2)是乳腺癌最重要的致病基因。本文探讨131I标记的HER-2特异结合小分子模拟肽B2-S22-AFA对乳腺癌细胞的特异性杀伤作用。采用溴代琥珀酰亚胺法(N-Bromide Succinimide, NBS)进行131I标记B2-S22-AFA,测定标记率、放化纯度、稳定性及免疫活性。用Western Blot法和免疫组化法测定人乳腺癌SKBR3及MDA-MB-231Her-2细胞HER-2表达,观察不同浓度表皮生长因子(Epidermal Growth Factor, EGF)条件下B2-S22-AFA对细胞生长的抑制率。设B2-S22-AFA组(B2-S22-AFA终浓度1 µg∙mL–1)、131I-B2-S22-AFA组(131I-B2-S22-AFA终浓度144 kBq∙µg–1∙mL)、131I组(131I终浓度144 kBq∙mL–1)、阴性对照组及试剂空白组,每组EGF终浓度均5.0 pg∙mL–1,采用四唑盐比色法(Methyl Thiazolyl Tetrazolium, MTT)测定SKBR3和MDA-MB-231细胞增殖活性,观察131I-B2-S22-AFA、B2-S22-AFA及131I作用不同时间对两种细胞生长的抑制率。结果显示,HER-2在SKBR3细胞呈强阳性表达,在MDA-MB-231细胞呈弱(或低)表达。131I-B2-S22-AFA标记率、放化纯度及比活度分别为64.8%–79.6%、95.0%–97.6%、151.7 MBq∙mg–1,在37 °C血清中放置4 h、12 h、24 h、48 h、72 h的放化纯度分别95.4%、93.5%、91.4%、88.2%、77.4%,131I-B2-S22-AFA与SKBR3细胞及MDA-MB-231细胞的最大结合率分别(66.47±3.24)%和(3.89±0.81)%(3次)。当EGF存在时,B2-S22-AFA可明显抑制SKBR3细胞生长;无EGF时,B2-S22-AFA无此作用。131I-B2-S22-AFA对SKBR3细胞的杀伤作用较B2-S22-AFA和131I明显增强(均<0.05),B2-S22-AFA对SKBR3细胞杀伤作用显著高于131I (<0.05),131I-B2-S22-AFA和B2-S22-AFA对MDA-MB-231细胞均无杀伤作用。综上所述,131I-B2-S22-AFA可显著加强、加速B2-S22-AFA对HER-2高表达乳腺癌细胞的特异性杀伤作用。
乳腺癌,同位素标记,131I-B2-S22-AFA,表皮生长因子受体2
乳腺癌是全球妇女最常见的恶性肿瘤之一,我国乳腺癌的死亡率呈逐年上升趋势[1]。研究证明[2],人类表皮生长因子受体2 (Human Epidermal Growth Factor Receptor 2, HER-2)与乳腺癌发生、发展、放化疗抵抗及不良预后密切相关,HER-2靶向治疗已经成为乳腺癌生物治疗的主要手段,其中针对HER-2受体胞外结合区的抗肿瘤生物靶向治疗药物人源化抗HER-2单克隆抗体赫赛汀的临床应用显示出良好的临床效果,但由于分子量大,难以到达实体瘤深部,疗效受到限制,大规模临床使用后又发现了耐药的产生。本研究在Berezov等[3]研究成果的基础上,对具有同样阻断HER-2功能的小分子多肽B2-S22-AFA进行131I标记,观察其在体外对HER-2高表达乳腺癌细胞SKBR3的生物和放射性双重靶向杀伤作用,为HER-2阳性乳腺癌靶向治疗研究增添新手段,为提高乳腺癌HER-2生物靶向治疗效果的研究奠定基础。
1 材料与方法
1.1 主要试剂及器材
HER-2高亲和力模拟肽B2-S22-AFA(序列为:YCFPDEEGACY)的合成与纯化(北京博奥森生物技术有限公司,纯度98%以上);细胞株SKBR3和MDA-MB-231(中国科学院上海细胞库);重组人表皮生长因子(Epidermal Growth Factors, EGF)(美国Cytolab公司产品);辣根过氧化物酶标记的羊抗鼠IgG(北京中杉生物公司产品);抗-HER-2单克隆抗体(美国Milipore公司产品);无载体Na131I(中国原子能科学院同位素所生产);N-溴代琥珀酸亚胺(N-Bromide Succinimide, NBS)、Sephadex G-25、MTT(4,5-二甲基噻唑-2-2,5-二苯基四氮唑溴盐)、胰蛋白酶和DMSO(二甲基亚砜)均美国Sigma公司产品;胎牛血清(美国Hyclone公司产品);RPMI 1640培养基(美国Gebico公司产品);0.22mm滤膜(美国Millipor产品);96孔细胞培养板(美国Costar公司产品)。GC-911型γ免疫计数仪(合肥中佳光电仪器公司产品);酶联免疫监测仪2550(美国BIO-RAD公司产品);RM-905A放射性活度计(中国科学计量研究院产品);高速低温冷冻离心机(美国SIGMA公司产品);CPA64型电子天平(美国Sartorius公司产品);倒置显微镜(美国Leica公司生产);DHZ-C型可调式恒温振荡仪(江苏太仓实验设备厂生产)。
1.2 方法
1.2.1 细胞培养
人乳腺癌SKBR3和MDA-MB-231细胞复苏后,加RPMI 1640培养液(内含2 mmol∙L−1谷氨酰胺,100 U·mL−1的青霉素和链霉素,对SKBR3细胞培养另加灭活的10%新生小牛血清,对MDA- MB-231细胞培养另加10%胎牛血清)置于37 °C、5% CO2、95%湿度的孵箱培养,每24 h换液一次,每2−3 d(细胞覆盖率达70%−80%)传代一次。倒置显微镜观察细胞生长情况,根据培养基中酚红颜色判断细胞代谢状态,取对数生长期细胞用于实验。
1.2.2 人乳腺癌细胞表面HER-2表达水平测定
采用Western Blot和免疫组化法测定人乳腺癌SKBR3、MDA-MB-231细胞表面HER-2表达水平。
免疫组化(Immunohistochemistry, IHC)法:对数生长期的SKBR3细胞、MDA-MB-2321细胞,胰酶消化,以(5−10)×104细胞数分别接种于放好灭菌爬片的12孔细胞培养板,孵箱培养24 h,磷酸盐缓冲液漂洗,加4%多聚甲醛固定30 min,漂洗,3% H2O2孵育15 min,再漂洗。用10%的山羊血清封闭30min,倾去封闭液,滴加一抗(兔抗HER-2抗体)200 μL,4 °C孵育过夜。空白对照用PBS代替一抗,均漂洗后滴加二抗(山羊抗兔)200 μL,37 °C结合30 min。漂洗袪除游离抗体,滴加二氨基联苯胺(3,3’-diaminobenzidine, DAB)底物显色液,避光孵育5−10 min,自来水冲洗,苏木素复核15−30 s,封片,显微镜下观察并采集图像。由两位经验丰富的病理科医师综合阳性细胞所占比例和染色强度进行半定量分析[4]。阳性细胞所占比例评分标准:阳性细胞数小于10%者计0分,10%−40%者计1分,40%−70%者计2分,大于等于70%者计3分。染色强度评分标准:不着色者计0分,淡黄色者计1分,棕黄色者计2分,黄褐色者计3分。两种评分相加:0−1分为不表达(−),2分为弱阳性表达(+),3−4分为阳性表达(2+),5−6分为强阳性表达(3+)。
蛋白质免疫印迹(Western Blot)法:对数生长期的SKBR3细胞、MDA-MB-2321细胞接种于平皿培养板,培养至细胞长满整壁,收集细胞,加细胞裂解液RIPA 100 μL,12000 r∙min−1,离心20 min。取上清,应用紫外分光光度计测定SKBR3、MDA-MB-231细胞表面蛋白含量,以标准蛋白作对照,取等量蛋白将二种细胞蛋白上样SDS-PAGE胶孔进行电泳。电泳完毕电转印,5%脱脂奶粉封闭,4 °C过夜,依次与一抗(鼠抗人HER-2抗体)、二抗(辣根过氧化物酶标记的羊抗鼠IgG)作用,分别采用电化学发光免疫检测法(Electrochemical Luminescence, ECL)及DAB染色法进行Western印迹分析。
1.2.3 B2-S22-AFA的131I标记及质量鉴定
采用溴代琥珀酰亚胺法:首先用0.1 mol∙L−1PBS (pH 7.4)溶解B2-S22-AFA和NBS,依次加入B2-S22-AFA 0.5 mg/0.2 mL、Na131I 55.5 MBq/ 0.2mL、NBS 2 µg/5 µL,室温下振荡60 s,反应结束。三氯醋酸沉淀法测定标记率:取标记反应液5µL、5% BSA 50 µL及5%三氯醋酸0.2 mL,混匀,2000 g离心5 min,测定每管(双复管)总放射性计数(),吸去上清,测沉淀放射性计数()。计算标记率(Labeling Rate, LR):
L=(/)×100% (1)
采用Sephadex G-25凝胶柱层析过滤纯化标记反应液,以每分钟15滴的速度分部收集淋洗液,共收集60管,每管1 mL(约20滴),测定每管放射性,将测量结果对管次作图,得到131I-B2-S22-AFA洗脱曲线,收集放射性活度最高的蛋白峰管的洗脱液即为纯化后的标记产品131I-B2-S22-AFA。标记产品用新华1号滤纸点样,以丙酮:生理盐水体积比为1:1的混合液作展开剂,做上行纸层析,将层析完后的层析纸从下到上逐段剪开(每段1.0 cm),分别测量放射性,131I-B2-S22-AFA浓聚部位的放射性计数(counts per minute, cpm)即cpm与纸层析点样的总放射性计数cpm比值即为131I-B2-S22-AFA的放化纯度(Radiochemical Purity, RCP)。
=cpm/cpm×100% (2)
另将131I-B2-S22-AFA加入人血清中37 °C水浴箱分别放置4 h、12 h、24 h、48 h、72 h,测定RCP,观察稳定性。取131I-B2-S22-AFA 100 µL和10 µL分别测定其蛋白含量(紫外分光光度法)和放射性活度(计数法),计算131I-B2-S22-AFA比活度(放射性活度/单位蛋白量)。采用细胞结合法检测131I- B2-S22-AFA的免疫活性:取50 µL131I-B2-S22-AFA分别加入过量的SKBR3和MDA-MB-231细胞中(均(5−6)×105),于 37 °C孵育2 h,离心后,分别测定上清液(为游离131I)放射性计数(cpm)和沉淀(为与细胞结合的131I-B2-S22-AFA)的放射性计数(cpm)。计算细胞结合率(Binding Rate of Cells, BRC):
乙型肝炎时现在世界上感染人数最多的疾病,我国大约有9.75%的乙肝病毒携带者,该疾病传播速度快,死亡率高。根据研究分析,当前乙肝病毒会引起肝硬化、肝癌等严重疾病,这是患者死亡的主要原因。乙型肝炎的临床传播是通过血液和皮肤黏膜进行的,如果医院对血制品进行严格的控制,对输血过程进行规范化管理,就能够让乙肝病毒传播减少[3]。日常的拥抱、握手和用餐并不会导致乙肝病毒传播。为了减少乙肝病毒的感染率,现在临床中最重要的就是对乙肝病毒复制情况进行检测,方便临床对症下药治疗,提升患者的治愈率。
=cpm/ (cpm+cpm)×100% (3)
1.2.4131I -B2-S22-AFA对乳腺癌细胞杀伤作用
EGF促细胞生长的有效浓度测定:采用MTT法测定细胞增殖活性,取SKBR3和MDA-MB-231单细胞悬液种于96孔培养板中,每孔103个细胞,设三个复孔,按前述条件孵箱培养4h,待细胞贴壁后,设不同浓度EGF组(experimental group, eg,EGF终浓度分别0.15 pg∙mL−1、0.31 pg∙mL−1、0.63pg∙mL−1、1.25 pg∙mL−1、2.5 pg∙mL−1、5 pg∙mL−1、10 pg∙mL−1、20 pg∙mL−1[5]),阴性对照组(negative control group, ncg,为单纯细胞)及试剂空白组(reagent blank group, rbg,仅1640培养液,作为吸光度值的零点),每孔总体积200 µL,孵箱培养96 h后,加入20 µL浓度为5 mg∙mL−1的MTT,继续孵育4 h,吸弃上清,每孔加250 µL DMSO,振荡10 min,用酶联免疫检测仪在490 nm波长下测定其光吸收值(OD490)。计算细胞存活率(Survival Rate of Cell, SRC),绘制EGF对两种细胞生长的剂量-效应曲线,为后续研究选择EGF浓度提供参考。
RC(%)=[(OD490(eg)−OD490(rbg))/(OD490(ncg)−
OD490(rbg))]×100 % (4)
B2-S22-AFA对乳腺癌细胞生长的抑制作用:取上述两种乳腺癌细胞的单细胞悬液分别种于96孔培养板中,每孔103个细胞(100 µL),设3个复孔,孵箱培养4 h。设EGF组(浓度分别5 pg∙mL−1、10pg∙mL−1、20 pg∙mL−1),B2-S22-AFA组(取5µg∙mL−1的B2-S22-AFA[6],加入100 µL/孔)、EGF加B2-S22-AFA组、阴性对照组及试剂空白组,每孔最终体积为200 µL,均培养48 h,采用MTT法测定细胞增殖活性,比较B2-S22-AFA对两种乳腺癌细胞生长的抑制率(The Inhibitory Rate of Cell Growth, IRCG)。
IRCG(%)=[( OD490(ncg)−OD490(rbg))−(OD490(eg)−
OD490(rbg))/(OD490(ncg)−OD490(rbg))]×100% (5)
131I-B2-S22-AFA对乳腺癌细胞的杀伤作用:取上述两种乳腺癌细胞的单细胞悬液分别种于96孔培养板中,每孔5×103个细胞(100 µL),设4个复孔,孵箱培养24 h,弃去培养液,根据预实验,设B2-S22-AFA组(加入B2-S22-AFA的终浓度为1µg∙mL−1)、131I-B2-S22-AFA组(加入131I-B2-S22- AFA的终浓度144 kBq/1 µg∙mL−1)、131I组(加入131I的终浓度为144 kBq∙mL−1)、阴性对照组及试剂空白组,每组EGF终浓度均5.0 pg∙mL−1,每孔最终体积200 µL。各组孵箱培养分别24 h、48 h、72 h、96 h后,采用MTT法测定细胞增殖活性。计算不同时间各组抑制率,比较131I-B2-S22-AFA、B2-S22-AFA及131I对两种不同乳腺癌细胞生长的抑制率。
1.2.5 统计学分析
采用SPSS 17.0统计学软件对数据进行统计分析。计量资料以均数±标准差表示,组间比较采用独立样本检验。<0.05为差异有统计学意义。
2 结果
2.1 细胞表面HER-2表达水平
免疫组化检测结果显示,SK-BR-3细胞HER-2表达强阳性(3+),MDA-MB-231细胞HER-2表达阴性(图1)。Western Blot法检测,ECL和DAB两种显色方法佐证的结果相同:均见SKBR3在蛋白量40mg时已出现条带,条带粗细均与上样蛋白量呈正相关;MDA-MB-231在蛋白量达160mg时仍未出现条带(图2)。

图1 IHC分析示SK-BR-3细胞HER-2表达(3+)(a)和MDA-MB-231细胞HER-2表达(−)(b)(×400)

图2 乳腺癌SKBR3和MDA-MB-231细胞表面HER-2蛋白表达分析 (a) ECI方法,(b) DAB法
2.2 131I-B2-S22-AFA鉴定
采用NBS法碘-131标记B2-S22-AFA的标记率为64.8%−79.6%,经SephadexG-25凝胶柱层析过滤纯化标记反应液后得到明显的双峰曲线,即产品131I-B2-S22-AFA峰高、尖、窄,131I盐峰低平,未见131I-B2-S22-AFA损伤峰和聚合峰(图3)。131I-B2-S22-AFA放化纯度为95.0%−97.6%,比活度为151.7 MBq∙mg−1。37 °C血清中放置4 h、12 h、24 h、48 h、72 h的放化纯度分别95.4%、93.5%、91.4%、88.2%、77.4%。131I-B2-S22-AFA与HER-2高表达的SKBR3细胞和HER-2低或不表达的MDA-MB-231细胞最大结合率分别(66.47±3.24)%和(3.89±0.81)%(3次)。

图3 131I标记HER2模拟肽(131I-B2-S22-AFA)洗脱曲线
2.3 EGF对两种乳腺癌细胞生长促进作用的有效浓度测定
EGF对SKBR3和MDA-MB-231细胞生长均有促进作用,但在相同EGF浓度下对HER-2高表达的SKBR3作用明显强于MDA-MB-231细胞,当其浓度为5 pg∙mL−1时,对两种细胞均有明显的促生长作用(图4)。
2.4 B2-S22-AFA对乳腺癌细胞生长的抑制作用

图4 EGF作用于SKBR3、MDA-MB-231细胞的剂量效应曲线
2.5 131I-B2-S22-AFA对HER-2高表达SKBR3细胞的杀伤作用
表1显示在131I-B2-S22-AFA与B2-S22-AFA化学量相同的条件下,131I-B2-S22-AFA组对HER-2高表达SKBR3细胞作用各时相的抑制率均显著高于未标记B2-S22-AFA组和游离131I组(<0.05);131I-B2-S22-AFA组和B2-S22-AFA组对SKBR3细胞生长的抑制率分别在48 h和72 h达到最大(图6),131I-B2-S22-AFA的最高抑制率(67.01±3.22)%显著高于B2-S22-AFA的最高抑制率(49.25±0.374)%,<0.05。未标记B2-S22-AFA组对SKBR3细胞作用各时相的抑制率均显著高于游离131I(均<0.05)。
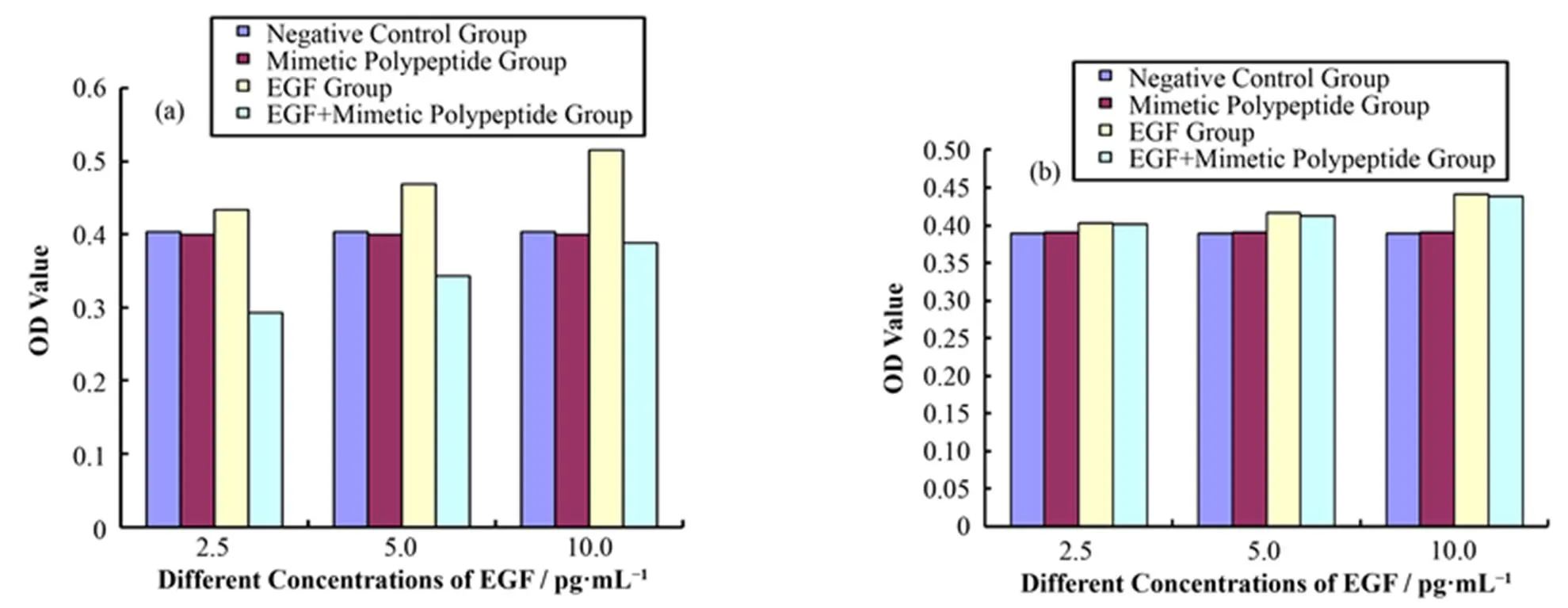
图5 EGF不同浓度下B2-S22-AFA对两种细胞生长的影响 (a) SKBR3细胞,(b) MDA-MB-231细胞

表1 不同处理组作用不同时间对SKBR3细胞生长的抑制率
注:(1)与(2)比较、(1)与(3)比较及(2)与(3)比较均<0.05
Note: Comparison between (1) and (2), (1) and (3), (2) and (3), all<0.05.

图6 各药物组对HER-2高表达SKBR3细胞生长的时间-抑制曲线
显微镜下观察碘-131标记与未标记B2-S22- AFA组SKBR3细胞生长状态,显示B2-S22-AFA组细胞生长状态差,细胞透明度减低,核颗粒明显增多,染色质增粗呈松解状态,但细胞形态未见明显改变。131I-B2-S22-AFA组大部分细胞分解、核碎裂,形态不规则、细胞碎片多(图7、8)。131I-B2-S22-AFA作用的MDA-MB-231细胞形态规则,呈梭形、条形或多角形,生长状态良好(×400倍)(图9)。
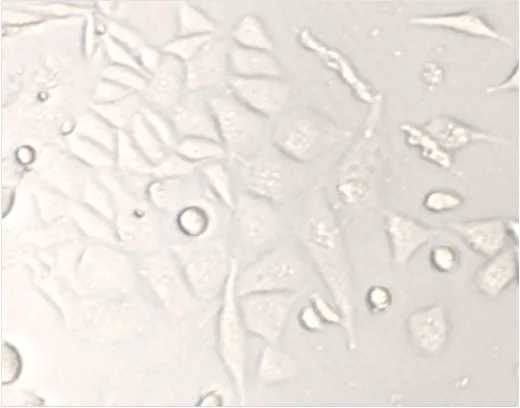
图7 B2-S22-AFA作用SKBR3细胞48 h后,镜下细胞生长状态差,细胞透明度减低,核颗粒明显增多,染色质增粗呈松解状态,但细胞形态未见明显改变(×400倍)

图8 131I-B2-S22-AFA作用SKBR3细胞48 h后,镜下大部分细胞分解、核碎裂,形态不规则,细胞碎片多见(×400倍)
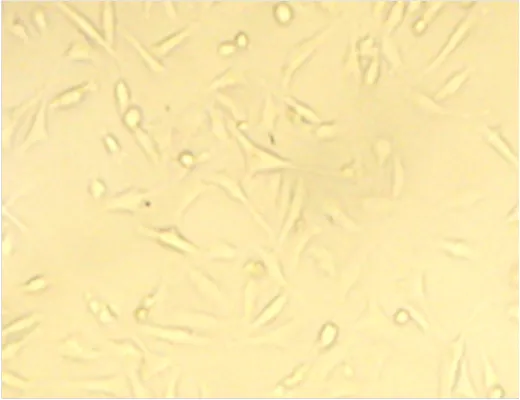
图9 131I-B2-S22-AFA作用48 h后,MDA-MB-231细胞镜 下细胞形态规则,呈梭形、条形或多角形,生长状态良好(×400倍)
表2显示131I-B2-S22-AFA对HER-2低表达MDA-MB-231细胞生长的各时相抑制率均极低,小于10.0%,其与游离131I作用无显著差异(均>0.05);B2-S22-AFA对MDA-MB-231细胞生长无抑制作用。
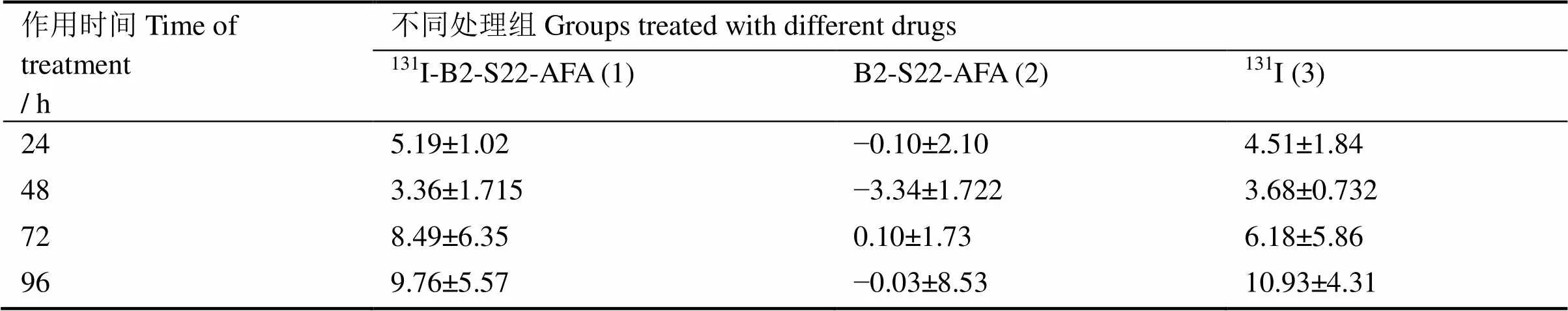
表2 不同处理组不同作用时间对MDA-MB-231细胞生长的抑制率
注:24 h、48 h、72 h:(1)与(2)比较,(2)与(3)比较,<0.05;(1)与(3)比较,>0.05;96 h:(1)与(2)比较,(2)与(3)比较,(1)与(3)比较,均>0.05
Notes: 24 h, 48 h, 72 h: comparison between (1) and (2), (2) and (3),<0.05; (1) and (3),>0.05; 96 h: comparison between (1) and (2), (2) and (3), (1) and (3),>0.05.
3 讨论
针对HER-2高表达乳腺癌的分子影像诊断和靶向治疗一直是乳腺癌研究的热点。B2-S22-AFA为具有11个氨基酸组成的多肽,可特异结合HER-2受体的胞外结合域,阻止配体或各种生长因子(如EGF)与HER-2结合,从而抑制配体介导的受体活化后导致的细胞恶性转化和增殖。赫赛汀的主要作用机制也即在于此,其联合化疗药物的临床应用已作为目前HER-2高表达乳腺癌的首选治疗方案。但是赫赛汀价格昂贵,对心脏有一定的毒副作用,且由于抗体分子量大,难以到达实体瘤深部,减弱治疗效果;鼠源性单抗用于人体还可产生人抗鼠抗体(Human Anti Mouse Antibody, HAMA)的不良反应等。利用小分子多肽模仿抗HER-2抗体与HER-2结合,同样可达到治疗目的,并且与单抗相比,小分子多肽具有以下优点:1) 可化学合成,制备方便、经济;2) 不仅修饰或放射性标记过程等苛刻条件对其生物活性影响小,而且利用化学方法还可优化其与受体结合的亲和力,使之具有更好的特异性分布和药物动力学性质[5];3)由于分子量小,引起人体免疫反应的可能性较小,血浆清除快,可较快浓集于靶器官,较易达到肿瘤组织深部,提高疗效。Berezov等[3]的研究证实,模拟肽B2-S22-AFA与乳腺癌细胞HER-1、HER-2、HER-3均具有高结合亲和力,尤其与HER-2结合的亲和力最高,并且与HER-2特异结合后可阻止二聚体的形成,明显抑制HER-2高表达乳腺癌细胞的增殖。这与本研究中B2-S22-AFA对HER-2高表达乳腺癌细胞生长的抑制作用研究结果基本一致。
EGF是潜在的有丝分裂因子,当恶性肿瘤高表达EGFR时,其通过与靶细胞受体结合,可促进肿瘤细胞增殖,在恶性肿瘤的发生及生长中起一定的作用。本研究中B2-S22-AFA对乳腺癌细胞生长的抑制作用研究显示:在EGF存在的条件下,B2-S22-AFA对体外培养的SKBR3细胞生长有明显抑制作用,并随EGF浓度的增加,抑制率减低,在无EGF的条件下,对SKBR3细胞生长则无抑制作用。B2-S22-AFA对HER-2低表达的MDA-MB-231细胞的生长无论有否EGF存在,均无明显抑制作用。另见B2-S22-AFA对SKBR3细胞生长不同时间的抑制率均显著高于游离131I(均<0.05)。表明B2-S22-AFA通过阻断EGF促细胞生长作用特异性抑制HER-2高表达细胞的生长。分析其机制,考虑主要如下:1) HER-2胞外区分4个亚区,Ⅰ、Ⅲ亚区是配体结合部位,Ⅳ亚区是受体与受体结合部位。受体与配体结合后,Ⅳ区更易与游离受体或受体-配体复合物结合形成受体二聚体,而HER受体二聚体的形成则是引起信号传导、导致乳腺癌的发生、发展的重要因素。B2-S22-AFA是根据HER-2受体4亚区设计的,当受体与配体(如EGF等)结合形成受体-配体复合物后,B2-S22-AFA才能与受体的4亚区结合,阻止受体二聚体的形成,阻断细胞内信号传导,抑制肿瘤细胞的恶性增殖。EGF是旁分泌生长因子,SKBR3细胞不分泌,所以培养液中需加入一定浓度EGF,B2-S22-AFA才能发挥作用。2) 当EGF浓度过高时,B2-S22-AFA的抑制作用难以抵抗EGF的促生长作用,则其对SKBR3细胞生长的抑制作用减弱。
放射性核素碘-131是标记蛋白和多肽类的最常用放射性核素[7−9],易于获得、价格便宜,主要发射β射线,半衰期较长(8.04 d),有利于发挥治疗作用,此外还可发射γ射线,用于治疗后显像观察疗效。为进一步提高B2-S22-AFA的生物靶向杀伤作用,本研究采用NBS法制备碘-131标记的B2-S22-AFA (131I-B2-S22-AFA),进一步观察该放射性药物对HER-2高表达乳腺癌细胞的放射性和生物靶向双重杀伤效果。
碘-131标记结果显示,产品标记率较高,放化纯度高(95.0%−97.6%),体外37 °C血清中放置24 h、48 h、72 h的放化纯度仍可分别达到91.4%、88.2%、77.4%,表明较不易分解或脱标记,稳定性较好。131I-B2-S22-AFA与HER-2高表达的SKBR3细胞和HER-2低或不表达的MDA-MB-231细胞最大结合率分别为(66.47±3.24)%和(3.89±0.81)%(3次),表明其仍保留有高特异性免疫结合活性。分析原因,考虑来自两方面:一是NBS标记方法简单,氧化剂作用温和,反应在室温下进行,对小分子多肽损伤小;二是该小分子肽两端各含一个酪氨酸残基,可直接标记,既有利于获得较高的131I 标记率,也不易影响原有生物活性;另外该小分子多肽呈环状结构,较稳定,不易被血清中蛋白酶分解。选择NBS法131I标记如此小的短肽,国内目前尚未见文献 报道。
131I -B2-S22-AFA靶向杀伤作用研究结果显示:131I-B2-S22-AFA对HER-2高表达SKBR3细胞生长不同时间的抑制率均显著高于未标记B2-S22-AFA和游离131I(均<0.05);131I-B2-S22-AFA对SKBR3细胞生长抑制作用的时间明显快于B2-S22-AFA(两者达最大抑制率时间分别48 h和72 h),131I-B2-S22-AFA对MDA-MB-231生长的抑制作用低,与游离131I的作用无显著差异(均>0.05)。显微镜观察也证实131I-B2-S22-AFA作用的SKBR3细胞大部分分解、核碎裂,形态不规则,表明有明显细胞杀伤。131I -B2-S22-AFA 作用的MDA-MB-231细胞,形态规则,呈梭形、条形或多角形,生长状态良好,无损伤。B2-S22-AFA作用的SKBR3细胞生长状态差,细胞透明度不高,核颗粒明显增多,染色质增粗呈松解状态,但细胞形态未见明显改变,表明其杀伤作用明显不如131I-B2-S22-AFA。
综上所述,B2-S22-AFA对HER-2高表达SKBR3细胞具有特异性生物杀伤作用,131I-B2-S22-AFA可进一步明显加强、加速B2-S22-AFA的靶向杀伤作用,131I -B2-S22-AFA对HER-2高表达乳腺癌SKBR3细胞具有放射性和生物性双重靶向杀伤作用。
HER-2既是乳腺癌的治疗靶点[10−12],也是HER-2阳性乳腺癌显像的示踪分子。我们最近尚采用放射性核素99mTc标记此模拟肽,成功制备了HER-2放射性配体99mTc-TP1623,对HER-2高表达乳腺癌(SKBR3细胞接种)小鼠显像研究证明,该标记多肽能靶向聚集在肿瘤部位,靶/非靶比值最高达到5.18[13]。本文研究结果为进一步放射性核素标记该模拟肽的体内靶向治疗实验研究提供理论依据。为提高乳腺癌HER-2生物靶向治疗效果的研究奠定基础。
本研究结果为进一步进行该标记药物的体内靶向治疗实验研究奠定了基础。
1 王乐,张玥, 石菊芳, 等. 中国女性乳腺癌疾病负担分析[J]. 中华流行病学杂志, 2016, 37(7): 970−976. DOI: 10.3760/cma.j.issn.0254-6450.2016.07.013. WANG Le, ZHANG Yue, SHI Jufang,. Disease burden of female breast cancerinchina[J]. Chinese Journal of Epidemiology, 2016, 37(7): 970−976. DOI: 10.3760/ cma.J.issn.0254-6450.2016.07.013.
2 Carlsson J. Potential for clinical radionuclide-based imaging and therapy of common cancers expressing EGFR-family receptors[J]. Tumour Biology, 2012, 33(3): 653−659. DOI: 10.1007/s13277-011-0307-x.
3 Berezov A, Chen J, Liu Q,. Disabling receptor ensembles with rationally designed interface peptidomimetics[J]. Journal of Biological Chemistry, 2002, 277(31): 28330−28339. DOI: 10.1074/jbc. M202880200.
4 Zhang J M, Zhao X M, Wang S J,. Monitoring therapeutic response of human ovarian cancer to trastuzumab by SPECT imaging with99mTc-peptide- ZHER2:342[J]. Nuclear Medicine and Biology, 2015, 42(6): 541−546. DOI: 10.1016/j.nucmedbio.2015.02.002.
5 钟锦绣, 李亚梅, 关晏星. 乳腺癌HER-2胞外配体结合区靶点治疗的研究进展[J]. 中国肿瘤临床, 2013, 4(17): 1076−1079. DOI: 10.3969/j.issn.1000-8179.20130329.ZHONG Jinxiu, LI Yamei, GUAN Yanxing. Research progress on target therapeutic agents of HER-2 extracellular ligand-binding domain in breast cancer[J]. Chinese Journal Clinical Oncology, 2013, 4(17): 1076−1079. DOI: 10.3969/j.issn.1000-8179.20130329.
6 郭文平, 赵阳, 卢小梅, 等. 重组人表皮生长因子对体外培养人角质细胞增殖的影响[J]. 中国临床康复, 2005, 9(38): 44−46. DOI: 10.3321/j.issn:1673-8225.2005.38. 023.GUO Wenping, ZHAO Yang, LU Xiaomei,. Effects of human recombinant epidermal growth factor on proliferation of human keratinocyte cultured[J]. Chinese Journal of Clinical Rehabilition, 2005, 9(38): 44−46. DOI: 10.3321/j.issn:1673-8225.2005.38.023.
7 范义湘, 石卫民, 罗荣城, 等.131I-Herceptin在荷人乳腺癌裸鼠模型中的生物分布及抗肿瘤活性研究[J]. 中华核医学杂志, 2009, 29(5): 311−315. DOI: 10.3760/cma. j.issn.0253-9780.2009.05.007.FAN Yixiang, SHI Weimin, LUO Rongcheng,. Experimental study on biodistribution and anticancer activity of131I-Herceptin in breast cancer xenograft[J]. Chinese Journal Nuclear Medicine, 2009, 29(5): 311−315. DOI: 10.3760/cma.j.issn.0253-9780.2009.05.007.
8 石怡珍, 熊敏超, 胡建铭, 等.131I-Herceptin在昆明小鼠及荷人卵巢癌裸鼠模型中的生物分布和显像[J]. 中华核医学杂志, 2010, 30(3): 170−175. DOI: 10.3760/ cma.j. issn.0253-9780.2010.03.008.SHI Yizhen, XIONG Minchao, HU Jianming,. Biodistribution and radioimmunoimaging of131I- Herceptin in healthy KM mice and nude mouse models bearing human ovarian cancer xenograft[J]. Chinese Journal Nuclear Medicine, 2010, 30(3): 170−175. DOI: 10.3760/cma.j.issn.0253-9780.2010.03.008.
9 马欢, 唐禹, 杨远友, 等.131I标记新型小分子肽VP2[J]. 同位素, 2016, 29(1): 1−4. DOI: 10.7538/tws.2016.29. 01.0001.MA Huan, TANG Yu, YANG Yuanyou,. Preliminary study of radioiodination of VP2[J]. Journal of Isoyopes, 2016, 29(1): 1−4. DOI: 10.7538/tws.2016.29.01.0001.
10 Zhang M Z, Guan Y X, Zhong J X,. Preparation and identification of HER2 radioactive ligands and imaging study of breast cancer-bearing nude mice[J]. Transl Oncol, 2017, 10: 518−26.
11 Sandberg D, Tolmachev V, Velikyan I,. Intra-image referencing for simplified assessment of HER2-expression in breast cancer metastases using the Affibody molecule ABY-025 with PET and SPECT[J].Journal ofand Molecular, 2017, 44(8): 1337−1346.
12 张龙杰, 侯和磊, 王国明, 等.131I-Trastuzumab对人表皮生长因子受体2过表达乳腺癌细胞的杀伤效应及机制研究[J]. 中华核医学杂志, 2015,35(4): 2095−2848. DOI: 10.3760/cma.j.issn.2095-2845.2015.04.014.ZHANG Longjie, HOU Helei, WANG Guoming,. Tumor inhibitory effects of131I-Trastuzumab on human epidermal growth factor receptor 2 overexpressing breast cancer cells and its possible mechanisms[J]. Chinese Journal Nuclear Medicine, 2015, 35(4): 2095−2848. DOI: 10.376/cma.j.issn.2095-2845.2015.04.014.
13 Zhang M, Guan Y, Zhang J,. Preparation and identification of HER2 radioactive ligands and imaging study of breast cancer-bearing nude mice[J]. Translational Oncology, 2017, 10(4): 518−526.
The killing effect of131I-labeled B2-S22-AFA on breast cancer cells with high HER-2 expression
LI Yamei GUAN Yanxing CHEN Xuezhong ZHANG Qing ZHANG Qing ZHANG Mengzhi
(Department of Nuclear Medicine, the First Affiliated Hospital of Nanchang University, Nanchang 330006, China)
B2-S22-AFA is a kind of small molecule mimetic polypeptide that can conjugate to epidermal growth factor receptor 2 (HER-2) specifically and has obvious depressant effect on breast cancer cells with overexpressing HER-2.This study aims to investigate the specific killing effect of131I-labeled B2-S22-AFA on breast cancer cell with overexpressing HER-2.131I-B2-S22-AFA was prepared by using N-bromosuccinimide method to measure the labeling efficiency, radiochemical purity, stability, and immunocompetence. The expression levels of HER-2 in SKBR3 and MDA-MB-231 cells were detected by Immunohistochemistry and Western Blot. The inhibitory rate of B2-S22-AFA on cell growth was observed with epidermal growth factors (EGF) at different concentrations. Five groups i.e, B2-S22-AFA group (B2-S22-AFA final concentration: 1µg∙mL–1),131I-B2-S22-AFA group (131I-B2-S22-AFA final concentration: 144 kBq/1 µg∙mL–1),131I group (131I final concentration: 144 kBq∙mL–1), negative control group and reagent blank group, were selected for contrast tests with the final concentration of EGF in each group at 5.0 pg∙mL–1. The proliferation and activity of cells were measured by Methyl thiazolyl tetrazolium assay. The inhibitory rates were compared among131I-B2-S22-AFA group, B2-S22-AFA group and131I group in the growth of the two kinds of cells at different time.1) HER-2 receptors were strongly expressed in SKBR3 cells while weakly (low) or no expressed in MDA-MB-231 cells. The radiochemical purity, labeling rate and specific activity of131I-B2-S22-AFA were 95.0%−97.6%, 64.8%−79.6% and 151.7 MBq∙mg–1, respectively. Radiochemical purity of131I-B2-S22-AFA was 95.4%, 93.5%, 91.4%, 88.2% and 77.4% when it was placed at 37 °C in serum for 4 h, 12 h, 24 h, 48 h and 72 h, respectively. The maximum binding rates of SKBR3 and MDA-MB-231 cells were (66.47±3.24)% and (3.89±0.81)% (tested for 3 times) respectively. 2) The inhibitory effect of B2-S22-AFA on the growth of SKBR3 cells only in the presence of EGF. 3) The killing effect of131I-B2-S22-AFA on SKBR3 cells was significantly stronger than that of B2-S22-AFA and131I (<0.05), and the inhibitory effect of B2-S22-AFA on the growth of SKBR3 cells was significantly higher than that of131I (<0.05).131I-B2-S22-AFA and B2-S22-AFA had no obvious killing effect on MDA-MB-231 cells.131I-B2-S22-AFA can significantly enhance and accelerate the specific killing effect of B2-S22-AFA on breast cancer cells with high HER-2 expression.
Breast cancer, Isotope labeling,131I-B2-S22-AFA, Epidermal growth factor receptor 2
LI Yamei, female, born in1974, graduated from Nanchang University with a master’s degree in 2008,focusing on obstetrics and gynecology imaging
GUAN Yanxing, E-mail: yanxingguan2000@aliyun.com
2017-03-21,
2017-10-19
R817.8
10.11889/j.0253-3219.2017.hjs.40.120301
李亚梅,女,1974年出生,2008年于南昌大学获硕士学位,研究领域为妇产科影像学
关晏星,E-mail: yanxingguan2000@aliyun.com
2017-03-21,
2017-10-19
Supported by Ganpo Excellence 555 Project and Natural Science Fund Project of Jiangxi Province (No.2007GZY1419)
江西省赣鄱英才555工程项目及江西省自然科学基金项目(No.2007GZY1419)资助
