山核桃花粉母细胞减数分裂及核型*
2017-12-15徐川梅黄坚钦王正加夏国华张启香黄有军张守攻中国林业科学研究院林业研究所林木遗传育种国家重点实验室北京0009浙江农林大学亚热带森林培育国家重点实验室杭州3300
徐川梅 黄坚钦 王正加 夏国华 张启香 黄有军 张守攻(. 中国林业科学研究院林业研究所 林木遗传育种国家重点实验室 北京0009; . 浙江农林大学 亚热带森林培育国家重点实验室 杭州3300)
山核桃花粉母细胞减数分裂及核型*
徐川梅1,2黄坚钦2王正加2夏国华2张启香2黄有军2张守攻1
(1. 中国林业科学研究院林业研究所 林木遗传育种国家重点实验室 北京100091; 2. 浙江农林大学 亚热带森林培育国家重点实验室 杭州311300)
【目的】 研究山核桃花粉母细胞减数分裂过程中染色体行为变化及其染色体核型特征,进而确定山核桃染色体数目及倍性水平,探索山核桃无融合生殖现象与其倍性水平的关系,丰富山核桃生殖生物学等相关研究内容,同时也为山核桃杂交育种及系统分类等研究提供一些细胞学资料。【方法】 1)以山核桃雄花序为研究材料,采用DAPI荧光染色技术对山核桃花粉母细胞减数分裂过程进行研究。2)以山核桃根尖为材料,采用核型分析技术分析山核桃染色体核型。【结果】 1)山核桃花粉母细胞减数分裂分2次进行。第1次为减数分裂,所形成的子细胞染色体数目减半,分为前期Ⅰ、中期Ⅰ、后期Ⅰ和末期Ⅰ4个阶段,其中前期Ⅰ最为复杂,分为细线期、偶线期、粗线期、双线期和终变期5个时期,所经历时间最长,占整个分裂周期的70%; 第2次为有丝分裂,形成的子细胞染色体数目不再减半,同样分为前期Ⅱ、中期Ⅱ、后期Ⅱ和末期Ⅱ4个阶段,历时较短。2)在减数分裂同步性方面,同一小花的不同花药间及同一花序轴的不同小花间表现较为一致。3)山核桃大多数花粉母细胞减数分裂中染色体行为正常,配成16个二价体,有一定比例的异常花粉母细胞出现,主要表现为中期Ⅰ出现落后染色体,异常率为8.86%,中期Ⅱ表现为不对称分裂,异常率为15.79%。4)山核桃核型公式为2n=32=20m+12sm,染色体相对长度变化范围为4.006(±0.449)~9.559(±1.175),臂比大于2的染色体比例为25.000%,最长染色体与最短染色体之比为2.417±0.456,核型不对称系数为62.875,核型分类属于2B。【结论】 1)山核桃虽然存在无融合生殖现象,但是其花粉母细胞减数分裂仍遵循大多数被子植物减数分裂规律,在整个减数分裂进程中,前期Ⅰ所需时间最长。2)山核桃花粉母细胞减数分裂同步性程度较高,不利于山核桃散粉期的延长。3)山核桃花粉母细胞减数分裂异常情况主要出现在中期Ⅰ及中期Ⅱ 2个阶段。4)山核桃核型属于比较对称的类型,其染色体数目为2n=32,减数分裂配对成16个二价体,在倍性水平上属于二倍体。
山核桃; 减数分裂; 花粉母细胞; 染色体; 核型; 无融合生殖
山核桃(Caryacathayensis)属于胡桃科(Juglandaceae)山核桃属(Carya),是珍贵的经济林树种和世界性著名干果,具有极高的经济价值,主要分布于浙江西部及安徽部分地区,目前已成为山核桃产区农民经济收入的主要来源(Huangetal., 2015)。花粉母细胞减数分裂是植物进行有性生殖必不可少的阶段,通过减数分裂,实现遗传重组及染色体数目减半,在保持物种稳定性及创造遗传变异等方面具有重要意义。染色体核型是一个物种的固有属性,已成为一些物种系统进化及分类研究的关键参数,在一些植物的系统分类及进化研究中发挥了重要的作用(Klosetal., 2009; Chramiec-Gąbiketal., 2012; Sánchez-Jiménezetal., 2012)。
目前在山核桃细胞学研究方面,主要集中在花芽分化、花器官构造、柱头可授性、雌配子体发育及开花生物学特性等方面(黎章炬等, 1986; 黄有军等, 2006; 2007; 张斌等, 2008),一些研究证实,山核桃可能存在无融合生殖现象,但是无融合生殖类型及比例目前尚不清楚(张斌等, 2008; Zhangetal., 2012)。一些研究者认为,植物的无融合生殖特性与其倍性水平有着特殊的关系,一般高倍体进行无融合生殖,低倍体进行有性生殖(刘传虎等, 2007)。山核桃的无融合生殖特性与其倍性水平之间是否存在联系,无融合生殖对山核桃花粉母细胞减数分裂中的染色体行为是否会造成一定影响,目前仅有山核桃染色体数目的报道(Chenetal.,1993),尚无关于其倍性水平的深入研究,在减数分裂进程方面,甚至整个山核桃属没有1个种被报道。为了探索以上问题,本研究对山核桃花粉母细胞减数分裂进程进行了研究,同时利用根尖制片进行了核型分析,以期进一步明确山核桃的倍性水平,阐明山核桃减数分裂过程,丰富山核桃生殖生物学研究内容,为山核桃杂交育种及系统分类等研究提供一些细胞学资料。
1 材料与方法
1.1 材料
1.1.1 山核桃雄花序采集 山核桃雄花序采自于浙江农林大学山核桃苗圃地, 2015年4月初—5月初,每天8:00—11:00点采集1次山核桃雄花序,采集的雄花序用FAA固定液进行固定,放入冰箱中备用。
1.1.2 山核桃根尖材料准备 9月中旬,从山核桃苗圃地采集山核桃新种子放入细沙中,23 ℃条件下进行催芽,待种子萌发至3~5 cm时,剪取根尖部分,用0.002 mol·L-1的8-羟基喹啉溶液室温条件下处理4.5 h,之后转入固定液中固定(甲醇∶乙酸体积比为3∶1),用于后续制片。
1.2 方法
1.2.1 山核桃花粉母细胞制片及观察 固定后的雄花序,经70%、90%及100%的酒精进行梯度脱水,然后用50%酒精和二甲苯的混合液及纯二甲苯对材料进行透明处理,透明后的材料再经过50%酒精和二甲苯的混合液、100%酒精、90%酒精、70%酒精、50%酒精及蒸馏水进行复水处理,每个梯度各处理30 min。复水后的材料再利用浓度为2 μg·mL-1的荧光染料DAPI(4′,6-diamidino-2-phenylindole, 4′, 6-二脒基-2-苯基吲哚)进行染色,染色后的材料用50%的甘油进行压片,利用Zeiss公司的激光共聚焦显微镜(LSM510)进行观察和扫描,不同时期的细胞观察数目均在20个以上。
1.2.2 山核桃根尖染色体制片及核型分析 1)山核桃根尖染色体制片 染色体标本制备参照陈瑞阳等(2002)的方法略进行改进。固定后的幼嫩根尖,用双蒸水冲洗数遍,去除固定液,之后用2.5%的纤维素酶和果胶酶的混合液37 ℃酶解3.5 h,酶解后的材料去除酶液,加入固定液,用镊子夹碎,进行滴片。相差显微镜下(Olympus BX 51)选取染色体分散较开、形态较好的中期染色体制片,利用Giemsa染色液进行染色,染色后的制片在荧光显微镜(Olympus BX 60)100倍油镜下拍照,染色体放大倍数为200倍。
2)山核桃核型分析 根据染色体形态大小等特征,采用Adobe Photo Shop 7.0图像处理软件对染色体进行剪贴、排列和同源染色体配对分析,并利用Motic Images Advanced 3.2高级图像处理软件进行染色体数据测量,共计分析5个染色体中期分裂相。核型分析参照陈瑞阳等(2002)和李懋学等(1985)的方法, 核型分类参照Stebbins(1971)的分类标准。染色体排列顺序按照由长到短的顺序进行排列,并依次命名为1-16。
2 结果与分析
2.1 花粉母细胞减数分裂
前期Ⅰ: 从4月4号开始,山核桃雄花序进入减数分裂阶段。图1a为进入减数分裂阶段的山核桃花粉母细胞,其细胞核已经开始膨大,膨大后的细胞核,其中的染色质开始凝集浓缩,染色质纤维逐渐折叠螺旋化,进入细线期(图1b),此时染色体和染色单体形态尚不清晰,细胞核清晰可见。随着染色质的进一步浓缩,进入偶线期(图1c1,c2),细长的染色体和染色单体开始出现,同源染色体开始进行联会,此时细胞核依然存在。染色体进一步螺旋化,浓缩变短,进入粗线期(图1d)。粗线期结束后,染色体进一步螺旋化,进入双线期(图1e),此阶段部分同源染色体之间仍然存在交叉,同源染色体完成联会。双线期结束后,进入终变期(图1f1, f2),此阶段,染色体进一步凝集,形成短棒状结构,交叉向染色体端部移动,发生端化,形成二价体和多价体,核仁逐渐消失。
中期Ⅰ: 约4月11号开始,山核桃花粉母细胞减数分裂进入减数分裂中期,该时期核膜、核仁已消失,所有的中期染色体配对成二价体聚集到赤道板上(图1g1, g2, g3),图1g1, g2为极面观察结果,图1g3为垂直面观察结果,可以看出有16个环状二价体排列在赤道板上。中期Ⅰ共观察了79个细胞,其中有 7个细胞出现了落后染色单体(图1h),异常率约为8.86%(表1)。
后期Ⅰ和末期Ⅰ: 在纺锤丝的牵引下,同源染色体开始分开并向两极移动,图1i1是中后期,同源染色体刚刚分开,随着纺锤丝的继续牵引,同源染色体逐渐被分开,直至完全分开,进入到减数分裂后期(图1i1,i2,i3)。2条同源染色体完全移到两级后,进入减数分裂末期Ⅰ(图1j1,j2),染色体开始解螺旋,回到染色质状态(图1k1),为第2次分裂做准备。通过第1次减数分裂,形成2个子细胞,其染色体数目是体细胞染色体数目的一半。
前期Ⅱ: 移向两极的细胞核体积开始增大,其中的细胞质不断浓缩和螺旋化,染色体形态开始出现,进入第2次减数分裂的前期(图1k2)。
中期Ⅱ: 染色体进一步浓缩和螺旋化,进入第2次减数分裂的中期,此时期染色体形态清晰可见,2组染色体均分布在各自的赤道板上,呈垂直分布(图1L1)或平行分布(图1L2,L3)。此时期观察到一些减数分裂不平衡的细胞(图1m),共观察了38个细胞,有6个细胞出现异常,异常率约为15.79%(表1)。
后期Ⅱ: 着丝点一分为二,姊妹染色体单体逐渐分开,并分别向两极移动,形成4组染色体(图1n1,n2)。
末期Ⅱ: 4组染色体移动到4极末端,进入末期Ⅱ(图1o),染色体解螺旋,形成染色质,细胞壁出现,形成四分体(图1p)。约从4月14号开始,可以在山核桃花药中观察到大量四分体,山核桃所形成的四分体构型以四面体型为主(图1q),少量为十字交叉型(图1p),共计观察了110个细胞,其中四面体型所占比例为81.82%,十字交叉型所占比例为18.18%。山核桃雄花序为柔荑花序,1朵小花中有4~6枚花药,在研究过程中,发现同一朵小花中的几个花药在减数分裂进程上是一致的,同一个花序轴的不同小花间在减数分裂进程上相差也不是很大。
2.2 山核桃核型分析
山核桃具体染色体数目、核型及核型模式如图2A1-A3所示。其核型公式为2n=32=20m+12sm,主要由20条中部着丝粒染色体和12条近中部着丝粒染色体组成,具有1对随体染色体,随体位于第11对染色体的短臂上。表2为山核桃核型的具体参数,其染色体相对长度为4.006(±0.449)~9.559(±1.175),臂比大于2的染色体比例为25.000%,最长染色体与最短染色体之比为2.417±0.456,平均臂比为1.765±0.144,核型不对称系数为62.875; 根据Stebbins(1971)的核型分类标准,山核桃在核型分类上属于2B类型。
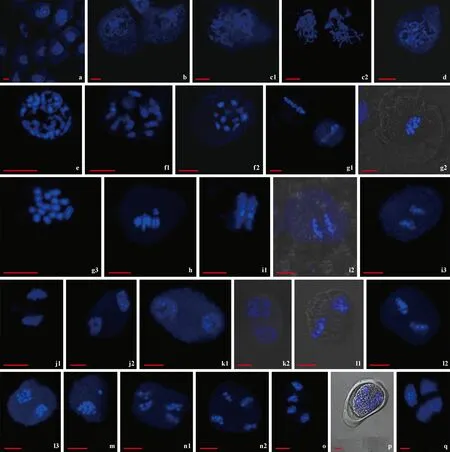
图1 山核桃花粉母细胞减数分裂过程Fig.1 Pollen mother cells meiosis of Carya cathayensis标尺 Bar: 5 μm.a.花粉母细胞; b.细线期; c1.偶线期; c2.偶线期三维图; d.粗线期; e.双线期; f1.终变期早期; f2.终变期后期; g1-g3.赤道板不同角度观察的中期Ⅰ; h.中期Ⅰ,存在1个落后单体; i1-i3.后期Ⅰ,处在不同分裂阶段; j1, j2.末期Ⅰ,处在不同分裂阶段; k1, k2.前期Ⅱ, 处在不同分裂阶段; L1-L3.中期Ⅱ,不同极面观察结果; m.中期Ⅱ,2个子细胞分裂不对称; n1, n2.后期Ⅱ,处在不同分裂阶段; o.末期Ⅱ; p.十字交叉型四分体; q.四面体型四分体。a. Pollen mother cells; b. Leptotene; c1. Zygotene; c2. Three-dimensional picture of zygotene; d. Pachytene; e. Diplotene; f1. Early stage of diakinesis; f2. Late stage of diakinesis; g1-g3. MetaphaseⅠ, observations from different angles of the equatorial plate; h. MetaphaseⅠ, one lagged univalent; i1-i3. AnaphaseⅠ, at different division stages; j1,j2. TelophaseⅠ, at different division stages; k1,k2. ProphaseⅡ, at different division stages; L1-L3. MetaphaseⅡ, different polar view of the equatorial plate; m. MetaphaseⅡ, asymmetric division of two cells; n1,n2. AnaphaseⅡ, at different division stages; o. TelophaseⅡ; p. Cross type tetrad; q. Tetrahedral tetrad.

表1 减数分裂不同时期的花粉母细胞数量及频率Tab.1 Number and frequency of pollen mother cells in each stage of meiosis
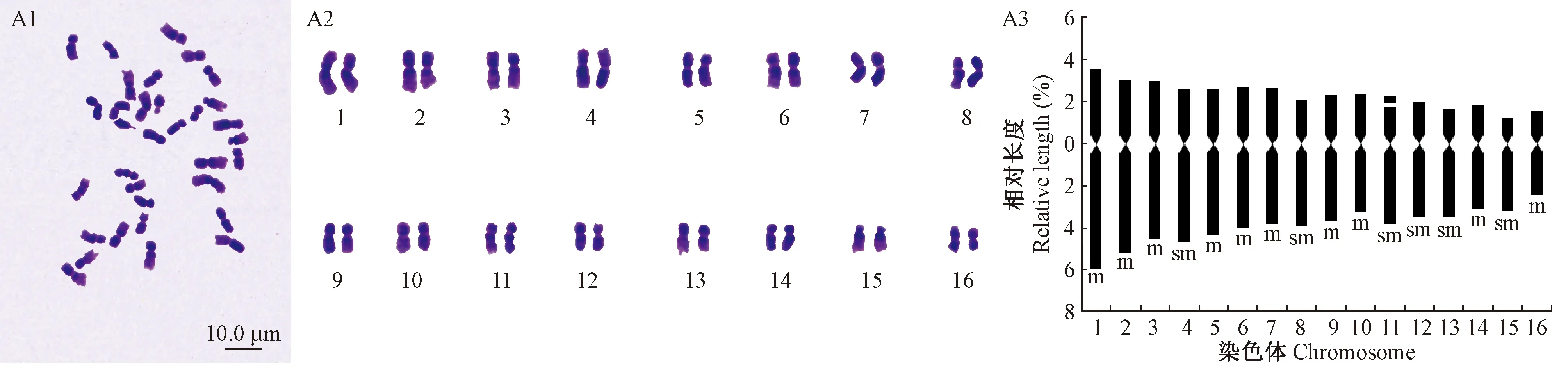
图2 山核桃的中期染色体(A1)、染色体配对(A2)及核型模式(A3)Fig. 2 The metaphase chromosomes(A1), karyotypes(A2) and ideograms(A3) of Carya cathayensis
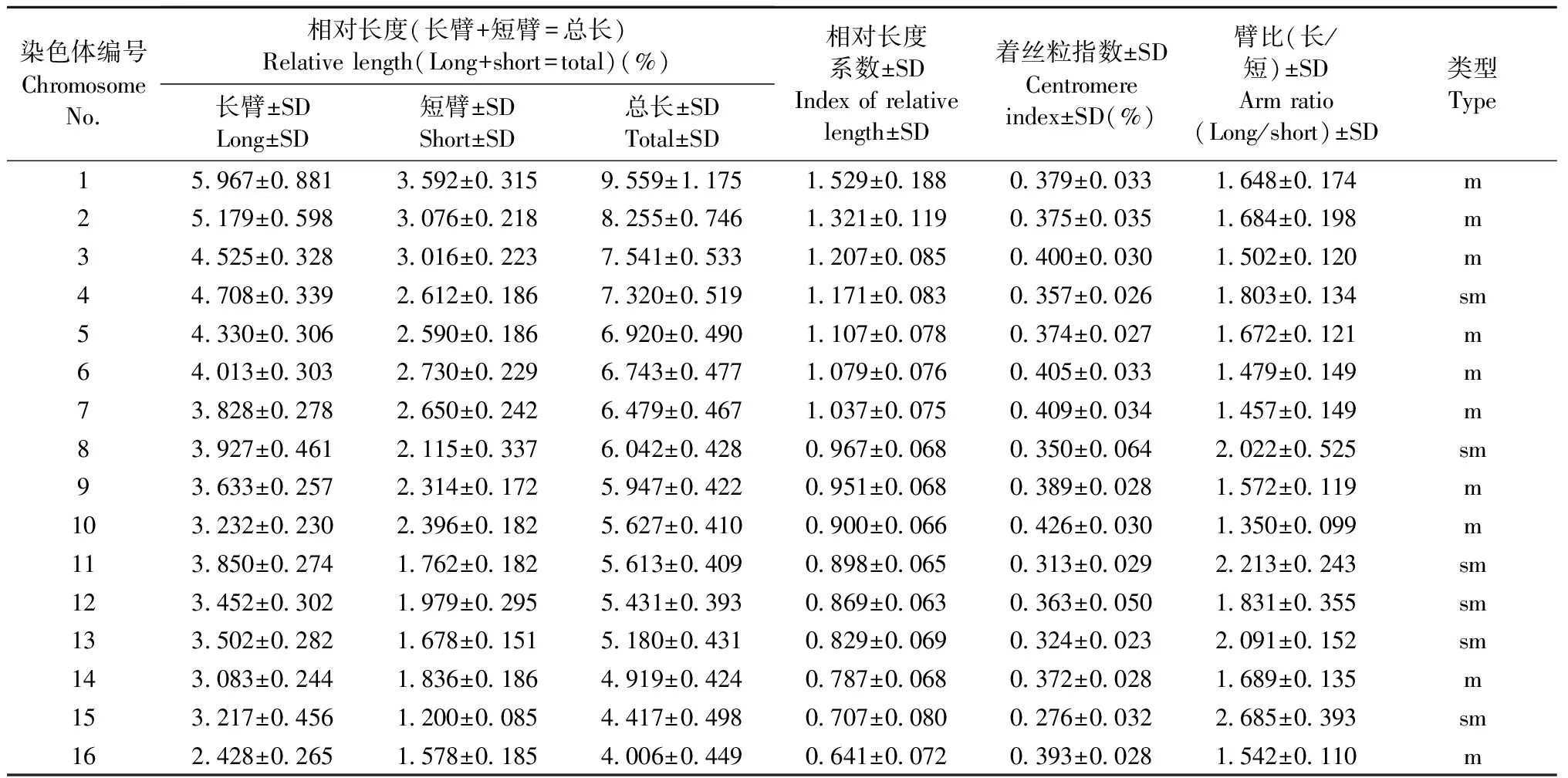
表2 山核桃核型参数Tab.2 Chromosome parameters of Carya cathayensis
3 讨论
本研究首次对山核桃花粉母细胞减数分裂进程进行研究,结果表明,山核桃花粉母细胞经过2次分裂,形成4个子细胞,其中第1次分裂是真正意义上的减数分裂,分为前期Ⅰ、中期Ⅰ、后期Ⅰ和末期Ⅰ4个时期。前期Ⅰ最为复杂,历时最长,约为7天,占到整个分裂周期的近70%(从减数分裂开始到四分体形成); 根据染色体的不同表现形式又可进一步分为细线期、偶线期、粗线期、双线期、终变期5个时期,终变期结束后染色体间遗传物质的交换工作已完成,同源染色体开始配对。中期Ⅰ,配对的同源染色体在纺锤丝的牵引下开始逐渐分开,进入后期Ⅰ和末期Ⅰ,形成2个子细胞,此时形成的子细胞染色体数目为体细胞染色体数目的一半。所形成的子细胞继续进行第2次分裂,此次分裂,染色体数目不再变化,同样经历前期Ⅱ、中期Ⅱ、后期Ⅱ和末期Ⅱ4个时期,最后形成四分体,减数分裂过程结束。中期Ⅰ开始至四分体形成,约需3天,占整个分裂周期的近30%。山核桃这一分裂规律与多数植物分裂周期规律吻合,各时期染色体行为也与多数物种类似(康向阳等, 2000; 王君等, 2006; 祁传磊等, 2009)。由此可见,虽然山核桃植物中存在无融合生殖现象,但是其花粉母细胞减数分裂过程并未受到影响。
另外,在减数分裂过程中,山核桃也有部分细胞表现出一定的异常,主要表现为中期Ⅰ出现落后染色体,中期Ⅱ出现不对称分裂等。一些研究者认为,在减数分裂过程中,着丝粒对染色体的行为起着重要的控制作用,来自于父母本的2条同源染色体配对成二价体,同源染色体的2条姊妹染色单体间由连接复合物(由减数分裂特异蛋白Rec8亚单位组成)紧密连接; 第1次分裂是2条同源染色体的分裂,此时具有同一着丝粒的2条姊妹染色单体间在行为上必需高度协调; 第2次分裂是2条姊妹染色单体的分离,2条姊妹染色单体间的协调性需要逐渐被打破,其中的连接复合物逐渐消失,以保证姊妹染色单体的着丝粒在赤道板上具有正确的方向和位置,以便与两极的纺锤体互作,进而保证2条姊妹染色单体从着丝粒部位准确分开(Lukaszewski, 2010; Cliftetal., 2011)。现存的一些植物中,特别是一些杂交种,由于染色体组组成类型复杂,一些同源染色体不能很好配对,姊妹染色单体间协调性也很差,因此在减数分裂过程中往往会出现各种异常,如四倍体提莫非维小麦(Triticumtimopheevi)与野燕麦(Avenafatua)的杂交后代(Anetal., 2015)、麻疯树(Jatrophacurcas)的种间杂交种等(Fukuharaetal., 2016)。除此之外,还有一些物种虽然不是杂交种,但是由于受到外界环境或者自身遗传因素等方面的影响,在减数分裂过程中也有一部分细胞表现出一定的异常,如杉木(Cunninghamialanceolata)、红皮云杉(Piceakoraiensis)、柑橘(Citrussinensis)、白菜(Brassicacampestrisssp.chinensis)、关苍术(Atractylodesjaponica)等(徐进等, 2007; 张守攻等, 2009; 崔群香等, 2010; 高娟等, 2010; 朴锦等, 2015)。本研究中,山核桃花粉母细胞减数分裂也出现一定比例的异常,推测可能与以上物种有一定的相似之处,由于受到外界环境或自身遗传因素的影响,部分细胞中的染色体结构发生了变化,因而导致部分同源染色体的姊妹染色单体间在协调性方面出现问题,或者是部分染色体的着丝粒受到影响,不能与两极的纺锤体正常互作,因此一些细胞在减数分裂过程中出现异常,犹如小麦(Triticumaestivum)(Lukaszewski, 2010)及小麦背景下的一些黑麦(Secalecereale)染色体的表现(Xieetal., 2013)。
在减数分裂同步性方面,一些物种表现出了明显的不同步现象,同一花芽的不同部位,同一部位的不同小花,甚至是同一小花的不同花药在减数分裂进程上均表现出不一致,如欧洲黑杨(Populusnigra)、龙眼(Dimocarpuslongan)、关苍术等。一些研究者认为,这种不同步性可以在一定程度上延长花期,避免外部恶劣环境对散粉的影响而增加授粉几率,对种群繁殖有利,是一种适应环境的进化机制(许雯婷等, 2011; 刘丽琴等, 2011; 朴锦等, 2015)。本研究表明,山核桃同一小花中的不同花药在减数分裂进程上是一致的,同时,同一花序轴上的不同小花间在同步性方面相差也不明显。作者曾对山核桃散粉期进行观察,其散粉期较短,可持续5~7天,几乎是集中散粉,这与其细胞学发育特性基本上是吻合的,从进化角度分析,这种散粉机制对山核桃种群繁育是极为不利的。
关于山核桃属染色体基数及倍性问题,山核桃属约有18个种,部分种的细胞学结果表明,一部分种染色体数目为2n=32,还有一部分种染色体数目为2n=64,因目前在山核桃属植物中尚未发现染色体数目更低的种,因此一些研究者认为山核桃属植物染色体基数可能为X=16,染色体数目为32的种为二倍体(Chenetal.,1993; 吕芳德等, 2002; Stone, 1997)。本研究中,山核桃核型分析结果表明,其核型公式为2n=32=20m+12sm,在染色体组成类型上,主要以中部着丝粒染色体和近中部着丝粒染色体2种类型为主,属于比较对称的核型; 在减数分裂中期Ⅰ观察到16个二价体,同源染色体配对良好。综合核型分析和减数分裂试验结果,可以进一步确定山核桃为二倍体。一些研究者认为,无融合生殖植物中大多存在不同的倍性类型,一般高倍性的物种进行无融合生殖,低倍性的物种进行有性生殖(刘传虎等, 2007)。在本研究中,由于目前还不能确定哪一株山核桃树或种子具有无融合生殖的特性,因此在试验材料选择上做不到精准选择,依据目前的研究结果,还无法揭示山核桃无融合生殖现象与其倍性水平的具体关系,以及山核桃是否存在倍性不同的群体或单株等,这些问题还有待于进一步扩大群体,通过深入的细胞学和分子生物学研究去揭示。
4 结论
山核桃虽然存在无融合生殖现象,但是其花粉母细胞减数分裂过程并未受到影响,仍然遵循大多数被子植物减数分裂规律,在整个减数分裂进程中,前期Ⅰ所需时间最长,约占整个分裂周期的70%,其他几个时期所经历时间较短,约占整个分裂周期的30%。山核桃花粉母细胞减数分裂同步性程度较高,这不利于延长山核桃散粉期,从进化角度上分析,不利于山核桃种群繁衍。山核桃体细胞染色体数为2n=32,在染色体组成类型上主要为中着丝粒染色体和近中着丝粒染色体2种,属于比较对称的核型,在减数分裂中期Ⅰ,32条染色体配对成16个二价体,可以进一步确定在倍性水平上山核桃属于二倍体。
陈瑞阳, 李秀兰, 宋文芹, 等. 2002. 中国主要经济植物基因组染色体图谱Ⅳ. 北京: 科学出版社, 625-628.
(Chen R Y, Li X L, Song W Q,etal. 2002. Chromosome atlas of major economic plants genome in China Ⅳ. Beijing: Science Press, 625-628. [in Chinese])
崔群香, 侯喜林, 肖木珠, 等.2010.不结球白菜花粉母细胞减数分裂及其雄配子体发育. 西北植物学报, 30(9): 1804-1808.
(Cui Q X, Hou X L,Xiao M Z,etal. 2010. Pollen mother cell meiosis and male gametophyte development ofBrassicacampestrisssp.chinensisMakino. Acta Botanica Boreali-Occidentalia Sinica, 30(9):1804-1808. [in Chinese])
高 娟,伊华林,胡志勇.2010.柑橘体细胞杂种有性后代花粉母细胞减数分裂的观察. 果树学报,27(1): 8-12.
(Gao J, Yin H L, Hu Z Y. 2010. Meiotic observations on pollen mother cells of sexual progenies of citrus somatic hybrid. Journal of Fruit Science, 27(1): 8-12. [in Chinese])
黄有军,夏国华,王正加,等. 2007. 山核桃雌花发育的解剖学研究. 江西农业大学学报,29(5): 723-726.
(Huang Y J, Xia G H, Wang Z J,etal. 2007. Studies on anatomy of development of female flower inCaryacathayensisSarg. Acta Agriculturae Universitatis Jiangxiensis, 29(5):723-726.[in Chinese])
黄有军,王正加,郑炳松,等.2006. 山核桃雄蕊发育的解剖学研究. 浙江林学院学报,23(1): 56-60.
(Huang Y J, Wang Z J, Zheng B S,etal. 2006. Anatomy of stamen development onCaryacathayensis. Journal of Zhejiang Forestry College, 23(1): 56-60.[in Chinese])
康向阳, 朱之悌, 张志毅.2000. 毛白杨花粉母细胞减数分裂及其进程的研究. 北京林业大学学报, 22(6): 5-7.
(Kang X Y, Zhu Z T, Zhang Z Y. 2000. Meiosis and its stages of pollen mother cells in Chinese white poplar. Journal of Beijing Forestry University, 22(6): 5-7. [in Chinese])
李懋学, 陈瑞阳.1985. 关于植物核型分析的标准化问题. 武汉植物学研究, 3(4): 297-302.
(Li M X, Chen R Y. 1985. A suggestion on the standardization of karyotype analysis in plants. Journal of Wuhan Botanical Research, 3(4): 297-302.[in Chinese])
黎章矩,钱 勤.1986. 山核桃花芽分化与开花习性的研究. 南京林业大学学报,(3): 36-47.
(Li Z J, Qian Q. 1986. Flower bud differentiation and flowering regularity ofCaryacathayensisSarg. Journal of Nanjing Forestry University, (3): 36-47. [in Chinese])
刘传虎,张秋平,姚家玲,等.2007. 龙须草核型分析和花粉母细胞减数分裂的细胞学研究. 中国农业科学,40(1): 27-33.
(Liu C H, Zhang Q P, Yao J L,etal. 2007. Karyotype analysis and pollen mother cells meiosis observation inEulaliopsisbinata. Scientia Agroicultura Sinica, 40(1): 27-33.[in Chinese])
刘丽琴,谢江辉,李伟才,等.2011.龙眼花粉母细胞减数分裂观察. 果树学报,28(5): 820-824.
(Liu L Q, Xie J H, Li W C,etal. 2011. Meiotic observations of the pollen mother cells ofDimocarpuslongan. Journal of Fruit Science, 28(5): 820-824. [in Chinese])
吕芳德,杨 帆,张日清.2002.山核桃属部分种的核型分析. 中南林学院学报, 22(1):47-49.
(Lü F D, Yang F, Zhang R Q. 2002. Karyotypes of threeCaryaNutt. species. Journal of Central South Forestry University, 22(1): 47-49. [in Chinese])
朴 锦,具红光,朴钟云.2015.关苍术花粉母细胞减数分裂及其雄配子体发育研究. 西北植物学报, 35(8): 1547-1553.
(Piao J, Ju H G, Piao Z Y. 2015. Pollen mother cell meiosis and male gametophyte development ofAtractylodesjaponica. Acta Botanica Boreali-Occidentalia Sinica, 35(8):1547-1553. [in Chinese]).
祁传磊,李开隆,肖 静,等. 2009. 大青杨花粉母细胞减数分裂及其发育. 东北林业大学学报, 37(3): 72-76.
(Qi C L, Li K L, Xiao J,etal. 2009. Meiosis of pollen mother cells and pollen development ofPopulusussuriensis. Journal of Northeast Forestry University, 37(3):72-76. [in Chinese])
王 君, 康向阳, 李代丽, 等.2006. 通辽杨花粉母细胞减数分裂及其染色体行为研究. 西北植物学报,26(11): 2231-2238.
(Wang J, Kang X Y, Li D L,etal. 2006. Meiosis and chromosome behavior of pollen mother cell inPopulussimoniiCarr. ×P.nigraL. ‘Tongliao’. Acta Botanica Boreali-Occidentalia Sinica, 26(11): 2231-2238.[in Chinese])
徐 进, 施季森,杨立伟,等.2007.杉木花粉母细胞减数分裂的细胞学特性及异常现象的观察.林业科学,43(11):32-38.
(Xu J, Shi J S, Yang L W,etal. 2007. Cell biological characteristics and abnormal behavior during the meiosis of pollen mother cells inCunninghamialanceolata. Scientia Silvae Sinicae, 43(11): 32-38. [in Chinese])
许雯婷, 赵 健, 赵 楠, 等.2011. 欧洲黑杨花粉母细胞减数分裂观察及其不同步性分析. 西北植物学报, 31(10): 1981-1987.
(Xu W T, Zhao J, Zhao N,etal. 2011. Meiosis of pollen mother cells and their asynchrony inPopulusnigraL. Acta Botanica Boreali-Occidentalia Sinica, 31(10): 1981-1987. [in Chinese])
张 斌,夏国华,王正加,等.2008. 山核桃开花生物学特性与雌花可授期. 西南林学院学报,28(6): 1-9.
(Zhang B, Xia G H, Wang Z J,etal. 2008. Studies on flowering biological characteristics and receptive period of female flowers ofCaryacathayensis. Journal of Southwest Forestry College, 28(6):1-9. [in Chinese])
张守攻,韩素英,杨文华,等. 2009. 红皮云杉花粉母细胞减数分裂和花粉发育的研究. 园艺学报,36 (7):1023-1030.
(Zhang S G, Han S Y, Yang W H,etal. 2009. Studies on the meiosis of pollen mother cell and pollen development ofPiceakoraiensisNakai. Acta Horticulturae Sinica, 36(7):1023-1030. [in Chinese])
An H Z, Hu M, Li P F,etal. 2015. Chromosomal behavior during meiosis in the progeny ofTriticumtimopheevii× hexaploid wild oat. PLoS One, 10(5): e0126398.
Chen R Y, Song W Q, Liang G L,etal. 1993. Chromosome atlas of Chinese fruit trees and their close wild relatives. Beijing: International Academic Publishers, 351-353.
Clift D, Marston A L. 2011. The role of Shugoshin in meiotic chromosome segregation. Cytogenetic and Genome Research, 133(2/4): 234-242.
Fukuhara S, Muakrong N, Kikuchi S,etal. 2016. Cytological characterization of an interspecific hybrid inJatrophaand its progeny reveals preferential uniparental chromosome transmission and interspecific translocation. Breeding Science, 66(5): 838-844.
Huang Y J, Zhou Q, Huang J Q,etal. 2015. Transcriptional profiling by DDRT-PCR analysis reveals gene expression during seed development inCaryacathayensisSarg. Plant Physiology and Biochemistry, 91: 28-35.
Klos J, Sliwinska E, Kula A,etal. 2009. Karyotype and nuclear DNA content of hexa-, octo-, and duodecaploid lines ofBromussubgen.Ceratochloa. Genet Mol Biol, 32(3): 528-537.
Lukaszewski A J. 2010. Behavior of centromeres in univalents and centric misdivision in wheat. Cytogenetic and Genome Research, 129(1/3):97-109.
Sánchez-Jiménez I, Hidalgo O, Canela M A,etal. 2012. Genome size and chromosome number inEchinops(Asteraceae, Cardueae) in the Aegean and Balkan regions: technical aspects of nuclear DNA amount assessment and genome evolution in a phylogenetic frame. Plant Syst Evol, 298(6): 1085-1099.
Stebbins G L. 1971.Chromosomal evolution in higher plants. London, UK: Edward Arnold Ltd, 85-104.
Stone D E. 1997. Juglandaceae//Flora of North America Editorial Committee. Flora of North America: north of Mexico. New York: Oxford University Press.
Xie Q, Kang H, Sparkes D L,etal. 2013. Mitotic and meiotic behavior of rye chromosomes in wheat-Psathyrostachyshuashanicaamphiploid×triticale progeny. Genetics and Molecular Research, 12 (3): 2537-2548.
Zhang B, Wang Z J, Huang J Q,etal. 2012. A pattern of unique embryogenesis occurring via apomixis in hickory (Caryacathayensis). Biologia Plantarum, 56 (4): 620-627.
(责任编辑 徐 红)
MeiosisofPollenMotherCellandKaryotypeofCaryacathayensis
Xu Chuanmei1, 2Huang Jianqin2Wang Zhengjia2Xia Guohua2Zhang Qixiang2Huang Youjun2Zhang Shougong1
(1.StateKeyLaboratoryofTreeGeneticsandBreedingResearchInstituteofForestry,ChineseAcademyofForestryBeijing100091;2.StateKeyLaboratoryofSubtropicalSilvicultureZhejiangAamp;FUniversityHangzhou311300)
【Objective】 This study was aimed to observe the meiosis of pollen mother cell and the karyotype ofCaryacathayensis, to determine the chromosome number and ploidy level ofC.cathayensisaccording to these results, to explore the relationship between the apomixis and the ploidy level ofC.cathayensis, and to enrich reproductive biology data ofCaryaspecies, meanwhile, to provide some cytological data for cross breeding and systematic classification ofC.cathayensis.【Method】 1)Male inflorescence ofC.cathayensiswas selected as material, DAPI fluorescent staining was used to study the meiosis of pollen mother cell ofC.cathayensis. 2)C.cathayensisroot tip was selected to prepare chromosome and make karyotype analysis.【Result】 1)The meiosis of pollen mother cells ofC.cathayensiswas divided into two stages, the chromosome number of daughter cells was reduced by half during the first division and not changed again during the second division. The first and second division were divided into prophase, metaphase, anaphase and telophase respectively, however, the prophaseⅠwas most complex among these stages and was further divided into leptotene, zygotene, pachytene, diplotene and diakinesis. The prophaseⅠwas the longest one among these stages, accounting for nearly 70% of the whole division cycle. The second division was relatively a shorter period. 2) In terms of meiosis synchronization, different anthers from the same floret are the same, there was no significant difference among different flowers from the same inflorescence axis. 3)The chromosome behavior of most pollen mother cells inC.cathayensiswas normal and paired as 16 bivalents at metaphaseⅠ. However, there was a certain proportion of abnormal pollen mother cells in the meiosis, such as appearing lagging chromosome in metaphase Ⅰ, which accounted for 8.86%, showing asymmetry division in metaphase Ⅱ, which accounted for 15.79%. 4) The karyotype formula ofC.cathayensiswas 2n=32=20m+12sm,and the range of its chromosome relative length was from 4.006(±0.449) to 9.559(±1.175), chromosome numbers whose arm ratio was more than 2 accounted for 25.000%, the ratio of chromosome length (L/S) and the karyotype asymmetry index were 2.417±0.456 and 62.875, respectively. The karyotype type was 2B.【Conclusion】 1) Although there is the phenomenon of apomixis inC.cathayensis, it still follows the law of meiosis of pollen mother cells in most angiosperms. In the whole process of meiosis, the prophase Ⅰ is the longest, other stages are short. 2)C.cathyensispollen mother cell meiosis synchronization degree is very high, which is unfavorable to prolong its pollination period. 3) The abnormal mother cell ofC.cathyensismainly appears in the two stages of metaphase Ⅰ and metaphase Ⅱ. 4) The karyotype ofC.cathyensisbelongs to a symmetrical type with the chromosome number of 2n=32 and paired as 16 bivalents at meiosis metaphaseⅠ, thus it is a diploid species.
Caryacathayensis; meiosis; pollen mother cell; chromosome; karyotype; apomixis
10.11707/j.1001-7488.20171109
2017-02-09;
2017-03-20。
国家高技术研究发展计划(863计划)“特色林木功能基因组研究与应用”(2013AA102605); 国家自然科学基金项目(31470682); 分析测试科技计划项目(2016C37081)。
*张守攻为通讯作者。
S718.46
A
1001-7488(2017)11-0077-08
