米曲霉形态与曲酸生产的关系
2017-12-14杨海泉陈献忠
华 珊,杨海泉,邹 伟,陈献忠,沈 微*
(1.江南大学 生物工程学院,江苏 无锡 214122;2.四川理工学院 生物工程学院,四川 自贡 643000)
米曲霉形态与曲酸生产的关系
华 珊1,杨海泉1,邹 伟2,陈献忠1,沈 微*1
(1.江南大学 生物工程学院,江苏 无锡 214122;2.四川理工学院 生物工程学院,四川 自贡 643000)
以米曲霉为出发菌株生产曲酸,通过改变培养基浓度和孢子接种量来研究曲酸生产关键因素对A.oryzae菌体形态的影响,进一步通过不同形态菌体发酵分析菌体形态与曲酸生产的关系。培养基中的碳氮比对A.oryzae菌球的直径的大小具有较大影响。当孢子浓度为109个/mL时,A.oryzae主要呈菌丝形态;但当孢子浓度为107~108个/mL时,菌体形态呈现为球状,并随着孢子浓度的增大菌球直径减少。A.oryzae发酵生产曲酸的最佳形态为菌球,并且菌球直径与曲酸合成能力关系密切,菌球直径为0.25~0.35 mm时,单位细胞曲酸积累量最高。
曲酸;米曲霉;形态;菌球
曲酸是一种与葡萄糖结构相似的有机酸,是由好氧微生物利用糖类发酵产生的次级代谢产物,广泛存在于酒类、酱油及豆瓣酱等酿造产品中。目前,国内外主要利用米曲霉(Aspergillus oryzae)及不产黄曲霉毒素的黄曲霉(A.flavus)发酵生产曲酸。由于具有抑菌能力、抗氧化性、抑制酪氨酸酶活性、与金属离子螯合等性质,曲酸常用作防腐剂、保鲜剂、杀虫剂、抗菌剂等,被广泛应用在医药、农业、食品及化妆品等各个行业[1]。国内外对曲酸的生产进行了许多研究,主要集中在高产菌株的筛选、培养基组分、培养条件及过程的优化等方面[2]。
曲霉作为典型的丝状真菌,液态深层发酵与其他单细胞微生物相比,一个显著的特征是个体形态具有明显的变化,易形成多种形态,使其发酵过程变得复杂与难以控制。丝状真菌在液态发酵过程中菌体形态主要分为丝状、球状、团状,这主要由自身的遗传特性与环境因素共同影响。菌体的形态受多个基因调控,影响曲霉属菌体形态发育的基因主要有hypA/podA、hypC、swoF和sepA等。通过这些基因编码的蛋白质维持菌丝极性、控制细胞大小或细胞间隔膜的间距、组织肌动蛋白微丝和促进菌丝尖端生长等来改变菌体形态[3]。影响菌体形态的环境因素主要包括培养基组成 (如碳氮源的种类及浓度、磷酸盐的水平、金属离子的添加等)、环境条件(如温度、pH、溶解氧及二氧化碳水平、机械剪切力、通气量等)、接种量、孢子形状、表面活性剂的种类、补料方式等[4-6]。
对于丝状真菌而言,菌体的外观和微观上的变化与酶、代谢产物的合成及分泌有着密切的关系,也会导致整个发酵过程参数(如流变性等)截然不同,对目标产物的产率有重要影响。发酵不同产物达到最高发酵强度的菌体最佳形态也不相同。例如,里氏木霉(Trichoderma reesei)合成组织型纤溶酶原激活剂(t-PA)时菌体以松散的菌丝体形态生长有利于t-PA的合成;德氏根霉(Rhizopus delemar)发酵生产延胡索酸的最佳形态为菌球[7-8]。作者通过考察环境因素对米曲霉菌体形态的影响,并由此调控A.oryzae深层培养过程中的菌丝形态来研究菌体形态与曲酸生产之间的关系,获得曲酸高产的最适菌体形态。
1 材料与方法
1.1 材料
1.1.1 菌种 A.oryzae (CCTCC NO:M2014436)保藏于中国典型培养物保藏中心。
1.1.2 试剂 曲酸标准样品:Aladdin公司产品;葡萄糖:山东西王生化科技有限公司;其他化学试剂均为分析纯:国药集团化学试剂有限公司产品。
1.1.3 培养基 斜面培养基(g/L):葡萄糖50,玉米淀粉 10,酵母提取物 5,KH2PO45,MgSO4·7H2O 2.5,琼脂20,pH 6.0;种子培养基 (g/L):葡萄糖 (60~160),玉米淀粉 10,酵母提取物(2.5~15),KH2PO45,MgSO4·7H2O 2.5,pH 6.0;发酵培养基(g/L):葡萄糖 120,酵母提取物 3,豆饼粉 5,KH2PO42,MgSO4·7H2O 0.5,pH 6.0。
1.2 实验方法
1.2.1 培养方法 生孢培养:从-70℃的甘油保藏管中取一环孢子悬液接种于斜面培养基,30℃恒温培养箱中培养5 d;种子培养:将培养5 d的成熟孢子用无菌生理盐水洗下,经玻璃珠打散后过滤制成孢子悬浮液,用血球计数板计数。将孢子悬浮液转接至种子培养基中,培养转速200 r/min,在30℃下恒温摇床培养30 h;发酵培养:按体积分数10%的接种量,将液体种子接种到发酵培养基中,发酵培养基的装液量为250 mL三角瓶中装入30 mL培养基,转速200 r/min,30℃下恒温摇床培养4 d。
1.2.2 分析方法 曲酸测定:采用三氯化铁比色法测定[9];生物量测定:采用干质量法,将发酵液经滤纸过滤后用蒸馏水洗涤,置于干燥箱中65℃烘干至恒重,用称重法测定其生物量;菌体形态测定:光学显微镜观察并拍摄,菌球直径用显微镜标尺测量;粘度测定:取30 mL发酵液用Brookfield DV-S数显粘度计进行测定,选用转子型号为4#,转速为60%。
2 结果与讨论
2.1 培养基关键组分对菌球形成的影响
培养基成分及浓度对丝状真菌菌体生长代谢至关重要,能显著影响菌体的形态。将制成的孢子浓度为107~108个/mL的悬浮液分别接种到含不同碳氮比的种子培养基中培养30 h,其对菌球大小与生物量的影响见图1。

图1 种子培养基底物浓度对菌球直径与生物量的影响Fig.1 Effect of glucose and yeast extract concentrations on pellet sizeand DCWduring preculture
结果表明,培养基组分中不同碳氮比对米曲霉菌球大小与生物量有显著的影响。当酵母提取物质量浓度为10 g/L保持不变时,随着碳氮比的不断增加,A.oryzae菌球直径从0.230 mm逐渐增大到0.463 mm,生物量也表现出随着碳氮比的增加而增大的规律。当葡萄糖质量浓度为100 g/L时,改变酵母提取物浓度,使碳氮比值从40∶1降低至10∶1时,A.oryzae菌球直径从0.521 mm降低到0.265 mm。之后,随着碳氮继续减小,菌球直径也增大。但随碳氮比减小,A.oryzae的生物量变化趋势先增加后降低。在碳氮为 10∶1时,生物量最大 (8.5 g/L)。Papagianni等[10]研究A.niger产柠檬酸时也得到相似的结果,发现培养基中葡萄糖浓度较低时可促进菌丝分支,菌球直径也较小。Bai等[11]在研究米根霉(Rhizopus oryzae)产乳酸的过程中发现NH4NO3能促进R.oryzae形成菌球,且随着NH4NO3浓度的升高,菌球直径变大,生物量也逐渐增多。蒋雪薇等[12]研究发现(NH4)2SO4浓度过大时R.oryzae菌体容易形成菌丝团块。Du等[13]研究发现不同的氮源可能导致华根霉(R.chinensis)形成不同的菌体形态。因此培养基底物组分及其浓度对菌体的形态有着明显的影响。
2.2 孢子浓度对菌球形成的影响
在液体发酵过程中,孢子悬浮液浓度能够直接影响孢子的聚集特性,对菌体形态有着至关重要的影响,作者测定分析了孢子悬浮液浓度对A.oryzae菌体形态的影响。

图2 孢子浓度对菌体形态及菌球直径的影响Fig.2 Effects of spores concentration on fungal morphology and pellet size during preculture
研究发现,当孢子悬浮液浓度为107~108个/mL时,A.oryzae 主要形成菌球(图 2(a)),且在一定范围内菌球直径与孢子浓度呈负相关,即孢子悬浮液浓度越高,菌球直径越小,接种孢子浓度为2×107个/mL的菌球直径为是孢子浓度为1.2×108个/mL的 3.61 倍(图 2(b))。 张一竹等[5]和 Bai等[11]研究也发现在一定孢子浓度范围内随着孢子接种量增加形成的菌球直径逐渐变小。这可能是由于培养液中孢子悬浮液浓度偏高时,孢子碰撞接触机会多,从而孢子聚集形成的初始晶核和生成的菌丝较多。菌球之间存在竞争生长空间,因而形成数量较多但较小的菌球。当孢子悬浮液浓度增大至109个/mL时,A.oryzae主要呈菌丝形态(图2(a))。据报道,孢子接种量对A.niger菌体形态的影响也存在类似的规律,当孢子接种量为104~105个/mL时,A.niger菌体形态主要为菌球;当孢子接种量为108~109个/mL时,菌体主要呈松散的菌丝状[14]。Teng等[15]研究接种量对R.chinensis形态影响时发现孢子接种量为106~107个/30 mL时,呈块状菌丝体,接种量为108个/30 mL时却为松散菌丝体。
2.3 转速对菌球形成的影响
米曲霉是好氧丝状真菌,溶氧水平对菌体生长及形态有重要影响。溶氧与转速/搅拌具有密切关系。同时,不同转速/搅拌带来的流体流动与剪切力也会显著影响菌体的形态。Park等考察了搅拌强度对蛹虫草(Cordyceps militaris)菌体形态的影响,发现搅拌转速为300 r/min时,菌球直径小并且光滑,但当搅拌转速为50 r/min时,菌球大而松散[16]。因此,研究中考察了培养过程中摇瓶转速对菌球形成的影响。如图3所示,当转速为150 r/min时,A.oryzae菌球直径为0.624 mm;转速为200 r/min时,菌球直径明显减小,仅为0.263 mm。进一步提高转速至250 r/min,菌球直径较200 r/min时略有减小。结果表明,提高转速有利于菌球直径的减小。在高转速条件下,液体流动快、剪切力大,形成的菌球直径小。乔双逵[17]研究100、150、200 r/min 3种转速对灵芝菌体形态的影响时,也发现增加转速有利于中小型菌球的形成,转速越高,剪切力越大,小型菌球比例增大及菌球平均直径减小。

图3 转速对菌球直径的影响Fig.3 Effects ofrotation rate on pellet size during preculture
2.4 基于形态的曲酸发酵优化
在液体发酵过程中,菌体的形态会影响发酵液的粘度、溶解氧等因素,进而影响目的产物的产量。作者中分析了不同A.oryzae菌体形态对发酵液粘度、曲酸产量、菌体干重等影响。实验过程中,首先分析了在对数生长中期 (24 h)、对数生长末期(48 h)和发酵结束(96 h)时,不同菌体形态与发酵液流变性之间的相关性。由图4可见,发酵液的表观粘度从对数生长中期到发酵结束整个过程中都有明显的增加。这可能是由于前期菌体的生长和后期代谢产物的分泌使发酵液变得更加粘稠。在发酵过程中菌体形态为菌丝时的发酵液表观粘度是菌球时的数倍。松散菌丝体在液态发酵过程中互相缠绕,导致发酵液粘度大、流动性低,相比而言,菌体为菌球时表面较光滑,发酵液粘度更低,流动性更好。

图4 菌体形态与发酵液表观粘度的关系Fig.4 Relationships between fungal morphology and apparent viscosity in different periods of time
研究中进一步分析了菌体形态对A.oryzae生产曲酸的影响。与菌丝相比,菌体形态为菌球时,A.oryzae的产酸能力较高,此时其曲酸积累量达到15.11 g/L。菌球状态下A.oryzae的单位细胞合成曲酸的能力是菌丝状态下的1.35倍,A.oryzae发酵生产曲酸的最佳形态为菌球。这与高倩等[18]的研究结果相似,土曲霉(A.terreus)为菌球时衣康酸产量明显比菌丝时高。当菌体为松散菌丝体时,发酵液表现出明显的非牛顿型流体,粘度大,流动指数低,从而使营养物质和代谢产物传递不均匀,溶氧水平下降,热量不能及时扩散,严重阻碍菌体利用糖类等底物和氧气[15],从而导致细胞代谢速度偏慢,致使曲酸产量下降。对于球状菌体,发酵液流体虽然也是假塑性流体,但相对菌丝而言发酵液表观粘度较低,利于传质、传氧及溶氧[19]。
2.5 菌球直径对曲酸产量的影响
菌球直径与细胞代谢关系密切,合适的菌球直径有利于目标产物的积累。将不同大小的菌球接种到发酵培养基中进行发酵培养,得到菌球直径与曲酸合成能力的关系:y=15.197x3-21.559x2+8.604 5x-0.274 3,R2=0.975 1(图5)。最佳菌球直径范围为0.25~0.35 mm,此时单位细胞合成曲酸能力最强(0.778 g/g),最有利于发酵生产曲酸。当菌球直径大于0.3 mm时,单位细胞曲酸积累量随菌球直径的增加而降低。菌球直径越大,对菌球内部溶氧及物质传递的阻碍作用越大。因此,菌球较大时,传质、传氧速度慢,对营养的利用及细胞代谢减慢,曲酸产量较低。乔双逵等在研究灵芝合成胞外多糖时,也发现中小型菌球比例较高时有利于灵芝合成胞外多糖[20]。当菌球直径小于0.3 mm时,单位细胞合成曲酸产量不随菌球直径的降低而增加。这主要是因为当菌体量相同时,菌球直径过小则数量较多,使发酵液粘度增加,同样不利于营养物质及O2的传递与利用,从而导致曲酸产量的降低。
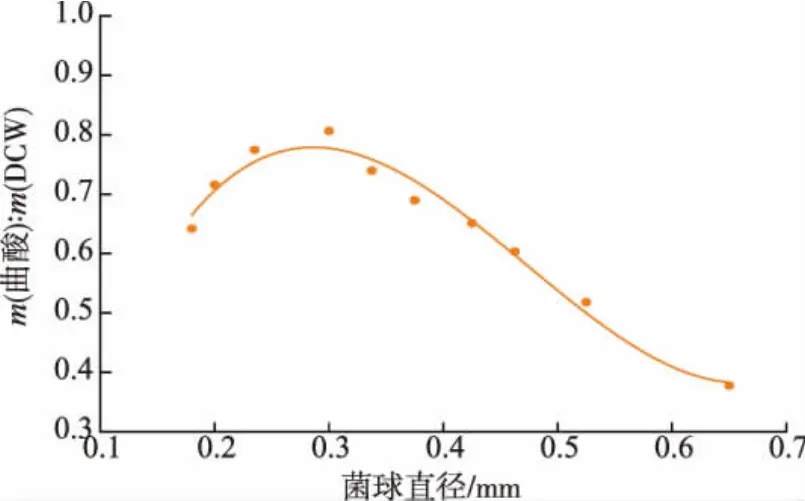
图5 菌球直径与单位细胞合成曲酸能力的关系Fig.5 Relationships between the pellet diameter and yield of kojic acid on DCW
3 结语
A.oryzae菌球的直径随着葡萄糖浓度提高而增大,随着酵母提取物浓度提高菌球直径先减小后增大。当孢子浓度为109个/mL时,A.oryzae主要呈菌丝形态,但在107~108个/mL时为菌球,并随着孢子浓度的增大菌球直径减少。
菌体形态为菌球时有利于A.oryzae生产曲酸,且菌球直径与单位细胞合成曲酸能力关系密切。菌球直径为0.25~0.35 mm时,单位细胞曲酸积累量最高,可达0.778 g/g。
[1]MOHAMAD R,MOHAMED M S,SUHAILI N,et al.Kojic acid:applications and development of fermentation process for production[J].Biotechnology and Molecular Biology Reviews,2010,5(2):24-37.
[2]CHAUDHARY J,PATHAK A,LAKHAWAT S.Production technology and applications of kojic acid[J].Annual Research&Review in Biology,2014,4(21):3165-3196.
[3]MCINTYRE M,MULLER C,DYNESEN J,et al.Metabolic Engineering of the morphology of Aspergillus[M].Metabolic Engineering,2001:103-128.
[4]PAPAGIANNI M.Fungal morphology and metabolite production in submerged mycelial processes[J].Biotechnology Advances,2004,22(3):189-259.
[5]ZHANG Yizhu,WANG Qingqi,LIU Jianshu,et al.Self-organizing mechanisms for fungal pellet-form[J].Biotechnology,2002,12(6):27-28.(in Chinese)
[6]HAACK M B,OLSSON L,HANSEN K,et al.Change in hyphal morphology of Aspergillus oryzae during fed-batch cultivation[J].Applied Microbiology and Biotechnology,2006,70(4):482-487.
[7]GANG Jie,DU Lianxiang,LU Fuping,et al.Influence of culture conditions on mycelium morphologyand t-PA production by Trichoderma reesei 306[J].Industrial Microbiology,2006,35(4):9-14.(in Chinese)
[8]ZHOU Z,DU G,HUA Z,et al.Optimization of fumaric acid production by Rhizopus delemar based on the morphology formation[J].Bioresource Technology,2011,102(20):9345-9349.
[9]ZHANG Limin,CHENG Lizhong,LU Hesheng.Improved FeCl3 colorimetric method for determination of kojic acid content[J].Biotechnology,2000,10(3):47-48.(in Chinese)
[10]PAPAGIANNI M,MATTEY M,KRISTIANSEN B.The influence of glucose concentration on citric acid production and morphology of Aspergillus niger in batch and culture[J].Enzyme and Microbial Technology,1999,25(8):710-717.
[11]BAI D M,JIA M Z,ZHAO X M,et al.L (+)-lactic acid production by pellet-form Rhizopus oryzae R1021 in a stirred tank fermentor[J].Chemical Engineering Science,2003,58(3):785-791.
[12]JIANG Xuewei,LUO Xiaoming,SHENG Canmei,et al.Effects of culture conditions of mycelial pellet formation and L-lactic acid production by Rhizopus oryzae[J].Food Science,2010,31(15):216-220.(in Chinese)
[13]DU L X,JIA S J,LU F P.Morphological changes of Rhizopus chinesis 12 in submerged culture and its relationship with antibiotic production[J].Process Biochemistry,2003,38(12):1643-1646.
[14]PAPAGIANNI M,MATTEY M.Morphological development of Aspergillus niger in submerged citric acid fermentation as a function of the spore inoculum level.Application of neural network and cluster analysis for characterization of mycelial morphology[J].Microbial Cell Factories,2006,5(1):3.
[15]TENG Y,XU Y,WANG D.Changes in morphology of Rhizopus chinensis in submerged fermentation and their effect on production of mycelium-bound lipase[J].Bioprocess and Biosystems Engineering,2009,32(3):397-405.
[16]PARK J,KIM Y,KIM S,et al.Effect of agitation intensity on the exo-biopolymer production and mycelial morphology in Cordyceps militaris[J].Letters in Applied Microbiology,2002,34(6):433-438.
[17]乔双逵.液态发酵过程发酵条件对灵芝形态及灵芝多糖合成影响的研究[D].无锡:江南大学,2014.
[18]GAO Qian,LIU Jie,LIU Liming,et al.Effect of morphology of Aspergillus terreus on itaconic acid production efficiency[J].The Chinese Journal of Process Engineering,2013,13(2):281-286.(in Chinese)
[19]GOGUS N,TARI C,ONCU S,et al.Relationship between morphology,rheology and polygalacturonase production by Aspergillus sojae ATCC 20235 in submerged cultures[J].Biochemical Engineering Journal,2006,32(3):171-178.
[20]QIAO Shuangkui,PENG Lin,DING Zhongyang,et al.Effect of different culture conditions on mycelium morphology and activityof exopolysaccharides from Ganoderma lucidum in submerged culture[J].Food and Fermentation Industries,2014,33(10):1070-1076.(in Chinese)
Relationship between Morphology and Kojic Acid Production by Aspergillus oryzae
HUA Shan1,YANG Haiquan1,ZOU Wei2,CHEN Xianzhong1,SHEN Wei*1
(1.School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.College of Bioengineering,Sichuan University of Science&Engineering,Zigong 643000,China)
To investigate the relationship between morphology and kojic acid production.Methods:Using Aspergillus oryzae to producekojic acid,the effect of critical factors on morphologies was studied by manipulating the concentrationof culture mediumand inoculum level,andfermented by different forms of cellto obtain the relationship between morphology and kojic acid production.Carbon/nitrogen ratio (C/N)of medium has great influence on pellet diameter size of A.oryzae.Dispersed mycelia wereformed with 109spores mL-1inoculum,but pellets were obtained under the condition of less spore number107to 108spores mL-1,and with the increasing of spores inoculation pellet diameterdecreased.Furthermore,the yield of kojic acid was closely correlated with pellet size,and the optimal pellet diameter range for higher yield of kojic acid on DCW was 0.25 to 0.35 mm.
kojic aid,Aspergillus oryzae,morphology,pellet
TS 261
A
1673—1689(2017)10—1090—06
2015-10-16
工业生物技术教育部重点实验室(江南大学)开放课题基金(KLIB-KF201301);四川省教育厅自然科学基金项目(15ZB0204)。
*通信作者:沈 微(1968—),男,江苏无锡人,工学博士,副教授,主要从事发酵工程研究。E-mail:shenwei_micro@163.com
华珊,杨海泉,邹伟,等.米曲霉形态与曲酸生产的关系[J].食品与生物技术学报,2017,36(10):1090-1095.
