多维度扫描核心考点
——铁及其化合物
2017-12-14卢国锋
卢国锋
黑龙江
多维度扫描核心考点
——铁及其化合物
卢国锋

我国高考命题的范式由“三维目标2.0版”升级到“核心素养3.0版”,铁元素具有三重特性,不能缺席高考盛宴,特性一:作为典型变价金属,属于少数核心知识,特性二:研究过程中采用多种科学认知方法,属于关键能力,特性三:是日常生活中不可或缺的重要元素,春秋冶铁、战国炼钢化学史实,金属腐蚀与防护属于考生责任担当的必备品格。对铁及其化合物知识点与命题点分类研究,能精准助考,事半功倍。
一、从变价特性角度考查
此维度加工试题的特点是知识点不变,设问角度从浅入深变化。
1.第一层次基础型:判断Fe与氧化性强弱不同的氧化剂反应时的产物价态。
例1:判断下列说法是否正确:
A.(2012天津2题节选)Fe在足量Cl2中燃烧生成FeCl2和FeCl3( )
B.(2012重庆2题节选)Fe与S混合加热生成FeS2( )
C.(2013广东23题节选)( )

操作现象结论将水蒸气通过灼热的铁粉粉末变红铁与水在高温下发生反应
解析:四个选项考查记忆的准确性,Fe与强氧化剂Cl2反应只能生成FeCl3,A与D都错误,Fe与弱氧化剂S反应只能生成FeS,Fe与弱氧化剂水蒸气反应生成黑色Fe3O4,B与C都错误。
2.第二层次数量型:在第一层次的基础上将性质与电子转移和产物数量结合在一起,进一步从定量角度考查变价和钝化性质。
例2:下列说法正确的是
( )
A.(2016全国1卷8题节选)1 mol Fe溶于过量硝酸,电子转移数为2NA
B.(2015广东10题节选)3 mol单质Fe完全转化变为Fe3O4,失去8NA个电子
C.(2014广东10题节选)56 g铁片投入足量浓H2SO4中生成NA个SO2分子
D.(2011广东9题节选)1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子

3.第三层次离子型:包括离子共存、离子方程式书写与正误判断,借此考查化学术语熟练程度。
例3:(2016江苏12题)制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后溶液中主要存在的一组离子正确的是
( )




4.第四层次实验型:Fe2+与Fe3+相互转化中关键知识是氧化还原反应规律,实验关键操作是条件控制,实验现象及结论的关键是科学合理。
例4:(2016全国2卷28题)问题展示:

问题1和问题3涉及的是同一问题:Fe2+具有较强的还原性,能被空气中的氧气氧化,加铁粉和煤油都是防止Fe2+被氧化。问题2和问题5涉及的知识点还是Fe2+,只是转换问题角度,不同氧化剂与Fe2+反应离子方程式的书写。问题4涉及可逆反应。问题5涉及产物对反应的催化作用使速率加快,反应的热效应对水解平衡的影响及相关化学理论。

二、从化学观念角度考查
此维度是用化学核心观念将不同知识串联在一起,此法可以达到“形散神不散”的效果。
1.实用观

例5:下列说法不正确的是
( )
A.(2016浙江7题节选)纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
B.(2011北京8题节选)结合图判断Ⅰ和Ⅱ中正极均被保护


D.(2011浙江10题节选)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少,推断液滴中的Cl―由b区向a区迁移


2.微粒观

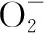


(4)显色性:①Fe3+与SCN-生成红色Fe(SCN)3,用于Fe3+检验,注意Fe(SCN)3不是沉淀,化学方程式中不能使用“↓”;②Fe3+与含酚羟基的有机物反应呈紫色,用于有机物的鉴别。
例6:(2015天津10题节选)FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是___________(用离子方程式表示)。

a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是____________。
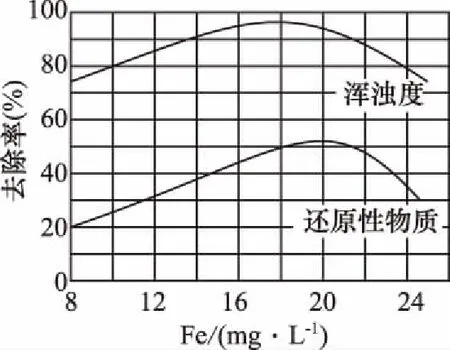
(3)某污水处理厂用氯化铁净化污水的结果如图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为___________mg·L-1。

3.守恒观
化学计算题是体现守恒观的主要形式,显性的知识是原子守恒,隐性的知识是溶液中电荷守恒和反应得失电子守恒,多步反应可以通过化学方程式中化学计量数寻找已知与未知的关系,也可以通过原子守恒获得关系式,混合物通过守恒列二元一次方程组求解。
(1)电荷守恒
例7:(2015天津10题节选)若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为___________。
解析:酸性溶液中c(OH-)忽略不计,根据阳离子所带正电荷总数(即离子浓度乘以离子所带电荷数)等于阴离子所带负电荷总数,2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-),c(H+)=1×10-2mol·L-1,pH=-lgc(H+)=2。
(2)原子守恒
例8:(2012全国2卷26题节选)现有一含有FeCl2和FeCl3的混合样品,采用实验方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。(结果保留2位有效数字)
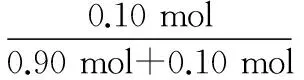
(3)得失电子守恒


(4)公式中守恒关系
例10:(2012海南14题节选)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。过程Ⅱ中调节溶液的pH为5,金属离子浓度为___________。(列式计算){已知:Ksp[Fe(OH)3]=4.0×10-38}
解析:pH=5,c(H+)=10-5,c(OH-)=10-9,Ksp[Fe(OH)3]=c3(OH-)·c(Fe3+)=10-27·c(Fe3+)=4.0×10-38,c(Fe3+)=4.0×10-11mol·L-1。
4.转化观
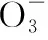

(1)针对“溶液呈黄色”,有同学认为溶液中有Fe3+,针对此观点实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了该同学的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:

序号取样时间/min现象ⅰ3产生大量白色沉淀;溶液呈红色ⅱ30产生白色沉淀;较3min时量少;溶液红色较3min时加深ⅲ120产生白色沉淀;较30min时量少;溶液红色较30min时变浅
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:由于空气中存在O2,可产生Fe3+;
假设d:根据加入KSCN溶液后产生白色沉淀现象,判断溶液中存在Ag+,可产生Fe3+。
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是____________。

(2)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:________。
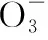

5.实验观
实验是考查过程与方法目标的最佳途径,“过程”指科学过程,它包括提出问题、收集资料和事实、整理加工资料和事实、得出结论、交流与应用等环节。“方法”指科学方法,它包括观察方法、实验方法、资料和事实处理方法、科学逻辑方法(如比较、分类、归纳、概括)、假说方法和模型方法等。
(1)分离提纯角度考查:①硫酸亚铁铵制备;②绿矾制备柠檬酸亚铁;③镀锌铁皮制备Fe3O4胶体粒子;④制备绿矾化工流程。
(2)性质探究角度考查:①温度对CO还原Fe2O3的影响;②探究弱酸条件下电化学腐蚀;③探究Fe2+对O3氧化I-反应的影响;④探究绿矾性质;⑤Fe3+催化H2O2分解的反应;⑥FeCl3吸收H2S实验,探究使FeCl3再生;⑦地下水脱氮;⑧纳米铁粉处理水;⑨环境修复:铁除去硝酸盐。
黑龙江省大庆市第五十六中学)
