叠氮化钠对绿豆种子和幼苗生长的诱变效应
2017-12-13温日宇刘建霞宋亚静刘支平
温日宇,刘建霞,宋亚静,刘支平
叠氮化钠对绿豆种子和幼苗生长的诱变效应
温日宇1,刘建霞2,宋亚静2,刘支平3
(1.山西省农业科学院玉米研究所,山西忻州034000;2.山西大同大学生命科学学院,山西大同037009;3.山西省农业科学院高寒区作物研究所,山西大同037008)
以晋绿9号为试验材料,测定不同浓度叠氮化钠对绿豆诱变不同时间种子的发芽率、幼苗鲜质量、根长的改变情况,探究叠氮化钠对绿豆种子和幼苗生长的诱变效应。结果表明,叠氮化钠的浓度16 mmol/L、诱变时长6 h为最佳诱变条件;在低浓度溶液诱变下,随着浓度的不断增加,诱变效应逐渐增强,诱变浓度为15 mmol/L或诱变时间小于6 h时,可提高其根长和幼苗鲜质量;叠氮化钠的浓度大于17 mmol/L或诱变时间超过6 h时,叠氮化钠诱变能够降低种子的萌发势,甚至致其死亡,幼苗及其根长也低于对照组。
绿豆;叠氮化钠;生长指标
绿豆(Vigna radiata(Linn.)Wilczek.),属豆科作物,别名青小豆、菉豆、植豆等,在我国已有超过2 000 a的种植历史。其原产于印度、缅甸地区,目前普遍种植于东南亚各国,在非洲、欧洲、美洲也有少量种植。在我国,绿豆的种植面积超过70.8万hm2,是仅次于印度的绿豆种植大国[1-3]。绿豆作为一种药用价值和经济价值特别高的作物,有着丰富的营养成分,是人们理想的营养保健食品。
改革开放以来,我国人民生活水平不断提高,膳食结构发生巨大变化,对于食品的保健作用愈加重视,再加上绿豆在食品工业、酿造工业和医药工业上的广泛应用,国内对绿豆的需求持续增长。但由于我国长期种植绿豆,一些名优品种退化、混杂现象严重,而绿豆遗传研究落后,近年来新品种选育进程缓慢,极大地制约了绿豆产业的发展[4-6]。因此,对绿豆种质创新,提高绿豆的产量、改善绿豆的品质显得尤为重要。
应对绿豆生长的恶劣环境,国内外进行过一系列改变绿豆抗逆性和抗病性的研究,而对于提高绿豆产量和改善绿豆品质所进行的试验研究中,虽然通过杂交育种和转基因技术已获得一些成效,但杂交育种的可遗传性较差和转基因的安全问题始终难以解决[7-10]。我国曾利用返回式卫星及气球做了空间诱变育种的尝试,但在绿豆方面收效甚微,而且空间诱变的成本昂贵,不适于长期使用[11-13]。相比于杂交育种,诱变育种周期短,效果明显且能获得较稳定的优良性状。在诸多化学试剂中,叠氮化钠(NaN3)因其效率高、低毒、价格便宜、使用安全等优点被广泛应用于育种方面。其诱变原理为[12-13]:NaN3溶液在pH为3(等电点pH=4.18)时可以生成最大量的HN3分子,容易通过膜渗透入细胞,HN3分子和DNA作用发生点突变,使其碱基置换,DNA单链断裂,从而影响DNA合成蛋白质,以达到影响酶活性的目的。叠氮化钠的诱变只能在DNA复制时才能发挥作用,所以种子在M1时期开始时用NaN3溶液进行处理,对DNA合成的胚胎进行预处理[14-18]。
目前,使用叠氮化钠对绿豆种子进行诱变育种鲜有研究。本试验以晋绿9号绿豆种子为试验材料,叠氮化钠作为诱变剂,探究绿豆在叠氮化钠处理后种子萌发率、根长和幼苗鲜质量的变化,以期找出对绿豆种子诱变效果最好的诱变浓度和时间,获得可遗传的优良性状,提高绿豆产量和品质。
1 材料和方法
1.1 材料
供试材料为晋绿9号绿豆种子,由山西省农业科学院高寒区作物研究所提供;试验所用的化学诱变试剂为叠氮化钠(NaN3)。
1.2 方法
取1 250粒颗粒饱满、大小均一的晋绿9号绿豆种子置于500 mL大烧杯中,用75%的乙醇将种子表面进行初步消毒,后用蒸馏水冲洗3次。用0.2%的HgCl2溶液消毒12 min,后用双蒸水清洗干净。取浓度为 15,16,17,18,19,20 mmol/L的叠氮化钠(各浓度取30 mL)于6个50 mL的锥形瓶中,对照组用清水处理,再将消毒处理的绿豆种子分别取50粒放于锥形瓶中进行诱变处理。设置4组,诱变时间为5.0,5.5,6.0,6.5 h。将绿豆种子分别摆放进灭菌后(培养皿预先用LS-35LJ型立式压力蒸汽灭菌器121℃下灭菌30 min)的5组(共25个)直径为8.5 cm的培养皿中(培养皿保持干燥),各培养皿内垫2层大小同样为直径8.5 cm的滤纸(预先喷洒适量蒸馏水润湿),每个培养皿放50颗种子,将种子摆放整齐,互相之间不要接触,加盖,放置于自然光照下,温度为室温,每日加入适量的清水,以保持滤纸的湿润,保证种子有足够的水分发芽。每天定时观察记录绿豆种子的发芽数,计算种子的发芽率。待绿豆种子的芽长超过自身长度后转培在花盆中,置于YTP-1250型高效组织培养架上,使其自然生长至二叶一心时,进行指标测定。
1.3 测定指标及方法
1.3.1 种子发芽率的测定 培养第1天开始至第7天计算各培养皿中种子的发芽率。

1.3.2 幼苗根长的测定 当幼苗生长至2个叶片时,每种幼苗各取5株,用精密不锈钢尺测量幼苗根(根据最长根的长度测定)的生长长度,取平均值作为最终数值。
1.3.3 幼苗鲜质量的测定 当幼苗生长到2个叶片时,每种浓度各选5株长势较好、大小均匀的幼苗,小心地从花盆中取出,根部先用蒸馏水冲洗,然后用去离子水冲洗,用吸收纸吸干表面水分,用J111102型电子天平测量5株幼苗的鲜质量。
1.4 数据分析
试验数据用统计学的方法进行处理,最终数据均为3次重复平均值。种子发芽率采用SPSS软件进行统计学分析;绿豆幼苗鲜质量、幼苗根长运用Excel做出标准误差分析。
2 结果与分析
2.1 叠氮化钠诱变对绿豆种子萌发率的影响
从表 1 可以看出,用浓度为 15,16,17,18,19,20 mmol/L的叠氮化钠分别对绿豆种子进行4个时间(5.0,5.5,6.0,6.5 h)处理,随着诱变浓度的增加,绿豆种子的发芽率和相对发芽率都呈递减趋势,除浓度为17,18 mmol/L的发芽率和相对发芽率差异不显著外,其他几个浓度差异都达显著水平。说明在该诱变条件下叠氮化钠对绿豆种子的萌发均有显著影响。
当诱变时间为6 h、叠氮化钠浓度为16 mmol/L时,绿豆种子的发芽率和相对发芽率分别为52%和51.32%,均接近50%,因此,本研究认为,叠氮化钠浓度16 mmol/L、诱变时间6 h为最佳诱变条件。
当诱变时间为6.5 h时,叠氮化钠对绿豆种子的萌发率有显著性降低;随着叠氮化钠浓度的增加,致死效应逐渐增强,当叠氮化钠的浓度为20 mmol/L时,绿豆种子的萌发率为2%;浓度为16,17,18,19 mmol/L时,绿豆种子的发芽率分别为34%,24%,12%和6%,对照的萌发率达到100%。
种子萌发率的试验结果表明,采用不同浓度的叠氮化钠对绿豆种子进行不同时长的诱变,对其萌 发率有不同的影响。

表1 不同浓度叠氮化钠溶液处理下绿豆的发芽率和相对发芽率
2.2 叠氮化钠诱变对绿豆根系生长的影响
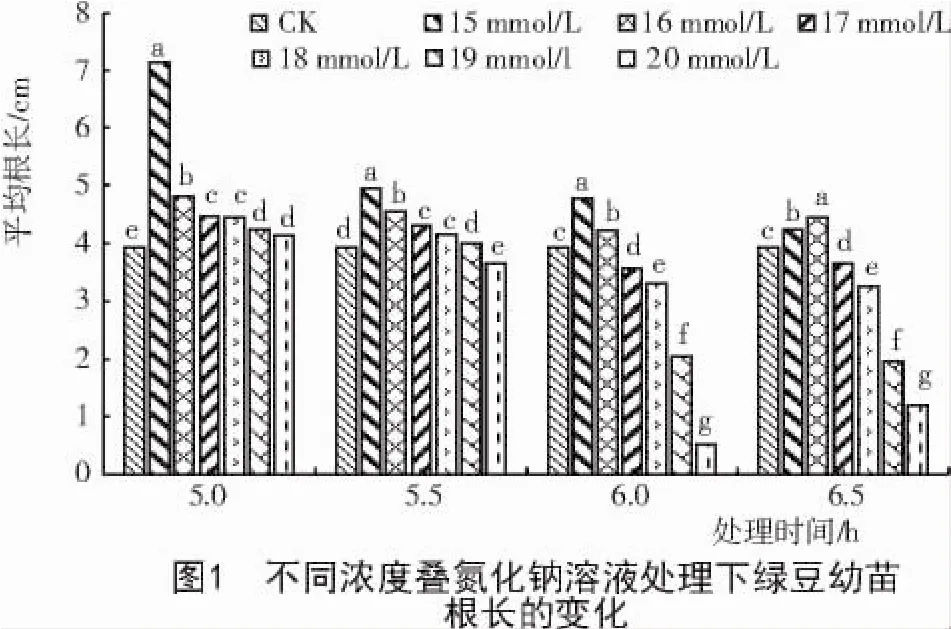
由图1可知,用不同浓度的叠氮化钠进行不同时长的诱变对绿豆根系生长有不同的影响。其中,不同浓度叠氮化钠对绿豆种子处理5 h时,叠氮化钠浓度为15mmol/L时幼苗根系最长,其他浓度的根系较短,但均比对照明显变长。叠氮化钠对绿豆种子处理5.5 h时,15 mmol/L浓度处理的幼苗根长达到最大值,浓度不超过16 mmol/L时,对幼苗的根长有明显的促进作用;浓度大于17 mmol/L时,根长有明显变短的迹象。叠氮化钠处理绿豆种子6 h时,浓度不超过16 mmol/L时对根长有促进作用,浓度为15 mmol/L时根长达到最大值;浓度大于16 mmol/L时,幼苗的根长表现出明显的抑制效果。叠氮化钠处理绿豆种子6.5 h时,浓度不超过16 mmol/L时会对根系有促进作用,但是效果不明显;当浓度大于16 mmol/L时,叠氮化钠的诱变使得绿豆幼苗的根系无法正常生长。
2.3 叠氮化钠诱变对绿豆幼苗鲜质量的影响
试验结果表明,叠氮化钠诱变对绿豆幼苗鲜质量的影响也表现出明显的诱变效应。由图2可知,低浓度短时间处理会使幼苗的鲜质量明显增加,且会有部分叶片发黄;高浓度下或者长时间诱变下,幼苗的鲜质量明显降低,部分幼苗由于叠氮化钠的诱变会出现矮化现象。

在用叠氮化钠对绿豆种子诱变5 h时,浓度为17 mmol/L时会显著增加幼苗的鲜质量,当叠氮化钠的浓度大于17 mmol/L时,幼苗的鲜质量较对照逐渐降低;在用叠氮化钠诱变5.5 h时,浓度为15~17 mmol/L时,诱变会使幼苗的鲜质量明显增加,浓度大于17 mmol/L时,诱变会使幼苗的鲜质量较对照降低;在用叠氮化钠对绿豆种子诱变6 h时,浓度为17 mmol/L时,诱变会使幼苗的鲜质量增加,但不明显,其他浓度诱变会使幼苗的鲜质量降低;在用叠氮化钠诱变6.5 h时,本试验中所有浓度的诱变都会使得幼苗的鲜质量明显减小。
3 讨论与结论
绿豆是一种极易发芽的豆科植物,在室温下置于清水中8 h便能完成发芽。本试验用毒性较低的叠氮化钠对绿豆种子予以不同时长的诱变处理,来探究绿豆种子发芽的变化情况。试验结果表明,随叠氮化钠浓度增加,若处理时间长短适宜,对种子的发芽有促进作用;若叠氮化钠的浓度高出一定范围或诱变时间过长,种子的发芽率会大幅下降,甚至有可能全部致死,说明绿豆种子DNA受到叠氮化钠的严重损坏。本试验中,叠氮化钠对种子发芽率、绿豆幼苗和根生长的影响显示出显著的浓度和时间效应。在低浓度的叠氮化钠诱变下绿豆种子初期萌发势能加快,绿豆幼苗和根系早期生长也得到提升,叠氮化钠对绿豆根伸长率和幼苗鲜质量也有显著的改善作用。叠氮化钠对绿豆根伸长率和幼苗鲜质量有显著的改善作用。当叠氮化钠的浓度低于17 mmol/L时,处理时间少于6 h时,不会破坏种子的发芽率,一旦高于6 h,叠氮化钠会对绿豆种子造成损害,使绿豆的发芽率显著下降,绿豆发芽率低于10%,甚至不发芽,幼苗和根系也不能正常生长。
[1]刘慧.我国绿豆生产现状及发展前景 [J].农业展望,2012(6):36-39.
[2]聂小琴,丁德馨,李广悦,等.铀矿浸出液对绿豆种子的萌发和幼苗生长及其抗氧化酶活性的影响 [J].农业环境科学学报,2009,28(4):789-795.
[3]贾健航,王斌.空间诱变育种研究进展 [J].核农学报,1993,13(3):187-192.
[4]WANGCH W,WEN D X,SUN A Q,et al.Differential activity and expression of antioxidant enzymes and alteration in osmolyte accumulation under high temperaturestressin wheat seedlings[J].Journal of Cereal Science,2014,24:653-659.
[5]张芬琴,孟红梅,沈振国,等.镉胁迫下绿豆和箭舌豌豆幼苗的抗氧化反应[J].西北植物学报,2006,26(7):1384-1389.
[6]王丽侠,程须珍,王素华,等.绿豆种质资源育种及遗传研究进展[J].中国农业科学,2009,42(5):1519-1527.
[7] LI Z G,GU SP.Hydrogen peroxide might be a downstream signal molecule of hydrogen sulfide in seed germination of mung bean(Vigna radiata)[J].Biol Plant,2016,60:595-600.
[8]徐明,路铁刚.植物诱变技术的研究进展 [J].生物技术进展,2011,1(2):90-97.
[9]彭波,徐庆国,李海林.农作物化学诱变育种研究进展[J].作物研究,2007,21(5):517-524.
[10]张瑞成,李魏,潘素君.化学诱变在种质资源改良上的应用[J].分子植物育种,2017(9):1-9.
[11]常金华,李玉华.诱变技术在植物遗传改良中的应用[J].河北农业大学学报,2002,5(3):6-9.
[12]钮力亚,于亮,付晶,等.叠氮化钠在农作物育种中的应用[J].河北农业科学,2010,14(12):52-57.
[13]郝爱平,詹亚光,尚洁.诱变技术在植物育种中的研究新进展[J].生物技术通报,2004(6):30-34.
[14]张超美.叠氮化钠对小麦的诱变效应 [J].湖北农学院学报,1994,14(3):56-60.
[15]曹欣,杨煜峰,钱强华.叠氮化钠对不同大麦品种的诱变效应[J].浙江农业学报,1991,3(3):143-146.
[16]AFSARAWANM,童渭渔,王彩莲.叠氮化钠对水稻的诱变效应[J].原子能农业译丛,1982(1):22-28.
[17]李明飞,谢彦周,刘录祥.叠氮化钠诱变普通小麦陕农33突变体库的构建和初步评估[J].麦类作物学报,2015,35(1):22-29.
[18]姜振峰,刘志华,李文滨,等.叠氮化钠对大豆M1的生物学诱变效应[J].核农学报,2006,20(3):208-210.
Mutagenic Effects of Sodium Azide on the Growth of Mung Bean Seeds and Seedlings
WENRiyu1,LIUJianxia2,SONGYajing2,LIUZhiping3
(1.Instituteof Maize,Shanxi Academy of Agricultural Sciences,Xinzhou 034000,China;2.Collegeof Life Science,Datong University,Datong037009,China;3.Instituteof the Crops in High Latitudeamp;Cold Climate Area,Shanxi Academy of Agricultural Sciences,Datong 037008,China)
In this study,taking Jinlü 9 as the test material,the effects of different concentrations of sodium azide on the germination rate,fresh quality and root length of seedlings at different time were investigated.The results showed that the optimal right condition was that the concentration of sodium azide was 16 mmol/L and the mutation time was 6 h.In the low concentration of solution mutagenesis,with the increase of concentration,the mutagenic effect gradually increased.At the concentration of 15 mmol/L,the germination potential,root length and fresh quality of seedlings were significantly increased when the mutagenesis time was less than 6 h.When the concentration of sodiumazide wasmore than 17 mmol/L or themutation time was more than 6 h,sodium azide had the tendency to reduce the germination potential of seeds,and even the lethal would not germinate,and the seedlings and root length were lower than the control group.
mungbean;sodiumazide;growth index
S522
A
1002-2481(2017)12-1933-04
10.3969/j.issn.1002-2481.2017.12.09
2017-07-25
山西省重点研发计划项目(201603D221004-5);山西省科技攻关项目(20140311005-3)
温日宇(1976-),男,山西朔州人,副研究员,硕士,主要从事作物种质资源开发与利用研究工作。
