双氰基荧光染料的合成、光学性质及其生物成像
2017-12-05李龙龙周宁宁刘世新
李龙龙, 赵 宁*, 李 冰, 彭 丹, 周宁宁, 刘世新
(1. 山东省科学院新材料研究所 山东省特种含硅新材料重点实验室, 山东 济南 250014;2. 山东省计量科学研究院, 山东 济南 250014; 3. 山东省标准化研究院, 山东 济南 250014)
双氰基荧光染料的合成、光学性质及其生物成像
李龙龙1, 赵 宁1*, 李 冰1, 彭 丹1, 周宁宁2, 刘世新3
(1. 山东省科学院新材料研究所 山东省特种含硅新材料重点实验室, 山东 济南 250014;2. 山东省计量科学研究院, 山东 济南 250014; 3. 山东省标准化研究院, 山东 济南 250014)
设计合成了一种A-π-D-π-A型的双光子荧光染料3,6-双(4-乙烯基苯腈)-9-乙基咔唑,测试了其在二氯甲烷(DCM)、乙酸乙酯(EA)、乙醇(EtOH)、乙腈(ACN)、二甲亚砜(DMSO)和磷酸缓冲盐溶液(PBS)等不同溶剂中的紫外吸收光谱、单光子及双光子荧光光谱。化合物3,6-双(4-乙烯基苯腈)-9-乙基咔唑在紫外吸收光谱中存在两个相似的特征吸收带并呈现出复杂的溶剂化效应,在DMSO中具有最大荧光量子产率(86.02%),其相应的活性吸收截面为12.56 GM。在双光子荧光成像方面,染料分子具有优良的细胞膜通透性并且在双光子荧光显微镜下呈现出明亮的绿色荧光,表现出较好的双光子荧光成像性能。这些数据表明,化合物3,6-双(4-乙烯基苯腈)-9-乙基咔唑可用作一种较为理想的双光子荧光标记染料。
双光子荧光染料; 紫外吸收; 量子产率; 活性吸收截面; 细胞成像
1 引 言
近年来,有机双光子吸收材料在荧光显微成像[1-2]、三维光存储[3-4]、微细加工[5-7]、上转换荧光[8]、光限幅[9]、光动力学治疗[10-11]和生物活种定位释放[12]等诸多领域越来越受到重视,尤其是在双光子荧光显微和成像中的应用得到了广泛的关注[13-18]。双光子荧光显微成像兼具诸如近红外激发、暗场成像、避免荧光漂白和光致毒、定靶激发、高分辨率、降低生物组织吸光系数及自发荧光干扰等特点而显著地优于单光子荧光显微成像,因此双光子荧光染料的设计与合成逐渐成为当前研究的焦点。
咔唑类化合物的分子刚性强,共轭平面大,适当修饰后具有较好的双光子荧光性能,在双光子甚至多光子激发荧光生物标记和无损光动力学治疗领域具有潜在的应用价值[19]。氰基作为强的吸电子基团,其π轨道能与芳香环的大π电子交盖,进一步拓宽π共轭体系,增加分子的平面刚性,从而进一步增强双光子荧光性能。Thomas[20]和Wang[21]分别报道了一系列含氰基的咔唑类化合物,但只简单测试了化合物在不同溶剂中的紫外吸收和单光子荧光性能,均未进一步阐述其在生物细胞成像方面的应用。因此,考虑到水溶性、相对较好的吸收截面和量子产率以及在生理环境下的实用性,我们合成了一种以咔唑为母体的在末端带有双氰基发色团的新型双光子染料3,6-双(4-乙烯基苯腈)-9-乙基咔唑,并且对其在不同溶剂下的紫外吸收、单光子荧光光谱、双光子荧光光谱及其生物成像性能进行了系统研究,为更进一步拓宽探针分子在生物成像上的应用奠定了理论基础。
2 实 验
2.1仪器和试剂
咔唑、(4-氰基苄基)亚磷酸二乙酯、叔丁醇钾、三氯氧磷、N, N-二甲基甲酰胺、四氢呋喃、二氯甲烷、氢氧化钾、氢氧化钠、硫酸镁等所用试剂和溶剂均为AR,各试剂使用前均经无水精制。紫外可见吸收光谱在HITACHI U-2910光谱仪上测得。单光子发射光谱在 HITACHI F-2700荧光光谱仪获得,用450W的氙灯为光源,荧光收集为侧面收集方式,半导体制冷的光电倍增管(PMT)为探测器。双光子荧光采用 Ti∶Sapphire Mira900-F 飞秒激光器所发出的脉冲激光作为激发光源,其重复频率为76MHz,脉冲宽度为200fs,采用SpectroPro300i光谱仪作记录。双光子荧光细胞成像图片在Zeiss LSM(Laser Scaning Microscopy德国)510上获得。
2.2染料的合成
双光子染料3,6-双(4-乙烯基苯腈)-9-乙基咔唑的合成路线如图1所示。
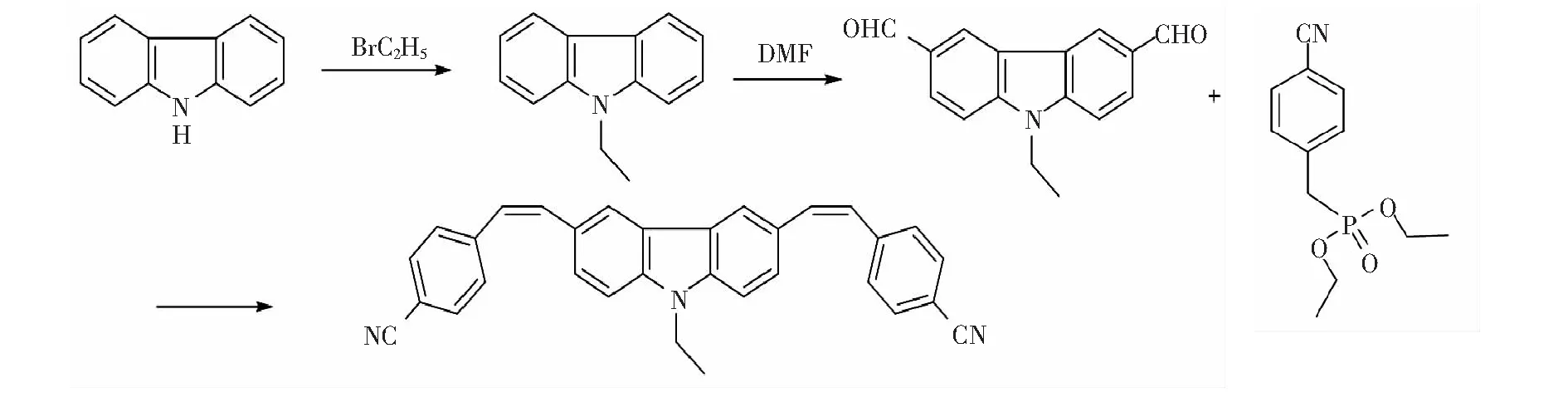
图1 染料分子的合成路线
2.2.19-乙基咔唑的合成
室温下,将氢氧化钾28g (500mmol)溶解在60mL的丙酮中,搅拌反应30min。将咔唑13.2g (80mmol)加入到上述反应液中,继续搅拌反应4h。将溴乙烷120mmol 缓慢滴加到上述反应液中,搅拌反应过夜。将反应液倒入200mL的冰水中,有黄色沉淀析出,过滤,乙醇重结晶得到白色针状产品8.2g,产率52.6%。1H NMR(400MHz)δ:8.11(d,J=7.2Hz,2H),7.48~7.41(m,4H),7.24(d,J=9.2Hz,2H),4.38(d,J=6.8Hz,2H),1.52~1.42(m,3H)。
2.2.23,6-二甲酰基-9-乙基咔唑的合成
将22mL (0.3mol)DMF加入到250mL的三口瓶中,降温至0℃。将三氯氧磷28mL (0.3mol)逐滴加入到上述反应液中,搅拌30min,待有白色沉淀生成后将溶解在20mL DMF中的3.15g (16mmol)N-乙基咔唑加入到反应液中,升温至100℃,搅拌反应30h后冷却至室温。将反应液倒入200mL的冰水中,用氢氧化钠调节pH至8,二氯甲烷萃取,硫酸镁干燥,硅胶担载柱分离,得淡黄色固体2.1g, 产率52.3%。1H NMR(400MHz)δ:10.11(s,2H),8.92(s,2H),8.08(d,J=8.0Hz,2H),7.91(d,J=8.0Hz,2H),4.59(d,J=6.4Hz,2H),1.37(s,3H)。
2.2.33,6-双(4-乙烯基苯腈)-9-乙基咔唑的合成
在无水无氧的条件下,取1.0g (3.98mmol)3,6-二甲酰基-9-乙基咔唑及(4-氰基苄基)亚磷酸二乙酯2.5g (9.88mmol)置于50mL的三口瓶中, 加入20mL的无水THF溶解。然后,将1.6g叔丁醇钾溶解在10mL 无水THF中,缓慢滴加到上述反应液中,室温下搅拌反应24h。将反应液倒入100mL水中,乙酸乙酯萃取,硫酸镁干燥,硅胶担载柱分离,得黄绿色固体1.2g, 产率67.2%。1H NMR(400MHz)δ:8.48(s,2H),7.81~7.86(m,10H),7.66(t,J=9.2Hz,4H),7.38(d,J=16.4Hz,2H),4.47(d,J=6.8Hz,2H),1.35(t,J=6.4Hz,3H)。
3 结果与讨论
3.1紫外吸收光谱
图2为染料在二氯甲烷(DCM)、乙酸乙酯(EA)、乙醇(EtOH)、乙腈(ACN)、二甲亚砜(DMSO) 和磷酸缓冲盐溶液(PBS) 等不同溶剂中的紫外吸收光谱。由图2可知,染料在不同溶剂中的紫外吸收都同时呈现出两个相似的特征吸收带。首先在330nm左右的吸收,可能源于探针分子中的取代咔唑通过双键与苯环相连形成的共轭大π 键,在光的照射下所产生的π→π*跃迁;而在390nm左右的吸收带,则源于氰基氮原子上的孤电子对与苯环π电子共轭形成的n→π*跃迁。

图2 染料在不同溶剂中的紫外吸收光谱
Fig.2UV-Vis absorption spectra of the dye in different solvents
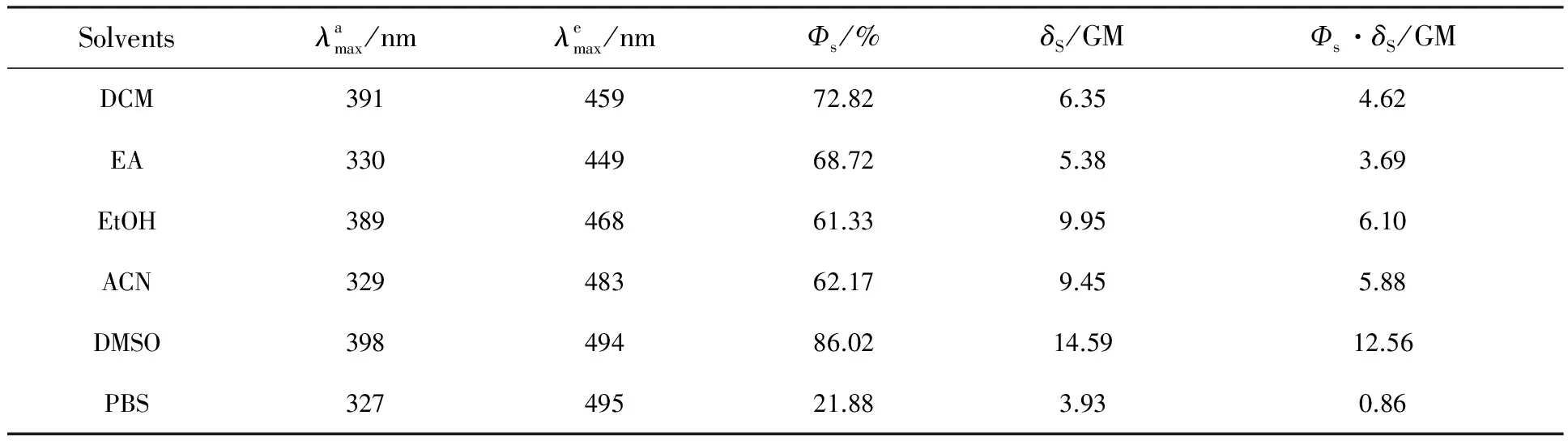
表1 染料在不同溶剂中的光谱数据

3.2 单光子荧光光谱
在不同溶剂中,染料荧光量子产率(Ф)的计算是以荧光素(Ф=0.95,pH=13)水溶液为参比测定并通过公式(1)计算:
(1)

图3 染料在不同溶剂中的单光子荧光光谱
Fig.3 Single-photon fluorescent spectra of the dye in different solvents

3.3 双光子荧光光谱
双光子吸收截面采用双光子诱导荧光法来测量,如公式(2)所示:

(2)
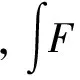
图4为染料在DCM、EA、EtOH、ACN、DMSO和PBS等不同溶剂中的双光子荧光光谱。由图4可以看出,染料在不同溶剂中的双光子荧光峰与单光子荧光峰相比略微红移,这种红移现象可以用再吸收效应解释。由于染料分子的线性吸收峰的长波段区域与发射光谱短波段区域的重叠,染料在该区域发射的荧光有一部分会被它自身的基态分子所吸收,使其双光子荧光的最大吸收峰发生红移。另一方面,染料在DCM、EA、EtOH 和ACN中的活性吸收截面分别为4.62,3.69,6.10,5.88 GM,水相PBS中的双光子荧光强度最低,其活性吸收截面只有0.86 GM;而在DMSO中染料分子具有最强的双光子荧光,相应的活性吸收截面约为在水相PBS中的15倍,达到12.56 GM。

图4 染料在不同溶剂中的双光子荧光光谱
Fig.4 Two-photon fluorescent spectra of the dye in different solvents
3.4 双光子荧光成像
3.4.1 活细胞的培养
首先将HeLa细胞注入到含有双抗(青霉素和链霉素)和10% 的小牛血清的伊格尔培养基(Eagle minimal essential medium)中,然后置于含有5% CO2的恒温(37 ℃)细胞培养箱中培养。当HeLa细胞在培养瓶中生长到对数期,再接片培养:用铬酸洗液浸泡盖玻片0.5 h,再用清水、超纯水冲洗3遍后,烘干,灭菌后放到无菌一次性培养皿中。将培养瓶中的培养液倒出后,细胞用PBS缓冲液冲洗3遍,再用1 mL浓度为0.25%的胰酶消化3 min,倒掉胰酶溶液,再加入少量培养基溶液,然后用移液枪鼓气吹打均匀,细胞计数,留取适当密度的细胞后,加入培养基,再次吹打均匀,然后将细胞加入到提前准备好的含有载玻片的培养皿中,把接种好的培养皿放到细胞培养箱中,待其贴壁生长。在CO2恒温细胞培养箱中培养12~36 h,待细胞密度达到50%~70%,即可用于细胞染色实验。
3.4.2 细胞的固定与染色
将准备好的活细胞用4%的多聚甲醛溶液浸泡0.5 h, 然后在室温下用0.5% Triton X-100溶液再处理2~3 min,将细胞固定。
先将染料配成1 mmol/L的DMSO母液,用5 μmol染料染色HeLa细胞在恒温细胞培养箱中孵育30 min,然后用 D-Hans 溶液洗去未进入细胞的多余的染料溶液, 再加入几滴 PBS 溶液, 把载玻片的细胞生长面朝下盖在培养皿的底片上,即可将培养皿放到荧光显微镜上进行荧光成像。
3.4.3 细胞活性实验
首先采用细胞计数板来检测细胞浓度,滴一滴细胞培养液到含有4块16格1 mm×1 mm的大方格的计数板上,数一下每个方格上的细胞个数,取平均值n(细胞浓度为n/mm3)。将细胞的浓度控制在5 000~50 000个/mm3,然后对细胞培养液进行稀释,再放入96孔板培养。待96孔板中的细胞生长1 d后,分别在2,8,12,24 h时在孔板中加入5 mol的染料3,6-双(4-乙烯基苯腈)-9-乙基咔唑,然后在孔板中加入20 mL浓度为5 μmg/mL的3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐商品名噻唑蓝,再继续培养4 h。依次把孔板内的培养液吸去,再向每个空格中分别加入150 mL DMSO,将孔板放到摇床上低速振荡使结晶物得到充分的溶解。最后在酶标仪上读取各孔的吸光值(OD 490 nm)进行计算。对照孔(培养液、细胞、浓度相同的药物溶解介质、二甲基亚砜和MTT)调零孔( 二甲基亚砜、培养基和MTT)。
染料的细胞毒性也是不容忽略的一个重要参数,染料的细胞毒性在HeLa细胞上用MTT实验测得。细胞毒性实验结果由表2可以看出:在染色2 h以内,HeLa细胞的存活率为89%左右,随着孵育染色时间的增长,细胞的存活率也在下降,24 h时细胞的存活率为51%。所以当染色浓度为5 μmol/L、染色时间为30 min 时,可以认为染料对细胞没有明显毒性。
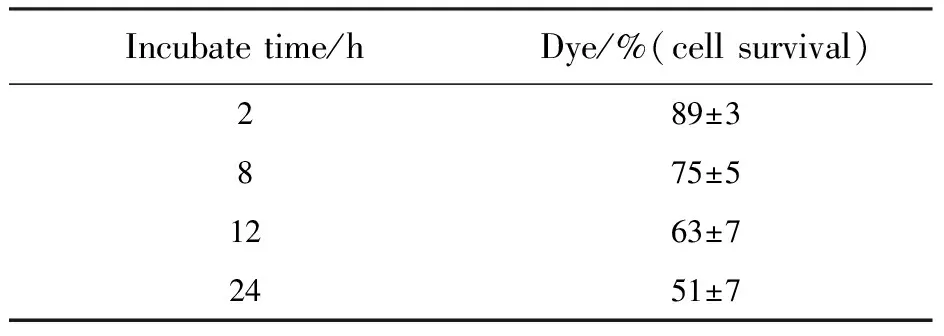
表2 染料毒性实验数据
aCell viability was quantified by the MTT assay (mean±SD)
3.4.4 细胞成像
为了进一步研究染料在细胞中的成像能力,我们对活的Hela细胞进行了严格的染色试验,并利用双光子激光扫描显微镜进行了荧光成像。如图5所示,(a)为染料在细胞内的荧光成像,(b)是细胞的微分干涉(DIC)成像,(c)为(a)和(b)的叠加图像。结果表明,染料能很好地穿透活Hela细胞的胞膜进入细胞,从而使细胞质呈现出明亮的绿色荧光,证明染料具有优良的细胞膜通透性和双光子荧光成像性能。
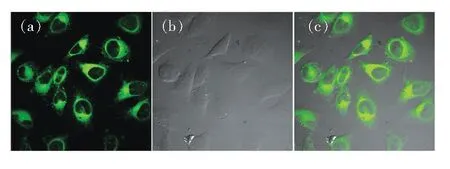
图5 染料在激发波长为800 nm下的双光子细胞成像
Fig.5 Two-photon fluorescence and DIC images of dye exciting in 800 nm.(a) Fluorescent image incubated with the dye. (b)DIC photo.(c) Overlay the (a) and (b).
4 结 论
本文合成了一种新型的双光子荧光染料3,6-双(4-乙烯基苯腈)-9-乙基咔唑,研究了该化合物在不同溶剂中的光学性质及其生物成像性能。结果表明:(1)染料在DCM、EA、EtOH、ACN、DMSO 和PBS 等不同溶剂的紫外吸收中呈现出两个相似的特征吸收带并且存在明显的溶剂化效应;(2)染料在水相PBS中的荧光量子产率最低只有21.88%,其活性吸收截面为0.86 GM,而在DMSO中荧光量子产率达到最大86.02%,相应的活性吸收截面约为在水相PBS中的15倍达到12.56 GM;(3)双光子荧光成像表明染料具有优良的细胞膜通透性和双光子荧光成像性能。综上所述,3,6-双(4-乙烯基苯腈)-9-乙基咔唑具有大的荧光量子产率,好的膜通透性和双光子荧光成像性能,可用作一种较为理想的双光子荧光标记染料,也为进一步构筑优秀的双光子荧光探针提供了一种理想的染料平台。
[1] KIM M K, LIM C S, HONG J T,etal.. Sodium-ion-selective two-photon fluorescent probe forinvivoimaging [J].Angew.Chem.Int.Ed., 2010, 49:364-367.
[2] STALMANS S, WILLEMS M, ADRIAENS E,etal.. Flatworm models in pharmacological research: the importance of compound stability testing [J].Regul.Toxicol.Pharm., 2014, 70:149-154.
[3] YANEZ C O, ANDRADE C D, YAO S,etal.. Photosensitive polymeric materials for two-photon 3D WORM optical data storage systems [J].ACSAppl.Mater.Interf., 2009, 1:2219-2229.
[4] HONDT M D, BRACKE N, TAEVERNIE R,etal.. Related impurities in peptide medicines [J].J.Pharm.Biomed.Anal., 2014, 101:2-30.
[5] JHAVERI S J, MCMULLEN J D, SIJBESMA R,etal.. Direct three-dimensional microfabrication of hydrogelsviatwo-photon lithography in aqueous solution [J].Chem.Mater., 2009, 21(10):2003-2006.
[6] STALMANS S, GEVAERT B, VERBEKE F,etal.. Quality control of cationic cell-penetrating peptides [J].J.Pharmaceut.Biomed.Anal., 2016, 117:289-297.
[7] XU D, JIANG L H. Designed filamentous cell penetrating peptides: probing supramolecular structure-dependent membrane activity and transfection efficiency [J].Chem.Commun., 2015, 51:11757-11760.
[8] LIN T C, CHUNG S J, KIM K S,etal.. Organics and polymers with high two-photon activities and their applications [J].Adv.Polymer.Sci., 2003, 161:157-193.
[9] OLIVEIRA S L, CORREA D S, MISOGUTI L,etal.. Perylene derivatives with large two-photon-absorption cross-sections for application in optical limiting and up conversion lasing [J].Adv.Mater., 2005, 17(15):1890-1893.
[10] PETER C F. Polychromophoric Metal complexes for generating the bioregulatory agent nitric oxide by single- and two-photon excitation [J].ACCChem.Res, 2008, 41(2):190-200.
[11] DEMIZU Y, OBA M, OKITSU K,etal.. A preorganized β-amino acid bearing aguanidinium side chain and its use in cell-penetrating peptides [J].Org.Biomol.Chem., 2015, 13:5617-5620.
[12] ELLIS-DAVIES G C R. Caged compounds: photorelease technology for control of cellular chemistry and physiology [J].Nat.Meth., 2007, 4:619-628.
[13] PISTON D W, BENNETT B D, YING G,etal.. Imaging of cellular dynamics by two-photon excitation microscopy [J].Microsc.Soc.Am., 1995, 1:25-34.
[14] 成春文, 王风贺, 段伦超, 等. 一种新型罗丹明类荧光分子探针及其对Fe(Ⅲ)的选择性识别 [J]. 发光学报, 2014, 35(1):125-130.
CHENG C W, WANG F H, DUAN L C,etal.. Synthesis of a new fluorescent probe based on rhodamine and its performance in selective recognition of Fe(Ⅲ) [J].Chin.J.Lumin., 2014, 35(1):125-130. (in Chinese)
[15] SONG G F, SUN Y M, LIU Y,etal.. Low molecular weight fluorescent probes with good photostability for imaging RNA-rich nucleolus and RNA in iytoplasm in living cells [J].Biomaterials, 2014, 35:2103-2112.
[16] 殷芳芳, 朱维菊, 方敏, 等. 咔唑-硫脲席夫碱荧光探针对Hg2+和Ag+的可视化识别 [J]. 发光学报, 2015, 36(10):1137-1144.
YIN F F, ZHU W J, FANG M,etal.. Visual recognition for Hg2+and Ag+of carbazole-thiourea schiff base fluorescence probe [J].Chin.J.Lumin., 2015, 36(10):1137-1144. (in Chinese)
[17] 马永山, 张凤霞, 孙友敏, 等. 水溶性苝二酰亚胺类衍生物pH荧光探针的合成及表征 [J]. 发光学报, 2011, 32(3):251-255.
MA Y S, ZHANG F X, SUN Y M,etal.. Synthesis and characterization of a pH fluorescence probe based on water soluble perylene diimide derivative [J].Chin.J.Lumin., 2011, 32(3):251-255. (in Chinese)
[18] MIAO F, SONG G F, SUN Y M,etal.. Fluorescent imaging of acidic compartments in living cells with a high selective novel one-photon ratiometric and two-photon acidic pH probe [J].Biosens.Bioelectron., 2013, 50:42-49.
[19] MIAO F, ZHANG W J , SUN Y M,etal.. Novel fluorescent probes for highly selective two-photon imaging of mitochondria in living cells [J].Biosens.Bioelectron., 2014, 55:423-429.
[20] JUSTIN THOMAS K R, VELUSAMG M, LIN J T,etal.. Cyanocarbazole derivatives for high-performance electroluminescent devies [J].Adv.Funct.Mater., 2004, 14(4):387-392.
[21] 王永涛, 赵栋, 陈婷婷, 等. 6-溴-3-(2,2-二氰基乙烯基)-N-正丁基咔唑的合成及其光谱性能 [J]. 石河子大学学报, 2012, 30(5):625-629.
WANG Y T, ZHAO D, CHEN T T,etal.. Synthesis and spectral properties of 6-bromo-3-(2,2-dinitrilevinyl)-N-butylcarbazole [J].J.ShiheziUniv., 2012, 30(5):625-629. (in Chinese)
[22] NARANG U, ZHAO C F, BHAWAKAR J D. Characterization of a new solvent-sensitive two-photon-induced fluorescent (aminostyryl) pyridinium salt dye [J].Phys.Chem., 1996, 10:4521-4525.
[23] FROMHERZ P. Monopole-dipole model for symmetrical solvatochromism of hemicyanine dyes [J].J.Phys.Chem., 1995, 99:7188-7192.
[24] ZHANG D H, ZHOU W, WONG X M. Solvents effects on the luminescent behavior of fluorescent molecules [J].Inform.Record.Mater., 2010, 11(4):34-39.
Synthesis,OpticalPropertiesandBiologicalImagingofANewTwo-photonFluorescenceDyewithDicyano-group
LILong-long1,ZHAONing1*,LIBing1,PENGDan1,ZHOUNing-ning2,LIUShi-xin3
(1.ShandongKeyLaboratoryforSpecialSilicon-containingMaterials,AdvancedMaterialsInstitute,ShandongAcademyofSciences,Jinan250014,China;2.ShandongInstituteofMetrology,Jinan250014,China;3.ShandongInstituteofStandardization,Jinan250014,China)
A novel two-photon fluorescence dye4,4′-((1Z,1′Z)-(9-ethyl-9H-carbazole-3,6-diyl)bis(ethene-2,1-diyl))dibenzonitrile was synthesized, and the linear absorption and fluorescent spectra of the dye in different solvents were investigated. The results indicate that the dye has a intricate solvent effect existing in UV-Vis absorption spectra, and the quantum yields and two-photon active cross-sections in DMSO are86.02%,12.56GM, respectively. About the images, the dye exhibites excellent cell membrane permeability and optical properties. These data show that the compound is a promising candidate for two-photon fluorescence labels.
two-photon fluorescence dye; UV-Vis absorption; quantum yields; active cross-sections; biological imaging
2017-04-26;
2017-08-18
国家自然科学基金青年基金(51303097)资助项目
Supported by National Natural Science Foundation for Youth(51303097)
1000-7032(2017)12-1575-07
O625.67
A
10.3788/fgxb20173812.1575
*CorrespondingAuthor,E-mail:zhaon@sdas.org

李龙龙(1988-),男,山东泰安人,硕士,2014年于齐鲁工业大学获得硕士学位,主要从事双光子荧光材料的制备、构效关系及其应用等方面的研究。E-mail: babylove8856@126.com

赵宁(1982-),男,山东莱芜人,博士,副研究员,2010年于山东大学获得博士学位,主要从事双光子荧光材料的制备、构效关系及其应用等方面的研究。E-mail: zhaon@sdas.org
