不同发育时期菊芋块茎DNA提取效果比较研究
2017-12-02青海大学农林科学院青海省蔬菜遗传与生理重点实验室西宁810016
, , , (青海大学农林科学院,青海省蔬菜遗传与生理重点实验室, 西宁 810016)
不同发育时期菊芋块茎DNA提取效果比较研究
宋向阳,赵孟良,王丽慧,李莉
(青海大学农林科学院,青海省蔬菜遗传与生理重点实验室, 西宁 810016)
为筛选菊芋块茎DNA提取的适宜生育时期,以“青芋1号”菊芋品种为试材,用改良CTAB法对不同发育时期菊芋块茎DNA进行提取,经琼脂糖凝胶电泳及全波长分光光度计检测总DNA的纯度、浓度及质量,选用4条ISSR引物进行PCR验证。结果表明:不同发育时期提取菊芋块茎DNA效果较好,DNA浓度呈现单峰曲线变化,峰值出现在第9周,与琼脂糖凝胶电泳检测呈现的亮度结果一致,PCR验证结果显示,提取的DNA能够满足后续相关分子生物学的要求。
菊芋块茎; 不同时期; DNA提取; ISSR-PCR
菊芋(HelianthusTuberosusL.)又称洋姜、鬼子姜,属菊科(compositae),向日葵属(Helianthusannuus)多年生草本植物。菊芋适应性很强,在我国分布广泛。其富含果聚糖、氨基酸及维生素等人体必需的营养物质[1],同时在改善环境[2]与生物能源[3]等方面具有很高的经济价值和发展前景。
DNA 提取质量的好坏关系到后续分子生物学研究成功与否,提取过程中受到很多因素的影响,另外不同的提取方法、不同提取部位所获得的DNA,其纯度和产率也不同[4]。目前关于不同作物上提取DNA的研究很多,在大豆[5]、葡萄[6]、荷花[7]、黄瓜[8]等提取DNA效果的比较已有报道,本课题组前期对菊芋不同部位的DNA提取效果进行了研究[9],但针对菊芋块茎不同发育时期DNA提取效果及质量的研究未见报道。
本研究以不同发育时期的菊芋块茎为对象,提取其DNA,对提取质量和产率进行分析,并进行PCR验证,以期为后续大规模提取高质量的菊芋块茎DNA提供理论依据和技术参考。

注:1~8分别为匍匐茎形成的第1周、第2周、第3周、第5周、第7周、第9周、第11周、第13周的块茎照片。图1 不同发育时期的菊芋块茎
1 材料和方法
1.1 试验材料
材料选用青海大学农林科学院自主选育的“青芋1号”菊芋品种。在2016年6月下旬菊芋块茎匍匐茎形成后开始取样,每周取样1次,7月后每隔2周取样1次。取样时清水冲洗干净,用锡箔纸包裹后放入液氮中速冻,-80 ℃保存备用。
1.2 试验地概况
样品种植于青海大学农林科学院园艺所3号试验田,该地区属湟水流域灌区,土壤为栗钙土,土壤有机质含量20.28 g/kg, pH值8.12,土壤含全氮1.17 g/kg,全磷2.18 g/kg,全钾22.5 g/kg,速效氮69.0 mg/kg,速效磷65 mg/kg,速效钾229. 0 mg/kg。
1.3 DNA提取
参考赵孟良[10]的改良CTAB法。
1.4 DNA样品检测
1.4.1 琼脂糖凝胶电泳检测
取2μL DNA与2μL 6×loading buffer混匀,于1.0%的BIO-PAD Power PACTMUniversal琼脂糖凝胶电泳检测,120 V,20 min,在BIO-RAD Gel DOCTMXR+凝胶成像系统中照相和分析。
1.4.2 分光光度计检测
采用天根生化科技(北京)有限公司生产的TGEM Plus 全波长分光光度计分别测量A260/280、A260/230值以及DNA的浓度。
1.5 ISSR-PCR验证
采用赵孟良[10]筛选出的4条ISSR引物(序列见表1),扩增程序及反应体系,对提取的8个时期DNA进行PCR扩增,PCR产物采用1.0%的琼脂糖凝胶电泳检测,并用凝胶成像系统拍照分析。
表1 引物名称及序列
引物名称序列(5’⁃3’)Y=(C,T)Tm(℃) P03HVHTCCTCCTCCTCCTCC58 UBC834AGAGAGAGAGAGAGAGYT53 UBC835AGAGAGAGAGAGAGAGYC55 UBC844CTCTCTCTCTCT55
2 结果与分析
2.1 DNA提取效果
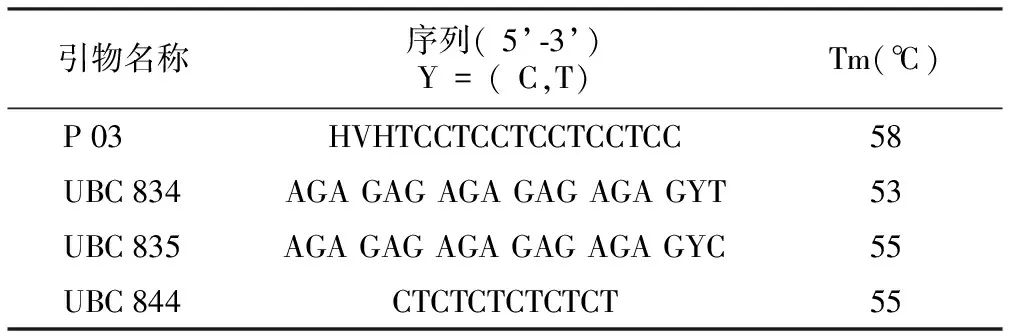
由图2可知,不同时期的菊芋块茎均能成功提取出DNA,并且提取的DNA条带亮度较高,无拖尾现象。其中以第9周提取的DNA条带亮度最高,第2周的亮度最低。
注:M为λ/HindIII DNA Marker;1~8分别为匍匐茎形成的第1周、第2周、第3周、第5周、第7周、第9周、第11周、第13周。图2 不同发育时期菊芋块茎DNA的提取电泳图
由表2与图3可知,在块茎发育的不同时期中,基因组DNA提取的纯度各不相同,第1周、第5周、第7周和第9周提取的DNA A260/280值在1.80~2.00之间,说明这4个时期提取DNA纯度较高;第2周、第3周、第11周、第13周提取DNA A260/280值低于1.80或高于2.00。另外,不同时期提取的DNA浓度也各不相同,在匍匐茎形成的第2周提取的浓度最低,为40.3 ng/g,第9周的浓度最高,为156.2 ng/g;从第7周至第9周中获得的DNA浓度相近,均超过100 ng/g。
表2 不同发育时期提取菊芋块茎DNA的全波长分光光度计检测结果

指标取样周期第1周第2周第3周第5周第7周第9周第11周第13周A260/2801.871.562.191.831.871.972.162.19A260/2301.491.631.491.972.021.931.961.72DNA浓度(ng/g)42.540.358.4586.4138.6156.2124.192.8
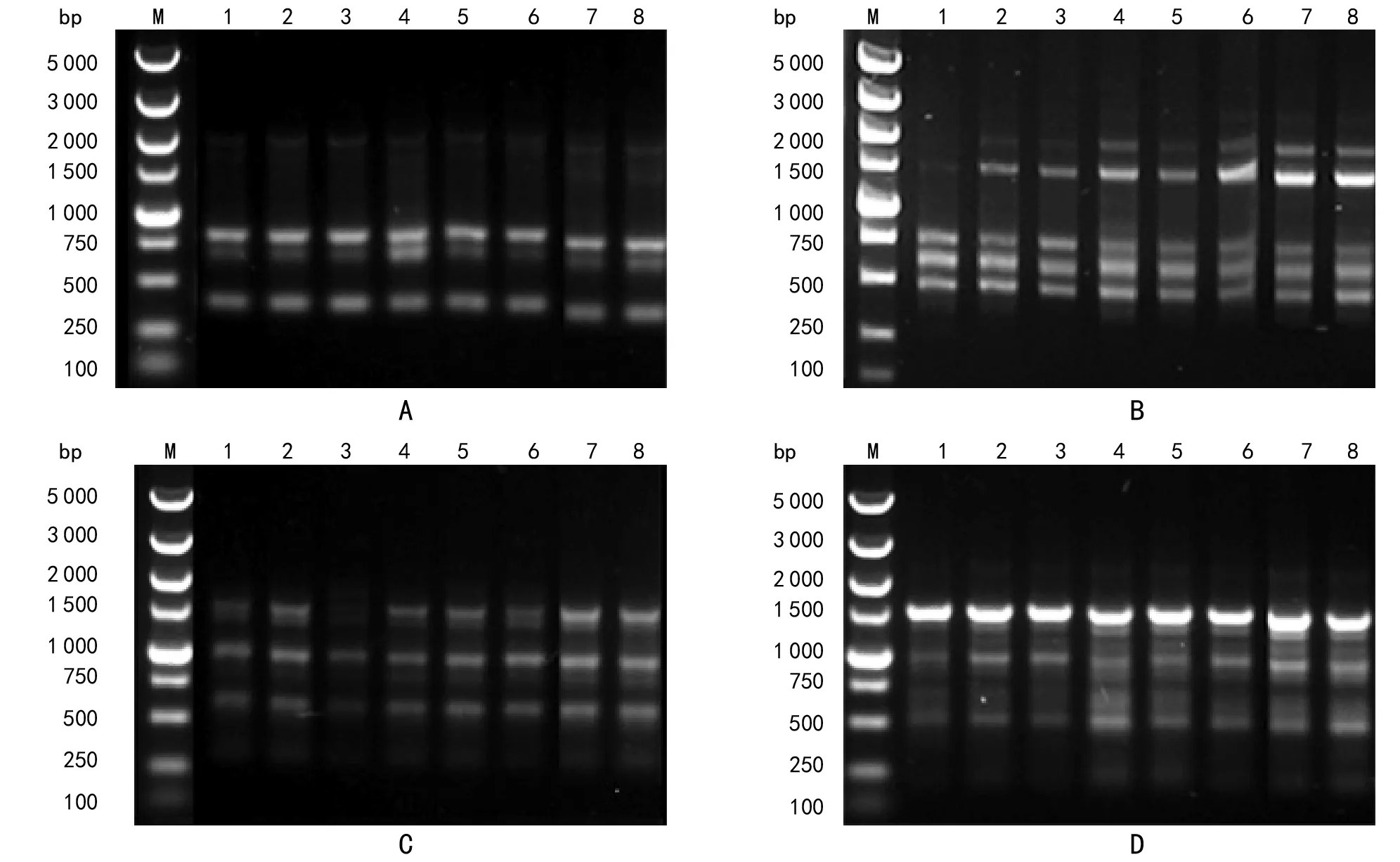
注:M为DNA Marker DSTM 5000;1~8为不同时期的DNA;A、B、C、D依次为引物UBCP 03、 UBC 834、UBC 835、UBC 844。图4 不同发育时期菊芋块茎提取DNA的PCR扩增图谱

图3 不同发育时期菊芋块茎DNA的提取浓度图
2.2 ISSR-PCR扩增验证
结果表明,不同时期提取的DNA模板对ISSR扩增没有明显影响,DNA的纯度都能达到扩增的要求;选用的4条随机引物均能扩增出条带,且条带比较清晰,明亮。
3 讨 论
菊芋块茎中富含大量的果聚糖及其他多糖类化合物,由于多糖类物质的理化性质与DNA极其相似,因此很难将其分离干净,对DNA的提取造成一定的困难。此外,多糖类物质与DNA结合形成的胶状物通过影响酶的活性严重影响分子生物学下游的研究工作[4],随着菊芋块茎发育,其糖分含量及比例也随之发生变化。
本研究在前人对不同部位DNA提取的对比基础上,针对不同发育时期的块茎进行DNA提取对比研究。结果表明,针对不同发育时期的块茎提取DNA,均能在琼脂糖凝胶电泳中呈现出清晰明亮的条带,在菊芋块茎不同发育期提取的DNA并未受到影响。随着匍匐茎的增大,块茎的不断形成,菊芋块茎中的DNA浓度初期呈现S型曲线,但随着块茎的逐渐增大,总体呈现单峰曲线变化,在第9周提取的浓度最高,第2周的浓度最低,这可能与同时期菊芋块茎中大量合成的多糖类物质有关,从而影响了DNA提取过程中糖类物质的剔除,导致提取的DNA浓度降低。
通过ISSR引物扩增验证发现,DNA浓度对ISSR标记的扩增条带较为清晰,说明块茎提取的DNA的产率能够满足实验需求,但同时也发现在引物扩增结果中出现条带缺失现象,且都在块茎发育的初期阶段,它们之间是否有关联还有待进一步实验论证。
[1]李莉.菊芋[M].青海人民出版社,2012.
[2]Srinameb BO,Nuchadomrong S,Jogloy S,et al.Preparation of Inulin Powder from Jerusalem Artichoke (HelianthustuberosusL.)Tuber[J].Plant Foods for Human Nutrition,2015,70(2):221-226.
[3]Lili Li,Li Li,Yipeng Wang,et al.Biorefinery products from the inulin- containing crop Jerusalem artichoke[J].Biotechnology Letters,2013,35:471-477.
[4]李金璐,王硕,于婧,等.一种改良的植物DNA 提取方法[J].植物学报,2013,48(1):72-78.
[5]王桂华,余丽芸,刘术闫,等.不同方法提取大豆基因组DNA的效果比较[J].安徽农业科学,2009,37(26):10 418-10 419,10 429.
[6]田淑芬,李树海,高杨,等.玫瑰香葡萄不同时期叶片提取DNA纯度的比较[J].天津农业科学,2003,6(9):5-7.
[7]桂腾琴,伍伟,卢鹏,等.荷花品种不同部位DNA提取的比较研究[J].种子,2016,35(7):41-44.
[8]王桂岭,秦智伟,周秀梅,等.黄瓜DNA提取及优化SSR反应体系的建立[J].分子植物育种,2007,5(6):196-200.
[9]赵孟良,韩睿,李莉.菊芋不同部位DNA提取的比较研究[J].浙江农业学报,2013,25(5):994-996.
[10]赵孟良,24份菊芋资源遗传多样性分析[D].青海大学,2013.
Comparative Study on Extraction Effect of DNA From Different Periods ofHelianthustuberosusL.
SONGXiangyang,ZHAOMengliang,WANGLihui,LILi
(Qinghai University of Agriculture and Forestry Research,Qinghai Province Laboratory of Vegetable Genetics and Physiology,Xining 810016,China)
For screening the suitable growth period of Jerusalem artichoke tuber for DNA extraction,the tubers of Qingyu No.1HelianthustuberosusL.were used as experimental materials,the DNA were extracted with modified CTAB method and examined with agarose gel electrophoresis.DNA purity and concentration were measured by full wavelength spectrophotometer.Chosen four ISSR primers,DNA extracted from different periods ofHelianthustuberosusL.were used as the templates for ISSR amplification.The results showed that the effect of DNA extraction from different development period of Jerusalem artichoke tuber are good,DNA concentration show unimodal curve,peak appears in the ninth week,with agarose gel electrophoresis test the brightness of the present results are consistent,PCR test results show that the extracted DNA could meet the requirements of subsequent related molecular biology.
HelianthustuberosusL.tuber; different periods; DNA extraction; ISSR-PCR
2017-01-10
青海省蔬菜遗传与生理重点实验室基金项目(Sczdsys-2014-02);青海省科技厅对外合作交流项目(2015-HZ-805)。
宋向阳 (1993—),女,河南新乡人;在读硕士研究生,研究方向:园艺;E-mail:xiangyang_s7@163.com。
李 莉(1959—),女,研究员,硕士生导师,主要从事蔬菜生理及遗传育种研究;E-mail:yyslili@ 163. Com。
10.16590/j.cnki.1001-4705.2017.07.037
S 632.9
A
1001-4705(2017)07-0037-04
