声辐射力脉冲弹性成像技术对大鼠肝脏脂肪变性的诊断研究
2017-12-01郭燕荣董常峰林浩铭张新宇沈圆圆汪天富陈思平刘映霞陈昕
郭燕荣,董常峰,林浩铭,张新宇,沈圆圆,汪天富,陈思平,刘映霞,陈昕
声辐射力脉冲弹性成像技术对大鼠肝脏脂肪变性的诊断研究
郭燕荣1,董常峰2,林浩铭1,张新宇1,沈圆圆1,汪天富1,陈思平1,刘映霞3,陈昕1
(1. 深圳大学生物医学工程学院,医学超声关键技术国家地方联合工程实验室,广东省生物医学信息检测与超声成像重点实验室,广东深圳 518060;2. 深圳第三人民医院感染科,广东深圳 518060;3. 深圳第三人民医院放射科,广东深圳 518060)
研究目的是利用声辐射力脉冲弹性成像技术(Acoustic Radiation Force Impulse,ARFI)评估大鼠肝脏的脂肪变性程度。实验通过对大鼠喂养不同时间高脂食物从而诱导成肝脏脂肪变性不同阶段,进而利用ARFI技术离体测量大鼠肝脏的剪切波速度值(Shear Wave Velocity,SWV)。研究结果显示,对照组[(2.25±0.52) m/s)]与脂肪变性组[(2.83±0.37) m/s]之间存在着显著性差异(< 0.05),而脂肪变性不同阶段之间差异却不明显。早期炎症等级与SWV值之间没有显著性相关。因此,ARFI弹性成像技术可以有效地区分大鼠肝脏正常组和脂肪变性组,但是对不同脂肪变性程度之间无法做出有效区分。同时,轻微的炎症活动并不影响ARFI测量。
声辐射力脉冲弹性成像;脂肪变性;剪切波速度;炎症
0 引言
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)目前在发达国家人群中的比例达到20%~30%,已成为一种严重的公共问题[1]。NAFLD是指病理组织学改变与酒精性脂肪性肝病相似、但无过量饮酒史的临床病理综合征,包括单纯性脂肪肝(Simple Steatosis,SS)和非酒精性脂肪性肝炎(Nonalcoholic Steatohepatitis,NASH)。其中NASH是NAFLD病程进展的关键环节,若NASH得不到有效控制,最终会发展成为更为严重的肝纤维化或者肝硬化[2]。因此,临床上区分NASH和SS有着非常重要的意义。然而,最近的研究成果表明,肝脏的脂肪变性程度与心血管疾病、糖尿病以及肝脏切除手术密切相关[3-5]。因此,在临床上对肝脏脂肪变性的评估也是一个重要的议题。
肝组织活检是诊断脂肪变性程度的金标准。然而,组织活检会产生相应的并发症,并且有0.01%的几率导致死亡。此外,这项技术高度依赖于操作者的个人主观经验以及受限于组织活检样品的尺寸[6]。因此,临床上急需一种简单、无创、可靠的脂肪肝诊断方法。
最近20多年,超声弹性成像技术得到了快速发展,包括准静态弹性成像(Transient Elastography,TE)和声辐射力脉冲弹性成像(Acoustic Radiation Force Impulse,ARFI)等。这些技术通过测量组织的弹性值来评估肝纤维化并取得较好的临床效果[7-8]。这些技术被应用到诊断NAFLD[9-11]。在检测肥胖型病人的脂肪肝疾病方面,常规的TE技术失败率达到了25%[5]。为了提升TE技术诊断NAFLD病人的准确率,研究者最近应用一种更低频率的换能器来检测身体质量指数较大的病人[9]。而ARFI技术利用声辐射力聚焦于组织内部使其产生振动,从而测量组织剪切波传播的速度值(Shear Wave Velocity,SWV)。这种技术可以有效地穿透脂肪层和腹腔,比较适用于肥胖型病人的NAFLD检测。
脂肪变性是脂肪滴在肝脏细胞中的累积过程,在临床上几乎没有任何症状[8]。而由于组织活检的有创性,病人在临床上不愿意采用肝组织活检进行疾病的诊断。因此,临床中对脂肪变性的研究主要集中在较为严重的肝炎和肝纤维化病人中,而对于不含肝纤维化的脂肪变性几乎没有相关的报道[12-15]。相关的动物模型也相对较少,如Aroca[16]等人在2010年采用鸡的脂肪肝模型来研究SWV值与脂肪变性程度的关系,但是实验中并没有考虑肝纤维化因素;2016年的Kang[17]等人采用大鼠NAFLD模型讨论弹性值与脂肪变性和肝纤维化的相关性,然而由于模型上的缺陷,研究者并没有对不含肝纤维化的大鼠进行脂肪变性研究。
本文目的是培养不含肝纤维化大鼠NAFLD模型,采用ARFI弹性成像技术测量大鼠肝脏的SWV值,进而评估其对肝脏脂肪变性的诊断能力。
1 材料和方法
1.1 动物模型
本实验采用的NAFLD大鼠模型由广东省医学动物实验中心提供。总共69只SD大鼠被随机分为对照组(12只)和实验组(57只),体重为(190±10) g。对照组给予正常饮食;实验组通过大鼠喂养2周(3只对照组,15只实验组)、4周(3只对照组,13只实验组)、6周(3只对照组,14只实验组)和8周(3只对照组,15只实验组)高脂食物(食物中包含20%猪油、10%胆固醇、2%胆酸钠、0.5%丙赛优和30%果糖的高脂乳剂)来诱导成脂肪变性的不同分期。每天观察动物的外观体态(毛、色、形)及二便情况并作相应记录。实验开始及试验结束各测量体重1次;实验期间,每周测量体重各1次。培养结束之后,大鼠被处死,取其右叶的肝脏嵌入到明胶制成的仿体中用于超声剪切波速度的测量,其它的大鼠肝脏用于组织学评估。
1.2 血液采集
在禁食12 h之后,从大鼠眼眶静脉窦中取1.5 mL的血液样本,离心取血清,保存在-80℃条件下。采用如下血清指标:胆固醇(Total Cholesterol,TC)、甘油三酯(TriGlyceride,TG)、低密度脂蛋白(Low Density Lipoprotein Cholesterol,LDL-C)、高密度脂蛋白(High Density Lipoprotein Cholesterol,HDL-C)、丙氨酸转氨酶(Alanine AminoTransferase,ALT)和天冬氨酸转氨酶 (Aspartate AminoTransferase,AST)。检测仪器采用的是全自动生化分析仪(型号7020,日立高新技术公司,东京,日本)。
1.3 组织学评估
离体的大鼠肝脏组织浸泡在 10% 福尔马林至少24 h后,进行清洗和脱水,常规石蜡包埋切片(厚度7 μm)以及油红、苏木精-伊红(Hematoxylin-Eosin, HE)和马森(Masson)三色染色处理。最终切片由拥有20年经验的病理专家采用显微镜(BX41,奥林帕斯,美国)进行分析,并且事先对超声测量结果并不知晓。脂肪变性病理检测标准为:S0期,含脂滴的肝细胞散在稀少;S1期,含脂滴的肝细胞≤1/4;S2期,1/4<含脂滴的肝细胞≤1/2;S3期,1/2<含脂滴的肝细胞≤3/4;S4期,肝组织几乎被脂滴代替。炎症的病理检测标准为:G0,未见炎细胞;G1,汇管区或中央静脉周围少量炎细胞散在分布;G2,汇管区、中央静脉周围、肝窦内或肝小叶桥接处炎细胞聚集;G3,灶性炎细胞浸润,伴随肝细胞变性、坏死;G4,弥漫性炎细胞浸润,大量肝细胞变性坏死。肝纤维化病理检测标准为:F0期,无肝纤维化;F1期,汇管区扩大纤维化;F2期,汇管区周围纤维化或纤维间隔形成,小叶结构保留。F3期,纤维化伴小叶结构紊乱,无肝硬化。F4期,可能的或肯定伴有肝硬化形成。图1为不同脂肪变性阶段的典型组织切片图。
图1 脂肪变性不同阶段典型组织切片图
1.4 体外实验
本研究采用的检测设备为Acuson S2000彩色超声诊断仪(西门子,美国),探头为8 MHz的线阵换能器,采用Virtual Touch Tissue Quantification 模式进行测量。体外实验时,右叶肝脏被嵌入在明胶仿体(G2500,西格玛,美国)的容器中(11 cm×11 cm×7 cm)。感兴趣区区域选在明胶仿体表面1.5~2 cm下的肝脏组织中,测量时避开大血管区域。每块仿体测量10次,取其平均值作为最终大鼠肝脏的弹性值。实验时超声医师对肝脏的病理结果并不知晓。
1.5 动物模型
统计软件选用SPSS 19。每只大鼠的SWV值用来估计脂肪变性的分期结果。采用带有Tukey测试的单因素方差分析方法来评估脂肪变性和炎症不同严重等级之间的差异性。ARFI在不同脂肪变性阶段之间的诊断能力采用受试者特性曲线面积(Areas Under the Receiver Operating Characteristic,AUROC),敏感性和特异性采用95%置信区间,截断值采用最大化约登系数。SWV值与血清指标和炎症等级之间的相关性采用斯皮尔曼相关系数。以<0.05为有效差异统计。
2 实验结果
表1列出了大鼠病理最终结果。图2是在不同脂肪变性等级的SWV均值和方差统计图,图中为处于脂肪变性不同分期的大鼠数量。在S0组平均SWV值为(2.25±0.52) m/s (范围:1.33~3.26 m/s);S1组为(2.66±0.40) m/s (范围:1.53~3.04 m/s);S2组为(2.90±0.40) m/s (范围:1.93~3.85 m/s);S3组为(2.93±0.27) m/s (范围:2.62~3.52 m/s);S4组为(2.82±0.28) m/s (范围:2.36~3.18 m/s)。单因素方差分析结果显示在正常组和脂肪变性组之间存在着明显的差异性(< 0.05)。但是在较严重的脂肪变性组之间不存在显著性的差异。图3是大鼠变性ROC物性曲线,从图3可见,剪切波速度在预测脂肪变性S1~S3阶段的受试者特性曲线面积值为0.82 (95%置信区间= 0.69,0.96;截断值为2.54 m/s;敏感性= 0.88;特异性= 0.76)。斯皮尔曼相关系数显示SWV值与脂肪肝严重等级之间有中度的显著性相关(= 0.458,< 0.05)。图4为大鼠炎症不同分期的SWV统计图,由图4可知,在炎症G0期的平均SWV值为(2.70±0.42) m/s (范围:1.53~3.52 m/s);G1期为(2.63±0.59) m/s (范围:1.53~3.52 m/s);G2期为(3.01±0.18) m/s (范围:2.80~3.16 m/s)。单因素方差结果显示在炎症的不同分级之间没有明显的差异。表2列出了大鼠的临床病理结果及对应的血清指标,结果显示与对照组相比,几乎所有的血清指标结果都增大。血清指标ALT (= 0.50,< 0.05),AST (= 0.42,< 0.05),TC (= 0.47,< 0.05)和LDL (= 0.45,< 0.05) 与SWV值之间显著性相关,然而TG和HDL指标与SWV值并不相关。在本实验中,马森三色染色结果显示在大鼠肝脏中不存在肝纤维化。

表1 组织学评估结果
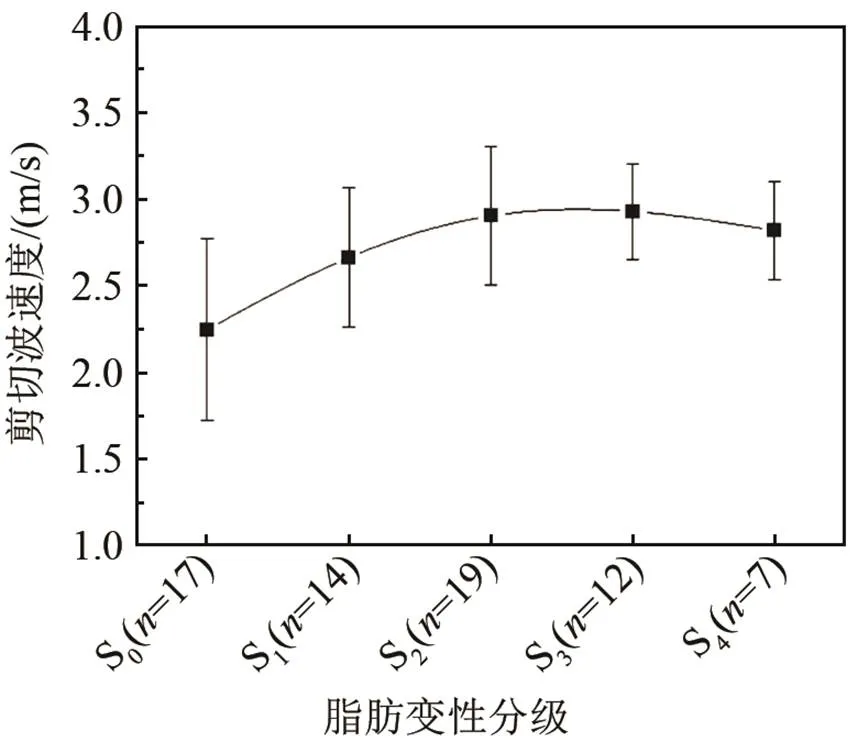
图2 大鼠脂肪变性不同分期的SWV统计图
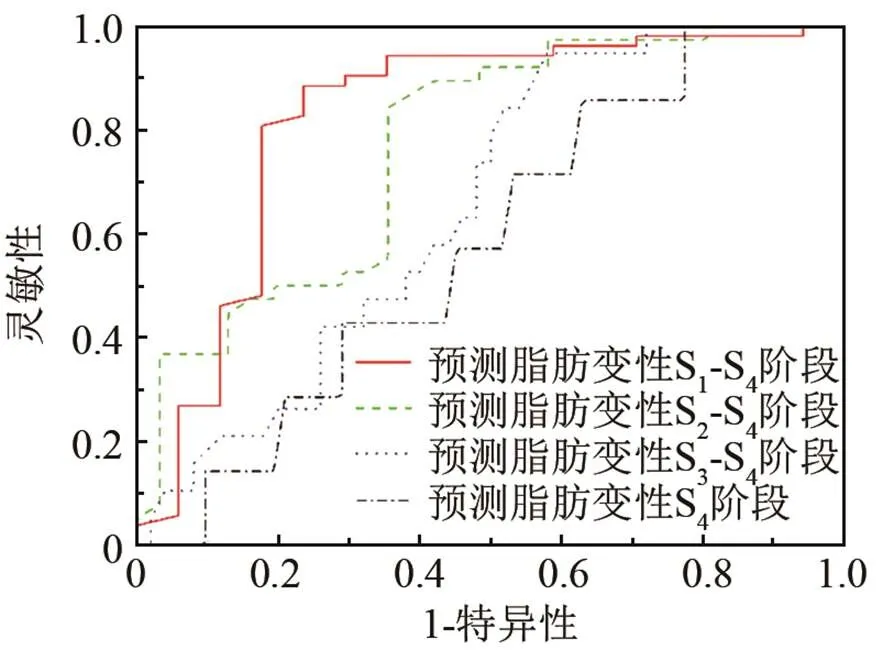
图3 大鼠脂肪变性ROC特性曲线图
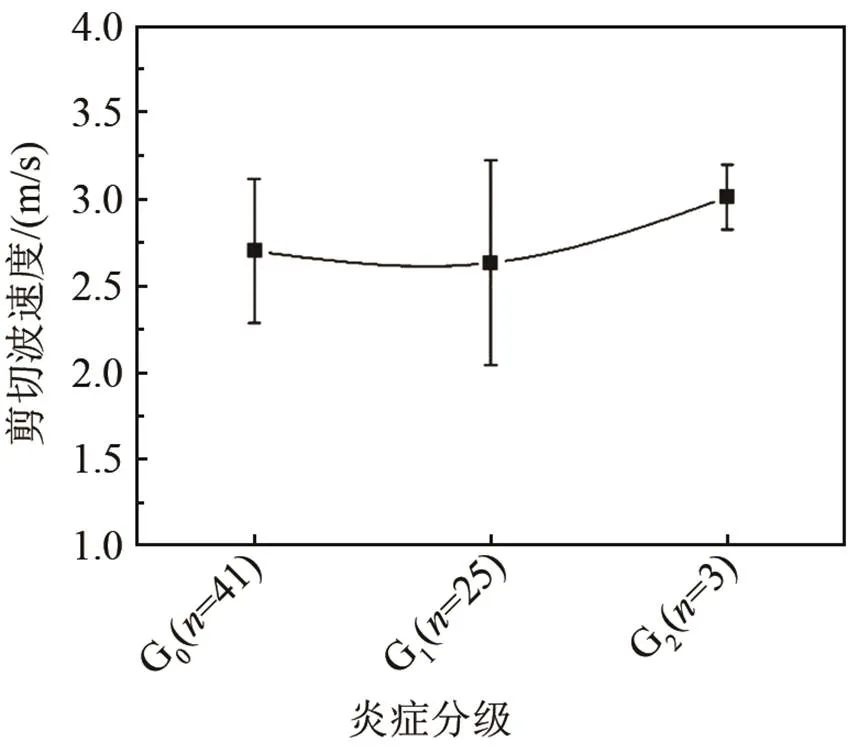
图4 大鼠炎症不同分期的SWV统计图
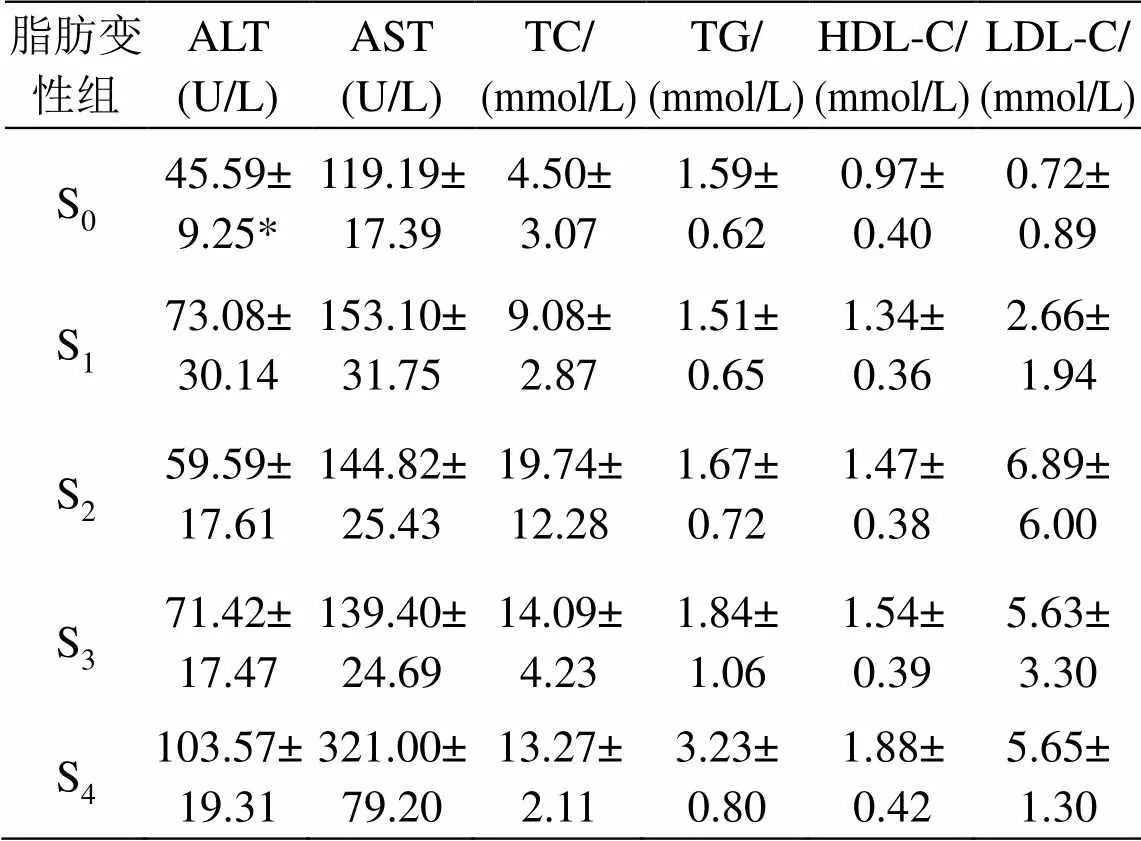
表2 生化指标统计结果
*生化指标统计结果以均值±标准差表示
3 讨论
非酒精性脂肪肝疾病是一个复杂的肝脏疾病,涉及遗传性、环境因素以及许多未知的生理病理因素等。相比于复杂的人体环境,动物模型可以提供给研究者一种工具来克服这些复杂的因素变量,提高对疾病的生理病理学理解。
非酒精性脂肪肝包括多种组织病理特征,如脂肪变性、炎症和肝纤维化等。这些因素都有可能影响超声的发射和剪切波的传播[7,18]。如Aroca[19]等人在临床研究结果表明SWV与肝纤维的严重等级(F0-F4级)显著正相关,同时炎症和脂肪变性因素会对肝脏弹性值产生影响。在本研究中,在大鼠模型中仅存在轻微的炎症(G1,= 25;G2,= 3;G3,= 0;G4,= 0),并且没有肝纤维化。单因素方差分析结果显示,在炎症G0期,G1期和G2期之间不存在明显的差异(> 0.05)。因此,实验中轻度的炎症并没有影响SWV的测量。
在本文中,正常组的平均SWV值为(2.25±0.52) m/s,脂肪变性组为(2.83±0.37) m/s,两组之间存在明显的差异(< 0.05)。Aroca[16]等人在鸡NAFLD模型在体研究的结果显示,正常组的SWV值为(0.9±0.1) m/s,脂肪肝组的SWV值为(1.9 ± 0.2) m/s,两组之间同样存在明显的统计学差异(< 0.001),上述结果与本实验是相似的。然而,我们的实验结果与临床的一些研究结果不同。Nightingale[12]等人在NAFLD病人中,发现脂肪变性程度与SWV值之间没有明显的相关性。另外两个研究结果显示在NAFLD病人中,SWV值随着脂肪变性严重程度的加深而减小[13,20]。上述研究结论的差异及与本实验结论的不同可能是由于NAFLD病人带有多种疾病,如脂肪变性、炎症和肝纤维化等,这些因素都可以影响SWV值的测量;同时,相对于人体NAFLD模型,动物的模型环境更为简单。在我们的大鼠模型研究中,脂肪变性是影响ARFI速度测量的主要因素。然而,Kang[17]等人在2016年最新的研究表明,采用超快速剪切波弹性成像测量方法,大鼠正常组和单纯性质脂肪肝组之间没有明显的差异。上述实验结果的差异可能是彼此建模方式及测量技术的不同引起的;同时本文研究的大鼠模型只存在脂肪变性和轻微的炎症,而Kang的动物模型中包含严重的肝纤维和炎症因素。
本研究存在一些不足:理想的大鼠实验模型中应该只包含脂肪变性这一种因素,但这在现实中是不可能实现的。因为,在大鼠培养期间,脂肪变性和炎症这两种病理是同步发展的。在实验中尽管炎症存在于大鼠的脂肪肝模型中,但单因素方差分析结果显示,轻度的炎症并没有影响SWV的测量。另一个不足是本研究进行的是体外实验,虽然这种实验条件可以克服一些复杂的体内环境因素,如不同个体的体温边界条件及不同的脂肪厚度等。但是力学性能和生理特征可能会发生改变。
4 结论
本文的实验结果显示,ARFI弹性成像技术可以有效地区分正常组大鼠和脂肪变性组大鼠,但对于不同严重等级的脂肪变性却无法有效检测。此外,研究发现轻微的炎症活动并不影响SWV的测量。
[1] Starley B Q, Calcagno C J, Harrison S A. Nonalcoholic fatty liver disease and hepatocellular carcinoma: a weighty connection[J]. Hepatology, 2010, 51(5): 1820-1832.
[2] Castera L, Vilgrain V, Angulo P. Noninvasive evaluation of NAFLD[J]. Nature Reviews Gastroenterology and Hepatology, 2013, 10(11): 666-675.
[3] Targher G, Day C P, Bonora E. Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease[J]. New England Journal of Medicine, 2010, 363(14): 1341-50.
[4] Chen C L, Cheng Y F, Yu C Y, et al. Living donor liver transplantation: the Asian perspective[J]. Transplantation, 2014, 97(8): S3-S6.
[5] Kwok R, Tse Y K, Wong G H, et al. Systematic review with meta-analysis: non-invasive assessment of non-alcoholic fatty liver disease-the role of transient elastography and plasma cytokeratin- 18 fragments[J]. Alimentary Pharmacology & Therapeutics, 2014, 39(3): 254-269.
[6] Pagadala M R, McCullough A J. The relevance of liver histology to predicting clinically meaningful outcomes in nonalcoholic steatohepatitis[J]. Clinics in Liver Disease, 2012, 16(3): 487-504.
[7] Jeong W K, Lim H K, Lee H K, et al. Principles and clinical application of ultrasound elastography for diffuse liver disease[J]. Ultrasonography, 2014, 33(3): 149-160.
[8] Machado M V, Cortez-Pinto H. Non-invasive diagnosis of non-alcoholic fatty liver disease. A critical appraisal[J]. Journal of Hepatology, 2013, 58(5): 1007-19.
[9] Sasso M,Audière S, Kemgang A, et al. Liver steatosis assessed by controlled attenuation parameter (CAP) measured with the XL probe of the fibroscan: a pilot study assessing diagnostic accuracy[J]. Ultrasound in Medicine & Biology, 2016, 42(1): 92-103.
[10] Cassinotto C, Boursier J, De L V, et al. Liver stiffness in nonalcoholic fatty liver disease: A comparison of Supersonic Shear Imaging, FibroScan and ARFI with liver biopsy[J]. Hepatology, 2016, 63(6): 1817-1827.
[11] Petta S, Maida M, Macaluso F S, et al. The severity of steatosis influences liver stiffness measurement in patients with nonalcoholic fatty liver disease[J]. Hepatology, 2015, 62(4): 1101-1110.
[12] Nightingale K R, Rouze N C, Rosenzweig S J, et al. Derivation and analysis of viscoelastic properties in human liver: impact of frequency on fibrosis and steatosis staging[J]. IEEE Transactions on Ultrasonics Ferroelectrics & Frequency Control, 2015, 62(1): 165-175.
[13] Braticevici C F, Sporea I, Panaitescu E, et al. Value of acoustic radiation force impulse imaging elastography for non-invasive evaluation of patients with nonalcoholic fatty liver disease[J]. Ultrasound in Medicine & Biology, 2013, 39(11): 1942-1950.
[14] Wong V W S, Vergniol J, Wong G L H, et al. Diagnosis of fibrosis and cirrhosis using liver stiffness measurement in nonalcoholic fatty liver disease[J]. Hepatology, 2010, 51(2): 454-462.
[15] Deffieux T, Gennisson J L, Bousquet L, et al. Investigating liver stiffness and viscosity for fibrosis, steatosis and activity staging using shear wave elastography[J]. Journal of Hepatology, 2015, 62(2): 317-324.
[16] Aroca F G, Ayala I, Serrano L, et al. Assessment of liver steatosis in chicken by using acoustic radiation force impulse imaging: preliminary results[J]. European Radiology, 2010, 20(10): 2367-2371.
[17] Kang B K, Lee S S, Cheong H, et al. Shear wave elastography for assessment of steatohepatitis and hepatic fibrosis in rat models of non-alcoholic fatty liver disease[J]. Ultrasound in Medicine & Biology, 2015, 41(12): 3205-3215.
[18] Piscaglia F, Marinelli S, Bota S. The role of ultrasound elastographic techniques in chronic liver disease: current status and future perspectives[J]. European Journal of Radiology, 2014, 83(3): 450-455.
[19] Aroca F, Frutos-Bernal M,Bas A, et al. Detection of non-alcoholic steatohepatitis in patients with morbid obesity before bariatric surgery: preliminary evaluation with acoustic radiation force impulse imaging[J]. European Radiology, 2012, 22(11): 2525-2532.
[20] Yoneda M, Suzuki K, Kato S, et al. Nonalcoholic fatty liver disease: US-based acoustic radiation force impulse elastography [J]. Radiology, 2010, 256(2): 640-647.
Evaluation of rat liver steatosis by acoustic radiation force impulse elastography
GUO Yan-rong1, DONG Chang-feng2, LIN Hao-ming1, ZHANG Xin-yu1, SHEN Yuan-yuan1, WANG Tian-fu1, CHEN Si-ping1, LIU Ying-xia2, CHEN Xin1
(1. School of Biomedical Engineering, Shenzhen University, National-Regional Key Technology Engineering Laboratory for Medical Ultrasound, Guangdong Key Laboratory for Biomedical Measurements and Ultrasound Imaging, Shenzhen 518060,Guangdong, China;2. Institute of Infection, The Third People’s Hospital of Shenzhen, Shenzhen 518060, Guangdong,China;3.Institute of Radiology, The Third People’s Hospital of Shenzhen, Shenzhen 518060, Guangdong,China)
The goal of this study is to evaluate the utility of acoustic radiation force impulse (ARFI) elastography for determining the severity grade of rat liver steatosis. Steatosis is induced in the rat livers by gavage feeding of a high fat emulsion. Liver mechanics are measured ex vivo using shear wave velocity (SWV) induced by acoustic radiation force. The results show that there is a significant difference between the normal group (2.25±0.52) m/s and steatosis group (2.83±0.37) m/s (<0.05). However, there are no significant differences in SWV measurements between the steatosis grades. SWV values do not correlate with the early grade of inflammation. In conclusion, ARFI elastography is a promising method for differentiating normal rat liver from the rat liver with steatosis, but it cannot reliably predict the grade of steatosis in rat livers. The early grade of inflammation activity does not significantly affect the SWV measurements.
acoustic radiation force impulse elastography; steatosis; shear wave velocity; inflammation.
R312
A
1000-3630(2017)-05-0450-05
10.16300/j.cnki.1000-3630.2017.05.009
2016-12-02;
2017-02-04
国家自然科学基金(81471735、81570552、61427806、61101025、61201041)、国家科技支撑计划(2015BAI01B02)、广东省自然科学基金(2016A030310047)资助。
郭燕荣(1988-), 男, 河南南阳人, 博士研究生, 研究方向为医学信号处理。
陈昕, E-mail: chenxin@szu.edu.cn
