香豆素对苏丹草种子萌发和幼苗生长的影响
2017-11-29王婧怡姚丹丹邬彩霞赵国琦华晨岚
王婧怡,姚丹丹,徐 军,邬彩霞,赵国琦,华晨岚
(扬州大学动物科学与技术学院,江苏 扬州 225009)
植物生产层
香豆素对苏丹草种子萌发和幼苗生长的影响
王婧怡,姚丹丹,徐 军,邬彩霞,赵国琦,华晨岚
(扬州大学动物科学与技术学院,江苏 扬州 225009)
香豆素为黄花草木樨(Melilotusofficinalis)水浸提液的主效化感物质,能抑制多种杂草种子的萌发和幼苗生长。为探明香豆素的化感抑草作用机理,本研究采用室内培养、生物检测的方法,研究了简单香豆素水溶液对苏丹草(Sorghumsudanense)种子萌发及其幼苗生长和生理生化指标的影响,并采用透射电镜观察了苏丹草幼苗根和茎的超微组织结构。结果表明,20~100 μg·mL-1香豆素水溶液能够显著抑制早期苏丹草种子的萌发 (Plt;0.05),且随浓度升高抑制作用增强,能够显著抑制苏丹草根伸长,随处理时间的延长和浓度的升高其抑制作用也增强,根变粗扭曲,而对茎长的影响存在浓度效应和时间效应,在4 d时,20~100 μg·mL-1浓度的香豆素水溶液均促进茎长,6和8 d则表现为低浓度促进、高浓度抑制;与加蒸馏水的对照组相比,100 μg·mL-1香豆素溶液处理显著(Plt;0.05)提高了过氧化氢酶(CAT)活性,并降低了超氧化物歧化酶(SOD)活性,对过氧化物酶(POD)抑制作用表现为先降低后升高;香豆素处理显著(Plt;0.05)提高了可溶性糖的含量,同时显著(Plt;0.05)降低了叶绿素的含量;在香豆素处理下,淀粉含量先降低后升高,吲哚乙酸氧化酶(IAAO)活性仅在第4天时低于对照组。香豆素水溶液破坏了苏丹草根细胞的超微结构,出现液泡体积变大,细胞器数量和种类减少的现象,细胞核的核膜发生明显的歪曲,细胞核变小甚至消失;香豆素水溶液处理下的苏丹草幼苗叶绿体内淀粉粒数目显著(Plt;0.05)增加,体积变大。以上结果显示,100 μg·mL-1的香豆素水溶液可以通过改变苏丹草抗氧化酶系统、增加渗透调节物质、降低叶绿素含量、影响酶活性以及破坏细胞超微结构等途径调节苏丹草的生长。
香豆素;苏丹草;化感;幼苗;生化指标;抗氧化酶;透射电镜
近年来,随着农药的使用量不断加大,其弊端逐渐暴露[1-4],主要的问题是农药残留[5-8]。利用植物化感物质抑制或者清除杂草是解决这一问题的有效途径之一[9-10]。国内外研究表明,很多植物对杂草表现出化感抑制作用,例如水稻(Oryzasativa)的水浸提液可以减少田间稗草(Echinochloacrusgalli)以及鳢肠(Ecliptaprostrate)等杂草[11];向日葵(Helianthusannuus)的水提液也可抑制稗草的生长[12];小飞蓬(Conyzacanadensis)水浸提液可以抑制马唐(Digitariasanguinalis)、稗草、反枝苋(Amaranthusretroflexus)和苘麻(Abutilontheophrasti)4种杂草种子萌发和幼苗生长[13]。目前该类研究成果已经进入田间试验评价阶段,并取得了一定的成果。王海斌等[14]探讨了连续3年5种不同化感潜力水稻田间抑草效应、产量及其之间的相互关系,发现水稻可以利用自身化感作用控制稻田杂草,且不同化感潜力水稻对稻田杂草的抑制能力存在一定差异,因此化感水稻在田间种植过程中可在保证相同成熟期下,采取适当多品种种植的生态调控策略,以提高水稻自身对多种类别杂草的防除效果或配以适当化学除草剂最终达到水稻的高产、优产和高效的目的。
有研究表明,黄花草木樨(Melilotusofficinalis)有很强的化感作用,其水浸液能够显著抑制稗草、藜(Chenopodiumalbum)、臭草(Melicascabrosa)、籽粒苋(Amaranthushypochondriacus)、萹蓄(Polygonumaviculare)和车前草(Plantagoasiatica)等杂草种子萌发和幼苗生长[15],经气质联用(GG-MS)及核磁共振(NMR)鉴定出其主要化感物质为香豆素,含量为46.78 μg·mL-1,且溶液中香豆素相对含量越高抑制作用越强。研究发现,香豆素溶液在浓度为40 μg·mL-1时能显著抑制多花黑麦草(Loliummultiflorum)、萹蓄、红三叶(Trifoliumpratense)和紫花苜蓿(Medicagosativa“Victoria”)等种子的萌发和幼苗生长,当香豆素溶液浓度达到100 μg·mL-1时,几乎达到完全抑制[16-17]。Razavi[18]研究发现,香豆素含量在100 μg·mL-1时能够完全阻碍生菜(Lactucasativa)的种子出苗和其根、茎的生长。由此可见,将香豆素开发为新型的除草剂[19]具有很大的潜力。
简单香豆素(C9H6O2)是香豆素类物质中以最简单形式存在的化合物,与大部分香豆素类化合物性质相似,因此通过研究简单香豆素,对于更好地理解香豆素类化合物的作用机理具有重要意义。目前关于香豆素对植物的化感作用大多还是停留在发芽率等形态上的研究,缺少对受体植物组织和细胞内部结构及其机理方面的报道。因此,为了进一步探明香豆素的化感抑制作用机理,本研究用不同浓度香豆素溶液对苏丹草(Sorghumsudanense)进行处理,观察其种子萌发和幼苗生长过程中的变化,并测定分析苏丹草100 μg·mL-1浓度处理下的一些重要生理生化指标,用透射电镜观察苏丹草根和茎细胞内部结构的变化,为开发香豆素新型生物除草剂提供一些理论基础。
1 材料与方法
1.1供试材料
供体药品为简单香豆素,固体香豆素购于SIGMA公司(编号:C4261-50G,纯度≥99%)。苏丹草“布鲁诺”为受体植物,种子购于百绿集团。
1.2香豆素水溶液制备及苏丹草培养
香豆素水溶液的制备:准确称取100 mg香豆素标准品,用水定容至1 L,充分溶解后得到100 μg·mL-1的香豆素水溶液,于4 ℃冷藏备用,要用时分别稀释至20、40、80 μg·mL-1。
苏丹草的培养:在直径为12 cm×12 cm的发芽盒中加入石英砂90 g,将经1%次氯酸钠消毒30 min的苏丹草种子均匀播入发芽盒中,每盒100粒,向试验组每个发芽盒中加20 mL 100 μg·mL-1的香豆素水溶液,对照组加等量蒸馏水,每个处理5次重复。然后采用完全随机区组设计,放入25 ℃光照培养箱(智能光照培养箱ZGX-300C,杭州钱江仪器设备有限公司)中进行培养,培养条件的光/暗12 h/12 h,光照强度4 000 lx[20]。
透射电镜样品前处理:选取播种处理后第4、6和8天已经发芽苏丹草的根和茎,切割成1 mm×1 mm×1 mm左右的样品,切割后立即放入戊二醛固定液抽真空,放在冰箱里4 ℃固定24 h以上。经0.1 mol·L-1的磷酸盐缓冲液(pH=7.2)冲洗3次,每次15 min,然后使用1%锇酸固定4 h,再使用0.1 mol·L-1的磷酸盐缓冲液冲洗3次,每次15 min,乙醇梯度脱水(30%、50%、70%、80%、90%、100%),每次15 min,进行常规树脂(美国SPI,02660-AB)包埋,在超薄切片机(徕卡,UC6)上用钻石刀切片,再经醋酸铀和枸椽酸铅双重染色,在Phillips Tecnai 12 TEM (荷兰)透射电镜下观察,照相[21]。
1.3测定项目及方法
出苗率:从第1天开始每天记录各处理下苏丹草出苗率,直到第8天。
苗长与根长:播种4、6和8 d后从每个发芽盒中随机取10株苏丹草测定其根长及苗长,取平均值。发芽数低于10株的只取发芽的幼苗测苗长和根长,并取该相应幼苗的平均值[20]。
茎叶干重与根干重:播种4、6和8 d后从每个发芽盒中随机取10株苏丹草,将幼苗的地上部分和地下部分分离,105 ℃杀青3 h,然后65 ℃烘干至恒重[20]。
植物全株过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)、可溶性糖(soluble sugar)含量:播种4、6和8 d后采样,使用试剂盒(南京建成生物有限公司)测定。
植物全株吲哚乙酸(IAAO)酶联免疫分析:播种4、6和8 d后采样,使用试剂盒(上海心语生物科技有限公司)测定。
植物全株淀粉(starch)含量:播种4、6和8 d后采样,采用蒽酮比色法[22]。
植物全株叶绿素含量、叶绿素a含量、叶绿素b含量:播种4、6和8 d后采样,采用80%乙醇浸提法[22]。
1.4统计方法
试验数据先用Excel进行初步处理后,用 SPSS 软件(SPSS Ver.17.0 for Windows)对数据进行单因素方差分析,数据以算术平均数±标准误表示,Plt;0.05为差异显著性判断标准。
2 结果和分析
2.1香豆素水溶液处理对苏丹草种子发芽及幼苗生长的影响
不同浓度香豆素水溶液对苏丹草种子的萌发有不同的抑制作用(表1),且随着浓度的升高抑制作用增强,在第5天时,100 μg·mL-1处理组低于对照组7.86%(Plt;0.05)。同时,香豆素水溶液处理出现发芽延迟、出苗不齐的现象。对照组根先萌发,而处理组则茎先突破种皮。
香豆素水溶液显著(Plt;0.05)抑制苏丹草的根长,浓度越高抑制作用越强,且随处理时间的延长其抑制作用也增强,根变粗扭曲(图1,图2);处理4、6和8 d后,20 μg·mL-1香豆素水溶液对苏丹草茎长均有促进作用,4 d,20~60 μg·mL-1香豆素处理显著(Plt;0.05)促进苗长,100 μg·mL-1虽然也促进苗长,但无显著影响(Pgt;0.05);6 d,40~100 μg·mL-1抑制苗长,但差异不显著(Pgt;0.05);8 d,20~80 μg·mL-1促进苗长,但无显著影响,100 μg·mL-1显著抑制苗长。
不同香豆素水溶液对苏丹草茎叶鲜重和干重均有促进作用(表2),20~80 μg·mL-1显著促进苏丹草茎叶鲜重(Plt;0.05),在100 μg·mL-1浓度时恢复至对照水平,20~60 μg·mL-1显著(Plt;0.05)促进苏丹草茎叶干重,在80和100 μg·mL-1浓度时恢复至对照水平;20~60μg·mL-1显著促进苏丹草根鲜重(Plt;0.05),80和100 μg·mL-1浓度下则显著抑制苏丹草根鲜重,20~100 μg·mL-1浓度区间均抑制苏丹草根干重,尤其在40~100 μg·mL-1显著抑制苏丹草根干重的积累(Plt;0.05)。
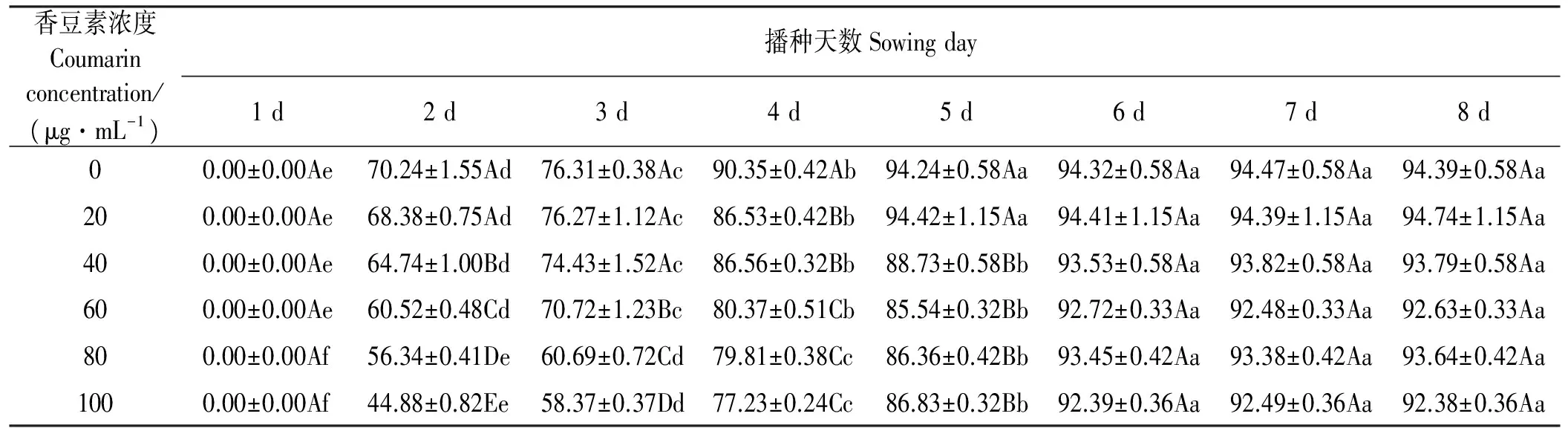
表1 不同浓度香豆素溶液处理下苏丹草发芽率
注:不同大写字母表示同一时间不同浓度处理之间差异显著(Plt;0.05),不同小写字母表示同一香豆素浓度不同时间之间差异显著(Plt;0.05),下同。
Note:Different capital letters in the same sowing day indicate significant differences among different coumarin concentrations at the 0.05 level. Different lowercase letters in the same coumarin concentration indicate significant differences among different sowing days at the 0.05 level; similarly for the following figures and tables.
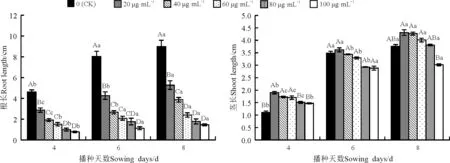
图1 不同浓度香豆素水溶液对苏丹草幼苗根长和茎长的影响

图2 不同浓度香豆素水溶液对苏丹草根的影响
2.2香豆素溶液对抗氧化酶系统的影响
香豆素溶液处理苏丹草种子后,苏丹草植株内CAT活性发生了变化(表3)。处理4、6和8 d后,处理组均高于对照组,尤其在处理6和8 d,处理组显著高于对照组(Plt;0.05)。对照组苏丹草CAT活性随着时间的延长,总体呈下降趋势且差异显著(Plt;0.05),香豆素处理的苏丹草CAT活性总体呈先升高后降低趋势,处理6 d高于处理4 d (Plt;0.05),处理4 d高于处理8 d(Plt;0.05)。处理4、6和8 d后分别比对照组提高11.56%、184.62%和1 085.71%。
香豆素溶液处理苏丹草种子后,苏丹草植株内POD活性发生了变化(表3)。处理4和6 d后,处理组均低于对照组,处理8 d后处理组高于对照组。对照组和香豆素处理的苏丹草POD活性随播种天数的变化趋势总体呈先降低后升高趋势(Plt;0.05)。处理4和6 d后,处理组分别比对照组下降了32.79%和3.91%,处理8 d后,处理组比对照组升高了12.30%。
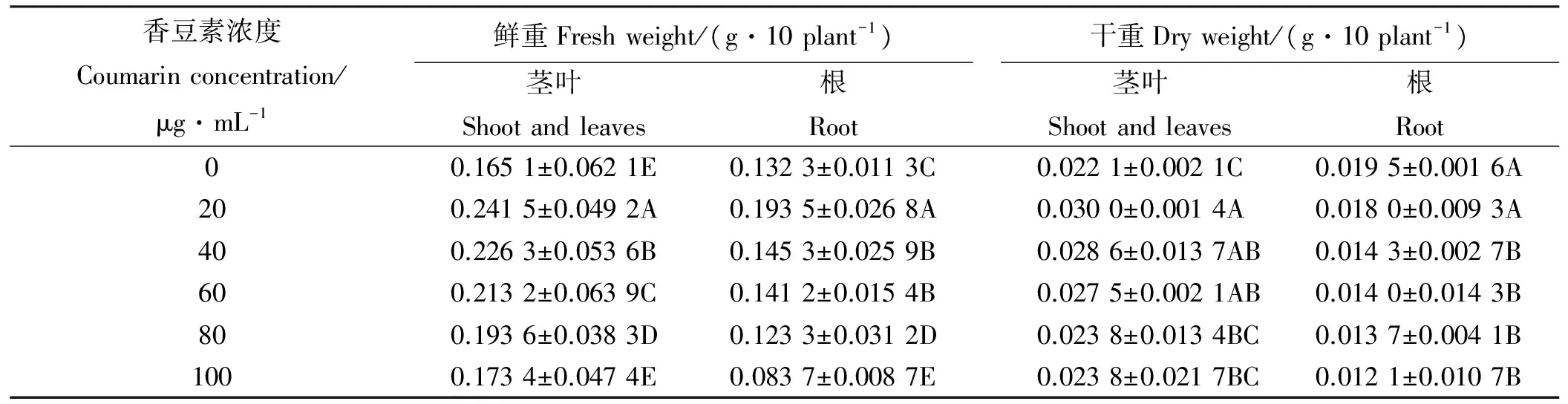
表2 不同浓度香豆素溶液处理下苏丹草鲜重和干重
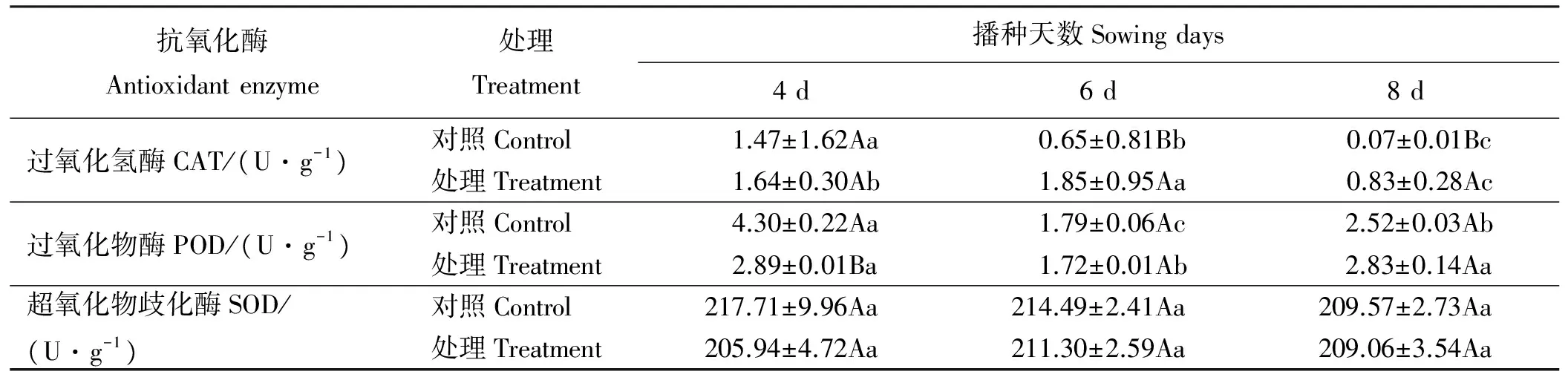
表3 香豆素水溶液处理对苏丹草幼苗抗氧化代谢酶活性的影响
香豆素溶液处理苏丹草种子后,苏丹草植株内SOD活性发生了变化(表3)。处理4、6和8 d后,处理组均低于对照组,但无显著差异(Pgt;0.05)。对照组苏丹草SOD活性随播种天数呈下降趋势,处理组苏丹草SOD活性呈先升高后降低趋势,但均无显著差异。处理4、6和8 d后,处理组分别较对照组下降了5.41%、1.49%和0.24%。
2.3香豆素溶液对IAAO活性的影响
香豆素溶液处理苏丹草种子后,苏丹草植株内IAAO活性发生了变化(图3)。处理4和8 d后,处理组高于对照组,处理6 d后处理组显著低于对照组(Plt;0.05)。对照组的苏丹草IAAO活性总体呈降低趋势,处理组苏丹草IAAO活性先降低后升高,处理4 d显著高于处理6和8 d (Plt;0.05)。处理4和8 d后,处理组分别较对照组升高了6.24%和451.35%,处理6 d后,处理组较对照组下降了29.72%。
2.4香豆素水溶液对渗透调节物质的影响
香豆素溶液处理苏丹草种子后,苏丹草植株内可溶性糖含量发生了变化(表4)。香豆素处理4、6和8 d后,处理组可溶性糖含量均显著高于对照组(Plt;0.05)。对照组和香豆素水溶液处理的苏丹草可溶性糖总体均呈下降趋势,且差异显著(Plt;0.05)。香豆素溶液处理4、6和8 d后,处理组分别比对照组提高了32.44%、48.87%和17.88%。
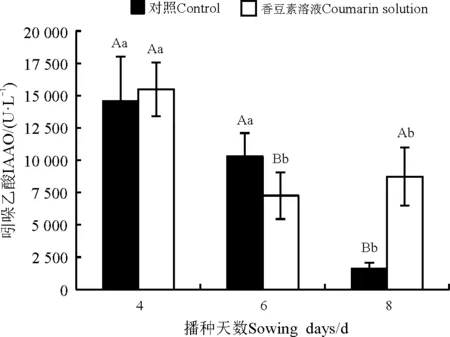
图3 香豆素水溶液处理对苏丹草IAAO活性影响
用香豆素溶液处理苏丹草种子后,苏丹草植株内淀粉含量发生了改变(表4)。用香豆素处理4和6 d后,处理组淀粉含量低于对照组(Plt;0.05),用香豆素处理8 d后,处理组淀粉含量高于对照组(Plt;0.05)。对照组和香豆素水溶液处理的苏丹草淀粉总体均呈下降趋势,且差异显著(Plt;0.05)。香豆素溶液处理4 d和6 d后,处理组较对照组分别降低了18.91%、25.44%,香豆素溶液处理8 d后,处理组较对照组升高了39.78%。
2.5香豆素水溶液对叶绿素的影响
香豆素溶液处理苏丹草种子后,苏丹草植株内叶绿素含量发生了变化(表5)。处理4、6和8 d后,总叶绿素、叶绿素a和叶绿素b的含量处理组基本低于对照组(Plt;0.05)。对照组和香豆素溶液处理的总叶绿素和叶绿素a含量均呈上升趋势,叶绿素b在对照组呈上升趋势(Plt;0.05),在香豆素溶液处理下呈先升高(Plt;0.05)后降低趋势。对照组中,随着播种天数的延长,总叶绿素、叶绿素a和叶绿素b含量显著升高(Plt;0.05);处理组中,处理6 d的总叶绿素、叶绿素a和叶绿素b与4 d相比显著增加(Plt;0.05),处理6和8 d间无显著差异(Pgt;0.05)。处理4、6和8 d处理组的总叶绿素含量较对照组分别降低了47.06%(Plt;0.05)、39.64%(Plt;0.05)和63.04%(Plt;0.05),处理组的叶绿素a与对照组相比分别降低了46.15%(Plt;0.05)、44.05%(Plt;0.05)和63.04%(Plt;0.05),处理组的叶绿素b与对照组相比分别降低了50.00%(Plt;0.05)、28.57%(Pgt;0.05)和58.14%(Plt;0.05)。
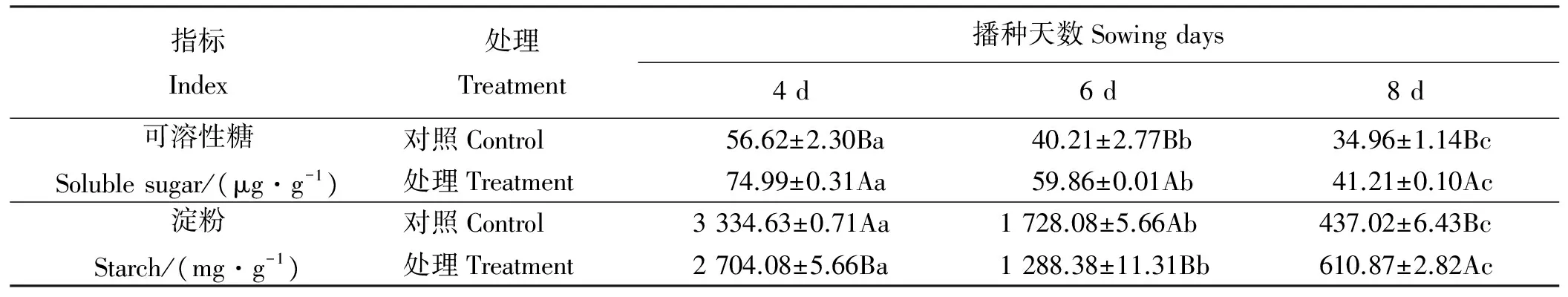
表4 香豆素水溶液处理对苏丹草渗透性调节物质的影响
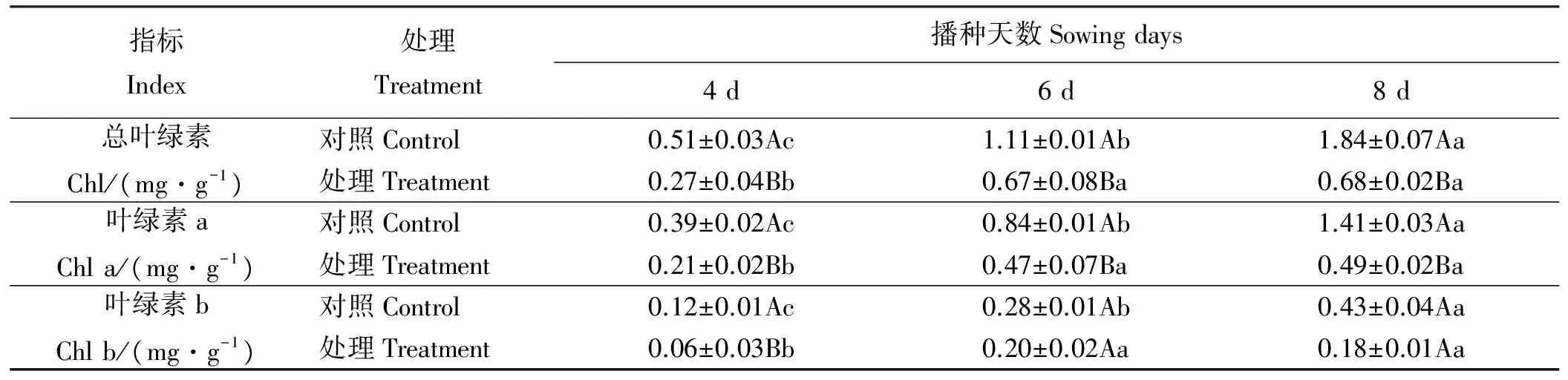
表5 香豆素水溶液处理对苏丹草总叶绿素的影响
2.6香豆素处理下苏丹草幼苗的根和茎超微结构变化
对照组中苏丹草幼苗的根细胞形态完整清晰,整个细胞充满了均匀的细胞质,内有完整的细胞核,细胞器数量多且明显,液泡呈正常大小(图4)。经100 μg·mL-1的香豆素溶液处理后,苏丹草幼苗根细胞的超微结构与对照相比有明显的变化(图4)。香豆素处理4 d,与对照相比,细胞内液泡体积变大,细胞器数量和种类减少(图4);香豆素处理6 d,细胞内液泡与4 d处理组相比变得更大,几乎占据整个细胞,细胞器数量和种类继续减少,对照中细胞核位置居中且核膜清晰,核仁致密,经处理后细胞核的核膜出现明显的歪曲,细胞核变小(图4)。香豆素处理8 d,细胞壁变薄,液泡消失,细胞核发生溶解,仅存在少量的细胞器(图4)。结果显示,随着处理时间的变长,香豆素对于苏丹草细胞结构的破坏程度也增强。
对照组中苏丹草幼苗茎细胞形态完整清晰,细胞壁与细胞膜紧密结合,内有完整的细胞核,液泡占据了大半个细胞,细胞器数量多且明显(图4)。经100 μg·mL-1的香豆素溶液处理后,苏丹草幼苗茎细胞的超微结构与对照相比,细胞结构和大小并不存在明显的变化,但茎叶绿体内淀粉粒数目显著增加,体积变大(图4),表明苏丹草启动了自身防御功能。
3 讨论
3.1香豆素水溶液对苏丹草种子萌发和幼苗生理生化指标影响
种子萌发是植物生活周期中最脆弱且最重要的阶段,种子是否成功萌发和正常成苗决定了植物的繁衍和生存[23]。种子的发芽率降低、发芽时间的延长以及出苗延后,会大大影响植物在生态系统中的竞争能力[24]。本研究结果表明,香豆素水溶液能够显著抑制苏丹草初期种子的萌发,对根有明显的抑制作用,且随浓度的增加抑制作用增强,对茎叶的影响表现为“低促高抑”,总体上对根长的抑制作用要比对茎长的抑制作用强,这与周先容等[25]的结果一致,可能是由于根的化感性要高于茎。在香豆素溶液处理,根系首先受到不同程度的抑制作用,导致根系变短变粗,甚至发生形变,阻止对养分和水分的吸收,从而引起植物体内一系列生理生化反应。
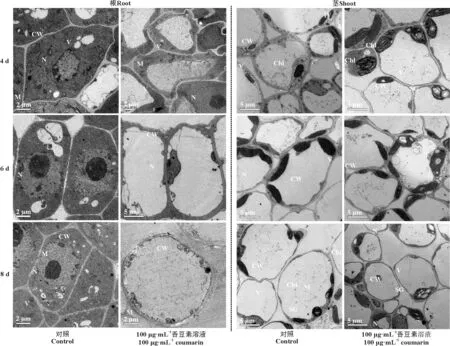
图4 苏丹草幼苗根和茎的超微结构
注:CW,细胞壁;V,液泡;N,细胞核;M,线粒体;Chl,叶绿体;SG,淀粉粒。
Note: CW, cell wall; V, vacuoles; N, nucleous; M, mitochondrion; Chl, chloroplast; SG, starch grain.
植物在逆境胁迫下体内的O2-·、H2O2等活性氧(ROS)含量会增加,进而会刺激某些抗逆基因的表达,建立防御系统,使得植物体内一系列抗氧化保护酶活性升高。抗氧化保护酶系统主要包含SOD、POD和CAT,其中SOD可以将O2-·歧化为H2O2,PDD和CAT则可以将H2O2分解为无毒的H2O和O2,从而阻止ROS对于膜的伤害[26]。本研究中,在香豆素溶液的处理下,CAT活性均高于对照组,且随着处理时间的延长逐渐增强,表明在香豆素处理下的苏丹草已启动抗氧化系统。香豆素处理的4和6 d后,处理组的POD活性均低于对照组,在8 d后处理组的活性超过了对照组,这可能是处理4和6 d后的胁迫不强,ROS产生的量还不太大,未能诱导POD的大量产生,而在8 d后胁迫加剧,ROS增多,诱导了POD的活性增强。在香豆素处理的4、6和8 d后,SOD活性均受到抑制,清除自由基能力减弱,这可能是苏丹草中的SOD对香豆素较敏感,也可能是SOD极易受到ROS的破坏导致。
吲哚乙酸(IAA)是植物生长过程中一种重要的内源激素,参与调节多种生理生化反应,如细胞的分裂分化和扩大、根茎的生长发育、器官的衰老等。研究IAA的代谢主要是通过研究其代谢相关酶实现的。吲哚乙酸酶(IAAO)和过氧化物酶(POD)均是IAA分解代谢的相关酶。其中IAAO是降解IAA的关键性酶,调节植物体内的IAA水平,其活性与IAA负相关。当植物受到外界胁迫时,IAAO会在IAA代谢过程中表现出相应的作用和变化。胡拥军等[27]研究发现,用100 mg·kg-1砷处理大叶井口边草(Pteriscretica)和剑叶凤尾蕨(Pterisensiformis)两种植物叶片,大叶井口边草在处理13 d时,IAAO活性显著降低,在处理3周左右又恢复到原来的活性,在之后总体呈先下降的趋势;剑叶凤尾蕨在培养37 d时表现出短暂的显著降低,之后IAAO活性总体上保持在较高水平。本研究与之类似,随着播种时间的延长对照组IAAO呈下降趋势,表明随着时间的延长体内IAA不断堆积,从而促进了植物的生长;处理组中IAAO随时间变长表现出动态变化, 6 d时IAAO显著降低,在8 d后活性有所上升,表明前6 d香豆素水溶液可能对IAAO影响小,到8 d时香豆素水溶液才开始对IAAO产生较强的作用。
在逆境胁迫下,植物细胞会通过积累大量的渗透调节物质来维持一定的渗透压,维持水分平衡,从而保持植物的光合作用、气孔的开合以及植物生长等生理过程的正常进行。可溶性糖在有机质代谢中具有重要的作用,可以提高植物对逆境的抵抗能力,张丽和白小娟[28]研究证明了在逆境胁迫下,植物体内的可溶性糖含量升高。本研究中,处理组的可溶性糖在4、6和8 d时均高于对照组,推测苏丹草通过增加其含量提高自身的抵抗能力,也可能是香豆素使得细胞内大分子糖类等降解为小分子可溶性糖。淀粉是贮藏在植物体内的高分子碳水化合物,在种子发芽时,种子胚乳中的淀粉水解成可溶性糖类,进而经合成作用再构建植物体[29-30]。本研究中,香豆素溶液处理4和6 d时,处理组中的淀粉含量均低于对照组,在8 d时,处理组高于对照组。推测在4和6 d时,香豆素对苏丹草造成胁迫,但胁迫力度不是很强,可以通过分解淀粉来增强自身对胁迫的抵抗能力,在8 d时,香豆素对苏丹草的胁迫增强导致分解淀粉能力下降,因此淀粉含量上升。
叶绿素是植物进行光合作用的物质基础,涉及一系列复杂的生理过程。植物可以通过捕获光能来进行体内有机物的合成,单位面积上叶绿素的含量可以反映植物光合能力强弱,因此,可以通过测定植物中叶绿素的含量来判断植物的生长状况[31]。很多研究表明逆境胁迫会打破植物正常的新陈代谢,导致叶绿素含量下降[32-33],本研究得出了类似的结果,在4、6和8 d时处理组的叶绿素含量均低于对照组。此外,4-6 d的叶绿素增加量明显低于6-8 d的叶绿素增加量,由此可见,随着播种天数的增加香豆素对于苏丹草叶绿素的胁迫增强。
3.2香豆素处理对苏丹草幼苗细胞超微结构的影响
植物的形态结构是总是与环境相适应的。当植物受到环境胁迫后,其细胞超微结构的变化是植物一系列生理生化活动异常的细胞学基础,因此研究苏丹草受香豆素处理后细胞超微结构的变化,对揭示香豆素对苏丹草化感作用机理有着重要意义。张黛静等[34]研究表明,小麦(Triticumaestivum)幼根根尖在铜处理下细胞壁和细胞膜均受到破坏,出现空泡现象,部分细胞核、核仁及细胞器消失;相关研究报道在高盐胁迫下的马铃薯(Solariumtuberosum)叶绿体内淀粉粒数目会明显增多,体积变大[35]。本研究结果与该研究结果一致,证明了香豆素可以通过破坏苏丹草的细胞结构来达到抑制其生长的目的。Mahmood等[36]用香豆素处理水稻根系也证明了这一结果,香豆素破坏了其细胞膜和细胞结构导致电解质泄露。此外,本研究表明,随着播种天数的增加,香豆素对苏丹草根系的破坏程度也增强,并且香豆素对苏丹草根系的破坏力要强于茎,这可能是由于根的化感性要高于茎。
4 结论
香豆素对苏丹草种子萌发和幼苗生长的影响存在浓度效应。通过对香豆素胁迫下苏丹草生理生化指标和超微结构的研究发现,100 μg·mL-1的香豆素水溶液不仅可以降低苏丹草种子胚乳中的淀粉转化利用效率,也会对细胞壁、细胞膜和细胞内部超微结构造成破坏,从而导致种子萌动受阻。此外,香豆素对苏丹草根的抑制作用要强于茎,因此,建议在实际应用中香豆素溶液应接近地面根部喷洒效果更佳。
References:
[1] Yadouleton A W.Insecticide resistance status inAnophelesgambiaein southern Benin.Malaria Journal,2010,9(1):1-6.
[2] 周秋霞,韦丽娇.2012/2013榨季海南甘蔗产业的现状及发展对策.中国热带农业,2013(5):32-34.
Zhou Q X,Wei L J.Present situation and development countermeasures of sugarcane industry in Hainan in the 2012/2013 crop season.China Tropical Agriculture,2013(5):32-34.(in Chinese)
[3] Zentai A,Szabó I J,Kerekes K,Ambrus.Risk assessment of the cumulative acute exposure ofHungarianpopulationto organophosphorus pesticide residues with regard to consumers of plant based foods.Food amp; Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2016,89:67-72.
[4] Gai N,Pan J,Tang H,Chen S,Chen D Z,Zhu X H,Lu G H,Yang Y L.Organochlorine pesticides and polychlorinated biphenyls in surface soils from Ruoergai high altitude prairie,east edge of Qinghai-Tibet Plateau.Science of the Total Environment,2014,478(8):90-97.
[5] Zacharia J T,Kishimba M A,Masahiko H.Biota uptake of pesticides by selected plant species:The case study ofKilomberosugarcaneplantations in Morogoro Region,Tanzania.Pesticide Biochemistry amp; Physiology,2010,97(1):71-75.
[6] 翁伯琦,雷锦桂,江枝和,林代炎.集约化畜牧业污染现状分析及资源化循环利用对策思考.农业环境科学学报,2010,29(S1):294-299.
Weng B Q,Lei J G,Jiang Z H,Lin D Y.Prsent situation analysis of intensive livestock pollution and countermeasures consideration of resource recycling.Journal of Agro-Environment Science,2010,29(S1):294-299.(in Chinese)
[7] Armstrong J L,Fenske R A,Yost M G,Galvin K,Tchong-French M,Yu J.Presence of organophosphorus pesticide oxygen analogs in air samples.Atmospheric Environment,2013,66:145-150.
[8] Gao J,Zhou H,Pan G Q,Wang J Z,Chen B Q.Factors influencing the persistence of organochlorine pesticides in surface soil from the region around the Hongze Lake,China.Science of the Total Environment,2013,443(3):7-13.
[9] Schulz M,Marocco A,Tabaglio V.Benzoxazinoids in rye allelopathy from discovery to application in sustainable weed control and organic farming.Journal of Chemical Ecology,2013,39(2):154-174.
[10] Worthington M,Reberg-Horton C.Breeding cereal crops for enhanced weed suppression:Optimizing allelopathy and competitive ability.Journal of Chemical Ecology,2013,39(2):213-231.
[11] Jabran K,Cheema Z A,Farooq M.Lower doses of pendimethalin mixed with allelopathic crop water extracts for weed management in canola (Brassicanapus).International Journal of Agriculture amp; Biology,2010,12(3):1560-8530.
[12] Dilipkumar M,Chuah T S.Effects of soil types on phytotoxic activity of pretilachlor in combination with sunflower leaf extracts on barnyardgrass (Echinochloacrus-galli).Weed Science,2012,60:126-132.
[13] 高兴祥,李美,房锋,李健.小飞蓬水浸提液对杂草萌发和生长的抑制效果.草业科学,2015,32(1):48-53.
Gao X X,Li M,Fang F,Li J.Effects of aqueous extractions ofConyzacanadensison germination and seedling growth of four weeds.Pratacultural Science,2015,32(1):48-53.(in Chinese)
[14] 王海斌,俞振明,何海斌,郭徐魁,黄锦文,周阳,徐志斌,林文雄.不同化感潜力水稻化感效应与产量的关系.中国生态农业学报,2012,20(1):75-79.
Wang H B,Yu Z M,He H B,Guo X K,Huang J W,Zhou Y,Xu Z B,Lin W X.Relationship between allelopathic potential and grain yield of different allelopathic rice accessions.Chinese Journal of Eco-Agriculture,2012,20(1):75-79.(in Chinese)
[15] 邬彩霞,刘苏娇,赵国琦,徐俊.黄花草木樨对杂草的化感作用研究.草地学报,2015,23(1):82-88.
Wu C X,Liu S J,Zhao G Q,Xu J.The allelopathy of yellow sweet clover on weeds.Acta Agrestia Sinica,2015,23(1):82-88.(in Chinese)
[16] 邬彩霞,赵国琦,刘苏娇,贡笑笑.黄花草木樨水浸液中香豆素的含量及其对7种植物种子萌发和幼苗生长的影响.草业科学,2014,31(12):2262-2269.
Wu C X,Zhao G Q,Liu S J,Gong X X.The content and effects of coumarin in the aqueous extract of yellow sweet clover.Pratacultural Science,2014,31(12):2262-2269.(in Chinese)
[17] Wu C X,Zhao G Q,Liu D L,Liu S J,Gong X X,Tang Q.Discovery and weed inhibition effects of coumarin as the predominant allelochemical of yellow sweetclover(Melilotusofficinalis).International Journal of Agriculture amp; Biology,2016,18(1):168-175.
[18] Razavi S M.Biological activity ofPrangosulopteraDC. roots,a medicinal plant from Iran.Natural Product Research,2010,24(9):797-803.
[19] Razavi S M.Plant coumarins as allelopathic agents.International Journal of Biological Chemistry,2011,5(1):86-90.
[20] 王婧怡,姚丹丹,赵国琦,邬彩霞,马钱波,徐军,唐晨阳.黄花草木樨水浸提液对苏丹草和黑麦草的化感作用.草业学报,2017,26(8):85-92.
Wang J Y,Yao D D,Zhao G Q,Wu C X,Ma Q B,Xu J,Tang C Y.Allopopathic effect of an aqueous extract ofMelilotusofficinalisonLoliummultiflorumandSorghumsudanense.Acta Agrestia Sinica,2017,26(8):85-92.(in Chinese)
[21] Jin B,Wang L,Wang J,Teng N J.The effect of experimental warming on leaf functional traits,leaf structure and leaf biochemistry inArabidopsisthaliana.BMC Plant Biology,2011,11(1):35.
[22] 邹琦.物生理学实验指导.北京:中国农业出版社,2000.
Zou Q.Experimental Instruction of Plant Physiology.Beijing:China Agriculture Press,2000.(in Chinese)
[23] 徐恒恒,黎妮,刘树君,王伟青,王伟平,张红,程红焱.宋松泉.种子萌发及其调控的研究进展.作物学报,2014,40(7):1141-1156.
Xu H H,Li N,Liu S J,Wang W Q,Wang W P,Zhang H,Cheng H Y,Song S Q.Research progress in seed germination and its control.Acta Agronomica Sinica,2014,40(7):1141-1156.(in Chinese)
[24] 许文花,马向丽,任健,文亦芾,段新慧,邓彬,陶勇,罗富成.蚕豆植株浸提液对3种牧草种子发芽的影响.草业科学,2016,33(8):1560-1565.
Xu W H,Ma X L,Ren J,Wen Y F,Duan X H,Deng B,Tao Y,Luo F C.Influence of faba bean plant extract on the seed germination of three grass species.Pratacultural Science,2016,33(8):1560-1565.(in Chinese)
[25] 周先容,周莉,杨苗,凡囡秋,甯川秀.酢浆草水浸液对茎瘤芥种子萌发和幼苗生长的化感效应.北方园艺,2016(3):9-12.
Zhou X R,Zhou L,Yang M,Fan N Q,Ning C X.Allelopathic effect of aqueous extract ofOxaliscorniculataon seed germination and seedling growth ofBrassicajunceavar.tumida.Northern Horticulture,2016(3):9-12.(in Chinese)
[26] 张彦妮,雷蕾,夏斌.干旱胁迫及复水对黄连花幼苗生长和生理特性的影响.草业科学,2016,33(9):1681-1689.
Zhang Y N,Lei L,Xia B.Effects of drought stress and rewatering on seedling growth and physiological characteristics ofLysimachiadavurica.Pratacultural Science,2016,33(9):1681-1689.(in Chinese)
[27] 胡拥军,王海娟,王宏镔,杨晓燕,李燕燕,殷飞.砷胁迫下不同砷富集能力植物内源生长素与抗氧化酶的关系.生态学报,2015,35(10):3214-3224.
Hu Y J,Wang H J,Wang H B,Yang X Y,Li Y Y,Yin F.The relationship between endogenous auxin and antioxidative enzymes in two plants with different arsenic-accumulative ability under arsenic stress.Acta Ecologica Sinica,2015,35(10):3214-3224.(in Chinese)
[28] 张丽,白小娟.预处理对萝卜离体花药生理生化特性的影响.西北农业学报,2011,20(7):60-63.
Zhang L,Bai X J.Effect of pretreatments on physiological and biochemical charateristics in isolated anthers of raish(RaphanussativusL.).Acta Agriculturae Boreali-occidentalis Sinica,2011,20(7):60-63.(in Chinese)
[29] Meng Y X,Wang S H,Wang J C,Xu X L,Lai Y,Si E J,Ma X L,Li B C,Yang K,Wang H J.Influences of CoClon the growth and seedling physiological indexes of under NaCl stress.Acta Pratacultuae Sinica,2014,23(3):160-166.
[30] Zhang Y,Yao Q,Li J,Hu Y L,Chen J Z.Growth response and nutrient uptake ofEriobotryajaponicaplants inoculated with three isolates of arbuscular mycorrhizal fungi under water stress Condition.Journal of Plant Nutrition,2014,37(5):690-703.
[31] 杨莉,韩梅,肖春萍,杨利民.入侵种加拿大蓬对玉米的化感潜力及机制研究.华南农业大学学报,2011,32(4):1-5.
Yang L,Han M,Xiao C P,Yang L M.Allelopathic potential and mechanism ofErigeroncanadensison maize.Journal of South China Agricultural University,2011,32(4):1-5.(in Chinese)
[32] 孙宁骁,宋桂龙.紫花苜蓿对镉胁迫的生理响应及积累特性.草业科学,2015,32(4):581-585.
Sun N X,Song G L.Physiological response ofMedicagosativato cadmium stress and accumulation property.Pratacultural Science,2015,32(4):581-585.(in Chinese)
[33] 陈绮翎,黄璇,周越,李强,周冀衡,程昌新.温度胁迫对不同烤烟品种幼苗生长及生理指标的影响.云南农业大学学报(自然科学),2016,31(3):462-468.
Chen Q L,Huang X,Zhou Y,Li Q,Zhou J H,Cheng C X.Effect of temperature stress on growth and physiological indexes of different varieties of flue-cured tobacco seedlings.Journal of Yunnan Agricultural University(Natural Science),2016,31(3):462-468.(in Chinese)
[34] 张黛静,马建辉,杨淑芳,陈惠婷,刘佩,王文斐,李春喜.硅对铜胁迫下小麦幼根细胞超微结构的影响.应用生态学报,2014,25(8):2385-2389.
Zhang D J,Ma J H,Yang S F,Chen H T,Liu P,Wang W F,Li C X.Effects of silicon on the ultrastructures of wheat radical cells under copper stress.Chinese Journal of Applied Ecology,2014,25(8):2385-2389.(in Chinese)
[35] Bruns S,Hecht-Buchholz C.Light and electron microscope studies on the leaves of several potato cultivars after application of salt at various development stages.Potato Research,1990,33(1):33-41.
[36] Mahmood K,Khan M B,Song Y Y,Mao Y E,Baerson S R,Zeng R S.Differential morphological,cytological and biochemical responses of two rice cultivars to coumarin.Allelopathy Journal,2013,31(2):281-296.
(责任编辑 张瑾)
EffectofcoumarinonSorghumsudanenseseedgerminationandseedlinggrowth
Wang Jing-yi, Yao Dan-dan, Xu Jun, Wu Cai-xia, Zhao Guo-qi, Hua Chen-lan
(College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, Jiangsu, China)
Coumarin is the main allelochemical ofMelilotusofficinalis, and can inhibit seed germination and seedling growth in a variety of weeds. In this study, we aimed to explore the allelopathy mechanism of coumarin and its inhibition of grass. Petri dish experiments were conducted onSorghumsudanenseto study the effect of coumarin on the main growth and physiological and biochemical indices, and to observe ultrastructural changes in the roots and stems by transmission electron microscopy. The following results were obtained. Coumarin concentrations in the range of 20 to 100 μg·mL-1significantly (Plt;0.05) inhibited the early germination ofS.sudanenseand the degree of inhibition increased with an increase in coumarin concentration. Coumarin solution significantly (Plt;0.05) inhibited root length, and with an increase in treatment time and coumarin concentration, the roots became more coarse and distorted. There were concentration and time effects on stem growth. At 4 d, a coumarin concentration of 20~100 μg·mL-1promoted stem length, whereas at 6 and 8 d, a low coumarin concentration promoted stem length and a high concentration inhibited stem length. A 100 μg·mL-1coumarin solution significantly (Plt;0.05) inhibited the growth ofS.sudanense, and the germination rate, root length, and stem length were all significantly (Plt;0.05) lower than in the control group; Coumarin solution significantly (Plt;0.05) increased the activity of catalase and reduced the activity of superoxide dismutase, whereas the activity of the peroxidase initially decreased and then significantly (Plt;0.05) increased. Coumarin solution significantly (Plt;0.05) enhanced the content of soluble sugars and reduced the content of chlorophyll. Furthermore, treatment with coumarin initially decreased and then increased the content of starch, and the activity of indole acetic acid oxidase in coumarin-treated plants was lower than that in the control group. Treatment with coumarin solution destroyed the ultrastructure of Sudan grass root cells, with vacuole volume becoming larger, the number and types of organelles decreasing, the nuclear membrane being distorted, and the nuclei becoming smaller or even disappearing. Coumarin treatment also significantly (Plt;0.05) increased the number of starch granules in the chloroplast ofS.sudanenseand their volume became larger. The above results indicate that 100 μg·mL-1coumarin solution can regulate the growth ofS.sudanenseby changing antioxidant enzyme systems, increasing osmotic adjustment substances, decreasing chlorophyll content, affecting enzyme activity, and destroying cell ultrastructure.
coumarin;Sorghumsudanense; allelopathy; seedling; biochemical indicator; antioxidase; transmission electron microscopy
Wu Cai-xia E-mail:cxwu@yzu.edu.cn
10.11829/j.issn.1001-0629.2017-0008
王婧怡,姚丹丹,徐军,邬彩霞,赵国琦,华晨岚.香豆素对苏丹草种子萌发和幼苗生长的影响.草业科学,2017,34(11):2279-2288.
Wang J Y,Yao D D,Xu J,Wu C X,Zhao G Q,Hua C L.Effect of coumarin onSorghumsudanenseseed germination and seedling growth.Pratacultural Science,2017,34(11):2279-2288.
S544+.103.5Q945.34
A
1001-0629(2017)11-2279-10
2017-01-07接受日期2017-06-02
国家自然科学基金(31101764)
王婧怡(1992-),女,江苏丹阳人,在读硕士生,主要从事植物化感研究。E-mail:1009317930@qq.com
邬彩霞(1978-),女,内蒙古临河人,副教授,博士,主要从事牧草栽培与利用研究。E-mail:cxwu@yzu.edu.cn
