接种AM真菌对四药门花生长的影响
2017-11-24谭宗健周玉洁黄久香
谭宗健,周玉洁,黄久香,余 洋
(1. 中山市国有森林资源保护中心,广东 中山 528400; 2. 华南农业大学林学与风景园林学院,广东 广州 510642)
接种AM真菌对四药门花生长的影响
谭宗健1,周玉洁2,黄久香2,余 洋2
(1. 中山市国有森林资源保护中心,广东 中山 528400; 2. 华南农业大学林学与风景园林学院,广东 广州 510642)
为筛选适宜四药门花的生物菌肥,并研究生物菌肥对其生长的促进作用,以四药门花扦插苗为试材,进行AM真菌接种试验。设置摩西球囊霉菌(GM)、幼套球囊霉菌(GE)、摩西球囊霉菌与幼套球囊霉菌的混合菌种(M)、对照(CK)共 4 种处理,对四药门花进行施菌,定期监测其接种菌根后的生长情况,并测定其生物量、菌根侵染率等。结果表明:接种 AM 菌剂能够促进四药门花的生长,单种菌剂的促进效果比混合菌剂的好。单种菌剂施用后 1 个月出现生长减缓现象,而施用混合菌种没有出现减缓现象。单种菌剂对植物的苗高、冠幅与叶片生长促进作用的时间不相同,对冠幅生长促进作用的时间出现最早,对苗高和叶片生长的促进作用均较为滞后。相对于 CK,GM 菌剂对地下与地上部分的生物量增加的促进作用均最为显著,而 GE 与 M 菌剂对地下部分生物量增加的促进作用均不显著,但对地上部分生物量增加的促进作用均明显。生长最好的处理,其菌根依赖性与菌根侵染率均最高,混合菌种处理的菌根侵染率最低。说明 GM 菌可作为四药门花种群复壮的优良菌剂。关键词:四药门花;AM 菌;接种;促进作用
丛枝菌根(AM)真菌为土壤中常见的真菌种类。正常条件下,大多数植物都能与 AM 真菌形成菌根共生体,并形成菌丝网络[1],便于为植物提供更多的营养,从而改善植物的生长状况[2-3];还能够增加植物的抗盐胁迫能力[4]、抗旱胁迫能力[5]等,以提高植物的适应性;同时能够改变土壤的结构,维持生态系统平衡,改善植物生长的土壤条件[6]等。目前,丛枝菌根被作为一种农林业植物高效培育的生物菌肥,应用十分广泛[7],是近年来国内外研究的热点。
四药门花(Loropetalum subcordatum (Benth.)Oliv.)是金缕梅科(Hamamelidaceae)檵木属(Loropetalum)的常绿灌木或小乔木,是中国特有的残遗植物和二级保护植物[8]。因其分布区域狭窄,且数量极少[9],种群数量下降[10],已经被列为 IUCN(International Union For Conservation Of Nature)稀有植物与中国国家重点保护野生植物[11]。因其株形优美,花期长,花量大,四药门花也是一种极具应用前景的景观植物[12]。目前,在四药门花的系统分类学[13-14]、群落生态学[15-16]、生态学特性[17-18]、生殖生态学[19]、保护遗传学[20]等方面都有相关的研究报道,揭示了自然条件下四药门花更新困难,适应性弱,不耐干旱,遗传多样性小的特点,因此,急需要进行相关的保育工作,但目前对于四药门花迁地保育的研究报道较少。近几年,广东省中山树木园已开始了初步的迁地保育与回归引种工作,将其作为一种独具特色的观赏植物应用于景观中,但由于其对生境要求严格,后期生长较为缓慢。本研究基于四药门花的迁地生长保护问题,对与四药门花共生的高效菌种进行了初步的筛选,并进一步探讨了 AM 真菌对四药门花生长的影响,为四药门花的高效培育与种群复壮提供参考,以期解决四药门花迁地保育过程中适应性弱的问题。
1 试验区概况
试验地位于华南农业大学树木园实验基地。该区气候属于南亚热带海洋性季风气候,温暖多雨,光热充足,温差较小,夏长冬短。年平均气温 22.2~23.2 ℃,年极端最高气温 37.4~38.2 ℃,年极端最低气温 -5.1~2.6 ℃。最冷为1 月,平均气温 13.3 ℃;最热为 8 月,平均气温 28.8 ℃。年平均相对湿度 79%。土壤为花岗岩发育而成的低丘赤红壤,土层深厚。
2 材料与方法
2.1 试验材料
试验用苗木为扦插半年后长势较为一致的四药门花扦插苗。扦插育苗基质配方为黄心土 : 河沙: 泥炭土=2 : 1 : 1,植栽容器为规格 16 cm×18 cm的黑色聚丙烯塑料钵,菌土中菌种为摩西球囊霉菌(Glomus mosseae,GM)、幼套球囊霉菌(Glomus etunicatum,GE)、摩西球囊霉菌与幼套球囊霉菌的混合菌(M),均购自北京市农林科学院植物营养与资源研究所(BGC),每 10 g 菌土含约 120 个孢子。扦插时插穗与育苗基质统一使用多菌灵灭菌。
2.2 研究方法
2.2.1 接种菌剂 2015 年 5 月在华南农业大学树木园温棚中接种菌剂,共设 4 种处理(GM,GE,M,CK),每种处理 15 株苗。接菌组(GM、GE、M)接种时在塑料钵内装入灭菌土到 2/3 时加入 30 g菌土,再用灭菌土覆盖;不接种组(CK)在 2/3 灭菌土上加入灭菌的菌种扩繁土 30 g ,覆盖灭菌土。种植时将半年生的无菌扦插苗根系与菌土层充分接触,每个花盆最终土壤总质量保持为 2 kg。
2.2.2 指标测定
(1)生长量测定。每 30 天测定 1 次四药门花幼苗的苗高,每 90 天测量 1 次冠幅、叶片数量等。
(2)生物量测定。接种 1 年后测定生物量,其测定方法是:幼苗经 105 ℃ 的烘箱中烘 15 min杀青后,置于 70 ℃ 烘干 24 h,测定地上部、地下部生物量和总生物量,并计算根冠比、菌根依赖性等。根冠比=地下部生物量/地上部生物量;菌根依赖性(myc-orrhizal dependence,MD):MD(%)=菌根植株干质量/对照植株干质量×100。
(3)菌根侵染率测定。接种 1 年后测定菌根侵染率,其测定方法是:将根系用自来水轻轻冲洗干净,剪取约 8 mm 长的幼根根段,固定在 FAA 中24 h 及以上。将固定后的根段经 10% KOH 透明处理,0.1 mol/L HCl 酸化处理,再用 0.2% 锥虫蓝染液染色,将 15 条根段整齐放于一个片中,每个处理 3 次重复。将菌根片置于 10 倍显微镜下目测法估计菌根侵染率。
2.2.3 数据分析 采用 Microsoft Excel 2010 和SPASS 19.0 软件进行数据统计与分析。
3 结果与分析
3.1 AM 真菌对四药门花扦插苗苗高生长的影响
由图 1 可知:从整体上看,4 种处理均经历了 3 个主要的生长阶段,施菌当年 6—8 月为迅速生长期,当年 8 月至翌年 2 月进入相对缓慢生长期,翌年 2—5 月为又一个迅速生长期,表明四药门花主要的生长期集中于 2—8 月。从苗高增长量看,CK、GM、GE、M 各处理的苗高增长量分别为 9.05、15.78、14.30、15.40 cm,表明接种菌剂对苗高生长均有促进作用,其促进作用表现为 GM>M>GE>CK。从苗高增长率看:施菌当年 6—7 月,CK、GM、GE、M 的苗高增长率分别为 16.69%、2.62%、7.01%、29.32%; 7—8 月,CK、GM、GE、M 的苗高增长率分别为 5.39%、33.93%、21.71%、21.76%。施菌当年 8 月至翌年 2月,苗高增长率分别为 13.47%、26.62%、31.76%、21.25%;翌年 2—5 月,苗高增长率分别为 9.10%、16.92%、17.29%、11.95%。说明施菌当年 6—7月,施用单种菌剂处理的生长率低于对照的,而施用 2 种混合菌剂处理的生长率高于对照的,其苗高增长率排序为 M>CK>GE>GM;施菌当年 7—8 月,施菌处理的生长率均高于对照的,其苗高增长率排序为 GM>GE>M>CK;施菌当年 8月至翌年 5 月,苗高增长率排序均为 GE>GM>M>CK。这表明不同菌种对四药门花的苗高生长的促进作用与机理存在差异。
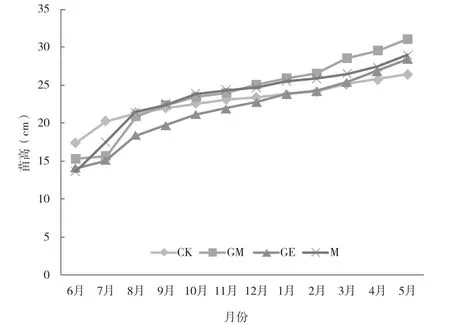
图1 接种不同AM真菌的四药门花扦插苗苗高生长曲线Fig.1 The curve of height growth of Loropetalum subcordatum cottage were inoculated with different AM fungi
3.2 AM 真菌对四药门花扦插苗冠幅的影响
由表 1 可知:接菌当年 6 月、9 月与 12 月各处理的冠幅并没有显著差异(p<0.05),而翌年 3 月 GM 处理的冠幅显著(p >0.05)高于 CK与 M 处理的。从冠幅增长量看,接菌当年 6—9月,CK、GM、GE、M 处理的冠幅增长量分别为 1.27、3.63、2.77、2.6 cm;9—12 月,CK、GM、GE、M 处理的冠幅增长量分别为 2.13、2.5、2.03、1.26 cm;接菌当年 12 月至翌年 3 月,CK、GM、GE、M 处理的冠幅增长量分别为 1.70、2.57、2.43、1.50 cm。由此可见:6—9 月,GM、GE 及M 处理的冠幅增长量均较 CK 的高;9—12 月,GM与 GE 处理的增长量较 CK 的均增加不明显,M 处理的低于 CK 的;12 月至翌年 3 月,GM 与 GE 处理冠幅增长量较 CK 的高,但 M 处理却较 CK 的低。这表明施加单种菌种对冠幅促进作用主要集中于 6—9 月以及 12 月至翌年 3 月,也就是四药门花主要的生长期,而混合菌种的施加对冠幅增加的促进作用不明显。

表1 接种不同AM真菌的四药门花扦插苗冠幅Tab.1 The cuttage seedlings crown of Loropetalum subcordatum were inoculated with different AM fungi(cm)
3.3 AM 真菌对四药门花扦插苗叶片数量的影响
由表 2 可知:接菌当年 6 月与 9 月,4 个处理的叶片数量均没有显著性差异(p>0.05),接菌当年 12 月与翌年 3 月,GM 处理的叶片数量均最多,均显著多于对照组(p<0.05)。翌年 3 月,GE 处理叶片数量显著多于对照组,M 处理与对照差异不显著。从叶片增加数量看:接菌当年 6—9月,CK、GM、GE、M 处理的叶片增加数量分别为2.46、2.46、2.07、2.53 片;9—12 月,CK、GM、GE、M 处理的叶片增加数量分别为 1.27、2.93、2.93、2.14 片;接菌当年 12 月至翌年 3 月,CK、GM、GE、M 处理的叶片增加数量分别为 3.53、5.00、5.80、5.93 片。由此可见,叶片的数量在 12月至翌年 3 月有一个较为显著的增加期,而之前其增加不明显。接菌年 6—9 月,接菌各处理相对于对照的叶片数量增加不显著,而 9 月至翌年 3 月的叶片数量有更为明显的增加。这表明施加菌剂能够影响叶片数量的增加,但增加的时间存在滞后性。

表2 接种不同AM真菌的四药门花扦插苗叶片数量Tab.2 The number of leaves of Loropetalum subcordatum were inoculated with different AM fungi(片)
3.4 AM 真菌对四药门花扦插苗生物量以及菌根侵染效果的影响
由表 3 可知:地下部分干质量最高的为 GM处理,且 GM 处理与其他处理间差异均显著(p<0.05。下同);接菌各处理的地上部分干质量均高于 CK 的;最高的为 GM 处理,且 GM 处理与CK 间差异显著,其次是M处理的;M 处理的根冠比显著低于其他 2 个接菌处理的;菌根依赖性在各接菌处理间的差异均达显著,以 GM 处理的最强,M处理的次之,GE 处理的最弱;菌根侵染率在接菌处理间的差异也均达显著,以 GM 处理的最大,GE 处理的次之,M 处理的最小。这表明 GM 菌对四药门花的影响最为显著,其他 2 种菌也有一定作用。
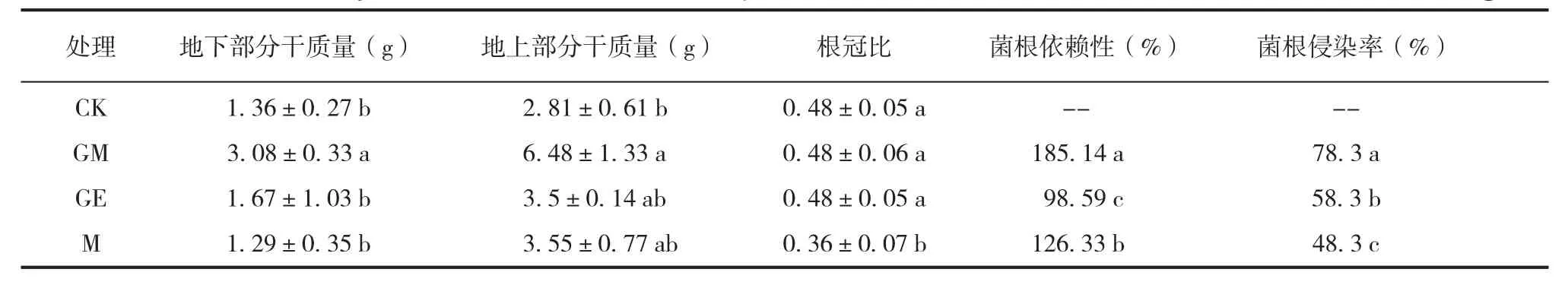
表3 接种不同AM真菌的四药门花扦插苗生物量以及菌根侵染率Tab.3 Biomass and mycorrhizal infection rate of Loropetalum subcordatum were inoculated with different AM fungi
4 结论与讨论
AM 菌作为分布最广的菌根菌类,对植物的生长、适应性以及环境改善都起着至关重要的作用[21]。自然界中,大多数植物的根系周围分布有多种菌类,然而并不清楚这些菌类对植物的生长分别起到什么作用。通过对单种菌类与混合菌类对植物的影响研究能够探索不同菌类对植物的生长所起作用及大小。本研究中,单种菌剂的接种效果优于混合菌种,且以 GM 菌的接种效果最佳。因此,GM 菌可以作为四药门花种群复壮的优良菌种。苗高生长结果显示,施用单一菌种时,在施菌后 1 个月出现了生长减缓的现象,可能是由于菌种与植物之间存在短暂的排斥,而混合菌种可能会减轻这种现象。这与菌种的种类和特性相关。1 个月后单一菌种对植株的促进作用强于混合菌种,说明了菌种的促进作用具有差异性与高效菌种筛选的可能性。树冠是林木进行光合作用的最直接部分,冠幅的大小决定植物与阳光的接触面积[22]。本研究结果表明,2 种单菌种对四药门花生长期冠幅的促进作用较为明显,而混合菌种促进作用却不明显,说明并非混合菌种更加适宜于植物的生长。这与陈志超[23]对短命植物接种单种菌剂与混合菌剂的研究结果一致。从单种菌剂对植物的苗高、冠幅与叶片生长的促进时间看,对冠幅生长的促进作用并不存在明显的滞后现象,而对苗高和叶片生长的促进作用较为滞后。这可能是菌根菌对植物生长的调节过程中,对冠幅的影响最直接,通过增加植物的冠幅,提高了植物的光合作用,从而加速了植物的苗高和叶片的生长。因此,苗高与叶片的生长存在着滞后的特点。
菌根侵染能够促进植物生物量的积累,且菌根浸染的强度与生物量的积累具有较大的相关性[24]。本研究中,相对于 CK,GM 菌剂对地下与地上部分生物量增长的促进作用均最为显著,而 GE 与 M 菌剂对地下部分的生物量增长的促进作用均不显著,但对地上部分生物量增长的促进作用均明显。表明不同菌种对植物促进作用的机制不同,菌根的侵染能够影响植物的地上或地下部分的生长,虽然菌种直接接触植物根系,对根系生长的作用并不一定是促进作用,而且在对根系生长无明显促进作用的情况下,地上部分仍然可能有促进作用。江龙[25]对烟苗的研究也表明并非对根系生长促进作用最大,对地上部分生长的促进作用也最大。这说明菌剂可能会以某种方式调控植物的地上部分生长,而与地下部分生长没有直接的关系;也可能是地上部分与地下部分竞争碳源的结果[26]。但菌种若对根系生长促进作用明显,就能够更为显著的促进地上部分的生长,因此,优良菌种筛选时,根系指标也是极为重要的参考要素。菌根侵染率和菌根依赖性研究结果表明,生长最好的处理,其菌根依赖性最高,揭示了菌根对植物生长的重要作用。接种混合菌种的菌根侵染率最低,说明菌根侵染率的强度并不是菌种叠加效应,可能菌种混合后菌根侵染率更低。这与杨晓红等[27]对枳壳的研究结果一致。
[1]Goetten L C,Moretto G,Stuermer S L.Influence of Arbuscular Mycorrhizal Fungi Inoculum Produced on-Farm and Phosphorus on Growth and Nutrition of Native Woody Plant Species from Brazil[J].Acta botanica brasilica,2016,30(1):9-16.
[2]Yang Y,Ou X,Yang G,et al.Arbuscular Mycorrhizal Fungi Regulate the Growth and Phyto-Active Compound of Salvia miltiorrhiza Seedlings[J].Applied Sciences-Basel,2017,7(1):68.
[3]祁红英,张秋萍,李 敏,等.丛枝菌根制剂对黄秋葵幼苗生长的影响[J].江苏农业科学,2014,42(4):138-139.
[4]Elhindi K M,El-Din A S,Elgorban A M.The Impact of Arbuscular Mycorrhizal Fungi in Mitigating Salt-Induced Adverse Effects in Sweet Basil (Ocimum basilicum L.)[J].Saudi Journal of Biological Sciences,2017,24(1):170-179.
[5]Boyer L R,Brain P, Xu X, et al.Inoculation of Drought-Stressed Strawberry With A Mixed Inoculum of Two Arbuscular Mycorrhizal Fungi:Effects on Population Dynamics of Fungal Species in Roots And Consequential Plant Tolerance to Water Deficiency[J].Mycorrhiza,2015,25(3):215-227.
[6]Scott D A,Baer S G,Blair J M.Recovery and Relative Influence of Root,Microbial,and Structural Properties of Soil on Physically Sequestered Carbon Stocks in Restored Grassland[J].Soil Science Society of America Journal,2017,81(1):50-60.
[7]Mukhongo R W,Tumuhairwe J B,Ebanyat P,et al.Combined Application of Biofertilizers and Inorganic Nutrients Improves Sweet Potato Yields.[J].Frontiers in Plant Science,2017,8(3):219.
[8]于永福.中国野生植物保护工作的里程碑——《国家重点保护野生植物名录(第一批)》出台[J].植物杂志,1999(5):3.
[9]谭成江.茂兰保护区珍稀濒危植物及保护与利用[J].贵州林业科技,2004,32(2):43-46.
[10]谭伟福.广西生物多样性评价及保护研究[J].贵州科学,2005,23(2):50-54.
[11]张宏达.中国植物志:金缕梅科[M].北京,科学出版社,1979:12.
[12]周劲松,孙 磊,邢福武.香港野生观赏植物资源观赏特性及应用探讨[J].中国园林,2006,22(1):89-93.
[13]Chun W Y.Flora of Kwangtung[J].Sunyatsenia,1934(4):245-247.
[14]施苏华,黄椰林,章 群,等.四药门花属及其近缘植物ITS 区序列分析和系统学意义[J].云南植物研究,1999,21(1):89-97.
[15]陈真权,庄雪影,黄久香,等.广东五桂山四药门花种群生态学研究[J].广东林业科技,2009,25(5):41-45.
[16]陈晓熹,申长青,洪文君,等.极小种群植物四药门花在中山五桂山的种群分布[J].安徽农业科学,2016,44(23):1-3.
[17]张华海.贵州珍稀濒危植物地理分布研究[J].种子,2009,28(6):68-72.
[18]洪文君,黄久香,申长青,等.3 种檵木属植物结构解剖及环境适应性评价[J].南京林业大学学报(自然科学版),2016,40(5):61-66.
[19]顾 垒,张奠湘.濒危植物四药门花的自花授粉[J].植物分类学报,2008,46(5):651-657.
[20]Gong W,Gu L,Zhang D.Low Genetic Diversity and High Genetic Divergence Caused by Inbreeding and Geographical Isolation in The Populations of Endangered Species Loropetalum subcordatum (Hamamelidaceae) Endemic to China[J].Conservation Genetics,2010,11(6):2281-2288.
[21]Cely M V T,Siviero M A,Emiliano J,et al.Inoculation of Schizolobium parahyba with Mycorrhizal Fungi and Plant Growth-Promoting Rhizofungis Increases Wood Yield under Field Conditions[J].Frontiers in Plant Science,2016,7(7):1-13.
[22]潘瑞炽.植物生理学(第 7 版)[M].北京:高等教育出版社,2012:70-72.
[23]陈志超,石兆勇,田长彦,等.接种 AM 真菌对短命植物生长发育及矿质养分吸收的影响[J].植物生态学报,2008,32(3):648-653.
[24]童 琳,唐旭利,张 静,等.菌根真菌侵染对植物生物量累积的影响[J].生态环境学报,2014,23(9):1520-1525.
[25]江 龙,李竹玫,黄建国,等.AM 真菌对烟苗生长及某些生理指标的影响[J].植物营养与肥料学报,2008,14(1):156-161.
[26]任爱天,娜丽克斯·外里,鲁为华,等.AM 真菌对紫花苜蓿细根生长及其生物量动态特征的影响[J].西北植物学报,2014,34(12):2535-2543.
[27]杨晓红,曾 斌,李新国,等.AM 真菌种间差异对枳壳生长及耐热性效应的研究[J].菌物学报,2005,24(4):112-119.
(文字编校:唐效蓉)
Effects of AM fungal inoculation on growth of Loropetalum subcordatum (Benth.)Oliv.
TAN Zongjian1,ZHOU Yujie2,HUANG Jiuxiang2,YU Yang2
(1. Zhongshan State-owned Forest Resources Protection Center,Zhongshan 528400,China;2. College of Forestry and Landscape Architecture,South China Agricultural University,Guangzhou 510642,China)
To study on biofertilizer which suitable for Loropetalum subcordatum and to discuss its promoting effects,cutting seedlings as the experimental materials,and AM fungal inoculation experiment was carried out,and 4 treatments were seted:GM,GE,M,CK.Growth status,Biomass,Mycorrhizal infection rate was regularly monitored.The result showed that:AM fungi could promote L.subcordatum growth,and single fungal treatment promoting effect is better than that of mixed fungi.The single fungal treatment growth began slow down after a month,but that of the mixed fungi didn't.The height,crown and leaf growth promoting time of plants inoculated with single fungi was different.The promoting time of the crown first appeared, height and leaf growth was hysteresis.Underground and above ground biomass accumulation of plants inoculated with GM have a significantly increase compare with CK.But that of plants inoculated with GE and M was not increased,except above ground biomass accumulation.Mycorrhizal dependence colonization rate of best treatment was the highest,that of mixed fungi treatment was the lowest.The researches show that GM fungi can be used as good biofertilizer for L.subcordatum rejuvenation.
Loropetalum subcordatum (Benth.)Oliv.;AM fungi;inoculation;promoting effect
Q 948.12
A
1003-5710(2017)04-0013 -05
10.3969 / j.issn. 1003-5710.2017.04.003
2017-05-27
中山市国有森林资源中心资助项目“广东省林业厅动植物保护处配套资金”(ZX134081)
谭宗健(1970-),男,广东省高州市人,高级工程师;研究方向:林学;E-mail:1354253030@qq.com
黄久香,副教授;E-mail:jxhuang@scau.edu.cn
