N末端脑钠肽前体、肌钙蛋白I与乳酸对脓毒症病人的预测价值
2017-11-24冯巧爱
曹 静,冯巧爱
N末端脑钠肽前体、肌钙蛋白I与乳酸对脓毒症病人的预测价值
曹 静1,冯巧爱2
目的探讨血清N末端脑钠肽前体(NT-proBNP)、肌钙蛋白I(cTnI)及乳酸(Lac)与脓毒症预后的关系。方法收集2015年3月—2017年3月因脓毒症入住山西医科大学第一医院ICU的48例病人资料。根据病人最终是否进展为脓毒性休克分为严重脓毒症组(26例)和脓毒性休克组(22例)。记录并比较所有病人治疗前和治疗后2 d、7 d的血清NT-proBNP和cTnI、Lac及白细胞计数,及治疗前后全身性感染相关性器官功能衰竭评分(SOFA)情况。绘制ROC曲线,分析比较NT-proBNP、cTnI及Lac对脓毒症及脓毒症并发休克病人的预测价值。结果脓毒症组和脓毒性休克组病人各时间点NT-proBNP(Plt;0.01)、cTnI(Plt;0.01)、Lac(Plt;0.01)、WBC(Plt;0.01)。NT-proBNP、WBC在治疗第2天呈升高趋势,后逐渐下降;cTnI和Lac呈持续下降趋势。两组治疗前与治疗后2 d,各值比较差异无统计学意义(Pgt;0.05);治疗后7 d,脓毒症病人NT-proBNP(P=0.004 3)、cTnI(P=0.040 7)、Lac(P=0.033 9)、WBC(P=0.026 3)均低于脓毒性休克病人(Plt;0.05)。脓毒症组和脓毒性休克组病人治疗后SOFA评分分值均显著低于治疗前(Plt;0.05);且脓毒症治疗前后SOFA评分低于休克组(Plt;0.05)。存活组和死亡组病人各时间点比较NT-proBNP(Plt;0.01)、cTnI(Plt;0.01)、Lac(Plt;0.01)、WBC(Plt;0.01)。两组治疗前与治疗后2 d,各值比较差异无统计学意义(Pgt;0.05);治疗后7 d,存活组病人NT-proBNP(Plt;0.000 1)、cTnI(P=0.026 0)、Lac(Plt;0.000 1)、WBC(Plt;0.000 1)均低于死亡组病人(Plt;0.05)。存活组和死亡组病人治疗后SOFA评分分值均显著低于治疗前(Plt;0.05),且存活组治疗前后SOFA评分均低于死亡组(Plt;0.05)。ROC曲线分析结果提示三者对脓毒症有预测价值,NT-proBNP预测脓毒性休克敏感度最高,Lac预测死亡敏感度最高。结论脓毒症病人血清NT-proBNP、cTnI、Lac浓度显著升高,提示脓毒性休克发生率高,预后较差。
脓毒症;N末端脑钠肽前体;肌钙蛋白I;乳酸;全身性感染相关性器官功能衰竭评分
脓毒症是由于感染引起宿主反应失调导致危及生命的器官功能障碍,脓毒性休克时脓毒症病人出现血压改变。严重脓毒症和脓毒性休克死亡率高达30%~60%,在美国是第十位的死因[1],造成巨大的经济负担[2]。脓毒性休克通常伴随心肌功能障碍,使脓毒症死亡率增加到70%[3]。心脏生物标记物N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)和肌钙蛋白I(cardiac troponin I)在心肌应激和损伤时产生。有文献报道,二者在脓毒症时迅速升高[4-6],其对脓毒症病人预后的预测价值研究结论不一。乳酸(lactate,Lac)是无氧酵解产物,与脓毒症病人死亡率密切相关[7]。本研究检测脓毒症病人治疗前及治疗后2 d、7 d NT-proBNP、cTnI及Lac趋势变化,分析比较急性期浓度变化,探究并比较三者预测脓毒症严重程度及预后的可能价值。
1 资料与方法
1.1 病例选择 选取自2015年3月—2017年3月入住山西医科大学第一医院ICU并确诊为脓毒症的病人48例,男29例,女19例,年龄28岁~77岁(59岁±14岁)。48例病人并发脓毒性休克病人22例,脓毒性休克发生率45.83%(22/48),最终发展为死亡者15例,病死率为31.25%(15/48),病程为10 d~62 d。
1.1.1 入选标准:年龄gt;18岁且lt;80岁;生存组病人存活时间gt;72 h;病人符合2012年、2016年脓毒症诊断标准。
1.1.2 排除标准 妊娠期或哺乳期妇女;治疗时间不足7 d;合并终末期肝肾功能衰竭、恶性肿瘤晚期、既往心衰等严重基础疾病者;病人及家属不配合治疗者。
1.2 研究方法
1.2.1 分组方法 根据病人是否发展为休克分为脓毒症组和脓毒性休克组,脓毒性休克是符合脓毒症诊断标准基础上合并收缩压lt;90 mmHg或收缩压较基础血压下降超过40 mmHg。脓毒症组26例,男16例,女10例;年龄53岁±15岁;病程27 d±10 d。脓毒性休克组22例,男13例,女9例;年龄60岁±12岁;平均病程40 d±22 d。两组病人性别构成比较,差异无统计学意义(χ2=0.029,P=0.860);两组病程比较,差异有统计学意义(t=5.504,P=0.005);两组年龄比较,差异无统计学意义(t=1.175,P=0.080),但休克组较脓毒症组年龄大。
根据病人最终存活与否分为存活组或死亡组。存活组33例,男20例,女13例,年龄55岁±14岁,病程28 d±18 d;死亡组15例,男9例,女6例,年龄58岁±16岁,病程30 d±19 d。两组病人性别构成比较,差异无统计学意义(χ2=0.002,P=0.99),两组年龄和病程比较,差异无统计学意义(t=0.81,P=0.42;t=0.92,P=0.39)。
1.2.2 检测指标及方法 病人治疗均参照2012年[8]及2016年[9]严重脓毒症与脓毒性休克处理国际指南进行治疗,包括初始复苏、抗生素治疗、液体治疗及营养支持等常规治疗。病人分别于治疗前,治疗后2 d、7 d清晨空腹抽取静脉血,测定NT-proBNP、cTnI、血细胞分析,血生化,凝血检查及血气分析(含Lac)等,并在治疗前和治疗后7 d行全身性感染相关性器官功能衰竭评分(SOFA)评分。经肘前静脉采血后,立即送生化室检测。NT-proBNP正常值lt;174 ng/L;cTnI正常值lt;0.5 μg/L;Lac正常值0.5 mmol/L~1.6 mmol/L。
2 结 果
2.1 脓毒症组和脓毒性休克组各指标比较 脓毒症组和脓毒性休克组病人各时间点NT-proBNP(F值分别为204.0、355.3,Plt;0.01)、cTnI(F值分别为476.3、208.9,Plt;0.01)、Lac(F值分别为361.3、120.6,Plt;0.01)、WBC(F值分别为49.08、30.09,Plt;0.01)。NT-proBNP、WBC在治疗第2天呈升高趋势,后逐渐下降;cTnI和Lac呈持续下降趋势。两组治疗前与治疗后2 d,各值比较差异无统计学意义(Pgt;0.05);治疗后7 d,脓毒症病人NT-proBNP(t=3.008,P=0.004 3)、cTnI(t=2.106,P=0.040 7)、Lac(t=2.187,P=0.0339)、WBC(t=2.296,P=0.026 3)均低于脓毒性休克病人(Plt;0.05)。详见表1。脓毒症病人SOFA评分治疗前后分别为(10±1)分及(7±2)分,脓毒性休克病人SOFA评分治疗前后分别为(12±2)分及(9±2)分,两组治疗后分值均显著低于治疗前(Plt;0.05);且脓毒症治疗前后SOFA评分低于脓毒休克组(Plt;0.05)。详见表1。

组别n时间NT-proBNP(ng/L)cTnI(μg/L)Lac(mmol/L)WBC(×109/L)脓毒症组26治疗前2972±13211.32±0.1811.31±0.2610.35±0.78治疗后2d19594±636 5.53±0.226.11±0.1718.37±0.46治疗后7d10121±4062)2.47±0.211)2.67±0.241)12.00±0.532)脓毒性休克组22治疗前2907±163 11.46±0.2811.08±0.3710.23±0.76治疗后2d20243±809 5.59±0.296.52±0.2619.82±1.08治疗后7d11292±6502)3.09±0.321)3.64±0.381)14.08±0.762) 与同组治疗前比较,1)Plt;0.05;与同组治疗后2d比较,2)Plt;0.05。
2.2 存活组与死亡组各指标比较 存活组和死亡组病人各时间点的NT-proBNP(F值分别为495.6、586.9,Plt;0.01)、cTnI(F值分别为804.0、340.0,Plt;0.01)、Lac(F值分别为557.0、167.6,Plt;0.01)、WBC(F值分别为84.06、31.04,Plt;0.01)。两组治疗前与治疗后2 d,各值比较差异无统计学意义(Pgt;0.05);治疗后7 d,存活组病人NT-proBNP(t=21.980,Plt;0.0001)、cTnI(t=2.276,P=0.0260)、Lac(t=15.220,Plt;0.0001)、WBC(t=25.580,Plt;0.0001)均低于死亡组病人(Plt;0.05)。详见表2。存活组病人SOFA评分治疗前后分别为(10±2)分及(7±1)分,死亡组病人SOFA评分治疗前后分别为(13±2)分及(8±1)分,两组治疗后分值均显著低于治疗前(Plt;0.05),且存活组治疗前后SOFA评分均低于死亡组(Plt;0.05)。详见表2。
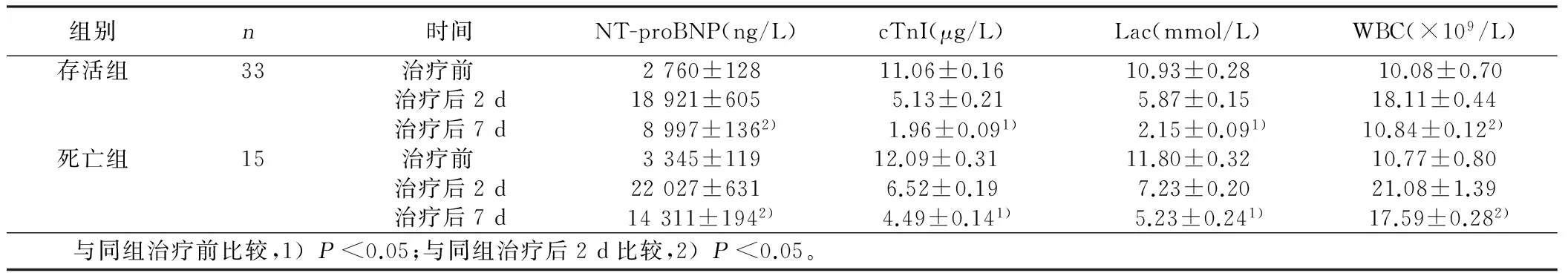
组别n时间NT-proBNP(ng/L)cTnI(μg/L)Lac(mmol/L)WBC(×109/L)存活组33治疗前 2760±12811.06±0.1610.93±0.2810.08±0.70治疗后2d18921±6055.13±0.215.87±0.1518.11±0.44治疗后7d8997±1362)1.96±0.091)2.15±0.091)10.84±0.122)死亡组15治疗前 3345±11912.09±0.31 11.80±0.3210.77±0.80治疗后2d22027±6316.52±0.197.23±0.2021.08±1.39治疗后7d14311±1942)4.49±0.141)5.23±0.241)17.59±0.282) 与同组治疗前比较,1)Plt;0.05;与同组治疗后2d比较,2)Plt;0.05。
2.3 NT-proBNP和cTnI、Lac对脓毒症病人并发休克的预测价值 根据ROC曲线分析结果提示:NT-proBNP、cTnI、Lac曲线下面积分别为0.89±0.04(Plt;0.000 1)、0.71±0.08(P=0.0110)、0.65±0.08(P=0.033 5);敏感度分别为0.80±0.15、0.67±0.16、0.67±0.31;特异度分别为0.88±0.46、0.59±0.09、0.63±0.35(Plt;0.05)。NT-proBNP判断脓毒症病人是否并发脓毒性休克的敏感性最高。详见图1。

图1预测脓毒症病人并发脓毒性休克ROC曲线
2.4 NT-proBNP和cTnI、Lac对脓毒症病人结局的预测价值 根据ROC曲线分析结果提示:NT-proBNP、cTnI、Lac曲线下面积分别为0.86±0.07(Plt;0.0001)、0.84±0.06(Plt;0.000 1)、0.87±0.09(Plt;0.0001);敏感度分别为0.86±0.13、0.77±0.27、0.87±0.29;特异度分别为0.81±0.20、0.66±0.30、0.75±0.19(Plt;0.05)。乳酸判断脓毒症病人预后的敏感性最高。详见图2。
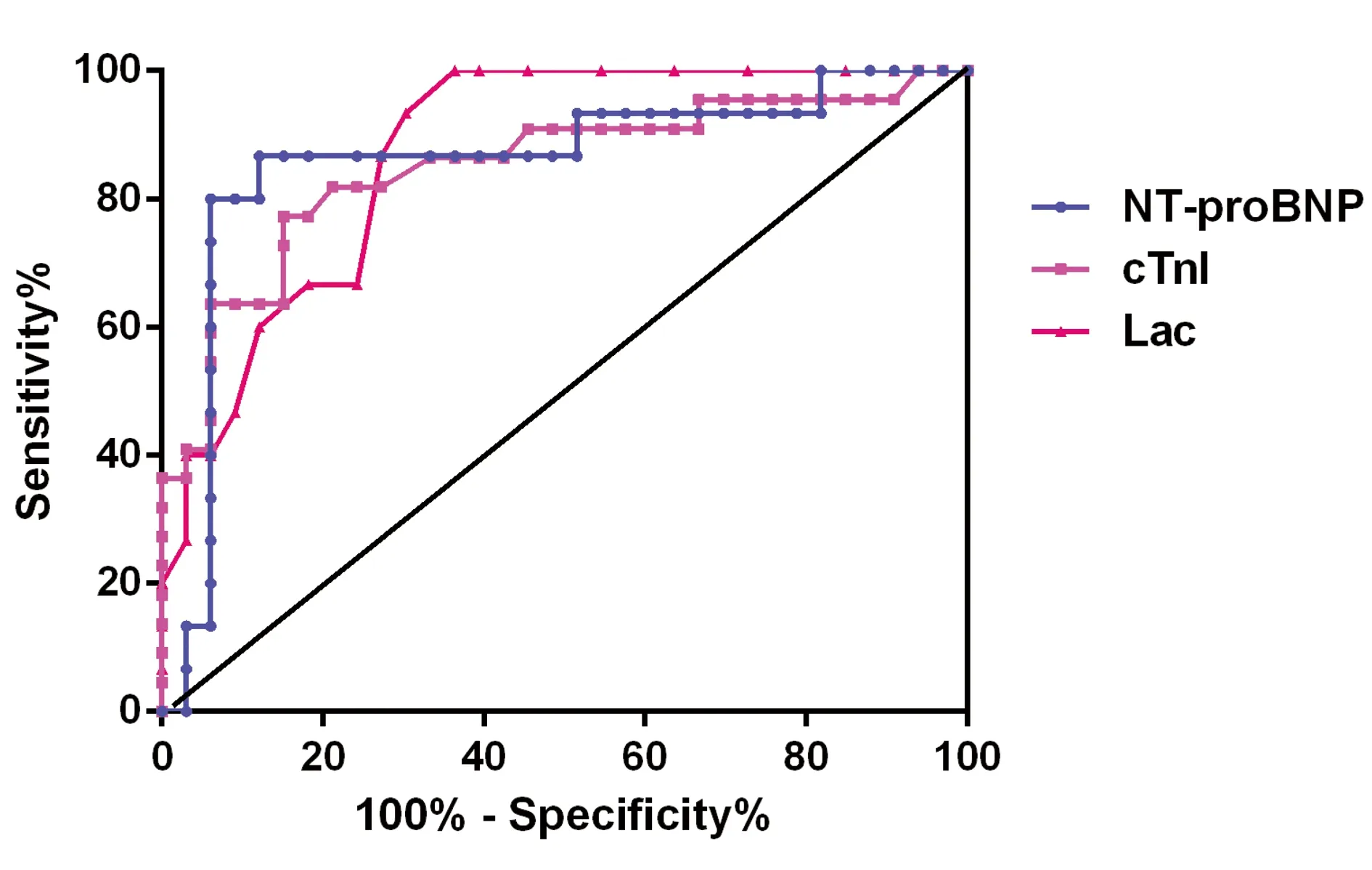
图2 预测脓毒症病人临床结局的ROC曲线
3 讨 论
脓毒症预后一直是临床上备受关注的问题,近年来,随着人们对脓毒症认识的不断深入,脓毒症预后明显改善,但脓毒性休克发生率和死亡率仍很高,部分原因可能是早期认识不足,在一定程度上延误治疗;如何早期识别高危病人,采取积极干预措施,改善病人预后尤为重要。本研究结果提示:血清NT-proBNP、cTnI、Lac水平在严重脓毒症和脓毒性休克病人中普遍升高,且死亡组高于存活组;ROC曲线分析发现,急性期血清NT-proBNP、cTnI、Lac浓度对脓毒症预后有预测作用,其中NT-proBNP预测休克敏感性最高,Lac预测死亡敏感性最高。SOFA评分是临床评估急危重症病人病情常用的评分系统之一,但由于评分项目繁多,不能快速、及时地判断脓毒症病人病情严重程度及预后。本研究结果显示SOFA评分在脓毒性休克组、死亡组较脓毒症组、存活组更高。
脓毒症病人NT-proBNP和cTnI浓度显著升高,可能原因是病人经历异常的心脏应激和损伤,且合并心脏功能障碍的脓毒症病人有较高的循环标志物水平和不利的结局[10]。本研究结果表明:脓毒症病人血清NT-proBNP、cTnI浓度发病后迅速升高,但与心脏射血分数下降无明显关系(数据未提供);左室射血分数≤45%是左室收缩功能不全的指标,有研究表明脓毒症或脓毒性休克时存在心室收缩和舒张功能障碍,导致射血分数下降,随着积极有效治疗,心功能多在1周左右恢复正常[11]。本研究未观察到心脏功能变化,可能的原因是未实时、动态追踪超声心动图的变化,在病程7 d时复查心脏超声,心功能障碍已减轻。有研究显示血清NT-proBNP在脓毒症发病后第2天达高峰,约为正常的10倍~20倍,随疾病好转或恶化下降或持续升高[12];NT-proBNP持续增高一定程度提示脓毒症的严重程度,可作为ICU死亡的独立预测指标[13];NT-proBNP较cTnI更能预测脓毒症的预后[4,10];cTnI在脓毒症中明显升高,但心电图及心脏超声无相应改变,基本除外心肌梗死;二者升高提示脓毒症损害全身脏器,心脏也是受累器官之一。本研究结果提示脓毒症时NT-proBNP及cTnI均升高,和预后明显相关;乳酸升高提示组织灌注不足,是脓毒症预后差的指标,乳酸预测脓毒症结局较NT-proBNP、cTnI更敏感。
综上所述,本研究分析脓毒症病人NT-proBNP、cTnI、Lac、SOFA评分、WBC、住院期间是否并发休克及最终结局,比较NT-proBNP、cTnI、Lac在脓毒症病人病情评估和预后判断中的价值,三者可能作为诊断脓毒性休克和判断预后的指标,在诊断及预后方面有良好的应用前景。
[1] Martin GS,Mannino DM,Eaton S,et al.The epidemiology of sepsis in the United States from 1979 through 2000[J].N Engl J Med,2003,348(16):1546-1554.
[2] Angus DC,Linde-Zwirble WT,Lidicker J,et al.Epidemiology of severe sepsis in the United States:analysis of incidence,outcome,and associated costs of care[J].Crit Care Med,2001,29(7):1303-1310.
[3] Blanco J,Muriel-Bombin A,Sagredo V,et al.Incidence,organ dysfunction and mortality in severe sepsis:a Spanish multicentre study[J].Crit Care,2008,12(6):R158.
[4] Brueckmann M,Huhle G,Lang S,et al.Prognostic value of plasma N-terminal pro-brain natriuretic peptide in patients with severe sepsis[J].Circulation,2005,112(4):527-534.
[5] Vasile VC,Chai HS,Abdeldayem D,et al.Elevated cardiac troponin T levels in critically ill patients with sepsis[J].Am J Med,2013,126(12):1114-1121.
[6] Cheng H,Fan WZ,Wang SC,et al.N-terminal pro-brain natriuretic peptide and cardiac troponin I for the prognostic utility in elderly patients with severe sepsis or septic shock in intensive care unit:a retrospective study[J].J Crit Care,2015,30(3):654 e659-e614.
[7] Drumheller BC,Agarwal A,Mikkelsen ME,et al.Risk factors for mortality despite early protocolized resuscitation for severe sepsis and septic shock in the emergency department[J].J Crit Care,2016,31(1):13-20.
[8] Dellinger RP,Levy MM,Rhodes A,et al.Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock:2012[J].Crit Care Med,2013,41(2):580-637.
[9] Rhodes A,Evans LE,Alhazzani W,et al.Surviving sepsis campaign:international guidelines for management of sepsis and septic shock:2016[J].Crit Care Med,2017,45(3):486-552.
[10] Masson S,Caironi P,Fanizza C,et al.Sequential N-terminal pro-B-type natriuretic peptide and high-sensitivity cardiac troponin measurements during albumin replacement in patients with severe sepsis or septic shock[J].Crit Care Med,2016,44(4):707-716.
[11] Parrillo JE,Burch C,Shelhamer JH,et al.A circulating myocardial depressant substance in humans with septic shock.Septic shock patients with a reduced ejection fraction have a circulating factor that depresses in vitro myocardial cell performance[J].J Clin Invest,1985,76(4):1539-1553.
[12] Hartemink KJ,Twisk JW,Groeneveld AB.High circulating N-terminal pro-B-type natriuretic peptide is associated with greater systolic cardiac dysfunction and nonresponsiveness to fluids in septic vs nonseptic critically ill patients[J].J Crit Care,2011,26(1):e101-e108.
[13] Wang F,Pan W,Pan S,et al.Usefulness of N-terminal pro-brain natriuretic peptide and C-reactive protein to predict ICU mortality in unselected medical ICU patients:a prospective,observational study[J].Crit Care,2011,15(1):R42.
2017-07-25)
(本文编辑 薛妮)
R631 R255
B
10.3969/j.issn.1672-1349.2017.20.043
1672-1349(2017)20-2640-04
1.山西医科大学第一医院(太原 030002),E-mail:13834691242@163.com;2.山西博爱医院
信息:曹静,冯巧爱.N末端脑钠肽前体、肌钙蛋白I与乳酸对脓毒症病人的预测价值[J].中西医结合心脑血管病杂志,2017,15(20):2640-2643.
