生物法拆分外消旋甲霜灵制备R-甲霜灵
2017-11-22张朝晖张利坤陆跃乐
张朝晖,张利坤,陆跃乐
(浙江工业大学生物工程学院,浙江 杭州 310014)
生物法拆分外消旋甲霜灵制备R-甲霜灵
张朝晖,张利坤,陆跃乐
(浙江工业大学生物工程学院,浙江 杭州 310014)
从土壤和污泥样品中分离得到一株能不对称水解甲霜灵的革兰阴性菌。通过分子生物学鉴定,命名该菌株为Albibacterssp.zjut528。当底物浓度为50 g·L-1,湿菌体(含水量81%):底物=0.3:1(质量比),反应28 h,产物得率为47.1%,主产物为R-甲霜灵酸,对映体过量值eep> 99.9%。将菌株细胞破碎得到的粗酶液分离纯化得到一个 SDS-PAGE 电泳纯的酯酶,分子量约为 40×103,酶的N端10个氨基酸序列为NH2-Ala-Ala-Lys-Ala-Pro-Leu-Arg-Leu-Lys-Glu。该酶最适温度为40℃,20~40℃稳定性较好。最适pH为9.0,在pH 5.0~10.0范围内稳定。Fe2+、Mn2+、Zn2+对酶活有促进作用,Fe3+对酶活有一定的抑制作用。在含有20%的乙腈、异丙醇、丙酮、二异丙醚、环己烷、正己烷的水溶液中,酶活均比在纯水相中有明显提高。该酶反应动力学符合米氏方程,Vm为 0.18 mmol·L-1·min-1,Km为 2.29 mmol·L-1,Kcat为 0.85 min-1。建立了一条利用Albibacterssp.zjut528细胞作催化剂拆分甲霜灵制备R-甲霜灵的工艺路线,终产品R-甲霜灵的纯度是96.2%,ee值为99.3%。
生物催化;生物过程;水解;R,S-甲霜灵;R-甲霜灵;菌种筛选和鉴定;酯酶;Albibacters
引 言
近年来,手性农药在农药化学品中占据的比例越来越大[1-2]。手性农药的对映体具有相同的物理和化学性质,但是生物特性方面却可能有很大的差异,包括降解性、生物活性和毒性等方面[3-11]。光学纯产品与外消旋产品相比,它的优势有:能提高单位产品的药效,减少农药喷洒的总量,减少非活性异构体的使用量(它可能对非靶标生物有副作用)。此外,光学纯产品的使用量只有外消旋产品的50%,方便运输和储存。
甲霜灵,化学名称R,S-N-(2,6-二甲基苯基)-N-(2-甲氧基乙酰)丙氨酸甲酯,是一种高效低毒、内吸性酰胺类杀菌剂,广泛用于防治病原真菌中的卵菌纲(Oomycetes)病菌引起的疾病,对多种农作物的霜霉病和疫霉病等有很强的治疗效果[12-13],还用于观赏植物、树木等的病害防治[14]。它是一种典型的旋光活性农药。研究表明,它的两个对映体在到达受体或与受体结合方面表现出明显差异[15]。甲霜灵活性主要来源于R-型,通常比S-型高很多[16-17]。对一些致病疫霉菌(Phythophthora infestans)和终极腐霉菌(Pythium ultimum)的体外实验表明,R-型活性约是S-型的 1000倍,在体内前者为后者的3~10倍[18]。甲霜灵对映体在土壤中的降解速度也不同。当土壤的 pH < 4时,S-甲霜灵降解速度比R-甲霜灵降解速度快,在 pH > 5的有氧条件下,R-甲霜灵的降解速度更快[12,19-20]。
目前,国内生产的甲霜灵主要是外消旋甲霜灵,有数千吨的规模。国外生产的甲霜灵主要是精甲霜灵(R体为主),国内精甲的生产规模较小。几乎所有的甲霜灵生产均采用化学法[21]。利用生物催化剂生产手性物质,与用化学法生产相比,优点是条件温和、选择性高和污染少。使用脂肪酶作催化剂进行生物拆分,已成为生产手性产品的重要方法之一[22]。
目前有一些用生物拆分法制备R-甲霜灵的研究报道,拆分对象是生产外消旋甲霜灵的中间体R,S-N-(2, 6-二甲基苯基)丙氨酸甲酯(MAP),得到的R-MAP再按原来的方法合成R-甲霜灵。已报道的可对映体选择性拆分 MAP的催化剂主要有:脂肪酶 Lipase PS (Burkhloderia cepacia)、Lipase OF、Lipase QLM[23]、Lipase CRL[24-25]、PSL[26-28]、CAL-B[27-28]等,碱性蛋白酶Alcalase以及酰基转移酶Acylase Amano[23]等,微生物细胞Burkhloderiasp.MC16-3和99-2-1[29]。上述催化剂对MAP的立体选择性有R型(如 Lipase PS),也有S型[28]。其中用Lipase PS催化MAP水解得到的R-MAP的ee值大于 98%[23]。Park等[30]报道了一条用Lipase PS实验室规模拆分MAP制备R-甲霜灵的工艺,终产品R-甲霜灵的ee值是96%。
本文将研究用生物法直接拆分外消旋甲霜灵制备R-甲霜灵。首先,利用以甲霜灵为唯一碳源的培养基,从土壤、污泥等样品中筛选能选择性水解甲霜灵的菌种,对其进行生物学鉴定;然后通过分离纯化获得胞内的目标酯酶,对其酶学性质进行研究;最后,利用菌体细胞作催化剂,建立一条生物法拆分外消旋甲霜灵制备R-甲霜灵的新工艺。
1 材料与方法
1.1 土壤等样品
浙江、江苏等地土壤和污泥样品若干份。
1.2 培养基和培养方法
富集培养基(g·L-1):K2HPO42.1,KH2PO40.4,NaCl 0.1,MgSO4·7H2O 0.2,CaCl20.025,NH4NO30.5,微量元素液1%(体积),甲霜灵(不同富集阶段加入不同量甲霜灵,使其最终在培养基终浓度为0.02、0.05、0.1、1 g·L-1),121℃灭菌 20 min。
微量元素液(g·L-1):CoCl20.1,MnSO40.5,FeSO4·7H2O 0.1,CuSO40.1,ZnSO4·7H2O 0.1,H3BO30.01,Al2(SO4)3·12H2O 0.01,Na2MoO4·2H2O 0.01,EDTA·2Na 1,配制方法:取 1g EDTA·2Na溶于800 ml去离子水中,再将其他组分依次加入,最后加水至1 L。
固体培养基(g·L-1):NaCl 0.5,MgSO4·7H2O 1.0,K2HPO41.0,NH4NO31.0,酵母浸出粉5.0,葡萄糖5.0,甲霜灵1,琼脂20,115℃灭菌20 min。
复 筛 摇 瓶 培 养 基 (g·L-1): NaCl 0.5 ,MgSO4·7H2O 1.0,K2HPO41.0,NH4NO31.0,酵母浸出粉5.0,葡萄糖5.0,甲霜灵1,115℃灭菌20 min。
复筛培养方法:将富集培养物涂布在固体培养基上,30℃培养2~4 d后,挑取单菌落接入复筛摇瓶培养基中,30℃、转速180 r·min-1培养,定期取样分析。
菌株的16S rDNA 扩增和进化树的构建:用通用引物27F/1492R进行16S rDNA的PCR扩增:正向 5′-AGTTTGATCCTGGCTCAG-3′; 反 向5′-GGTTACCTTGTTACGACTT-3′。
采用 MEGA 4.0软件中的邻近法(Neighbor-Joining)与1000次Bootstrap的统计检验构建进化树。
1.3 菌体细胞催化外消旋体甲霜灵不对称水解的性能
催化反应体系为100 ml,含外消旋甲霜灵5 g,湿菌体(含水量81%)1.5 g,异丙醇终浓度20%(体积),以磷酸缓冲液(pH=8.0)为反应介质,在 180 r·min-1,37℃下摇瓶中反应。
1.4 目标酯酶的分离纯化
1.4.1 粗酶液的收集 将菌种接种于发酵培养基,180 r·min-1、30℃培养48 h,离心收集菌体,用缓冲液(10 mmol·L-1Tris-HCl,pH 8.0)洗涤 3 次,重悬于缓冲液,超声破碎细胞,8000 r·min-1离心10 min,收集上清液得粗酶液。
1.4.2 粗酶液在离子交换柱层析前的预处理 将粗酶液在冰浴条件下搅拌,缓慢加入适量粉状硫酸铵,4℃静置6 h后,4000 r·min-1离心30 min,沉淀用100 mmol·L-1Tris-HCl(pH 8.0)溶液溶解。 将溶解的酶液转移到透析袋中,在10 mmol·L-1Tris-HCl(pH 8.0)缓冲液进行冰水浴透析,更换4~5次缓冲液,透析12 h。将透析后的酶液装入15 ml截留分子量10×103的超滤离心管中,6000 r·min-1离心 30 min,截留粗酶液用适量 10 mmol·L-1Tris-HCl(pH 8.0)缓冲液稀释,用于离子交换层析。
1.4.3 阴离子交换层析 以 DEAE Sepharose Fast Flow层析柱进行蛋白分离,先用平衡缓冲溶液(10 mmol·L-1Tris-HCl,pH 8.0)以 1 ml·min-1流速冲洗柱子,柱子平衡后,用0.22 μm滤头对样品过滤后上样。用含不同浓度 NaCl的洗脱缓冲溶液(10 mmol·L-1Tris-HCl,pH 8.0)进行梯度洗脱,流速 1 ml·min-1,收集洗脱峰,检测各个峰的酶活,将有活性的酶液进行超滤浓缩后,用于凝胶过滤层析。
1.4.4 凝胶过滤层析 采用SephadexG75为填料,先用缓冲溶液(10 mmol·L-1Tris-HCl,pH 8.0)平衡凝胶柱,流速为 1 ml·min-1。将样品经 0.22 μm 滤头过滤后,以柱体积的2%进行上样。以1 ml·min-1的流速用缓冲溶液洗脱1.5倍柱体积直到基线平稳,收集不同洗脱体积下的洗脱峰,检测各个峰的酶活。
1.5 酶动力学测定
在37℃、pH 8.0条件下测定酶液在不同甲霜灵底物浓度下的反应速度,加入20%异丙醇作助溶剂。
1.6 拆分外消旋甲霜灵制备R-甲霜灵的工艺
1.6.1 细胞催化甲霜灵不对称水解 将菌株Albibactersp.zjut528接种于发酵培养基培养48 h,离心保留菌体,用200 mmol·L-1磷酸盐缓冲液(pH 8.0)洗涤3次。水解反应体系同1.3节。
将反应后的反应液用氨水调节至pH约9.0,乙酸乙酯萃取,有机相加无水硫酸镁除水,过滤后旋蒸,得到S-甲霜灵。萃余水相用浓盐酸调节pH为4.0左右,再用乙酸乙酯萃取,有机相加入无水硫酸镁除水,过滤后旋蒸得到R-甲霜灵酸。
1.6.2R-甲霜灵酸与甲醇反应制备R-甲霜灵 取1.6.1节制得的R-甲霜灵酸,溶于无水甲醇中,冰浴滴加二氯亚砜(1.1倍于R-甲霜灵酸物质的量),滴加完毕后冰浴反应10 min,然后回流反应4 h,旋蒸浓缩。将旋蒸后的产物溶于乙酸乙酯,用5%Na2CO3溶液洗涤2次,去离子水洗涤1次。有机相加入无水硫酸镁除水,过滤后旋蒸,得到R-甲霜灵。
1.6.3S-甲霜灵的消旋化 取适量由 1.6.1节得到的S-甲霜灵溶于无水乙腈,加入消旋催化剂,在30、40、50、60℃下反应,反应结束后旋蒸乙腈,用HCl(0.1mol·L-1)溶液洗涤旋蒸后的产物,乙酸乙酯萃取,有机相加入无水硫酸镁除水,过滤后旋蒸,即得消旋产物。
1.7 分析方法
1.7.1 甲霜灵和甲霜灵酸的HPLC分析 根据文献[31]进行了改进。样品预处理:取一定量水解反应液加HCl至pH为4左右,乙酸乙酯萃取,取一定量有机相,氮气吹干,加入流动相溶解。流动相组成是正己烷:异丙醇:三氟乙酸=80:20:0.1,流速 0.8 ml·min-1,检测波长 230 nm,柱温 30℃,大赛璐(Daicel)手性OD柱250 mm × 4 mm。
产物对映体过量值 (eep) 和产物收率C按下式计算

式中,[P]S和[P]R分别为样品中S和R型产物的含量,eep为产物的对映体过量值,CP为产物的浓度,CS为底物的浓度。
1.7.2 酯酶活力测定 取适量酶液,加到含1 g·L-1甲霜灵的 100 mmol·L-1Tris-HCl(pH 8.0)缓冲液中,反应体系5 ml,37℃反应10 min,强酸终止反应,液相检测产物生成量。
1U:在上述条件下,1 min产生1 μmol甲霜灵酸所需的酶量。
2 结果与讨论
2.1 菌种的筛选和鉴定
2.1.1 菌种的筛选 对采集到的多份土壤和污泥样品进行富集培养,有一个培养物中检测到对甲霜灵有降解效果。在10-7进行稀释涂布后的固体培养基平板上根据菌落不同特征选取了50个单菌落,再将其分别接种到复筛摇瓶培养基,成功获得了一株能不对称水解甲霜灵的菌株,发酵培养初始和2 d,分别取样进行液相色谱分析,结果见图1,将该菌株初步命名为zjut528。
从图1可以看出,菌株zjut528在复筛摇瓶培养液(含外消旋甲霜灵1 g·L-1)中水解甲霜灵,反应 2 d,R-甲霜灵已被完全水解为 R-甲霜灵酸,S-甲霜灵未发生反应。产物收率近50%,产物甲酸灵酸的主构型为R型,对映体过量值eep> 99.9%。
2.1.2 菌株 zjut528的形态和分子生物学鉴定 菌株zjut528在固体培养基平板上菌落均呈圆形,表面隆起,边缘整齐,湿润,光滑,白色,不透明,随着时间的推移,菌落未见有明显颜色变化。革兰染色后zjut528的形态特征为革兰阴性菌,呈球杆状。
将菌株zjut528基因组送到某生物公司进行16S rDNA鉴定。将测序得到的原序列经去载体、拼接后获得较完整的16S rDNA序列,长度为1236 bp,将该序列在NCBI网站上用BLAST检索Genbank中相关菌株的16S rDNA序列,并进行核苷酸同源性比对和系统发育分析,发现它与 Albibactermethylovoransstrain DSM22840T相似性达到了99%,该菌株系统发育树见图2。16S rDNA分子鉴定一般只能鉴定到属,所以该菌株只能鉴定为Albibacter属,该属目前只有一个种。

图1 用菌株zjut528水解外消旋甲霜灵反应初始(a)和第2 d时(b)反应液的HPLC图Fig.1 HPLC chromatograph of reactant at beginning (a) and the 2nd day(b) of hydrolysis of racemic metalaxyl catalyzed by zjut528 cells
2.1.3 菌体细胞催化甲霜灵不对称水解的性能 用菌体催化外消旋体甲霜灵的水解,甲霜灵浓度 50 g·L-1,湿菌体(含水量81%):甲霜灵=0.3:1(质量比),以异丙醇(终浓度20%, 体积分数)作助溶剂,在pH=8.0下反应28 h,产物R-甲霜灵酸的收率是47.1%,eep> 99.9%。
2.2 酶的分离纯化
2.2.1 盐析 当硫酸铵饱和度在20%~40%时,酶活主要存在于上清中。当硫酸铵饱和度在 40%~60%时,上清中酶活明显减少,沉淀中酶活明显增加。当硫酸铵饱和度高于60%时,几乎所有目的蛋白都沉淀下来。
2.2.2 阴离子交换色谱分离 用阴离子交换柱对盐析后的粗酶液进行分离,在 0.5和 1.0 mol·L-1的NaCl浓度洗脱液中检测出了酶活性,此二者对甲霜灵有着相同的水解效果,将上述2组活性蛋白液合并,超滤浓缩用于凝胶过滤色谱分离。

图2 菌株zjut528的16S rDNA系统发育树Fig.2 16S rDNA phylogenetic tree of strain zjut528
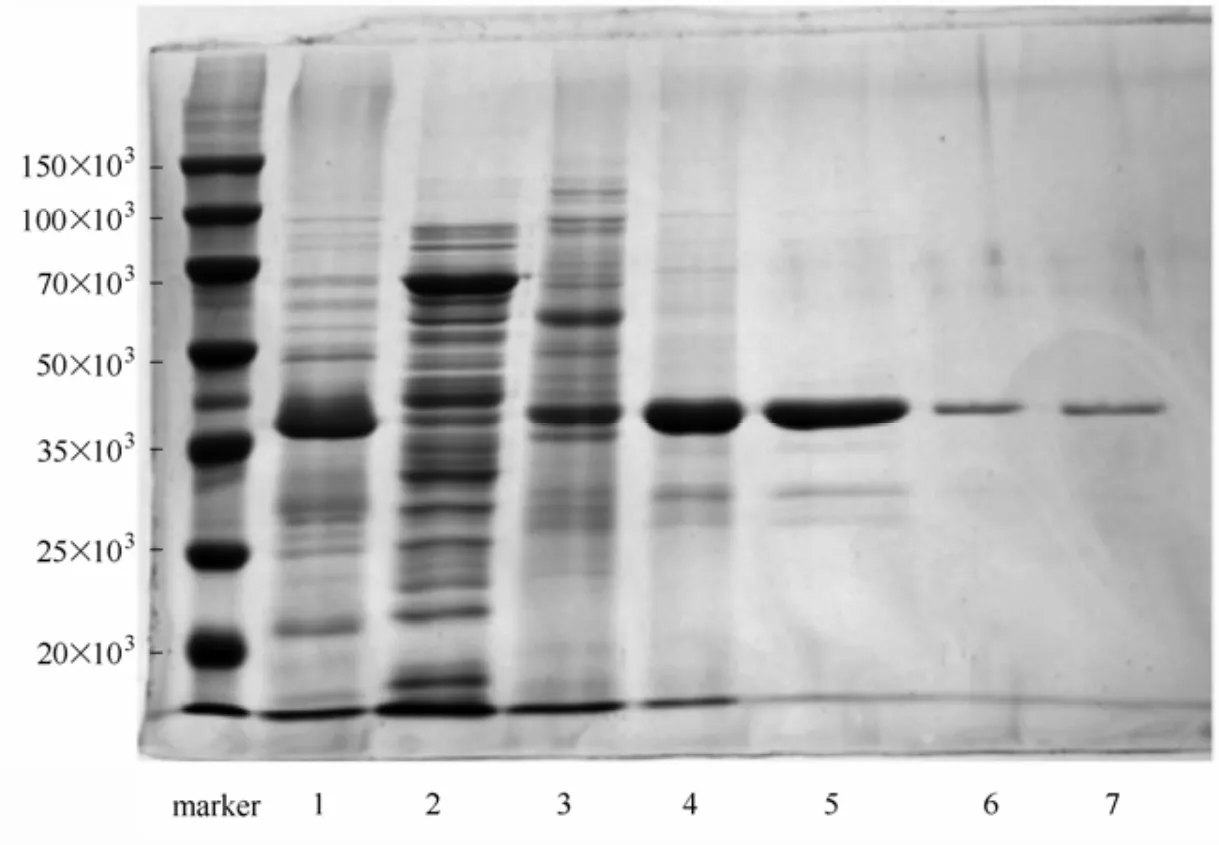
图3 在离子交换和凝胶过滤层析中各收集液的SDS-PAGE分析Fig.3 SDS-PAGE analysis of elution portions from ion exchange and gel filtration chromatography
2.2.3 凝胶过滤色谱分离 对离子交换色谱分离后的活性蛋白液进行凝胶过滤色谱分离,在 26~44 min之间出现一个大的洗脱峰,经过验证该峰具有酶活性。
2.2.4 色谱分离收集液的SDS-PAGE分析 对两个色谱分离步骤中所得收集液进行SDS-PAGE电泳,结果如图3所示。从图中可以看出,离子交换色谱分离收集到的活性峰中杂蛋白的含量已经很少。再经由凝胶过滤色谱分离后,目的蛋白在SDS-PAG凝胶上为单一条带,分子量约为40×103,经转PVDF膜后外送进行 N端测序。测得 N端 10个氨基酸序列为NH2-Ala-Ala-Lys-Ala-Pro-Leu-Arg-Leu-Lys-Glu。
2.3 酯酶的酶学性质研究
所用酶均为分离纯化后的电泳纯酶。
2.3.1 温度对酶活及稳定性影响 在pH 8.0下,考察了20~60℃范围内温度对酶活的影响,以最高酶活为100%,结果如图4所示,该酯酶在40℃下酶活最高,50℃仍保留70%酶活,但在60℃时已经完全失活。

图4 温度对酶活的影响Fig.4 Effect of temperature on enzyme activity

图5 温度对酶稳定性的影响Fig.5 Effect of temperature on enzyme’s stability
在pH 8.0下,将酶按一定温度保温4 h,不同温度下酶的稳定性如图5所示。20~40℃下酶较为稳定,4 h后仍保留90%以上的初始酶活;40~50℃下剩余酶活迅速下降,50℃下只保留约20%的初始酶活,60℃处理4 h后已经检测不到剩余活性。
2.3.2 pH对酶活及稳定性影响 在 37℃下,分别测定不同pH下的酶活,以最高酶活为100%,结果如图6所示,酶在pH为9.0时酶活最高,pH为10.0时仍有90%的酶活,由于甲霜灵在pH为11.0条件下自身会发生水解,因此未测定pH在10.0以上的酶活。该酶在酸性条件下,酶活迅速下降,在 pH为4.0时,几乎检测不到活性。
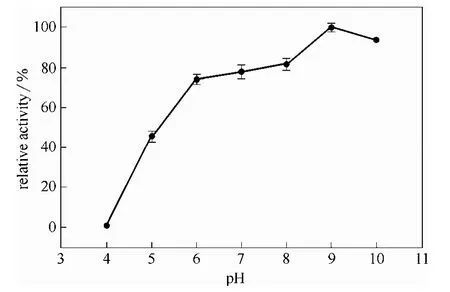
图6 pH对酶活的影响Fig.6 Effect of pH on enzyme activity
4℃下将酶在不同pH下保温4 h,酶的pH稳定性如图7所示。在pH为5.0~10.0下,剩余酶活仍保留初始时的90%以上,而在pH为4.0时,剩余酶活只有初始时的43%。

图7 pH对酶稳定性的影响Fig.7 Effect of pH on enzyme’s stability
2.3.3 金属离子对酶活影响 分别测定加入 2 mmol·L-1不同金属离子后酶液的酶活,以不加金属离子时的酶活(CK)为100%,结果如图8所示,Fe2+、Mn2+、Zn2+能促进酶活,Fe3+对酶活有一定的抑制,其他金属离子对酶活的影响较小。
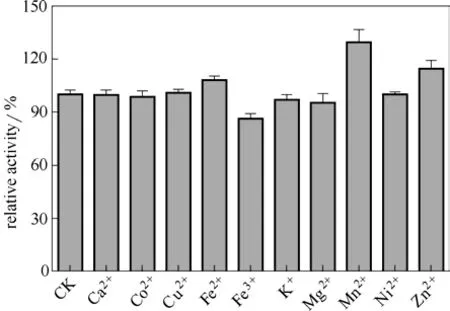
图8 金属离子对酶活的影响Fig.8 Effect of various metal ions (2 mmol·L-1) on enzyme’s activity
2.3.4 有机溶剂的加入对酶活的影响 测定加入不同有机溶剂 (浓度20%(体积))对酶活的影响,以未加有机溶剂为100%(CK),结果如图9所示,乙腈、甲醇、异丙醇、丙酮、二异丙醚、环己烷、正己烷的加入均对酶活有明显的促进作用,其中异丙醇促进作用最大,提高到原来的约2.5倍。因为甲霜灵的溶解度不高(约 8 g·L-1),溶剂对酶活的促进作用可能来源于它们对底物的助溶作用。液相色谱检测表明,不同有机溶剂对酶的选择性没有明显的影响,产物对映体过量值eep均大于99%。
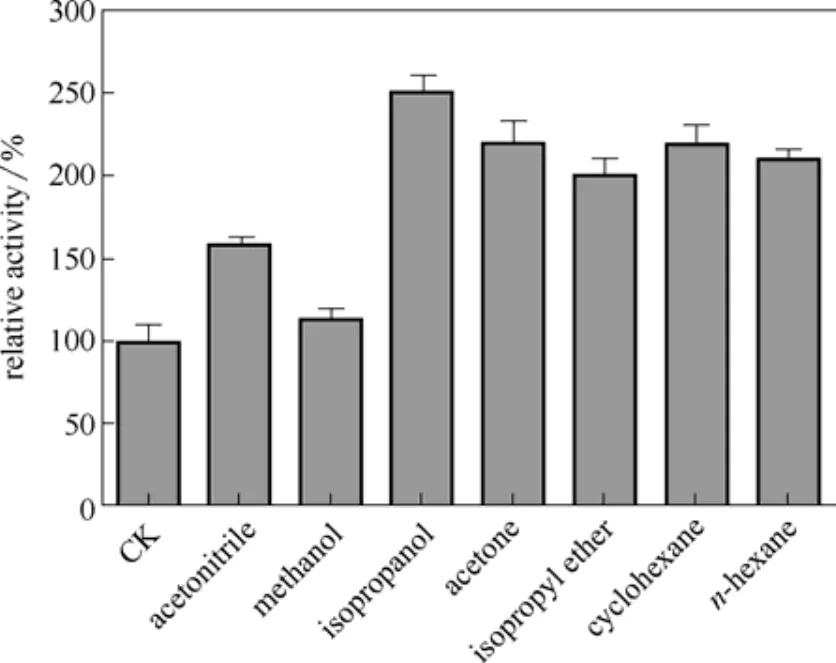
图9 有机溶剂的加入对酶活的影响Fig. 9 Effect of various organic solvent (20%, vol) on enzyme activity in aqueous solution
2.3.5 酶动力学测定 测定了不同甲霜灵浓度下的酶反应速率,结果如图10所示。在低浓度下,反应近似于一级反应,随着底物浓度的增加,反应由一级反应向零级反应过渡,与典型米氏方程曲线相符。用Lineweaver Burk双倒数作图法并进行曲线拟合(图10 内插图),求得 Vmax=0.18 mmol·L-1·min-1,Km=2.29 mmol·L-1。测定时反应体系中酶浓度[E]=0.21×10-3mol·L-1,因为Kcat=Vm/[E], 所 以 得Kcat=0.85 min-1。
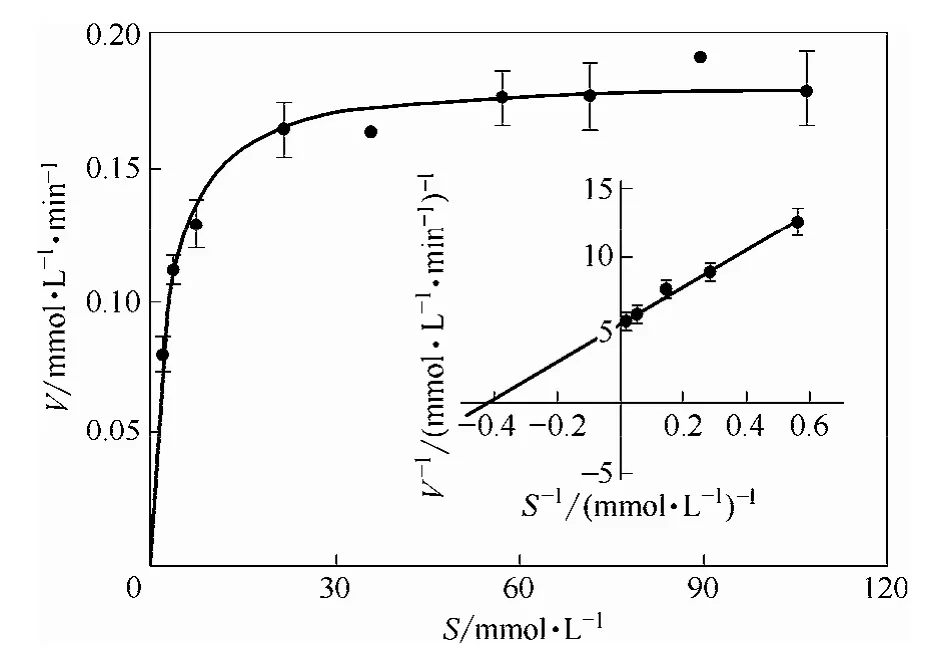
图10 不同甲霜灵浓度下的酶反应速率(内插图是用Michaelis–Menten方程双倒数作图法对实验数据(●)进行了拟合)Fig.10 Velocity of reaction catalyzed by purified esterase at different metalaxyl concentration(Data (●) were fit for Michaelis–Menten equation in double-reciprocal plotin inserted figure)
2.4 生物拆分外消旋甲霜灵制备R-甲霜灵的工艺
设计了利用Albibacter sp. zjut528细胞作催化剂制备R-甲霜灵的新工艺(工艺流程如图11所示)。先利用菌株细胞催化外消旋甲霜灵不对称水解,然后将水解产物 R-甲酸灵酸与未反应的底物 S-甲霜灵进行分离。分离得到的R-甲霜灵酸和甲醇进行酯化反应合成R-甲霜灵;分离得到的S-甲霜灵进行消旋化,生成的外消旋体可以返回细胞催化步骤重新利用。
2.4.1 细胞催化甲霜灵不对称水解 甲霜灵经细胞催化水解后,得到的产物为R-甲霜灵酸,产物收率47.1%,对映体过量值eep> 99.9%。经萃取分离、旋蒸后制得了R-甲霜灵酸与S-甲霜灵。R-甲霜灵酸的ee值 > 99.9%,S-甲霜灵ee值为99.4%。
2.4.2 R-甲霜灵的制备 R-甲霜灵酸经二氯亚砜催化与甲醇反应4 h后,产物的收率为94.2%。反应结束后反应液通过萃取、旋蒸等分离操作最终得到了R-甲霜灵产品,产品的液相色谱检测结果如图12所示,R-甲霜灵的纯度为96.2%,对映体过量值ee为 99.3%。酯化步骤(包括分离)产物的总收率80.6%。
2.4.3 S-甲霜灵消旋化研究 加入消旋催化剂,在30~60℃范围内,研究了S-甲霜灵的消旋化情况。温度越高,消旋速度越快。60℃下消旋速度最快,反应6 h,对映体过量值从99.4%减小到4.2%。
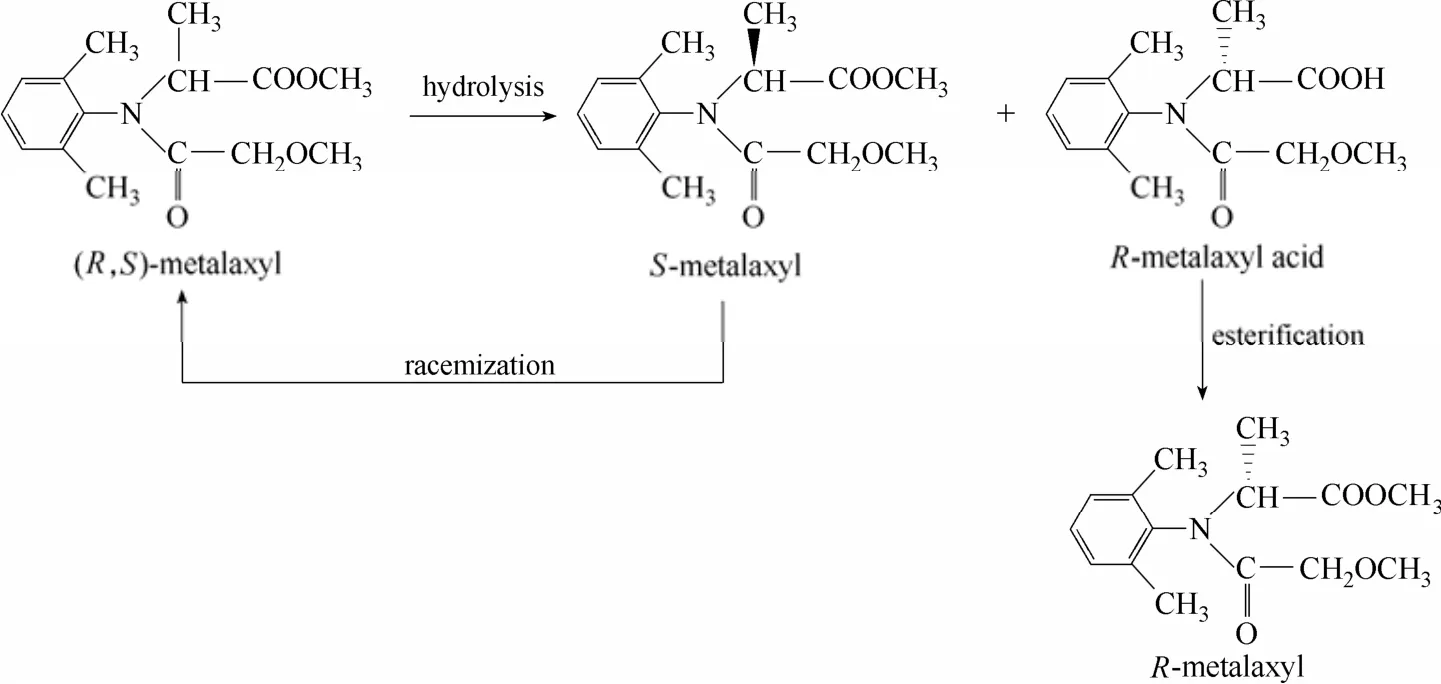
图11 用Albibacter sp. zjut528细胞作催化剂拆分外消旋甲霜灵制备R-甲霜灵的工艺流程Fig.11 Flow chart of production of R-metalaxyl by resolution of racemic metalaxyl using Albibacters sp. zjut528 cells as catalyst

图12 新拆分工艺所得终产品R-甲霜灵的HPLC图Fig.12 HPLC chromatograph of final-product of R-metalaxyl produced by new resolution process using Albibacters sp. zjut528 cells as catalyst
3 结 论
(1)本研究从土壤、污泥等样品中,筛选到一株可以不对称水解甲霜灵的革兰阴性菌,对该菌株进行了生理生化和分子生物学鉴定,命名为Albibactersp.zjut528。当底物浓度为 50 g·L-1,湿菌体(含水量81%):底物=0.3:1(质量比),反应28 h,产物得率为 47.1%,主产物为R-甲霜灵酸,eep>99.9%。
(2)将菌株细胞破碎得到的粗酶液,经盐析、阴离子交换色谱分离、凝胶过滤色谱分离得到一个SDS-PAGE电泳纯的酯酶,分子量约为40×104,酶蛋白N端10个氨基酸序列为NH2-Ala-Ala-Lys-Ala-Pro-Leu-Arg-Leu-Lys-Glu。该酶最适温度为40℃。20~40℃稳定性较好。最适pH为9.0,在pH 5.0~10.0范围稳定。2 mmol·L-1的Fe2+、Mn2+、Zn2+对酶活有促进作用,Fe3+对酶活有一定的抑制作用。在含有20%的乙腈、异丙醇、丙酮、二异丙醚、环己烷、正己烷的水溶液中,酶活均比在纯水相中有较明显的提高。该酶反应动力学符合米氏方程,Vm为 0.18 mmol·L-1·min-1,Km为2.29 mmol·L-1,Kcat为 0.85 min-1。
(3)建立了一条利用Albibacterssp.zjut528细胞作催化剂对外消旋甲霜灵进行拆分制备R-甲霜灵的工艺路线。其中第一步外消旋甲霜灵经细胞催化水解后,得到的主产物为R-甲霜灵酸,eep> 99%,产物得率47.1%。反应结束后,将R-甲霜灵酸和未反应的S-甲霜灵分离。对分离出的S-甲霜灵(ee为99.4%)进行消旋化重新利用,60℃反应6 h,甲霜灵的对映体过量值ee下降为 4.2%。对分离出的R-甲霜灵酸和甲醇进行酯化反应,经分离纯化,得到的终产品R-甲霜灵的纯度是96.2%,ee值为99.3%。
与用商品酶Lipase PS拆分中间体制备R-甲霜灵[30]的工艺相比,本工艺的催化剂成本低得多(催化剂是菌体细胞)、产品的ee值更高,是一个有工业化价值的生产工艺。
[1] WILLIAMS A. Opportunities for chiral agrochemicals[J]. Pesticide Science, 1996, 46(1): 3-9.
[2] YE J, WU J, LIU W. Enantioselective separation and analysis of chiral pesticides by high-performance liquid chromatography[J]. Trac Trends in Analytical Chemistry, 2009, 28(10): 1148-1163.
[3] GARRISON A W. Probing the enantioselectivity of chiral pesticides[J]. Environmental Science and Technology, 2006, 40(40):16-23.
[4] GARRISON A W. An introduction to pesticide chirality and the consequences of stereoselectivity [J]. ACS Symposium, 2011, 1085:1-7.
[5] LIU W, YE J, JIN M. Enantioselective phytoeffects of chiral pesticides[J]. Journal of Agricultural and Food Chemistry, 2009,57(6): 2087-2095.
[6] JIN Y, LIU J, WANG L,et al. Permethrin exposure during puberty has the potential to enantioselectively induce reproductive toxicity in mice[J]. Environment International, 2012, 42(1): 144-151.
[7] HUANG L, LU D, DIAO J,et al. Enantioselective toxic effects and biodegradation of benalaxyl inScenedesmusobliquus[J].Chemosphere, 2012, 87(1): 7-11.
[8] SULIMMA L, BULLACH A, KUSARI S,et al. Enantioselective degradation of the chiral fungicides metalaxyl and furalaxyl byBrevibacillus brevis[J]. Chirality, 2013, 25(6): 336-340.
[9] SUN M, LIU D, DANG Z,et al. Enantioselective behavior of malathion enantiomers in toxicity to beneficial organisms and their dissipation in vegetables and crops[J]. Journal of Hazardous Materials,2012, 237/238(6): 140-146.
[10] LIU D, WANG P, ZHU W,et al. Enantioselective degradation of fipronil in Chinese cabbage (Brassica pekinensis)[J]. Food Chemistry,2008, 110(2): 399-405.
[11] LI Y, DONG F, LIU X,et al. Studies of enantiomeric degradation of the triazole fungicide hexaconazole in tomato, cucumber, and field soil by chiral liquid chromatography-tandem mass spectrometry[J].Chirality, 2013, 25(3): 160-169.
[12] BUERGE I J, POIGER T, MULLER M D,et al. Enantioselective degradation of metalaxyl in soils: chiral preference changes with soil pH[J]. Environmental Science & Technology, 2003, 37(12):2668-2674.
[13] FISHER D J, HAYES A L. Mode of action of the systemic fungicides furalaxyl, metalaxyl and ofurace[J]. Pesticide Science, 1982, 13(3):330-339.
[14] PING Z, ZHU W, JING Q,et al. Evaluating the enantioselective degradation and novel metabolites following a single oral dose of metalaxyl in mice[J]. Pesticide Biochemistry & Physiology, 2014,116: 32-39.
[15] VISHUNAVAT K, NASHAAT N I, HERAN A,et al. Sensitivity to the racemic mixture and isomeric forms of metalaxyl in Indian and European homothallic and heterothallic isolates ofPeronospora parasiticain Brassica species[J]. Crop Protection, 1998, 17(17):543-546.
[16] 刘西莉, 马安捷, 林吉柏. 精甲霜灵与外消旋体甲霜灵对掘氏疫霉菌的抑菌活性比较[J]. 农药学学报, 2003, 5(3): 45-49.LIU X L, MA A J, LIN J P. The comparison of inhibitory action between stereoisomers of metalaxyl[J]. Chinese Journal of Pesticide Science, 2003, 5(3): 45-49.
[17] BUSER H R, POIGER T, MULLER M D. Changed enantiomer composition of metolachlor in surface water following the introduction of the enantiomerically enriched product to the market.[J]. Environmental Science & Technology, 2000, 34(13):2690-2696.
[18] ZADRA C, MARUCCHINI C, ZAZZERINI A. Behavior of metalaxyl and its pure renantiomer in sunflower plants (Helianthus annus) [J]. Journal of Agricultural and Food Chemistry, 2002, 50(19):5373-5377.
[19] CHEN S, LIU W. Enantioselective degradation of metalaxyl in anaerobic activated sewage sludge[J]. Bulletin of Environmental Contamination and Toxi, 2009, 82(3): 327-331.
[20] BUSER H R, MULLER M D, POIGER T,et al. Environmental behavior of the chiral acetamide pesticide metalaxyl: enantioselective degradation and chiral stability in soil[J]. Environmental Science and Technology, 2002, 36(2): 221-226.
[21] 孙家隆. 现代农药合成技术[M]. 北京: 化学工业出版社, 2011:386.SUN J L. Modern Pesticide Synthesis Technology[M]. Beijing:Chemical Industry Press, 2011: 386.
[22] CHIKUSA Y, HIRAYAMA Y, IKUNAKA M,et al. There’s no industrial biocatalyst like hydrolase: development of scalable enantioselective processes using hydrolytic enzymes[J]. Organic Process Research & Development,2003, 7(3):289-296.
[23] PARK O, LEE S, PARK T,et al. Enzyme-catalyzed preparation of methyl (R)-N-(2,6-dimethylphenyl) alaninate: a key intermediate for (R)-metalaxyl[J]. Tetrahedron: Asymmetry, 2005, 16(6):1221-1225.
[24] 黄丽琴, 陈道文, 杨红. 酶法拆分(±)-N-(2,6-二甲苯基)-丙氨酸甲酯[J]. 有机化学, 2005, 25(12): 1575-1579.HUANG L Q, CHEN D W, YANG H. Enzymatic resolution of methyl(±)-N-(2,6-dimethylphenyl) alanine[J]. Chinese Journal of Organic Chemistry, 2005, 25(12): 1575-1579.
[25] 黄丽琴, 杨红. (±)-N-(2,6-二甲苯基)-丙氨酸甲酯的脂肪酶酶促水解拆分方法[J]. 南京农业大学学报, 2007, 30(4): 135-139.HUANG L Q, YANG H. The lipase catalyzed reaction of methyl(±)-N-(2, 6-dimethylphenyl) alanine and determination of conversion[J]. Journal of Nanjing Agricultural University, 2007, 30(4):135-139.
[26] 王岩. 精甲霜灵的合成研究[D]. 长春: 吉林大学, 2008.WANG Y. Study on the synthesis ofR-metalaxyl [D]. Changchun:Jilin University, 2008.
[27] 王世辉. 微胶囊法固定脂肪酶及拆分手性胺的研究[D]. 长春:吉林大学, 2010.WANG S H. Study on the immobilization of lipase by micro capsule and resolution chiral amine[D]. Changchun: Jilin University, 2010.
[28] 郑良玉. 脂肪酶催化拆分N取代苯基α-氨基丙酸的研究[D]. 长春:吉林大学, 2004.ZHENG L Y. Study on lipase-catalyzed resolution ofN-substituted phenyl α-alanine[D]. Changchun: Jilin University, 2004.
[29] PARK O, LEE S. Stereoselective lipases fromBurkholderiasp.,cloning and their application to preparation of methyl(R)-N-(2,6-dimethylphenyl) alaninate, a key intermediate for(R)-metalaxyl[J]. Journal of Biotechnology, 2005, 120(2):174-182.
[30] PARK O, LEE S, PARK T,et al. Development of a scalable process for a key intermediate of (R)-metalaxyl by enzymatic kinetic resolution [J]. Organic Process Research & Development, 2006, 10(3):588-591.
[31] ZHANG X X, XIA T T, CHEN J W,et al.Direct chiral resolution of metalaxyl and metabolite metalaxyl acid in aged mobile phases:the role of trace water[J]. J. Agric. Food Chem., 2010, 58:5004-5010.
date:2017-04-13.
ZHANG Zhaohui, zzh@zjut.edu.cn
supported by the National Natural Science Foundation of China (31601390).
Production ofR-metalaxyl by resolution of racemic metalaxyl using biocatalyst
ZHANG Zhaohui, ZHANG Likun, LU Yuele
(College of Biological Engineering,Zhejiang University of Technology,Hangzhou310014,Zhejiang,China)
A Gram-negative bacterium was isolated from the soil and sludge samples, which had high activity for enantioselective hydrolysis of (R,S)-metalaxyl. The strain was identified asAlbibactersby 16S rDNA sequence analysis. It was namedAlbibacterssp.zjut528. At 37℃, 15 g·L-1of the wet cells (81% water content) catalyzed the hydrolysis of (R,S)-metalaxyl at the concentration of 50 g·L-1for 28h, the yield reached 47.1% and the main product wasR-metalaxyl acid witheep> 99.9%. In order to isolate its intracellular esterase, the cells were disrupted by ultrasonic. After centrifugation, the supernatant was treated by ammonium sulfate precipitation,followed by ion-exchange chromatography and gel filtration chromatography. A SDS-PAGE electrophoresis-pure esterase protein was obtained with a molecular mass of about 40×103. Its N-terminal amino acid sequence was determined as NH2-Ala-Ala -Lys-Ala-Pro-Leu-Arg-Leu-Lys-Glu. Its optimum catalytic temperature and pH were 40℃ and 9.0, respectively. The enzyme was stable at 20—40℃ and pH 5.0—10.0. 0.2 mmol·L-1of Fe2+, Mn2+,Zn2+can improve its activity, but Fe3+inhibited it. Its activity was highly improved when some organic solvents,such as acetonitrile, isopropanol, acetone, isopropyl ether, cyclohexane andn-hexane, were added at the concentration of 20% (vol). The Michaelis-Menten kinetics parameters for the enzyme wereVm=0.18 mmol·L-1·min-1,Km=2.29 mmol·L-1andKcat=0.85 min-1. A new process for producingR-matalaxyl fromR,S-matalaxyl was established by usingAlbibacterssp.zjut528 cells as the catalyst. First, the cells catalyzed enantioeletive hydrolysis of (R,S)-matalaxyl to produceR-metalaxyl. After reaction, theR-metalaxyl acid and the unreactedS-matalaxyl were separated by extraction.R-Metalaxy acid was esterified with methanol to produceR-metalaxyl. Followed by some separation steps, the final product ofR-metalaxy was obtained. Its purity was 96.2% andeevalue was 99.3%. The unreactedS-metalaxyl can be reused by racemization. After heated for 6 h at 60℃, itseevalue reduced from 99.4% to 4.2%.
biocatalysis; bioprocess; hydrolysis;R,S-metalaxyl;R-metalaxyl; strain screening and identification;esterase;Albibacters
Q 814
A
0438—1157(2017)11—4229—10
10.11949/j.issn.0438-1157.20170398
2017-04-13收到初稿,2017-08-17收到修改稿。
联系人及第一作者:张朝晖(1968—),男,博士,副教授。
国家自然科学基金青年基金项目(31601390)。
