桑叶黄酮类和生物碱类成分在正常和糖尿病大鼠体内的药代动力学研究
2017-11-17张立雯季涛宿树兰尚尔鑫郭盛郭建明钱大玮段金廒
张立雯 季涛 宿树兰 尚尔鑫 郭盛 郭建明 钱大玮 段金廒

[摘要]采用UPLCTQMS同時测定糖尿病模型大鼠和空白大鼠血浆中芦丁、异槲皮苷、紫云英苷、山柰酚、槲皮素、绿原酸、隐绿原酸、新绿原酸、DNJ、fagomine 10种有效成分,并计算其在大鼠体内药动学参数,以阐明桑叶黄酮类及生物碱类在正常和糖尿病模型大鼠体内的药代动力学特征。以高糖高脂饲料结合尾静脉注射四氧嘧啶的方法复制糖尿病模型,大鼠灌胃给予桑叶黄酮类及生物碱类成分的提取物后不同时间点取血浆,血浆样品经乙腈沉淀蛋白,以UPLCTQMS测定血浆中桑叶10种成分的血药浓度,采用DAS 20软件计算药动学参数。结果显示,槲皮素和山柰酚灌胃0333 h达到峰值,说明大鼠口服桑叶黄酮类成分后吸收和分布较为迅速;服药后4 h,两者第2次达到峰浓度,说明其在肠道内的停留时间较长;DNJ和fagomine在胃肠道能较快地吸收入血,血药浓度在0667 h达到峰值,提示两者进入大鼠体循环后可快速分布。在模型组大鼠体内新绿原酸、隐绿原酸、槲皮素、山柰酚、芦丁的Cmax和AUC0–t降低,新绿原酸、隐绿原酸t1/2缩短,而槲皮素、山柰酚、芦丁的t1/2延长;绿原酸、紫云英苷、异槲皮苷、fagomine在模型动物体内Cmax升高,紫云英苷、fagomine的t1/2延长,提示在正常生理状态与模型病理状态下机体对药物有效成分的吸收存在一定的差异。
[关键词]桑叶; 黄酮类; 生物碱类; 糖尿病; 药动学
[Abstract]To study the pharmacokinetic effect of Mori Folium flavones and alkaloids in normal and diabetic rats An UPLCTQMS method was developed for the simultaneous determination of rutin, isoquercitrin, astragalin, kaempferol, quercetin, chlorogenic acid, cryptochlorogenic acid, neochlorogenic acid, DNJ and fagomine in plasma of rats The diabetic rat model was induced through intravenous injection with alloxan and highfat diet Samples of plasma of rats were obtained at different time points, after the rats were administrated with Mori Folium flavones and alkaloids After the deproteinization with acetonitrile, the concentrations of Mori Foliam constituents in rats at different time points were detected by UPLCTQMS method, and pharmacokinetic parameters were calculated by DAS 20 software The results showed that quercetin and kaempferol reached peak at 0333 h, indicating that Mori Folium flavonoid constituents were absorbed and distributed quickly At about 4 h after administration, both of them reached the peak concentrations for the second time, suggesting that they stayed in intestine for a long time DNJ and fagomine in gastrointestinal tract can be quickly absorbed into blood, and the concentration in plasma reached peak after 0667 h, suggesting that both of them could be rapidly distributed in the systemic circulation of rats Cryptochlorogenic acid, neochlorogenic acid, quercetin, kaempferol and rutin were found to have a higher Cmax and AUC0t in normal rats than those in diabetic rats The t1/2values of cryptochlorogenic acid and neochlorogenic acid were shorter in diabetic rats, while quercetin, kaempferol and rutin had a longer t1/2value in diabetic rats Chlorogenic acid, astragalin, isoquercitrin, fagomine had a higher Cmax in diabetic rats, and the t1/2values of astragalin and fagomine were longer, which suggested differences in absorption of active ingredients under normal and diabetic conditions.endprint
[Key words]Mori Folium; flavones; alkaloids; diabetic; pharmacokinetic
糖尿病是一种由于胰岛素分泌下降或胰岛素抵抗而引起以糖代谢紊乱为主要特征的一类代谢性疾病,表现为高血糖和糖尿,糖尿病及其并发症已成为威胁人类健康主要疾病之一。桑叶为桑科Moraceae桑属植物桑Morus alba L的干燥叶,其性寒、味甘苦,是临床上治疗糖尿病的常用中药之一。现代研究表明,桑叶中主要的药效成分为生物碱类、黄酮类、多糖类成分[14]。其所含以1脱氧野尻霉素(DNJ)为主的生物碱类成分可通过与α葡萄糖苷酶上的位点结合,抑制酶水解体内二糖,延缓葡萄糖吸收,显著降低餐后血糖水平;桑叶黄酮则具有较显著的抗氧化作用,能够清除自由基保持胰岛β细胞的完整性以及抑制蛋白非酶糖基化作用等,从而防治糖尿病及其并发症[58]。
药物代谢动力学(pharmacokinetics,PK)是应用动力学的原理与数学处理方法,定量地描述药物通过各种给药途径进入机体后的吸收、分布、代谢和排泄等过程的动态变化规律,并提出解释这些动态规律的数学关系式的学科。它可定量地说明体内药物浓度与生物效应的关系、药物结构与药理作用的关系及药物代谢途径和作用机制等[9]。从药物代谢动力学角度对桑叶中多种成分在大鼠体内的体内代谢过程进行研究,可以直观地掌握其动态变化规律,对揭示其作用机制具有重要意义。本研究通过比较正常和糖尿病模型大鼠灌胃桑叶黄酮与生物碱组分后血浆中有效成分的药动学特征,以期为阐明桑叶防治糖尿病及其并发症的作用机制提供科学依据。
1材料
11动物SPF级SD大鼠50只,雄性,体质量220~250 g,由南京中医药大学动物中心提供,合格证号SCXK(苏)20140001。大鼠分笼饲养,置于温度(25±2) ℃、湿度50%~60%的饲养室,每日光照8 h,饮水为高温灭菌水,饲料为常规饲料,动物均自由饮水、进食。
12试药及仪器乙腈(色谱纯,Tedia);甲酸(色谱纯,Merck);亮氨酸脑啡肽购自美国Sigma公司;超纯水(自制,过022 μm滤膜);甲醇(色谱纯,江苏汉邦科技有限公司);枸橼酸钠(天津市生物化学制药厂),其余试剂均为分析纯。芦丁(批号LGNR5N9L,纯度≥98%)、异槲皮苷(批号Y076120325)、紫云英苷(批号Z020120312)、绿原酸(批号110753201314)、新绿原酸(批号MUST14043010)、隐绿原酸(批号MUST14041410)、DNJ(批号T021120611)、内标克拉霉素对照品(批号130356200403)均购自中国食品药品检定研究院。桑叶黄酮提取物、桑叶生物碱提取物均由实验室自制[10]。
Waters UPLC AcquityTM系统;BEH C18色谱柱(21 mm×50 mm,17 μm);Xevo TMTQ 质谱仪(美国Waters公司),配有 ESI 离子源和MassLynx 41质谱工作站软件;EPED超纯水机(南京易普易达科技发展有限公司);Startorius BT1250电子天平(赛多利斯科学仪器北京有限公司);TDL240B离心机(上海安亭科学仪器厂)。
2方法
21造模方法大鼠随机分为对照组20只、糖尿病模型组30只。正常对照组大鼠普通饲料喂养,模型组大鼠以高糖高脂饲料(为普通饲料基础上添加10%猪油、10%蔗糖、5%蛋黄粉和05%胆固醇)喂养。喂养6周后,模型组尾静脉注射四氧嘧啶,对照组注射等剂量的生理盐水作为对照。1周后检测造模组大鼠空腹血糖(FBG)水平,FBG≥100 mmol·L-1,表明造模成功。
22血浆样本收集将造模成功大鼠随机分为2组。实验前1天禁食12 h,不禁水,给药8 h后统一进食。将桑叶生物碱1025 mg、黄酮3348 mg溶解在5 mL水中,按01 mL/100 g灌胃给药。芦丁、异槲皮苷、紫云英苷、山柰酚、槲皮素、绿原酸、隐绿原酸、新绿原酸的给药剂量依次为1852,415,708,768,463,2612,3334,2144 mg·kg-1,DNJ,fagomine的给药剂量分别为6454,968 mg·kg-1。给药后于5,10,20,40 min及1,2,4,6,8,10,12 h取血1 mL,置于肝素钠抗凝管中,3 500 r·min-1离心15 min,分离血浆,-80 ℃冷冻保存。
23血浆样品处理精密吸取200 μL血浆样品,依次加入内标克拉霉素工作液 10 μL、甲醇600 μL,涡旋2 min,13 000 r·min-1离心10 min,吸取上清液在37 ℃水浴上氮气吹干。残渣用200 μL流动相复溶,涡旋2 min,13 000 r·min-1离心10 min后,取上清用于分析。
24对照品溶液的配制取蘆丁、异槲皮苷、紫云英苷、山柰酚、槲皮素、绿原酸、隐绿原酸、新绿原酸、DNJ、fagomine对照品适量,精密称量,用80%甲醇溶解配制成储备溶液。取上述储备液适量,置于10 mL量瓶中,加80%甲醇稀释至刻度,配制成混合对照品溶液,将上述混合对照品溶液稀释成不同质量浓度:芦丁0145~145 μg·L-1、异槲皮苷0082~820 μg·L-1、紫云英苷0075~149 μg·L-1、山柰酚0063~126 μg·L-1、槲皮素0329~160 μg·L-1、绿原酸0007~145 μg·L-1、隐绿原酸 0142~142 μg·L-1、新绿原酸0164~82 μg·L-1、DNJ 0016~82 μg·L-1、fagomine 0018~86 μg·L-1;取内标克拉霉素和氯霉素适量,精密称量后80%甲醇溶解配制成不同质量浓度的内标工作液。
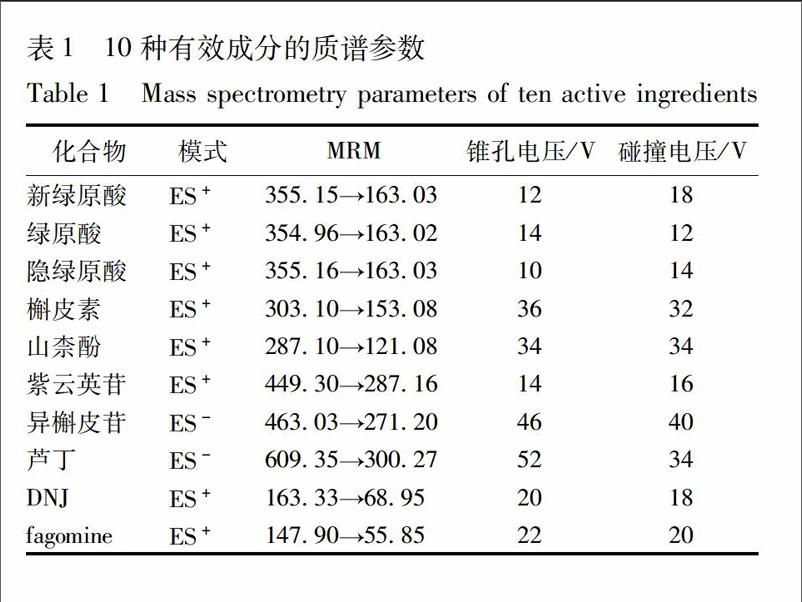
25液相色谱和质谱条件黄酮类成分分析色谱条件:流动相A为01%甲酸水溶液,流动相B为乙腈溶液。梯度洗脱:0~1 min,95%A;1~15 min,95%~93%A;15~5 min,93%A;5~55 min,93%~85%A;55~11 min,85%A;11~12 min,85%~5%A;12~13 min,5%A;13~14 min,5%~95%A。生物碱类成分分析色谱条件:流动相A为5 mmol·L-1甲酸铵+5 mmol·L-1乙酸铵+02%甲酸水溶液,流动相B为乙腈溶液。梯度洗脱:0~4 min,10%~22%A;4~9 min,22%~30%A;9~12 min,30%~5%A;12~13 min,5%~10%A。柱温35 ℃,流速04 mL· min-1,进样量5 μL。质谱条件:离子源ESI源;检测方式为正、负离子检测;扫描方式为多反应监测(MRM)。毛细管电压30 kV,离子源温度150 ℃,脱溶剂气温度550 ℃,锥孔电压30 V。数据处理采用Masslynx及DAS 20软件。各成分的质谱参数见表1。endprint
26方法学考察对所建的方法进行专属性实验、标准曲线与定量限、精密度与准确度、提取回收率与基质效应、稳定性考察。
3结果
31专属性考察取空白血浆、空白血浆加混合对照品和大鼠给药1 h后的血浆样品,按23项下方法处理后进行UPLCTQMS检测,考察方法的专属性。实验结果表明,空白血浆中的内源性物质对芦丁、异槲皮苷、紫云英苷、山柰酚、槲皮素、绿原酸、隐绿原酸、新绿原酸、DNJ、fagomine及内标克拉霉素的测定不会造成干扰,方法专属性良好。各成分典型MRM色谱图见图1。
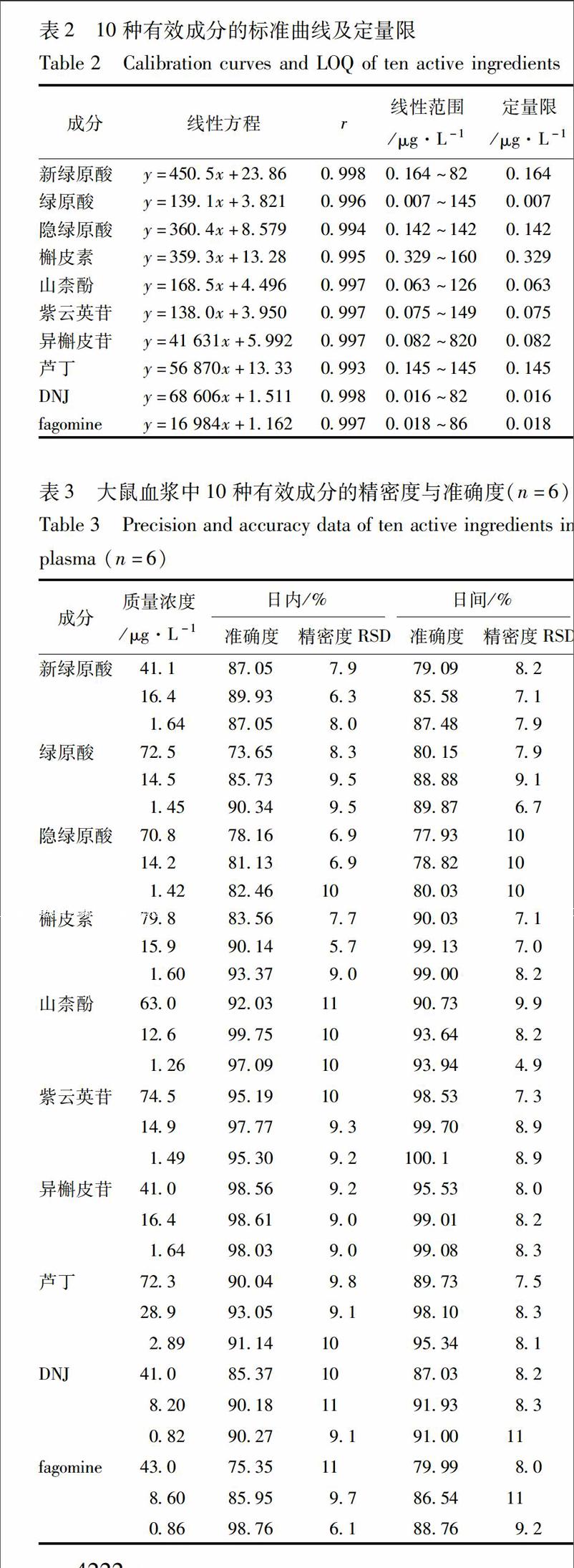
32标准曲线与定量限取空白血浆120 μL,加入不同质量浓度的混合对照品溶液30 μL,按23项下方法处理后进行UPLCTQMS检测,以被测化合物与内标的峰面积之比(y)与质量浓度(x)进行线性回归,得回归方程,同时按信噪比(S/N)=10计算被测化合物的定量限,见表2。
33精密度与准确度考察取空白血浆120 μL,加入不同质量浓度混合对照品溶液30 μL,配制成高、中、低浓度的质控样品,按样品处理方法处理后进行UPLCTQMS检测,每个浓度进行6样本分析,结果进行方差分析,考察方法的精密度与准确度,见表3。
34提取回收率与基质效应取空白血浆120
A空白血浆;B空白血浆中加入对照品和内标;C大鼠灌胃1h后血浆样品;1芦丁;2异槲皮苷;3氯霉素(黄酮类内标);4克拉霉素(黄酮类内标);5紫云英苷;6新绿原酸;7隐绿原酸;8绿原酸;9槲皮素;10山柰酚;11氯霉素(生物碱类内标);12克拉霉素(生物碱类内标);13DNJ;14fagomine。
μL,加入不同质量浓度的混合对照品溶液30 μL,配制成各成分高、中、低质控样品,按样品处理方法处理后进行UPLCTQMS检测,记录峰面积;此外取空白血浆150 μL,沉淀蛋白后复溶用含有相同质量浓度的混合对照品的流动相,进样并记录峰面积。以2次峰面积之比计算提取回收率。
取空白血浆150 μL,沉淀蛋白吹干后用含低、中、高浓度混合对照品的流动相复溶,检测并记录峰面积;复溶用流动相直接进样,进样并记录相应的峰面积。以2次峰面积之比考察基质效应,見表4。
35稳定性考察考察各成分的高、中、低质量浓度质控样品在不同条件下的稳定性(n=5)。结果显示,样品在室温条件下放置12 h(RE-523%~813%)、冷藏条件4 ℃放置24 h(RE-1032%~98%),稳定性良好。样品冻融3次后仍能保持稳定(RE-125%~66%),在-80 ℃保存20 d后稳定性良好(RE-135%~952%)。
36药时曲线样品检测后记录相应数据,代入当天的标准曲线计算血药浓度,绘制平均血药浓度时间曲线,见图2。从图2可知,与空白组相比,模型组大鼠灌胃桑叶黄酮类组分后,3个酚酸成分的药时曲线均不同。其中模型组大鼠新绿原酸与隐绿原酸的最大血药浓度高于空白组,两者的达峰时间比空白组短;绿原酸在空白组的峰值比模型组高,两者的达峰时间无显著性差异。5个黄酮类成分槲皮素、山柰酚、紫云英苷、异槲皮苷、芦丁在空白组的最大血药浓度均高于模型组,其中槲皮素与山柰酚2种成分出现双峰现象。桑叶生物碱类成分DNJ和fagomine在空白组的最大血药浓度与模型组相比无显著性差异。
37主要药代动力学参数用DAS 20软件对空白组与模型组大鼠血药浓度数据进行智能化分析,采用非房室模型方法计算统计矩参数,主要的药动学参数见表5。其中,Cmax为最大血药浓度,tmax为药物达到最高血药浓度的达峰时间,AUC0–t为吸收相对数量,三者均为药物吸收进入血液循环的指标;t1/2为药物在体内分布达到平衡后,血药浓度消除一半所需的时间,即消除半衰期,是表达药物在体内消除快慢的重要参数,能够反映消除器官功能的变化,与人体的病理/生理状态有关;CL/F为单位时间内清除药物的总量与当时血浆药物浓度的比值,即药物的清除率。
结果表明,在模型组大鼠体内新绿原酸、隐绿原酸、槲皮素、山柰酚、芦丁的Cmax降低,AUC0–t亦降低;新绿原酸、隐绿原酸t1/2缩短,而槲皮素、山柰酚、芦丁t1/2延长;绿原酸、紫云英苷、异槲皮苷、fagomine在模型动物体内Cmax升高,紫云英苷、fagomine的t1/2延长,提示在正常生理状态和模型病理状态下机体对药物有效成分的吸收产生变化,糖尿病状态下有机酸类成分更容易快速吸收,生物碱类成分DNJ变化不明显,而fagomine显示出更容易吸收,其Cmax和AUC0–t均高于正常组,且在机体内停留时间
4讨论
应用UPLCTQMS法建立了同时测定大鼠灌胃桑叶生物碱与黄酮后血浆中10种有效成分的定量分析方法,并且计算了其在正常及糖尿病模型大鼠体内的药动学参数。结果显示,槲皮素和山柰酚灌胃0333 h后达到峰值,说明大鼠口服桑叶黄酮组分后吸收和分布迅速。灌胃4 h左右后,2种成分血药浓度第2次达到峰值,表明其在肠道内的代谢时间较长,可能为存在肝肠循环,导致血药浓度的再次升高,这与之前的研究报道一致[1113]。双峰现象的出现,说明槲皮素和山柰酚2种成分在肠道内存在重吸收现象。血浆中两者的第1个吸收高峰出现可能为桑叶黄酮组分中原始的葡糖苷酸,而其半衰期消除时间较长可能是存在肝肠循环所致。但由于桑叶黄酮组分含多种成分,它们之间的相互作用可能会使其吸收、分布、代谢等转运环节发生变化。
大鼠灌胃桑叶生物碱组分后,DNJ和fagomine在胃肠道能较快地吸收入血,血药浓度在0667 h即达峰值,说明两者进入大鼠体循环后可快速分布并发挥药效,随后快速从体内消除;6 h时两者的血药浓度约为峰浓度的1/20,提示两者不易在体内蓄积,这与文献报道的DNJ的体内过程基本一致[1416]。
此外,糖尿病大鼠的药代动力学参数与正常大鼠存在差异。在糖尿病大鼠口服桑叶黄酮组分后,有机酸类成分容易快速吸收;生物碱类成分中DNJ无明显变化,而fagomine更易吸收,且在机体内停留时间长于正常组,更有利于疾病的治疗。由此可见,糖尿病状态可以使机体对药物有效成分的吸收产生影响,其原因可能是相关的药物代谢酶和药物转运蛋白的功能和表达发生改变,从而导致糖尿病模型大鼠药代动力学行为的改变[1718]。根据以上特性可为探求桑叶有效成分的吸收规律提供依据,为桑叶在糖尿病治疗领域的开发及临床应用提供指导。endprint
[参考文献]
[1]Zhang Y, Ren C, Lu G, et al. Antidiabetic effect of mulberry leaf polysaccharide by inhibiting pancreatic islet cell apoptosis and ameliorating insulin secretory capacity in diabetic rats [J]. Int Immunopharmacol, 2014, 22(1):248.
[2]Li Y, Ji D, Zhong S, et al. Hypoglycemic effect of deoxynojirimycinpolysaccharide on high fat diet and streptozotocininduced diabetic mice via regulation of hepatic glucose metabolism[J]. Chem Biol Interact, 2015, 225:70.
[3]Liu C, Xiang W, Yu Y, et al. Comparative analysis of 1deoxynojirimycin contribution degree to αglucosidase inhibitory activity and physiological distribution in Morus alba L[J]. Ind Crop Prod, 2015, 70:309.
[4]Ma D, Jiang Z, Xu S, et al. Effects of flavonoids in Morus indica on bood lipids and glucose in hyperlipidemiadiabetic rats[J]. Chin Herb Med, 2012, 4(4):314.
[5]原爱红, 马骏, 蒋晓峰, 等 桑叶中糖苷酶抑制活性组分的筛选[J]. 中国中药杂志, 2006, 31(3):223.
[6]Shang Q, Xiang J F, Tang Y L Screening αglucosidase inhibitors from mulberry extracts via DOSY and relaxationedited NNR[J]. Talanta, 2012, 97:362.
[7]Young R K, Jong S L, Ki R L, et al. Effects of mulberry ethanol extracts on hydrogen peroxideinduced oxidative stress in pancreatic βcells[J]. Int J Mol Med, 2014, 33(1):128.
[8]Jarinyaporn N, Patchareewan P, Veerapol K, et al. Antihyperglycemic, antioxidant and antiglycation activities of mulberry leaf extract in streptozotocininduced chronic diabetic rats[J]. Plant Foods Hum Nutr, 2009, 64(2):116.
[9]Ieiri I Pharmacokinetics and pharmacodynamics of antidiabetic drugsfrom the viewpoints of drug transporters and metabolic enzymes[J]. Nihon Rinsho, 2015, 73(3):358.
[10]季濤, 张丽丽, 黄晓晨, 等 基于代谢组学的桑叶多组分治疗糖尿病的作用机制研究[J]. 药学学报, 2015(7):830.
[11]Crespy V, Morand C, Manach C, et al. Part of quercetin absorbed in the small intestine is conjugated and further secreted in the intestinal lumen[J]. Am J Physiol, 1999, 277(1):G120.
[12]李芳, 杨培民, 曹广尚 白花蛇舌草黄酮类成分大鼠在体肠吸收研究[J]. 中草药, 2015(2):240.
[13]田杨, 蒋学华, 于佳, 等 山柰酚大鼠在体肠吸收研究[J]. 四川大学学报:医学版, 2008(3):503.
[14]Nakagawa K, Kubota H, Kimura T, et al. Occurrence of orally administered mulberry 1deoxynojirimycin in rat plasma[J]. J Agric Food Chem, 2007, 55(22):8928.
[15]Kim J Y, Kwon H J, Jung J Y, et al. Comparison of absorption of 1deoxynojirimycin from mulberry water extract in rats[J]. J Agric Food Chem, 2010, 58(11):6666.
[16]曹旭, 欧阳臻, 赵明, 等 桑叶总生物碱中1脱氧野尻霉素在大鼠体内的药物动力学研究[J]. 中药新药与临床药理, 2012(4):449.
[17]He M Y, Deng Y X, Shi Q Z,et al. Comparative pharmacokinetic investigation on baicalin and wogonoside in type 2 diabetic and normal rats after oral administration of traditional Chinese medicine Huanglian Jiedu decoction[J]. J Ethnopharmacol, 2014, 155:334.
[18]巩仔鹏, 陈颖, 张瑞杰, 等 疾病状态下的中药药代动力学研究进展[J]. 中国中药杂志, 2015, 40(2):169
[责任编辑张燕]endprint
