甘蔗ASR基因克隆及水分胁迫下的表达分析
2017-11-16梁潘霞李长宁黄太庆江泽普李杨瑞
梁潘霞,邢 颖,廖 青,黄 杏 ,李长宁,黄太庆,江泽普,李杨瑞*
(1.广西农业科学院资源与环境研究所,广西 南宁 530007;2.中国农业科学院甘蔗研究中心/农业部广西甘蔗生物技术与遗传改良重点实验室/广西甘蔗遗传改良重点实验室,广西 南宁 530007)
甘蔗ASR基因克隆及水分胁迫下的表达分析
梁潘霞1,邢 颖1,廖 青1,黄 杏2,李长宁2,黄太庆1,江泽普1,李杨瑞2*
(1.广西农业科学院资源与环境研究所,广西 南宁 530007;2.中国农业科学院甘蔗研究中心/农业部广西甘蔗生物技术与遗传改良重点实验室/广西甘蔗遗传改良重点实验室,广西 南宁 530007)
【目的】克隆甘蔗ASR(ABA-stress-ripening)基因的序列并检测其在干旱胁迫下的表达量,为甘蔗抗逆胁迫机制的研究提供实验依据。【方法】以甘蔗叶片总 RNA 为模板,通过 RT-PCR 扩增ASR基因的 cDNA,采用生物信息学软件分析所克隆基因的编码蛋白特性,并用荧光定量PCR分析该基因的表达情况。【结果】克隆得到的 cDNA 片段长度为402 bp,编码133个氨基酸,命名为SoASR1(GenBank登录号:JQ712581)。同源性分析表明,SoASR1 基因在12种植物中的一致性为56 % ~ 99 %。实时荧光定量分析结果表明,随着甘蔗干旱胁迫时间的延长,SoASR1基因表达量先升高后下降,干旱胁迫加硅处理的甘蔗叶片SoASR1基因表达量峰值比干旱处理提前34 h出现。【结论】克隆获得甘蔗SoASR1基因,SoASR1基因受到干旱胁迫的诱导表达,在转录水平上参与了甘蔗抗干旱胁迫反应,可作为候选基因用于甘蔗抗旱机制研究。施硅能进一步提高甘蔗抗旱性。
甘蔗;干旱胁迫;ASR基因
【研究意义】甘蔗是我国重要的经济作物和生物能源作物,甘蔗生产在我国农村经济发展和农民增收等方面扮演极其重要的角色。但近年极端气候(如干旱、寒害)的频发,对甘蔗产量和品质造成了严重影响,使甘蔗和制糖工业生产遭受巨大损失。ASR基因在植物对逆境的适应过程中起重要的保护作用,可以提高植物对干旱的耐胁迫能力。因此,对甘蔗ASR基因进行克隆和表达分析,对研究其在甘蔗抗旱中的调控机制具有重要意义。【前人研究进展】Jha 等[1]研究表明,盐角草在0.25 mol/L NaCl处理12 h后ASR基因表达量达到峰值,表明ASR蛋白的表达具有提高盐角草细胞抗逆的能力。Frankel等[2]研究表明,番茄叶片的Asr1基因在干旱条件下大量表达,从而提高其抗旱性。Maskin等[3]发现,番茄受到水分胁迫后,在叶片中被诱导表达的是ASR1和ASR2基因,ASR3基因的表达量变化不大,在根中仅有ASR2被诱导表达。González等[4]研究发现,在水分胁迫下番茄叶片中ASR1基因甲基化位点数量减少,内含子区域发生了去甲基化作用,这可能是ASR1基因表达量在水分胁迫下增加的重要原因。Wang等[5]在百合花粉中克隆到的ASR基因LLA23,在干旱胁迫下受到诱导。【本研究切入点】目前已从玉米[6]、水稻[7]、番茄[8]、葡萄[9]、大豆[10]等植物中克隆出了相关的ASR蛋白,但还未见甘蔗ASR基因的克隆和甘蔗在PEG胁迫下表达的研究报道。【拟解决的关键问题】克隆甘蔗ASR基因,通过荧光定量技术初步探明ASR基因在甘蔗干旱胁迫下的表达情况,为揭示甘蔗ASR基因基因抗旱调控机制打下基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 选取新台糖22号(ROC22)为研究材料,沙培幼苗长至2~3片真叶后,选取长势健壮且生长一致的幼苗,转移到不透光的塑料箱中,每箱装有25 L硅浓度为1.7 mM的1/2 Hoagland营养液(营养液pH用H2SO4稀溶液调至5.8)。当幼苗在含硅的1/2 Hoagland营养液中生长至5~6片真叶时,加入200 g/L的PEG-6000进行模拟干旱胁迫(Si+PEG)。以不加硅的1/2 Hoagland营养液培养的苗进行模拟干旱处理设为PEG,没有硅和模拟干旱胁迫的为对照(CK),分别在模拟干旱处理0、18、30、40、64、96、144 h取样(+1叶),将采好的样品立即保存于-80 ℃冰箱备用。
1.1.2 菌株与试剂 大肠杆菌DH5α与BL21、pMD18-T 载体(TaKaRa)、凝胶回收试剂盒购自Bioer 公司; M-MLV逆转录酶购自TaKaRa 宝生物工程有限公司(中国大连)公司,dNTP、TaqDNA 聚合酶、硅酸钠购自上海生工,Trizol购自Invitrogen公司。
1.2 方法
1.2.1 总RNA 提取及cDNA 合成 提取甘蔗叶片总RNA,具体参照Invitrogen公司的Trizol说明书,cDNA 合成用M-MLV 逆转录酶,逆转录引物为Oligo (dT) 18:5'-GGCCACGCGTCG ACTAGTAC(T)18-3′,具体步骤按说明书进行,完成后取5 μl PCR 产物用1 %琼脂糖凝胶电泳检查并用紫外分光光度计检测cDNA 浓度,最后将各处理cDNA 浓度稀释至同一浓度。
1.2.2ASR基因的克隆 以Genbank数据库中已知的高粱、玉米、水稻、小麦等植物ASR基因的核酸序列为参照,利用DNAMAN 软件在基因起始密码子位置设计ASR基因上游简并引物ASR-F: 5′- ATGGCGGAGGAGAAGCACCACCA -3′,ASR-R: 5′- GCCGAAGAAGTGGTGCTTCTTCT -3′。
扩增甘蔗ASR基因的PCR体系为25 μl,模板以不同处理的cDNA 等量混合样。PCR扩增参数为:95 ℃ 5 min;95 ℃ 40 s;58 ℃ 45 s;72 ℃ 2 min共35个循环;72 ℃延伸10 min。PCR结束后加2 μl核酸染料混匀后经1.5 %的琼脂糖凝胶电泳检测,检测条带大小正确后,回收纯化目的条带,连接到pMD18-T载体,热激转化感受态细胞大肠杆菌DH5α,通过蓝白斑筛选挑取白色菌落,经菌液PCR验证为阳性克隆子后送上海生工测序,测序结果经拼接后在NCBI 上BLAST 比对。
1.2.3ASR基因生物信息学分析 用BioXM 2.6软件推导该基因氨基酸序列,在NCBI的BLAST上进行相似性比对;Clustalx软件进行多重序列比对;MEGA 6.0软件构建进化树;在线网站(http://isoelectric.ovh.org/)预测甘蔗ASR的蛋白质分子量和等电点;用WoLF PSORT在线软件对该基因进行亚细胞定位;用SOSUI signal软件预测基因的信号肽;ExPASy Proteomics Server预测蛋白质的亲水性和跨膜结构;SOPMA软件预测基因的二级结构。
1.2.4ASR基因的表达分析 根据获得的甘蔗ASR基因的开放阅读框序列设计实时荧光定量引物ASRQ-F: 5′- GAGTACACGGAGACCACGGT -3′、ASRQ-R: 5′- TGCCTCGTGCTTCTCGTAG -3′;以甘蔗管家基因 25S作内参,设计内参引物25S-F: 5′- GCAGCCAAGCGTTCATAGC -3′、25S-R: 5′- CCAGC TCACGTTCCCTATTG -3′,实时荧光定量PCR在ABI Stepone plus型荧光定量PCR仪上进行,PCR反应体系为20 μl,具体方法参照天根公司荧光定量试剂盒Real Master Mix(SYBR Green Ⅰ)说明书。PCR扩增参数为95 ℃ 10 min;95 ℃ 15s;60 ℃ 1 min;72 ℃延伸30 s共40个循环,所有样品在同一台PCR仪上进行扩增,每个样品重复3次,根据荧光PCR扩增CT值,按照 2-ΔΔCt法计算出基因相表达量。

M: DL2000 marker; 1:基因cDNA全长扩增结果;2: 菌液PCRM: DL2000 marker; 1: PCR product of the full-length cDNA of SoASR1 gene; 2: Bacteria liquid PCR图1 甘蔗 SoASR1序列扩增结果Fig.1 PCR product of SoASR1 gene from sugarcane
2 结果与分析
2.1 ASR基因全长cDNA克隆
以甘蔗叶片第1 链cDNA 为模板,用ASR上、下游引物进行PCR扩增,产物用琼脂糖凝胶电泳检测,结果显示,从cDNA 中扩增得到长约400 多bp 的条带,对目的条带回收,连接转化,测序得到基因全长。对得到的序列通过GenBank Blast搜索比对,显示结果为干旱诱导蛋白(ASR)。该序列包含启始密码子ATG 和终止密码子TGA,为ASR基因全长序列,命名为SoASR1(GenBank 登录号:JQ712581)。该基因cDNA包含一个402 bp的完整开放阅读框,编码133 个氨基酸(图1)。
2.2 SoASR1基因生物信息学分析
用在线网站(http://isoelectric.ovh.org/)预测SoASR1基因所编码的氨基酸序列的蛋白分子量为15.10 kD,等电点为6.32。SoASR1亚细胞定位于细胞核。SOSUIsignal 软件预测SoASR1的信号肽,显示该基因不含信号肽,为可溶性蛋白。采用 ExPASy 数据库工具分析甘蔗 SoASR1疏水性,其预测最小值为-3.61,最大值为2.19,最高值位于氨基酸序列第67处,最低值位于氨基酸序列第50、51、114处;SoASR1没有跨膜区域。在氨基酸组成中,部分氨基酸使用频率较高,如谷氨酸、组氨酸、丙氨酸分别占总氨基酸的18.05 %、14.29 %和14.29 %,一些出现频率则较低,如蛋氨酸、精氨酸均仅占0.75 %。利用SOPMA 软件完整地预测SoASR1的二级结构,结果显示:共出现4种构象,总数为69个。其中,α-螺旋占51.88 %;随机卷曲38个,占28.57 %;延伸链占9.02 %;β-转角14个,只占10.53 %。

图2 5种植物SoASR1氨基酸序列多重比对Fig.2 Multialignment of amino acid of the SoASR1 isolated from five plants
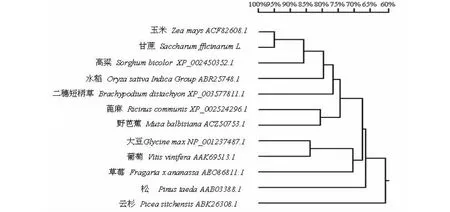
图3 甘蔗SoASR1基因与其它物种的同源性分析Fig.3 Homology analysis of predicted amino acid sequences of SoASR1 gene from sugarcane compared with other plant species
另外SoASR1序列没有糖基化位点,有1个丝氨酸、3个酪氨酸和3个苏氨酸磷酸化位点。用SMART 和Motif Scan 软件对SoASR1的蛋白质功能结构域进行分析,结果显示:36~39、122~125 为酪蛋白激酶Ⅱ磷酸化位点,62~67 为N端豆蔻酰基化位点,6~13为富含组氨酸区,61~105为富含丙氨酸区,43~122 为水分胁迫诱导蛋白活性位点。
利用NCBI Blast 检索甘蔗SoASR1基因核苷酸序列和编码氨基酸序列同源的物种,用MEGA6 软件构建SoASR1蛋白基因氨基酸序列进化树(图3)。甘蔗SoASR1基因与其它物种的核苷酸序列的同源性在77 %~96 %,其中与二穗短柄草的同源性最低为77 %,与高粱最高为96 %,其次是玉米92 %。SoASR1基因氨基酸序列与其它物种相比同源在56 %~99 %,其中与云杉的同源性最低为56 %,和玉米的同源性最高为93 %。从图3可以看出,聚云杉SoASR1与甘蔗的距离较远,甘蔗SoASR1与玉米的聚为一类。
2.3 SoASR1基因在干旱胁迫下表达量分析
以甘蔗管家基因 25S作为内参,利用荧光定量技术分析了SoASR1 基因在甘蔗不同处理干旱胁迫下叶中的转录水平。由图4可知,随着胁迫时间的延长,2个处理的SoASR1基因表达均呈先升高后降低的趋势。在PEG处理中,SoASR1基因的表达随胁迫时间逐渐缓慢上升,至第64小时达到峰值,是对照的40倍;PEG加Si处理中,在18 h时SoASR1基因的表达急剧上升,是对照的65倍,在30 h达到最大值,是对照的71倍;在处理后的18、30、40、64、96和144 h, PEG加Si处理的SoASR1 基因表达量均比PEG高,在18和30 h分别是PEG处理的14.60和5.75倍,同一时间两处理之间该基因的表达量有显著差异。
3 讨 论
植物原来的一些蛋白的合成在逆境胁迫下(干旱、低温、盐渍等)被抑制,降低了体内总蛋白的合成速率,而与此同时又有一些新的蛋白质被合成,这就是干旱诱导蛋白。在不断对分子生物学理论与技术的深入探索、研究下,有报道指出一些编码干旱蛋白的基因和与逆境抗性相关的蛋白激酶已经被分离、测序,干旱诱导蛋白的研究已取得了较大的进展[11-13]。
本研究克隆出的SoASR1基因属于ABA/WDS induced protein family(ASR)蛋白家族成员,该基因cDNA包含1个402 bp的完整开放阅读框,编码133 个氨基酸。其为亲水性蛋白,富含谷氨酸、组氨酸等氨基酸。这与Gonzalez 等[14]和Li 等[15]的报道一致,由此推测SoASR1可能在干旱胁迫下通过降低水分流失而增强植物抗旱能力,这与水分胁迫导致细胞脱水的适应保护机制密切相关。同时SoASR1序列没有糖基化位点,有1个丝氨酸、3个酪氨酸和3个苏氨酸磷酸化位点,推测SoASR1基因通过其氨基酸序列中的磷酸化位点和酪蛋白激酶Ⅱ磷酸化位点进行蛋白磷酸化来介导信号转导,使蛋白激酶总活性提高来减少活性氧的生成,起到抗氧化防护作用[16]。
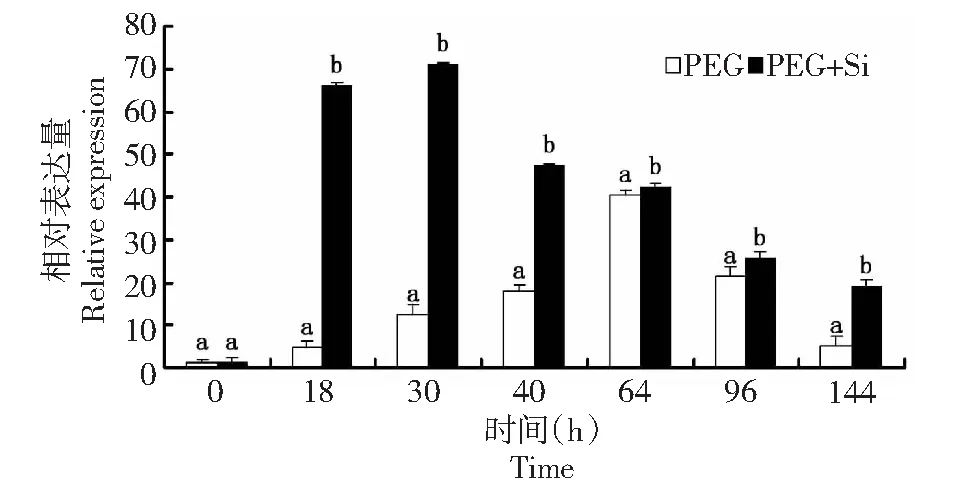
同一时间点内标有不同字母表示处理间在0.05水平上差异显著Datas followed by different lowercase letters are significantly different at the 0.05 probability level for the treatments in the same variety图4 荧光定量PCR 检测SoASR1基因在甘蔗水分胁迫中的表达Fig.4 Expression of SoASR1 gene in sugarcane under water stress detected by quantitative real-time PCR
本研究对甘蔗SoASR1基因在PEG和加硅处理下的转录水平进行了分析,结果显示,随着胁迫时间的延长,2处理SoASR1基因的表达均先升高后下降,且PEG+Si处理的表达量始终比PEG处理高。李妮亚等[17]研究发现,萌动的小麦种子在PEG-6000水分胁迫处理24 h后,所诱导产生的41.5 kD 蛋白含量随着水分胁迫时间延长而上升,在处理后48h时41.5 kD 蛋白含量达到最高峰,直至72 h后不再有改变,然而该41.5 kD 的蛋白在复水后消失,再进行水分胁迫48 h后其含量与处理24 h时接近。Reviron等[18]对油菜的研究也观察到相似的结果。这说明不同水分胁迫强度和时间对干旱诱导蛋白的表达具有明显的差异,因此推测干旱诱导蛋白的产生、积累并不是一种伤害的结果,而是植物适应干旱胁迫环境的一种机制。
Goldgur 等[19]报道,ASR家族蛋白可以通过Zn2+与DNA结合以提高其抗逆境胁迫能力。Desclos等[20]研究发现,甘蓝型油菜抗旱22 kDa分子量蛋白(BnD22)具有胰蛋白酶抑制剂与水溶性叶绿素结合蛋白双重功能,BnD22可能通过抑制蛋白酶活性而有助于逆境胁迫下的氮素吸收,从而保护植物幼嫩组织蛋白的完整性和光合作用的正常进行。在本研究中,加硅处理促进SoASR1表达量的增加,可能是因为硅通过影响植物体的离子浓度,参与了一些生理代谢过程,同时可能加强SoASR1基因通过磷酸化和去磷酸化来介导信号传导途径,从而提高甘蔗自身抗氧化防护的能力。这说明ASR家族蛋白可能是通过感应逆境胁迫引起的细胞内元素浓度变化来改变蛋白构象,从而应答逆境胁迫,但具体作用机理还有待进一步研究。
4 结 论
克隆获得甘蔗SoASR1基因,cDNA长度为402 bp,编码133 个氨基酸,Gene Bank登录号为JQ712581。在干旱胁迫下,甘蔗SoASR1基因大量表达,从而提高甘蔗抗旱性,施硅能使SoASR1基因表达量增加,进一步提高抗旱性。
[1]Jha B, Agarwal P K, Reddy P S, et al. Identification of salt-induced genes fromSalicorniabrachiata, an extreme halophyte through expressed sequence tags analysis[J]. Genes Genet Syst, 2009, 84: 111-120.
[2]Frankel N, Carrari F, Hasson E. Evolutionary history of the Asr gene family[J]. Gene, 2006, 37(8): 74-83.
[3]Maskin L, Maldonado S, Iusem N D. Tomato leaf spatial expression of stress-induced Asrgenes[J]. Mol Biol Rep, 2008, 35: 501-505.
[4]González R M, Ricardi M M, Iusem N D. A typical epigenetic mark in an atypical location: cytosine methylation at asymmetric (CNN) sites within the body of a non-repetitive tomato gene[J]. BMC Plant Biol, 2011, 11: 94-104.
[5]Wang C S, Hsu S W, Hsu Y F. New insights into desiccation-associated gene regulation byLiliumlongiflorumASR during pollen maturation and in transgenicArabidopsis[J]. Int Rev of Cel Mol Bio, 2013, 301: 37-94.
[6]Virlouvet L, Jacquemot M P, Gerentes D, et al. The ZmASR1 protein influences branched-chain amino acid biosynthesis and maintains kernel yield in maize under water-limited conditions[J]. Plant Physiol, 2011, 157(2): 917-936.
[7]Philippe R, Courtois B, McNally K L, et al. Structure, allelic diversity and selection ofAsrgenes, candidate for drought tolerance,inOryzasativaL. and wild relatives[J]. Theor Appl Genet, 2010, 121(4):769-787.
[8]Iusem N D, Bartholomew D M, Hitz W D, et al. Tomato (Lycopersiconesculentum) transcript induced by water deficit and ripening[J]. Plant Physiol, 1993, 102(4): 1353-1354.
[9]Cakir B, Agasse A, Gaillard C, et al. A grape ASR protein involved in sugar and abscisic acid signaling[J]. Plant Cell, 2003,15: 2165-2180.
[10]Gonzalez R M, Iusem N D. Twenty years of research on Asr (ABA-stress-ripening) genes and proteins[J]. Planta, 2014, 239(5): 941-949.
[11]Zaïd I, Ebel C, Touzri M, et al. TMKP1 is a novel wheat stress responsive MAP kinase phosphatase localized in the nucleus[J]. Plant Mol Biol, 2010, 73(3): 325-338.
[12]陈林波, 房 超, 王 郁, 等. 茶树抗逆相关基因ERF的克隆与表达特性分析[J]. 茶叶科学, 2011, 31(1): 53-58.
[13]刘 昀,吴佳辉,李冉辉,等.植物ASR蛋白的研究进展[J]. 生命科学,2015,27(5):625-630.
[14]Gonzalez R M, Iusem N D. Twenty years of research on Asr (ABA-stress-ripening) genes and proteins[J]. Planta, 2014, 239(5): 941-949.
[15]Li R H, Liu G B, Wang H, et al. Effects of Fe3+and Zn2+on the structural and thermo dynamic properties of a soybean ASR protein[J]. Biosci Biotechnol Biochem, 2013, 77(3): 475-81.
[16]许树成, 祝雪兰, 张 丽. 蛋白激酶组在玉米叶片ABA 和H2O2诱导抗氧化防护中的作用[J]. 植物分类与资源学报, 2011, 33(3): 275-286.
[17]李妮亚, 高俊凤, 汪沛洪. 小麦幼芽水分胁迫诱导蛋白的特征[J]. 植物生理学报, 1998, 24(1): 65-71.
[18]Reviron M P, Vartanian N, Sallantin M, et al. Characterization of a movel protein induced by progressive or rapid drought and salinity inBrassicanapusleaves[J]. Plant Physiology, 1992, 100:1486-1493.
[19]Goldgur Y, Rom S, Ghirlando R, et al. Desiccation and zinc binding induce transition of tomato abscisic acid stress ripening.1, a water stress and salt stress regulated plant specific protein, from unfolded to folded state[J]. Plant Physiol, 2007, 143(2): 617-628.
[20]Desclos M, Dubousset L, Etienne P, et al. A proteomic profiling approach to reveal a novel role ofBrassicanapusdrought 22kD/water-soluble chlorophyll-binding protein in young leaves during nitrogen remobilization induced by stressful conditions[J]. Plant Physiol, 2008, 147(4):1830-1844.
CloningofABA-stress-ripening(ASR)GenefromSugarcaneandAnalysisofItsExpressionProfileunderDroughtStress
LIANG Pan-xia1, XING Ying1, LIAO Qing1, HUANG Xing2, LI Chang-ning2, HUANG Tai-qing1, JIANG Ze-pu1, LI Yang-rui2*
(1.Resources and Environment Research Institute, Guangxi Academy of Agricultural Sciences, Guangxi Nanning 530007, China;2.Sugarcane Research Center, Chinese Academy of Agricultural Sciences/ Key Laboratory of Sugarcane Biotechnology and Genetic Improvement (Guangxi), Ministry of Agriculture/ Guangxi Key Laboratory of Sugarcane Genetic Improvement, Guangxi Nanning 530007,China)
【Objective】To provide experimental basis for further research on regulation mechanism ofASRin response to drought,ASR(ABA-stress-ripening)gene from sugarcane was cloned and its expression level under drought stress was detected.【Method】Based on the total RNA of sugarcane leaves, the cDNA ofASRgene was amplified by RT-PCR, the characteristics of the deduced protein were analyzed by using bioinformatics software and its expression was analyzed by quantitative real-time PCR. 【Result】The results showed that the cDNA ofASRgene which obtained by RT-PCR, was 402 bp in full length, and it encoded a putative ASR protein with 133 amino acids, named SoASR1, its GenBank accession number was JQ712581. Comparison of the amino acids sequences homology inSoASR1 protein from 12 different species indicated that the ASR protein had 56 % to 99 % identity in amino acids sequence with other plants. The results of quantitative real-time PCR analysis showed that the mRNA ofSoASR1 was increased initially and then decreased with extension of time under drought stress. The peak value ofSoASR1 gene expression in sugarcane leaves treated with PEG and Si was 34 h earlier than that of drought treatment.【Conclusion】SoASR1 was induced by drought stress and was involved in drought-resistant reaction at transcriptional level, so it could be served as a candidate gene for further study of drought-resistant mechanism of sugarcane, which could be enhanced by Si application.
Sugarcane; Drought; ABA-stress-ripening
1001-4829(2017)10-2196-06
10.16213/j.cnki.scjas.2017.10.007
2017-05-06
广西自然科学基金项目(2014GXNSFBA118139,2016 GXNSFBA380131); 广西农业科学院科技发展基金项目(桂农科2017JM03,桂农科2017JM01,桂农科2015JM23);南宁市西乡塘区科学研究与技术开发计划项目(201710304)
梁潘霞(1979-),女,广西邕宁人,博士,助理研究员,主要从事土壤环境生态、植物生理生化和生物技术研究,E-mail:lpx831@163. com,*为通讯作者:李杨瑞,E-mail:liyr@gxaas.net。
S566.1
A
(责任编辑 韦 幂)
