土木香乙酸乙酯提取物对人胰腺癌Capan-2细胞增殖的抑制作用及机制研究Δ
2017-11-16王霖玲曾健梅阎优优张博林能明浙江中医药大学附属杭州第一医院转化医学研究中心杭州30006杭州市第一人民医院南京医科大学附属杭州医院转化医学研究中心杭州30006
王霖玲,曾健梅,阎优优,张博,林能明,#(.浙江中医药大学附属杭州第一医院转化医学研究中心,杭州30006;.杭州市第一人民医院/南京医科大学附属杭州医院转化医学研究中心,杭州30006)
土木香乙酸乙酯提取物对人胰腺癌Capan-2细胞增殖的抑制作用及机制研究Δ
王霖玲1*,曾健梅1,阎优优2,张博2,林能明1,2#(1.浙江中医药大学附属杭州第一医院转化医学研究中心,杭州310006;2.杭州市第一人民医院/南京医科大学附属杭州医院转化医学研究中心,杭州310006)
目的:研究土木香乙酸乙酯提取物(IHE)对人胰腺癌Capan-2细胞增殖的抑制作用及机制。方法:采用MTT法测定0、0.5、1、2、4、8 μg/mL的IHE作用48 h后细胞的增殖抑制率,克隆形成试验观察0、1、2 μg/mL的IHE作用1周后对细胞克隆形成的影响,Hoechst 33342染色法观察0、2、4 μg/mL的IHE作用48 h后细胞核形态的变化,流式细胞术检测0、4、8、16 μg/mL的IHE作用48 h后细胞的凋亡率,JC-1染色法观察0、4、8、16 μg/mL的IHE作用24 h后细胞线粒体膜电位变化,Western blot法检测0、4、8、16 μg/mL的IHE作用48 h后细胞线粒体凋亡相关蛋白Bcl-2、Bax、Mcl-1和p53上调凋亡因子(PUMA)、多聚二磷酸腺苷核糖聚合酶(PARP)蛋白的表达。结果:2、4、8 μg/mL的IHE对细胞的增殖有明显抑制作用,且呈浓度依赖性,半数抑制浓度为6.6 μg/mL;1、2 μg/mL的IHE可明显抑制细胞的克隆形成;4 μg/mL的IHE可明显造成细胞核固缩;8、16 μg/mL的IHE可明显促进细胞凋亡,16μg/mL的IHE作用48 h后细胞凋亡率达到45.53%;16 μg/mL的IHE作用24 h后可引起82.47%的细胞线粒体膜电位下降;8 μg/mL的IHE可明显下调细胞中Bcl-2、Mcl-1、PUMA、PARP蛋白表达,16 μg/mL的IHE可明显下调细胞中Mcl-1、PUMA表达。结论:IHE可能通过引起细胞线粒体膜电位的下降,下调细胞中PUMA、Mcl-1蛋白的表达,引起细胞的凋亡,从而发挥其抑制人胰腺癌Capan-2细胞增殖的作用。
土木香;乙酸乙酯提取物;人胰腺癌Capan-2细胞;线粒体;细胞凋亡
胰腺癌是恶性程度最高的肿瘤之一,预计在2030年将成为病死率第二高的恶性肿瘤[1]。由于大多数胰腺癌患者确诊时已处于晚期,失去了手术机会,因此全身化疗对于晚期胰腺癌患者来说显得至关重要。尽管已有大量的研究致力于开发抗胰腺癌药物,但胰腺癌患者的5年生存率在过去40年没有明显提高,仍低于5%[2]。我国中药资源丰富,尚有许多具有抗肿瘤活性的天然药物仍处于开发阶段。土木香系菊科旋覆花属植物,为多年生草本,其根供药用,具有健胃、利尿和驱虫的功效[3]。有研究表明,土木香的醇提取物中富含倍半萜内酯类成分,而该类成分具有较强的抗肿瘤活性,对头颈部鳞状细胞癌、成胶质细胞瘤、前列腺癌等具有明显的细胞毒作用,但对胰腺癌的作用尚不明确[4]。本研究在获得土木香醇提取物的基础上[5-6],进一步用乙酸乙酯萃取,得到了富含倍半萜内酯类成分的土木香乙酸乙酯提取物(Inula helenium ethyl acetate extract,IHE),并探讨IHE对人胰腺癌Capan-2细胞增殖的抑制作用及机制。
1 材料
1.1 仪器
FACSCantoⅡ型流式细胞仪(美国BD公司);SpectraMax M3型全波长多功能酶标仪(美国Molecular Devices公司);高速冷冻离心机(美国Thermo Fisher公司);Microsystems CMS GmbH Am Friendensplatz 3型荧光显微镜(德国Leica公司);ChemiDoc XRS+型凝胶成像系统(美国Bio-Rad公司)。
1.2 药品与试剂
RPMI 1640培养基、胎牛血清(美国Gibco公司);胰蛋白酶-EDTA消化液(0.25%)、MTT(北京索莱宝科技有限公司);荧光素异硫氰酸(FITC)标记的膜联蛋白Ⅴ(AnnexinⅤ-FITC)/碘化丙啶(PI)凋亡检测试剂盒(美国BD公司,批号:6119908);线粒体膜电位检测试剂盒(美国SAB公司,批号:H16);Hoeschst 33258染色液(碧云天生物技术研究所);兔源B细胞白血病2(Bcl-2)、Bax、p53上调凋亡因子(PUMA)、髓样细胞白血病1(Mcl-1)、多聚二磷酸腺苷核糖聚合酶(PARP)单克隆抗体和鼠源β-肌动蛋白(β-actin)单克隆抗体(美国Abcam公司);辣根过氧化酶(HRP)标记的二抗(武汉艾美捷科技有限公司);其余试剂均为分析纯。
1.3 细胞
人胰腺癌Capan-2细胞购于中国科学院上海生物化学与细胞生物学研究所细胞库,以含10%胎牛血清的RPMI 1640为培养基,在37℃、5%CO2培养箱中培养。
2 方法
2.1 IHE的提取
将10.0 kg干燥的土木香根茎磨成粗粉,95%乙醇浸泡48 h,在室温下用20倍的95%乙醇渗滤提取,真空浓缩,得到粗提物,约3.7 kg。将粗提物溶于1.5 L温水中,并用3倍量的乙酸乙酯(3×1.5 L)萃取后,减压蒸发,得到370.16 g的IHE(产率为3.7%)。用香草醛-硫酸比色法验证IHE中含有生物活性化合物[3]。临用时,用二甲基亚砜(DMSO)制备成高浓度母液后,用培养基稀释成不同质量浓度的IHE样品溶液。
2.2 MTT法检测细胞的增殖活性
收集对数生长期的Capan-2细胞,以离心半径为13.5 cm、1 000 r/min离心3 min,弃上清液,用培养基吹打成细胞悬液。然后分别以5×103个细胞/孔的密度接种于96孔板中,每孔100 μL,置于细胞培养箱中培养24 h,然后分别加入质量浓度分别为0(空白对照,含DMSO的培养液,下同)、1、2、4、8 μg/mL的IHE。作用48 h后,弃培养液,加入50 μL的MTT溶液,在细胞培养箱中继续孵育4 h后,离心去上清,每孔加入100 μL的DMSO,轻微振荡使蓝色结晶完全溶解。用全波长多功能酶标仪测每孔的光密度(OD),检测波长为570 nm,参照波长为650 nm。试验重复3次,每次设定5个平行复孔。细胞增殖抑制率(%)=(1-给药孔OD均值/空白对照孔OD均值)×100%。使用GraphPad Prism 5软件计算半数抑制浓度(IC50)。
2.3 克隆形成试验检测细胞的克隆形成能力
收集对数生长期的Capan-2细胞,计数,以500个细胞/孔的细胞密度接种于6孔板中,置于细胞培养箱中培养72 h后,加入0(空白对照)、1、2 μg/mL的IHE,置于培养箱中培养1周。取出,弃去原培养液,以磷酸盐缓冲液(PBS)洗2遍,然后用4%的多聚甲醛固定20 min,用吉姆萨(Giemsa)染液染色20 min。PBS洗干净后晾干,拍照观察细胞集落形成数量。试验重复3次。
2.4 Hoechst 33342染色试验观察细胞核形态变化
收集对数生长期的Capan-2细胞,以2×104个细胞/孔的密度接种于24孔板中,置于培养箱中培养24 h后,加入0(空白对照)、2、4 μg/mL的IHE,培养48 h。弃原培养液,用PBS洗2遍,然后每孔加入1 mL的4%多聚甲醛固定20 min。用PBS洗2遍后,再每孔加入300 μL的Hoechst 33342荧光染色液,于细胞培养箱中培养20 min。取出后弃培养液,PBS洗2遍,用荧光显微镜观察细胞核变化,并拍照记录。试验重复3次。
2.5 AnnexinⅤ-FITC/PI双染法流式细胞术检测细胞的凋亡情况
收集对数生长期的Capan-2细胞,以2×105个细胞/孔的密度接种于6孔板中,将细胞置于培养箱中培养24 h后,加入0(空白对照)、4、8、16 μg/mL的IHE培养48 h,收集上清培养液,用胰酶消化细胞并收集。之后加入300 μL的AnnexinⅤ-FITC凋亡检测试剂盒中的缓冲液、5 μL的AnnexinⅤ-FITC染液,轻轻混匀后,于2~8℃避光条件下培养15 min。再加入10 μL的PI,轻轻混匀,于2~8℃避光条件下培养5 min后,流式细胞仪检测,计算细胞凋亡率(%)。试验重复3次。
2.6 JC-1染色法检测细胞内线粒体膜电位
收集对数生长期的Capan-2细胞,以2×105个细胞/孔的密度接种于6孔板中,将细胞置于培养箱中培养24 h后,加入0(空白对照)、4、8、16 μg/mL的IHE培养24 h。收集上清培养液,用胰酶消化并收集细胞,然后用PBS洗2遍。每个样本加入500 μL的JC-1工作液,于细胞培养箱中培养15 min后,用流式细胞仪检测膜电位下降细胞比例。试验重复3次。
2.7 Western blot法检测细胞中凋亡相关蛋白的表达
收集对数生长期的Capan-2细胞,分别加入0(空白对照)、4、8、16 μg/mL的IHE培养48 h后,采用细胞裂解液收集细胞。二喹啉甲酸(BCA)蛋白定量检测试剂盒测定总蛋白浓度,将样品调整至等浓度后分装,-80℃保存。以β-actin为内参进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),并转移至聚偏二氟乙烯膜(PVDF)上。用50 g/L的脱脂奶粉溶液室温封闭1 h后,分别加入1∶1 000稀释的一抗(Bcl-2、Bax、Mcl-1、PUMA、PARP、β-actin),4℃孵育过夜,用缓冲液TBST洗膜3次,每次10 min。然后加入HRP标记的二抗(1∶5 000),于室温条件下培养2 h,再用缓冲液TBST洗膜3次,每次10 min。用超敏化学发光试剂显影检测,应用化学发光成像仪进行图像采集,以目标蛋白条带的灰度值与内参β-actin条带灰度值的比值表示目标蛋白的相对表达量。试验重复3次。
2.8 统计学方法
3 结果
3.1 IHE对Capan-2细胞体外增殖的影响
IHE对细胞的增殖抑制率呈明显的浓度依赖性增加。与0µg/mL比较,2、4、8 μg/mL的IHE作用48 h后细胞的增殖抑制率均明显升高(P<0.05或P<0.01),其中8 μg/mL的IHE对Capan-2的抑制率超过了80%。1、2、4、8 μg/mL的IHE作用48 h后,细胞的增殖抑制率分别为(7.01±1.84)%、(12.39±3.84)%、(38.23±3.30)%、(80.83±1.37)%(n=3),IC50为6.6 μg/mL。
3.2 IHE对Capan-2细胞克隆形成的影响
克隆形成试验也表明,不同质量浓度IHE对Capan-2细胞的增殖有不同程度的抑制作用。经Giemsa染色后可看出,IHE作用于细胞1周后,随着其质量浓度的增加,细胞集落形成数逐渐减少。与0 μg/mL比较,2 μg/mL的IHE作用1周后细胞集落形成数明显减少(P<0.01)。0、1、2 μg/mL的IHE作用1周后细胞集落形成数分别为(362.67±17.90)、(234.67±17.79)、(74.33±6.11)个(n=3)。
3.3 IHE对Capan-2细胞核的影响
以2、4 μg/mL的IHE作用于细胞48 h后,细胞核固缩,荧光强度显著增加,且4 μg/mL的IHE作用较2 μg/mL明显。这一结果也证实了IHE能抑制Capan-2细胞的增殖,染色后荧光显微图见图1。

图1 不同质量浓度IHE作用48 h后细胞核的荧光显微图(Hoechst 33342染色,×40)Fig1 Fluorescence micrographs of nuclear morphology after 48 h with different mass concentrations of IHE(Hoechst 33342 staining,×40)
3.4 IHE对Capan-2细胞凋亡的影响
4、8、16 μg/mL的IHE作用于细胞48 h后,细胞凋亡率均不同程度升高,且呈明显的浓度依赖性。与0 μg/mL比较,8、16 μg/mL的IHE作用后细胞凋亡率均明显升高(P<0.01)。0、4、8、16 μg/mL的IHE作用48 h后细胞的凋亡率依次为(8.43±2.47)%、(12.87±4.52)%、(23.97±3.24)%、(40.60±8.27)%(n=3),流式图见图2。

图2 不同质量浓度IHE作用48 h后细胞凋亡的流式图Fig2 Flow cytometry charts of cell apoptosis after 48 h with different mass concentrations of IHE
3.5 IHE对细胞线粒体膜电位的影响
4、8、16 μg/mL的IHE作用于细胞24 h后,均可不同程度地降低细胞线粒体膜电位,且呈明显的浓度依赖性。与0 μg/mL比较,16 μg/mL的IHE作用后线粒体膜电位下降细胞比例为(82.47±1.25)%(P<0.01)。0、4、8、16 μg/mL的IHE作用24 h后线粒体膜电位下降的细胞比例依次为(3.8±0.61)%、(10.87±0.83)%、(19.2±1.01)%、(82.47±1.25)%,结果见图3。

图3 不同质量浓度IHE作用24 h后细胞线粒体膜电位的流式图Fig3 Flow cytometry charts of mitochondria membrane potential after 24 h with different mass concentrations of IHE
3.6 IHE对细胞线粒体凋亡相关蛋白表达的影响
与0 μg/mL比较,8 μg/mL的IHE作用于细胞48 h后,细胞中Bcl-2、Mcl-1、PUMA、PARP蛋白表达明显减弱(P<0.05或P<0.01);16 μg/mL的IHE作用于细胞48 h后,细胞中PUMA、Mcl-1蛋白表达明显减弱(P<0.01)。蛋白表达电泳结果见图4、测定结果见表2。
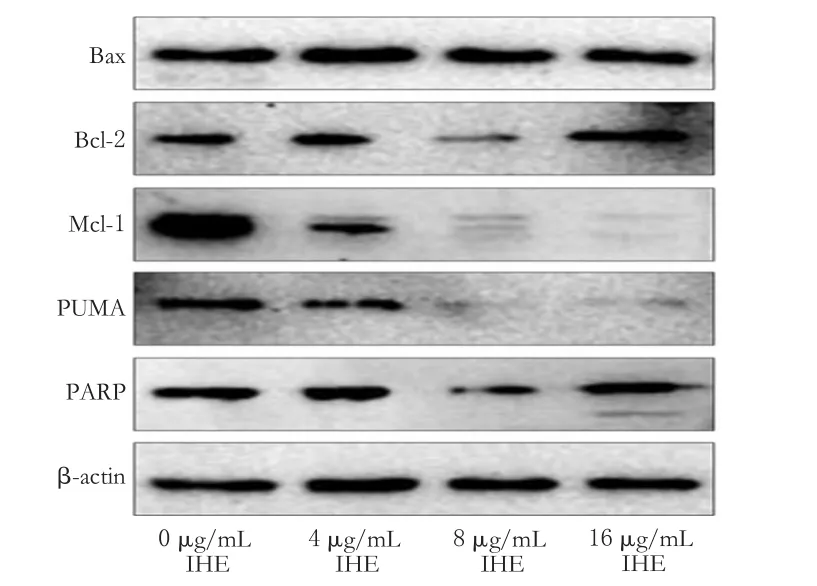
图4 不同质量浓度IHE作用48 h后细胞线粒体凋亡相关蛋白的电泳图Fig4 Electrophoresis charts of mitochondrial apoptosis-related proteins after 48 h with different mass concentrations of IHE
4 讨论
在本研究中,笔者采用了不同方法来验证IHE对胰腺癌Capan-2细胞有增殖抑制作用,包括MTT试验、克隆形成试验和细胞核荧光染色试验。在进行克隆形成试验时,因作用时间较长,药物浓度应低于IC50,故笔者采用了0、1、2 μg/mL的IHE进行试验。在MTT预试验中,笔者设置了0、0.5、1、2、4、8、16、32 μg/mL的等浓度梯度,结果当IHE质量浓度为8 μg/mL时细胞的增殖抑制作用已经达到峰值,故正式试验时IHE的质量浓度设置为0、0.5、1、2、4、8 μg/mL。
表2 不同质量浓度IHE作用48 h后细胞线粒体凋亡相关蛋白的测定结果(±s,n=3)Tab2 Determination results of mitochondrial apoptosis-related proteins after 48 h with different mass concentrations of IHE(±s,n=3)

表2 不同质量浓度IHE作用48 h后细胞线粒体凋亡相关蛋白的测定结果(±s,n=3)Tab2 Determination results of mitochondrial apoptosis-related proteins after 48 h with different mass concentrations of IHE(±s,n=3)
注:与0 μg/mL比较,*P<0.05,**P<0.01Note:vs.0 μg/mL,*P<0.05,**P<0.01
PARP/β-actin 0.77±0.01 0.66±0.01 0.31±0.02*0.78±0.01 IHE质量浓度,μg/mL 0481 6 Bax/β-actin 1.41±0.02 1.27±0.01 1.26±0.02 1.28±0.03 Bcl-2/β-actin 0.82±0.03 0.58±0.01 0.41±0.02*0.98±0.03 Mcl-1/β-actin 1.48±0.08 0.51±0.02 0.17±0.01**0.08±0.01**PUMA/β-actin 1.01±0.03 0.63±0.01 0.23±0.01**0.28±0.03**
JC-1是一种阳离子染料,可以检测细胞线粒体膜电位的变化。当细胞线粒体膜电位较高时,JC-1能聚集在线粒体基质中,形成聚合物,产生红色荧光;当线粒体膜电位较低时,JC-1不能聚集,以单体存在,此时产生绿色荧光[7]。当JC-1从红色荧光到绿色荧光转变时可以反映出线粒体膜电位的下降,而线粒体膜电位下降则是细胞早期凋亡的一个重要标志。线粒体膜电位下降后可以促使线粒体释放细胞色素C[8],细胞色素C与凋亡酶激活因子(Apaf-1)结合后能够催化半胱氨酸天冬氨酸蛋白酶9(Caspase-9)的活化,最终使下游Caspase-3活化而诱导细胞凋亡[9]。PARP作为细胞凋亡核心成员Caspase水解的切割底物,其在DNA损伤修复和细胞凋亡中发挥着重要作用。PARP在体内是Caspase-3的主要切割对象,被剪切后PARP的羧基端的催化结构域(89 kD)和氨基端的DNA结合结构域(24 kD)分离,使其失去酶活力,其裂解片段的出现被认为是细胞凋亡的重要信号[7]。Bcl-2家族蛋白成员是线粒体凋亡通路的重要调节因子,如Bak、Bax等可以促进细胞凋亡,Bcl-2、Mcl-1等可以抑制细胞凋亡,另外还有一些BH3-only蛋白(如NOXA、PUMA等)也可促进细胞凋亡。
本研究结果显示,Capan-2细胞经IHE处理后,随着IHE质量浓度的增加细胞线粒体膜电位明显下降,细胞凋亡率明显升高。此外,从Western blot的结果也可以看到,抑凋亡蛋白Mcl-1的表达随着IHE质量浓度的增加而减弱;而Bcl-2的表达也随着IHE质量浓度的增加而减弱,但在高质量浓度(16 μg/mL)IHE的作用下则有反馈性的上调;而促凋亡蛋白Bax则无明显变化。BH3-only蛋白PUMA的表达也随着IHE质量浓度的增加而减弱。PARP在高质量浓度IHE处理后出现裂解片段。本研究结果表明,IHE可能是通过引起线粒体膜电位的下降,从而引起胰腺癌Capan-2细胞的凋亡。
综上所述,IHE对人胰腺癌Capan-2细胞具有较强的体外增殖抑制作用。其作用机制可能是通过引起线粒体膜电位的下降,下调细胞中Mcl-1、PUMA蛋白的表达,从而引起胰腺癌细胞的凋亡。
[1] Rahib L,Smith BD,Aizenberg R,et al.Matrisian projecting cancer incidence and deaths to 2030:the unexpected burden of thyroid,liver,and pancreas cancers in the United States[J].Cancer Res,2014,74(14):2913-2921.
[2] Siegel RL,Miller KD,Jemal A.Cancer statistics:2016[J].CA Cancer J Clin,2016,66(1):7-30.
[3] 张乐,方羽,陆国红,等.土木香化学成分及药理研究概况[J].中成药,2015,37(6):1313-1316.
[4] 小西天二.土木香中抑制肿瘤细胞增殖的成分[J].国外医学:中医中药分册,2003,25(3):174.
[5] 赵永明,张嫚丽,霍长虹,等.土木香化学成分的研究[J].天然产物研究与开发,2009,21(4):616-618.
[6] Ren Y,J Yu,Kinghorn AD.Development of anticancer agents from plant-derived sesquiterpene lactones[J].Curr Med Chem,2016,23(23):2397-2420.
[7] Hamacher-Brady A,Brady NR.Bax/Bak-dependent,Drp1-independent targeting of X-linked inhibitor of apoptosis protein(XIAP)into inner mitochondrial compartments counteracts Smac/DIABLO-dependent effector Caspase activation[J].J Biol Chem,2015,290(36):22005-22018.
[8] 赵秀梅,周冰,张桂贤,等.扶正解毒祛瘀方联合奥沙利铂对人结肠癌HT-29细胞增殖与凋亡的影响及机制研究[J].中国药房,2017,28(19):2613-2616.
[9] Horbay R,Bilyy R.Mitochondrial dynamics during cell cycling[J].Apoptosis,2016,21(12):1327-1335.
Study on the Inhibitory Effect and Mechanism of Inula helenium Ethyl Acetate Extract on Proliferation of Human Pancreatic Cancer Capan-2 Cells
WANG Linling1,ZENG Jianmei1,YAN Youyou2,ZHANG Bo2,LIN Nengming1,2(1.Transformational Medicine Research Center,Hangzhou First Hospital Affiliated to Zhejiang University of TCM,Hangzhou 310006,China;2.Transformational Medicine Research Center,Hangzhou First People’s Hospital/Hangzhou Hospital Affiliated to Nanjing Medical University,Hangzhou,310006,China)
OBJECTIVE:To study the inhibitory effect and mechanism of Inula helenium ethyl acetate extract(IHE)on proliferation of human pancreatic cancer Capan-2 cells.METHODS:MTT was used to determine the cell proliferation inhibition rate after treated by 0,0.5,1,2,4,8 μg/mL IHE;clone formation test was used to observe the effects of 0,1,2 μg/mL IHE treating for 1 week on cell clone formation;Hoechest 33342 staining was used to observe the changes of nuclear morphology after treated by 0,2,4 μg/mL IHE for 48 h;flow cytometry was used to detect the cell apoptosis rate after treated by 0,4,8,16 μg/mL IHE for 48 h;JC-1 staining was used to observe the changes of intracellular mitochondrial membrane potential after treated by 0,4,8,16 μg/mL IHE for 24 h;Western blot was used to detect the expressions of mitochondrial apoptosis-related proteins Bcl-2,Bax,Mcl-1,p53 upregulated modulator of apoptosis(PUMA),and polymerase(PARP)after treated by 0,4,8,16 μg/mL IHE for 48 h.RESULTS:2,4,8 μg/mL IHE had obvious inhibitory effect on cell proliferation,showing concentration-dependent relationship,with IC50of 6.6 μg/mL;1,2 μg/mL IHE can obviously inhibit the clone formation of cells;4 μg/mL IHE can obviously cause cell nuclear condensation;8,16 μg/mL IHE can obviously promote the cell apoptosis,and the cell apoptosis rate reached 45.53%after treated by 16 μg/mL IHE for 48 h;16 μg/mL IHE treating for 24 h can cause the decrease of 82.47%cells’mitochondrial membrane potential;8 μg/mL IHE can obviously down-regulate the protein expressions of Bcl-2,Mcl-1,PUMA and PARP,and 16 μg/mL IHE can obviously down-regulate the expressions of Mcl-1 and PUMA.CONCLUSIONS:IHE may show its inhibitory effect on proliferation of human pancreatic cancer Capan-2 cells by causing the decrease of mitochondrial membrane potential in cells and down-regulating the protein expressions of Mcl-1 and PUMA to cause cell apoptosis.KEYWORDSInula helenium;Ethyl acetate extract;Human pancreatic cancer Capan-2 cells;Mitochondrion;Cell apoptosis
R285.5
A
1001-0408(2017)31-4384-05
DOI 10.6039/j.issn.1001-0408.2017.31.17
浙江省卫生高层次创新人才培养工程项目(No.2010-190-4)
*硕士研究生。研究方向:肿瘤药理学。电话:0571-56007664。E-mail:sweetyling@126.com
#通信作者:教授,主任药师,博士生导师。研究方向:临床药理学、临床毒理学。电话:0571-56007809。E-mail:lnm1013@163.com
2017-02-09
2017-08-10)
(编辑:林静)
