超声辅助低共熔溶剂提取沙棘籽粕多酚的工艺优化
2017-11-10倪玉娇赵春建李春英李国春王楷婷张玉坤
倪玉娇 赵春建 李春英* 李国春 王楷婷 张玉坤
(1.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040; 2.黑龙江省林业监测规划院,哈尔滨 150040)
超声辅助低共熔溶剂提取沙棘籽粕多酚的工艺优化
倪玉娇1赵春建1李春英1*李国春2王楷婷1张玉坤1
(1.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040;2.黑龙江省林业监测规划院,哈尔滨 150040)
以一系列低共熔溶剂为提取剂,采用超声波辅助法从沙棘籽粕中提取多酚。在单因素试验结果基础上,利用Box-Behnken实验设计,运用响应面分析法对影响沙棘籽粕多酚得率的主要因素(超声功率、超声时间、超声温度)进行优化。结果表明,沙棘籽粕多酚最佳提取工艺条件为:以含水量为30%的氯化胆碱—草酸低共熔溶剂为最佳提取剂,液料比为14∶1,超声功率420 W,超声时间56 min,超声温度44℃。在此条件下,多酚得率为3.31±0.008%。对比试验发现:氯化胆碱—草酸低共熔溶剂对沙棘籽粕多酚的得率明显优于传统溶剂;与热回流提取相比,超声提取法具有明显的优势。
低共熔溶剂;超声;沙棘籽粕;多酚
沙棘(HippophaerhamnoidesL.)是胡颓子科(Elaeagnaceae)沙棘属(Hippophae)多年生落叶灌木或小乔木,主要分布于亚欧大陆的温带、寒温带及亚热带高山区,我国是世界上沙棘资源蕴藏量最丰富的的国家,占世界总面积的95%以上,素有“沙棘王国”之称[1]。沙棘的各部分器官都具有很高的营养和药用价值,其药用价值主要有抗氧化、降血压、降血脂、抗肿瘤、抗菌、抗炎、抗辐射等功效,可用于心血管、消化、血液系统的疾病[2]。沙棘的果实是沙棘价值的主要部分,其化学成分主要有维生素、氨基酸、油脂、挥发油、糖类、有机酸、酚类和黄酮、萜类及甾体类等[3]。目前,从新鲜的沙棘浆果中取得果汁、分离果油,在果汁移去后保留的果浆中提取“沙棘黄”可有效地利用资源[4]。而沙棘籽主要用于提取沙棘油,在提油之后沙棘籽粕中仍遗留大量生物活性物质,而这部分籽粕通常被当作废弃物,极大地浪费了资源[5]。近年来,对沙棘籽粕的研究主要集中在提取黄酮[6]和原花色素方面[7],对多酚提取工艺的研究尚未见报道。
植物多酚(plant polyphenols),主要有酚酸、黄酮类物质、木酚素等,是一种植物体内的多元酚类次生代谢产物[8],具有良好的保健功能。它的生理活性主要表现在抗氧化、清除自由基方面,与人工合成的抗氧化剂相比,不会对生物体造成伤害。其药理活性主要表现在对心血管疾病的防预和保护以及增强免疫、抗炎、抗癌、抗突变等方面[9~10]。植物多酚对人类身体健康具有重要和多元的作用,并且因其具有天然、高效、低毒的特点,植物多酚已迅速成为当前研究的一个热点。沙棘籽粕作为加工中产生的残渣没有得到充分利用,因此合理利用加工副产物,构建工业固体废弃物资源利用的绿色模式,对促进沙棘的综合利用,延长产业链,具有积极的意义。
低共熔溶剂(deep eutectic solvents,DESs)是一类具有比单个纯组分更低熔点的离子型溶剂,因具有一系列独特性质使得其在萃取天然产品领域的潜力也渐渐为人们所重视[11~12]。Xu[13]等将DESs用于双水相体系中的蛋白质萃取,Dai[14]等研究了利用低共熔溶剂从红花中提取酚类代谢产物,Marina[15]等和Peng[16]等也已成功将DESs用于多酚类化合物的提取。本实验以超临界CO2萃取沙棘油后的沙棘籽粕为原料,应用超声波辅助提取技术,研究不同DESs对沙棘籽粕多酚得率的影响,并利用BBD实验设计结合响应面对提取工艺进行了优化,以期为沙棘籽粕多酚工业化提取提供基础数据。
1 材料与方法
1.1 材料与试剂
材料:沙棘籽粕(超临界CO2萃取后的沙棘籽粕),由内蒙古宇航人有限公司提供,密封后在-20℃下避光储存备用。
试剂:氯化胆碱、草酸、葡萄糖、苹果酸、丙三醇、乳酸、碳酸钠等,均为分析醇,购于哈尔滨百特生物试剂有限公司;没食子酸标准品(纯度≥98%),购于阿拉丁试剂有限公司;福林酚试剂:购于美国Sigma公司。
1.2 方法
1.2.1 低共熔溶剂的制备
制备5种低共熔溶剂(DES-1到DES-5)如表1。将氯化胆碱与草酸(葡萄糖、苹果酸、丙三醇)或乳酸与葡萄糖按照一定的摩尔比混合置于圆底烧瓶中,在恒温水浴锅中,保持温度50℃~80℃,磁力搅拌2~4 h,待反应结束后取出,冷却至室温后得到无色透明液体,在室温、4℃~-20℃条件下,放置一周仍为均匀透明的液体。
表1不同类型的低共熔溶剂
Table1Differenttypesofdeepeutecticsolvents(DESs)

缩写Abbreviation溶剂体系Solventsystem氢受体Hydrogenacceptor氢供体Hydrogenbonddonors摩尔比MoleratioDES⁃1氯化胆碱Cholinechloride葡萄糖Glucose1∶1DES⁃2氯化胆碱Cholinechloride苹果酸Malicacid1.5∶1DES⁃3氯化胆碱Cholinechloride草酸Oxalicacid1∶1DES⁃4氯化胆碱Cholinechloride丙三醇Glycerol1∶2DES⁃5乳酸Lacticacid葡萄糖Glucose5∶1
1.2.2 多酚提取的工艺流程
脱脂后的沙棘籽粕粉末→加入低共熔溶剂(或传统溶剂)→混匀→超声波辅助(热回流)避光提取→离心→定容。
1.2.3 多酚得率的测定
利用Folin-ciocalteu比色法测定多酚含量[17]。具体操作如下:终体积为200 μL,取2 μL没食子酸标准品溶液或样品溶液、空白溶液加入到96孔板,依次加入福林酚试剂10 μL,去离子水20 μL,静置1~8 min后,加入10 μL,20%的碳酸钠溶液,最后用去离子水补至终体积,室温条件下反应2 h,于760 nm波长处测定吸光值。得到吸光值(Y)与样品中多酚浓度(X,mg·mL-1)的回归方程:Y=1.306 5X-0.014 8,R2=0.999 3。多酚得率的计算公式如下:
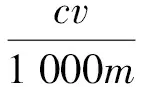
(1)
式中:c为提取液中多酚含量(mg·mL-1);v为样品溶液定容体积(mL);m为提取前沙棘籽粕质量(g)。
1.2.4 试验设计
准确称取0.2 g沙棘籽粕于10 mL的指形管中,以沙棘籽粕中多酚得率为评价指标进行单因素试验,分别考察低共熔溶剂类型(DES-1、DES-2、DES-3、DES-4、DES-5)、低共熔溶剂含水量(10%~100%)、超声功率(280~700 W)、超声温度(30℃~60℃)、液料比(8∶1~20∶1)、超声时间(10~60min)对多酚得率的影响。
在单因素试验结果的基础上,根据单因素方差分析选择影响较大的3个因素(超声功率、超声时间 和超声温度),运用响应面分析软件的Box-Behnken模型,以多酚得率为响应值进行响应面试验分析,确定多酚提取最佳工艺条件。响应面因素编码及各自变量水平见表2。数据运用Design-Expert 8.05统计软件处理。
表2响应面实验因素水平及编码
Table2CodedvaluesandcorrespondingactualvaluesoffactorsinBBDdesign
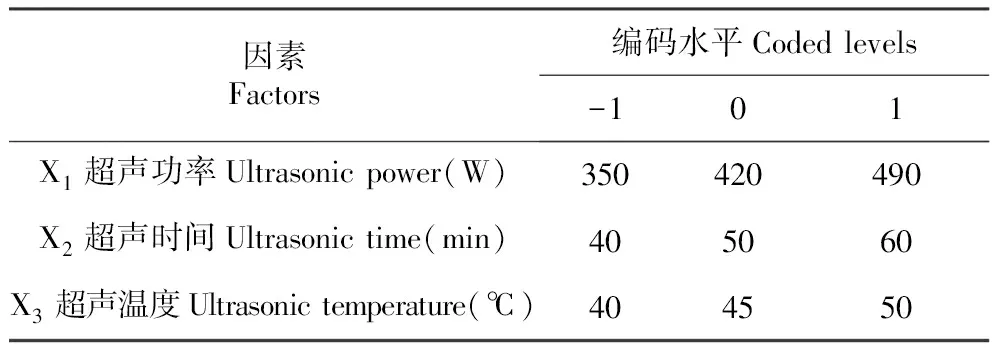
因素Factors编码水平Codedlevels-101X1超声功率Ultrasonicpower(W)350420490X2超声时间Ultrasonictime(min)405060X3超声温度Ultrasonictemperature(℃)404550
2 结果与讨论
2.1 低共熔溶剂(DESs)种类的选择
以液料比10∶1、超声波功率350 W、超声温度40℃、超声波辅助提取40 min作为多酚提取条件,5种不同低共熔溶剂对多酚得率的影响如图1所示。由图1可以看出,5种低共熔溶剂中,DES-3对多酚的提取效果最佳,其余依次为DES-5>DES-4>DES-2>DES-1。DES对于多酚的高得率可能是由于DESs与多酚类化合物之间的氢键作用力[15],当氯化胆碱为氢受体,氢供体为草酸、苹果酸、丙三醇、葡萄糖等多元醇类和羧酸类化合物时,对沙棘籽粕多酚的提取优于氢供体为糖类化合物的低共熔剂。另外也可能是由于DES-3相对于其它低共熔溶剂的运动分散性好,能更好地与多酚分子接触,故在后续实验中,选择氯化胆碱—草酸(DES-3)低共熔溶剂为萃取剂。
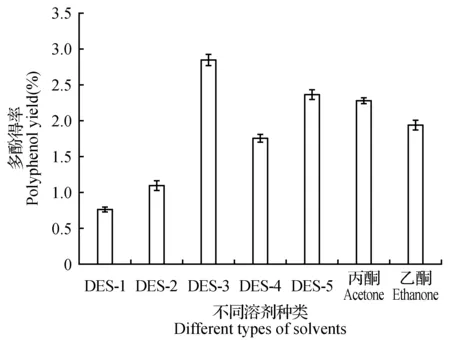
图1 提取溶剂对多酚得率的影响Fig.1 The influence of extraction solvents on polyphenol yield
同时,参考文献报道[16~17],比较了低共熔溶剂与有机溶剂(60%丙酮和80%乙醇)对提取沙棘籽粕多酚提取的影响(图1),结果表明:低共熔溶剂DES-3对沙棘籽粕多酚的提取明显优于传统溶剂。
2.2 低共熔溶剂含水量的选择
作为萃取溶剂DESs具有较高的粘度、较差的扩散能力,导致其较难渗入到样品基质的内部[18]。试验证明,在低共熔溶剂中加入一定比例的水可以显著地降低DESs的粘度[19]。因此,以不同含水量的DES-3为提取溶剂,液料比10∶1、超声波功率350 W、超声温度40℃、超声波辅助提取时间为40 min进行多酚的提取(图2)。如图2所示,在含水量为30%时,多酚得率达到了最大值3.27%,是水作为提取剂时的6.95倍。但低共熔溶剂含水量超过30%后,继续增加含水量,多酚的得率呈现下降趋势,这可能是由于加入过量的水后减弱了低共熔溶剂与多酚类成分间的作用力,从而使目标成分得率下降[18]。因此,选择含水量为30%的DES-3作为后续实验中的提取剂。
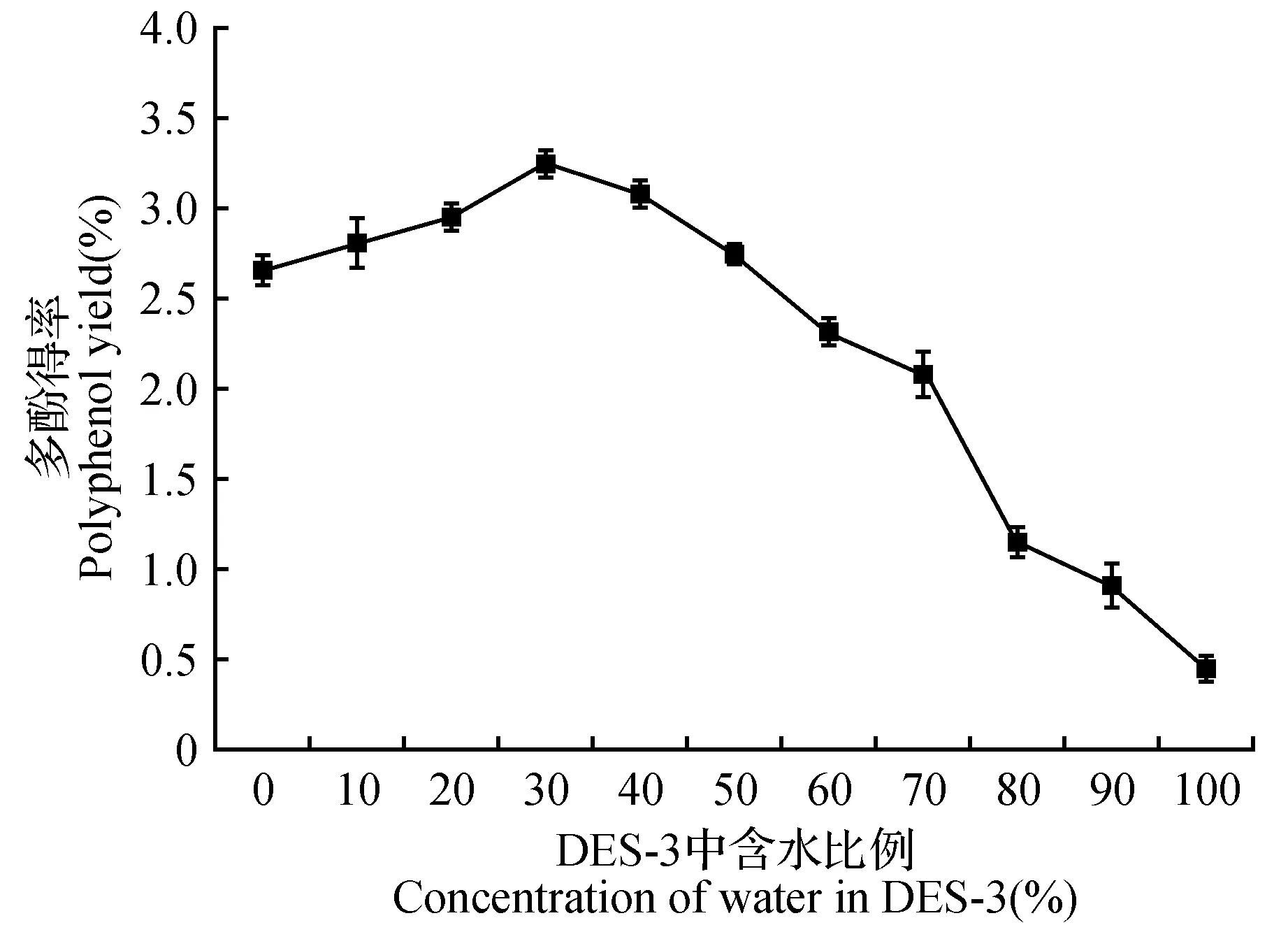
图2 低共熔溶剂(DES-3)的含水量对多酚得率的影响Fig.2 The influence of water content in DES-3 on polyphenol yield
2.3 单因素试验
2.3.1 超声功率对多酚得率的影响
在提取温度35℃,提取时间40 min,液料比10∶1(mL∶g)的条件下,不同超声功率对多酚得率的影响如图3A所示。从图3A可以看出,随着功率的增大,得率逐渐增大,这可能是因为超声波可使原料质点在其传播空间内进入振动状态,产生空化现象,原料细胞部分被破坏,强化了溶质扩散,同时也极大促进了低共熔溶剂萃取离子态的多酚,因而其得率增加。当超声功率达到420 W后,多酚的得率降低,可能因为超声功率导致了多酚部分降解,从而其得率下降。因此,选择超声功率420 W进行后续实验。
2.3.2 超声温度对多酚得率的影响
在液料比10∶1,提取时间40 min,超声功率420 W的条件下,不同温度对多酚得率的影响如图3B。由图3B可知,当温度从30℃上升到45℃时,多酚得率呈上升趋势。但是继续升高温度,得率随温度的升高而下降。可能的原因是温度的升高会加速分子的运动,降低低共熔溶剂的粘度系数,同时增加扩散系数,增加表面张力,提高其对多酚的溶解度;而温度继续升高,可能导致部分热敏性的多酚,因而得率降低[20]。综合考虑,选择45℃作为沙棘籽粕多酚最佳提取温度。
2.3.3 液料比对多酚得率的影响
在超声功率420 W,提取温度45℃,提取时间40 min的条件下,考察不同料液比对多酚得率的影响,如图3C所示。由图3C可知,在液料比为14∶1之前,得率随液料比的增大而增大,在14∶1时达到最大,但在14∶1后得率稍有下降。在提取过程中,液料比的提高必然会在较大程度上提高传质推动力,有利于多酚得率的增加[21]。然而,当液料比增加到一定程度后,萃取剂已将多酚充分提出,再单纯加大溶剂比例对多酚的提取作用不明显,反而使得已吸附的多酚脱附重新回到待提取物中,导致得率出现下降[22]。因此,应选择14∶1作为沙棘籽粕多酚最佳提取液料比。

图3 多酚提取的单因素试验结果Fig.3 Results of the single factor test of polyphenol extraction
2.3.4 超声时间对多酚得率的影响
超声功率420 W,提取温度45℃,液料比14∶1,考察超声时间对多酚的得率的影响,如图3D所示,随着提取时间的延长,多酚的得率先上升,后下降,多酚得率50 min时达到最大,为3.54%。随着提取时间的继续延长,多酚的得率反而下降,这可能是由于提取时间过长提取液中的多酚部分被氧化所致。因此,最佳提取时间选用50 min。
2.4 响应面试验结果分析
2.4.1 回归模型的建立与分析
在单因素试验的基础上,选择超声功率、超声时间、超声温度对得率有显著影响的3个因素,设计了3因素3水平的响应面分析试验,以获得最佳提取工艺参数。BBD实验设计及结果见表2。
表2BBD试验设计及结果
Table2TheBBDdesignofexperimentandresults

序号Run因素FactorsX1X2X3多酚得率Polyphenolyield(%)149060452.99242050453.26335040451.37449040451.84542050453.28642040501.65749050402.23835060452.77942040401.341042050453.131142060502.861242060402.681335050502.231442050453.131549050502.591635050401.351742050453.11
采用Design-Expert 8.05软件对表2的响应面试验结果进行分析,得到试验条件与响应值间的回归模型:

式中:Y为多酚的得率(%);X1为超声功率(W);X2为超声时间(min);X3为超声温度(℃)。
对回归模型进行方差分析结果见表3。表3表明,得到的回归模型极显著(P<0.000 1),失拟项不显著(P=0.066 8>0.05),说明建立的模型是可靠的。相关系数R2为0.983 3,说明该模型拟合程度较好,预测值与实测值之间有较好的相关性,该模型可以用来预测提取沙棘籽粕多酚的得率。
表3回归模型的方差分析
Table3Analysisofvariance(ANOVA)forafittedregressionequation

方差来源Source平方和Sumofsquares自由度df均方MeansquareF值FvalueP值Pvalue显著性Significant模型Model7.9290.8845.84<0.0001∗X10.4710.4724.250.0017∗X23.2513.25169.33<0.0001∗X30.3710.3719.480.0031∗X1X20.01610.0160.810.3970nsX1X30.0710.0683.520.1027nsX2X34.22×10-314.22×10-30.220.6533nsX120.9910.9951.800.0002∗X220.8710.8745.100.0003∗X321.5011.5077.90<0.0001∗残差Residual0.1370.019失拟项LackofFit0.1130.0365.490.0668nsR2(adj)=0.9619R2=0.9833
注:*.差异显著(P<0.01);ns.差异不显著(P>0.05)
Note:*.Significant(P<0.01);ns.Not significant(P>0.05)
由方差分析结果可知,一次项X1、X2、X3均极显著(P<0.01),二次项X1X2、X1X3、X2X3均不显著(P>0.05),X12、X22、X32均极显著(P<0.01)。表明各因素与响应值之间不是简单的线性关系。从回归系数绝对值大小分析各因素对提取沙棘籽粕多酚得率影响依次为超声时间、超声功率、超声温度。
2.4.2 响应面交互作用分析
运用Design-Expert8.05软件,根据回归方程分析作响应面图,如图4所示。由图4可以看出,多酚得率随3个因素的变化均为开口向下的抛物线,即沙棘多酚得率最初随3个因素的逐渐增大而升高,在超过各因素中心值后,沙棘多酚得率随各因素的增大而下降。由3组图对比可知,超声时间(B)对沙棘多酚得率影响最为显著,表现为图4A、C中超声时间的曲面较陡,这与二次回归方程方差分析结果一致。由图4B可知,超声温度和超声功率交互作用不明显。
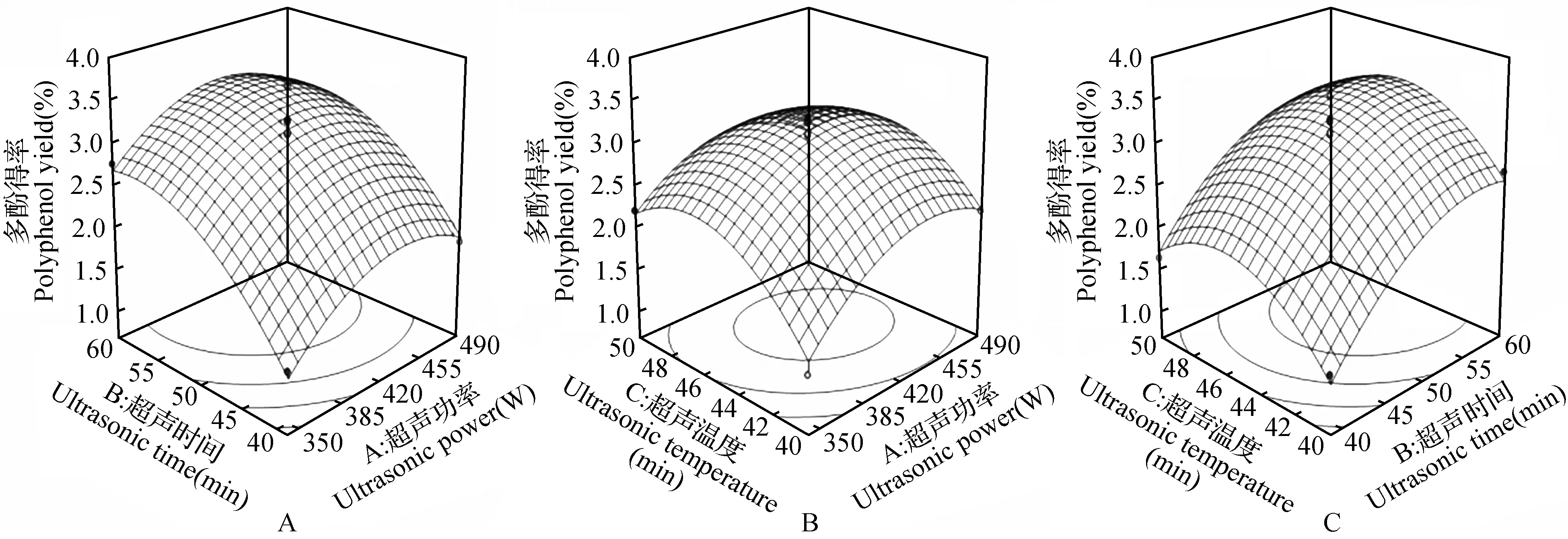
图4 各因素对多酚得率影响的响应面图Fig.4 Response surface plots for the ultrasonic power, ultrasonic time and ultrasonic temperature on polyphenol yield
2.5 最佳工艺条件的确定及验证实验
采用Design-Expert8.05软件进行最佳理论工艺优化得出最佳提取工艺参数为:超声功率451.11 W,超声时间56.35 min,超声温度44.46℃,在此条件下沙棘多酚得率为3.38%。综合考虑试验的可操作性、效率和成本等,将各因素确定为:超声功率420 W,超声时间56 min,超声温度44℃,在此条件下,多酚得率的实验验证值为(3.31±0.08)%,与理论值接近,说明本研究优化得到的提取沙棘多酚工艺参数是可靠的,可拟合实际提取过程。
2.6超声提取和传统热回流提取对沙棘籽粕多酚得率的对比分析
为了比较沙棘籽粕多酚不同方法的提取效果,取相同质量的沙棘籽粕,以含水量为30%的DES-3为提取剂,分别采用44℃热回流提取56 min,120 min;超声功率420 W、超声温度44℃、超声波辅助提取56 min,对沙棘籽粕多酚得率的对比分析如图5所示。由图5可知,当提取时间均为56 min时,超声辅助提取的得率为3.32±0.076%,是热回流提取的得率的1.6倍。热回流提取120 min的得率为3.25%与超声提取56 min的得率相当。对比结果说明超声辅助提取法的效率高于传统的热回流提取法。

图5 不同提取方法对多酚得率比较Fig.5 The comparison of the polyphenol yield with different extraction methods
3 结论
本文通过单因素和响应面分析实验优化获得了低共熔溶剂超声波辅助提取沙棘籽粕中的多酚的最佳工艺条件:以含水量为30%的氯化胆碱—草酸低共熔溶剂为提取剂,液料比为14∶1,超声功率420 W,超声时间56 min,超声温度44℃提取沙棘粕多酚。通过超声波辅助提取与传统热回流提取法比较,发现超声波辅助提取方法有具有较高的效率。本文的数据可为沙棘籽粕多酚的工业化提取提供参考。
1.何士敏,袁小娟,汪建华.中国沙棘属植物资源及其开发利用现状[J].现代农业科学,2008,15(11):87-92.
He S M,Yuan X J,Wang J H.The plant resources of Hippophae and its development and utilization status in China[J].Modern Agricultural Sciences,2008,15(11):87-92.
2.金怡,姚敏.沙棘的研究概况[J].中医药信息,2003,20(3):21-22.
Jin Y,Yao M.Research on seabuckthorn[J].Information on Traditional Chinese Medicine,2003,20(3):21-22.
3.张鞍灵,高锦明.中国沙棘果实化学成分初步研究[J].陕西林业科技,1999(2):14-15.
Zhang A L,Gao J M.A preliminary study on chemica constituents of the fruits ofHippophaerhamnoides[J].Shaanxi Forest Science and Technology,1999,(2):14-15.
4.顾关云.沙棘的化学成分、生物活性与临床研究[J].国外医药:植物药分册,2007,22(4):139-149.
Gu G Y.Studies on chemical constituents,bioactivities and clinical research of seabuckthorn[J].World Phytomedicines,2007,22(4):139-149.
5.傅建熙,田鹏,康靖全,等.沙棘籽的综合利用Ⅰ-沙棘籽油渣的化学成分研究[J].沙棘,2006,19(3):30-32.
Fu J X,Tian P,Kang J Q,et al.Comprehensive utilization of seabuckthorn seed:Ⅰ.chemical components of oil dregs[J].Hippophae,2006,19(3):30-32.
6.王昌涛,张佳婵,孙啸涛,等.鼠李糖脂/蔗糖酯辅助乙醇提取沙棘籽黄酮的工艺条件及初步鉴定[J].食品科学,2014,35(2):62-68.
Wang C T,Zhang J C,Sun X T,et al.Optimization of process conditions for the extraction of flavonoids from sea buckthorn seeds using ethanol combined with different surfactants and preliminary characterization of the extracted flavonoids[J].Food Science,2014,35(2):62-68.
7.田亚新,韩晓云,王运来,等.联合均匀设计法和Microsoft Excell优化沙棘籽原花色素提取工艺[J].食品科学,2012,33(16):91-95.
Tian Y X,Han X Y,Wang Y L,et al.Optimization of extraction program of sea buckthorn seeds proanthocyanidins by combining uniform design and Microsoft excel[J].Food Chemistry,2012,33(16):91-95.
8.陈亮,李医明,陈凯先,等.植物多酚类成分提取分离研究进展[J].中草药,2013,44(11):1501-1507.
Chen L,Li Y M,Chen K X,et al.Research progress in extraction and isolation of plant polyphenols[J].Chinese Traditional and Herbal Drugs,2013,44(11):1501-1507.
9.Wani T A,Wani S M,Ahmad M,et al.Bioactive profile,health benefits and safety evaluation of sea buckthorn(HippophaerhamnoidesL.):a review[J].Cogent Food & Agriculture,2016,2(1):1128519.
10.Arimboor R,Arumughan C.Sea buckthorn(Hippophaerhamnoides) proanthocyanidins inhibitinvitroenzymatic hydrolysis of protein[J].Journal of Food Science,2011,76(6):T130-T137.
11.Zhang Q H,De Oliveira Vigier K,Royer S,et al.Deep eutectic solvents:syntheses,properties and applications[J].Chemical Society Reviews,2012,41(21):7108-7146.
12.Guo W J,Hou Y C,Wu W Z,et al.Separation of phenol from model oils with quaternary ammonium salts via forming deep eutectic solvents[J].Green Chemistry,2013,15(1):226-229.
13.Xu K J,Wang Y Z,Huang Y H,et al.A green deep eutectic solvent-based aqueous two-phase system for protein extracting[J].Analytica Chimica Acta,2015,864:9-20.
14.Dai Y T,Van Spronsen J,Witkamp G J,et al.Natural deep eutectic solvents as new potential media for green technology[J].Analytica Chimica Acta,2013,766:61-68.
15.Bubalo M C,Curko N,Tomaševic M,et al.Green extraction of grape skin phenolics by using deep eutectic solvents[J].Food Chemistry,2016,200:159-166.
16.谢阳姣,谢冬养,何志鹏,等.油茶籽饼多酚丙酮提取工艺研究[J].南方农业学报,2012,43(3):376-379.
Xie Y J,Xie D Y,He Z P,et al.Extraction of polyphenols from oil-tea(CamelliaoleiferaL.) seed cake using acetone solvent[J].Journal of Southern Agriculture,2012,43(3):376-379.
17.王徐卿,沈建福,王敏,等.油茶籽饼多酚的乙醇提取工艺优化研究[J].浙江林业科技,2007,27(3):41-44.
Wang X Q,Shen J F,Wang M,et al.Study on extracting technology of polyphenol from oil-tea seed cake with ethanol[J].Journal of Zhejiang Forestry Science and Technology,2007,27(3):41-44.
18.Dai Y T,Witkamp G J,Verpoorte R,et al.Tailoring properties of natural deep eutectic solvents with water to facilitate their applications[J].Food Chemistry,2015,187:14-19.
19.Bi W T,Tian M L,Row K H.Evaluation of alcohol-based deep eutectic solvent in extraction and determination of flavonoids with response surface methodology optimization[J].Journal of Chromatography A,2013,1285:22-30.
20.姚晓慧,段喜华,段明慧,等.鹿蹄草中2″-O-没食子酰基金丝桃苷的提取工艺研究[J].植物研究,2012,32(4):497-500.
Yao X H,Duan X H,Duan M H,et al.Ultrasound-assisted Extraction of 2″-O-galloylhyperin fromPyrolacallianthaH.Andr.[J].Bulletin of Botanical Research,2012,32(4):497-500.
21.李大婧,宋江峰,刘春泉,等.超声波辅助提取黑豆皮色素工艺优化[J].农业工程学报,2009,25(2):273-279.
Li D J,Song J F,Liu C Q,et al.Optimization of technology for ultrasonic-assisted extraction of pigments from black soybean hulls[J].Transactions of the CSAE,2009,25(2):273-279.
22.崔萌,胡乐根,马停停,等.离子液体在番茄红素提取中的应用研究[J].化学研究与应用,2012,24(11):1771-1776.
Cui M,Hu L G,Ma T T,et al.Ultrasonicwave-assisted extraction of lycopene from fresh tomato with ionic liquid[J].Chemical Research and Application,2012,24(11):1771-1776.
The Fundamental Research Funds for the Central Universities(2572015EA04)
introduction:NI Yu-Jiao(1992—),female,master,research on plant resources development and utilization.
date:2017-02-27
ProcessOptimizationofUltrasonicAssistedDeepEutecticSolvents(DESs)ExtractionofPolyphenolsfromHippophaerhamnoidesSeedMeal
NI Yu-Jiao1ZHAO Chun-Jian1LI Chun-Ying1*LI Guo-Chun2WANG Kai-Ting1ZHANG Yu-Kun1
(1.Key Laboratory of Forest Plant Ecology,Ministry of Education,Northeast Forestry University,Harbin 150040;2.Heilongjiang Province Forestry Survey and Planning Institute,Harbin 150040)
A range of deep eutectic solvents(DESs) as the solvent were used for extraction polyphenols with ultrasonic-assisted extraction methods from sea buckthorn. According to the single-parameter study, experiment factors(ultrasonic power、ultrasonic time、ultrasonic temperature) remarkably affected the yield of polyphenols were selected and Box-Behnken experimental design was investigated to be optimized by response surface methodology. The results indicated that with 30% water in Choline chloride-Oxalic acid as the suitable solvent and liquid to material ratio of 14∶1, the optimal conditions of ultrasonic extraction were as follows: ultrasonic power of 420 W, ultrasonic time of 56 min, and ultrasonic temperature of 44℃. Under these conditions, the yield of polyphenols was(3.31±0.08)%. Comparison experiment indicated that the extraction efficiency of polyphenols from sea buckthorn seed meal by DES was superior to the traditional solvent. Compared with the heat refluxing extraction method, DESs extraction method was a extraction technology with high efficiency.
deep eutectic solvents(DESs);ultrasonic-assisted extraction;sea buckthorn seed meal;polyphenol
中央高校基本科研业务费专项资金项目(2572015EA04)
倪玉娇(1992—) ,女,硕士研究生,主要从事植物资源开发与利用研究。
* 通信作者:E-mail:lcy@nefu.edu.cn
2017-02-27
* Corresponding author:E-mail:lcy@nefu.edu.cn
Q949.9
A
10.7525/j.issn.1673-5102.2017.03.020
