流式细胞术检测胞内细胞因子的经验分析
2017-11-09颜彩玲周瑞祥
颜彩玲, 张 慧, 周瑞祥
流式细胞术检测胞内细胞因子的经验分析
颜彩玲1, 张 慧2, 周瑞祥1
目的探讨流式细胞术检测胞内细胞因子的注意事项。方法制备小鼠脾脏淋巴细胞悬液。采用细胞表面抗原CD4、CD25及细胞核内因子FOXP3染色检测调节T细胞,胞内因子TNF-α的检测采用PMA/Ionomycin,anti-CD3/CD28,PMA/Ionomycin 与anti-CD3/CD28联合3种方案进行刺激,比较不同刺激条件下TNF-α胞内因子的表达情况,培养后各组细胞悬液采用固定破膜处理技术进行细胞表面抗原CD3、CD4及细胞内因子TNF-α染色。结果脾脏淋巴细胞悬液制备中研磨、裂解红细胞及染色过程中破膜等操作的不当,均导致前向/侧向(FSC/SSC)点图中目的细胞群模糊不清,从而影响后续分析。新鲜脾脏淋巴细胞得率、CD3+T淋巴细胞得率及TNF-α表达率与冻存的脾脏各类细胞比较,差别无统计学意义(P>0.05)。胞内因子TNF-α检测结果显示,刺激组PMA/Ionomycin以及anti-CD3/CD28表达率显著高于未刺激组(P<0.05),PMA/Ionomycin与anti-CD3/CD28联合刺激组的表达率也显著高于未刺激组和独立刺激组(P<0.05)。结论流式细胞术胞内细胞因子的检测有很多影响因素,包括脾脏细胞悬液制备中的研磨、裂解红细胞操作,染色处理过程中的破膜、固定,上机检测过程中补偿的调节、对照的设置等均影响实验结果,检测前应注意摸索选择适合待测胞内因子的测定条件。
流式细胞术; 细胞因子类; 小鼠
辅助性T淋巴细胞(T helper, Th)是人体内免疫系统的重要组成部分。研究表明,CD4+T淋巴细胞亚群如Th1,Th2,Th17和调节T细胞(regulatory T cells,Treg),其相关细胞因子及Th1/Th2和Treg/Th17的稳态平衡在机体抗肿瘤免疫、肿瘤免疫逃避和耐受机制、肿瘤免疫微环境以及机体免疫稳态中发挥重要作用,对恶性肿瘤的发生、发展及预后至关重要[1]。
检测细胞因子是判断机体免疫功能的一个重要指标。目前,检测单个细胞特定细胞因子的表达手段有Elispot、原位杂交、免疫细胞化学、限制性稀释分析和单细胞PCR,但各自存在局限性而难以推广。胞内因子的流式检测法是运用不同荧光标记的抗细胞因子抗体与细胞表面或胞内特定亚群的抗体组合,可以在同一个细胞内同时检测多种细胞因子,也可根据细胞免疫表型区分分泌细胞因子的细胞亚型,进行多参数相关分析[2]。但在胞内细胞因子的流式测定中,常出现一些异常的实验结果。为制备适于流式细胞仪检测的被检样品及保证获取数据的准确性,笔者通过对核内因子FOXP3及胞内因子TNF-α的检测反复进行实验,总结了一些注意事项,现报告如下。
1 材料与方法
1.1材料
1.1.1 试剂 带荧光标记的单抗CD3-APC(批号: 17-0032);CD4-FITC(批号:11-0041);TNF alpha-PE(TNF-α-PE,批号: 12-7321);Treg检测试剂盒Mouse Regulatory T Cell Staining Kit #2(CD4-FITC、CD25-PE、FOXP3-APC,批号: 88-8118);同型对照IgG1(批号: 12-4301)和IgG2a(批号: 17-4321)及抗CD3单抗和抗CD28单抗[Anti-Mouse CD3e,anti-CD3,Functional Grade Purified(145-2C11),批号: 16-0031;Anti-Mouse CD28 ,anti-CD28,Functional Grade Purified(37.51),批号: 16-0281];破核膜的固定破膜剂:[Permeabilization Buffer(10×)(批号: 00-8333-56);Fixation/Permeabilization Concentrate(批号: 00-5123-43);Fixation/Permeabilization Diluent(批号: 00-5223-56);Flow Cytometry Staining Buffer(批号: 00-4222-57)]均购自美国eBiosciences公司,上述所有试剂的储存及作用温度均为4 ℃。
胞内因子检测刺激/阻断剂Leukocyte Activation Cocktail, with BD GolgiPlugTM(批号: 550583),存于-80 ℃,用时37 ℃水浴快速解冻;固定/通透液Fixation/Permeabilization solution(批号:554722),储存及作用温度均为4 ℃;细胞清洗/稀释液Perm/WashTMBuffer(批号:554723),储存及作用温度均为4 ℃,均购自美国BD Pharmingen公司。
RPMI 1640 培养液(批号:SH30809.01B)、HEPES缓冲液(批号:US16924-500ML)、丙酮酸钠溶液(批号:SH30239.01)、L-谷氨酰胺(批号:SH30034.01)、青霉素-链霉素溶液(批号:SV30010)、PBS缓冲液(批号:SH30256.01B)均购自美国Hyclone公司。胎牛血清(fetal calf serum,FCS,批号:10100147,美国Gibco公司);β-巯基乙醇(批号: DH195-1,中国北京鼎国生物科技有限公司);红细胞裂解液自行配置(配置方法为:250 mL双蒸水加NH4CL 2.07 g,KHCO30.25 g Na2EDTA 9.3 mg,0.22 μm过滤);台盼蓝0.4%(终浓度为0.2%)。
完全RPMI 1640培养基为RPMI 1640培养液+青霉素(100 U/mL),链霉素(100 mg/mL),β-巯基乙醇 (50 mmol/L),L-谷氨酰胺(2 mmol/L),丙酮酸钠溶液(1 mmol/L),10% FCS,HEPES。
1.1.2仪器 流式细胞分析仪(FACS Verse型,美国Becton Dickinson公司);低速台式离心机(TDL-5C型,中国上海安亭科学仪器厂);CO2培养箱(水套式)(Forma 3111型,美国Thermo scientific 公司);漩涡混合器(QL-901型,海门市其林贝尔仪器制造有限公司)。
1.2方法
1.2.1脾细胞的制备 颈椎脱臼法处死小鼠,无菌取出脾脏,置于含PBS培养皿内的Cell Strainer(40 μm,美国BD公司)中,用1 mL注射器头轻轻研磨。收集细胞悬液,1 000 r/min离心5 min弃上清液。加入5 mL 37 ℃预温的红细胞裂解液,混匀,室温裂解5 min,加入5 mL PBS,1 000 r/min离心5 min,弃上清液。PBS洗涤1次,取50 μL细胞于1.5 mL EP管中,予950 μL PBS稀释20倍计数。使用10 μL台盼蓝和10 μL细胞悬液对倍稀释计数。活细胞比例>95%,可用于后续实验。
1.2.2TNF-α胞内因子检测细胞刺激及培养 将脾细胞以1×106mL-1重悬于完全RPMI 1640培养液中,置于24孔培养板中,每1 mL培养液加2 μL Leukocyte Activation Cocktail with BD GolgiPlug,anti-CD3终浓度为2 μg/mL,anti-CD28终浓度为 1 μg/mL。实验设未刺激组、PMA/Ionomycin刺激组、anti-CD3/CD28刺激组、PMA/Ionomycin 与 anti-CD3/CD28联合刺激组,各组细胞置孵箱(37 ℃,体积分数为0.05的CO2)培养6 h。
1.2.3表面抗原及细胞因子染色 收集培养后细胞,PBS洗涤1次,调整细胞浓度为5×106mL-1,每检测管取100 μL。Treg实验中每检测管各加入0.5 μL FITC-CD4,0.5 μL PE-CD25;TNF-α实验中每检测管加入0.3 μL APC-CD3,0.5 μL FITC-CD4,充分混匀,4 ℃避光孵育15 min,用冰预冷PBS洗涤细胞(1 000 r/min,5 min),弃上清。
1.2.3.1TNF-α实验 低转速旋涡震荡重悬细胞,每管加入250 μL BD Fixation/Permeabilization solution,并再次低转速旋涡混匀,避光4 ℃孵育20 min;用2 mL预冷的1×BD Perm/WashTMBuffer 洗涤细胞(1 000 r/min,5 min),弃上清,细胞沉淀重悬于50 μL 1×BD Perm/WashTMBuffer中,每检测管加入2.5 μL TNF-α-PE抗体,充分混匀,避光4 ℃孵育30 min;用2 mL 预冷的1×BD Perm/WashTMBuffer洗涤细胞(1 000 r/min,5 min),弃上清,用500 μL的流式固定液重悬细胞,待上机分析。
1.2.3.2Treg实验 低转速旋涡震荡重悬细胞,每管加入1 mL新鲜配置的eBiosciences Fixation/Permeabilization working solution,并再次低转速旋涡混匀,避光4 ℃孵育25 min,1 000 r/min,5 min离心,弃上清,细胞沉淀重悬于1 mL 1×Permeabilization Buffer中,1 000 r/min,5 min离心,弃上清,细胞沉淀重悬于200 μL 1× Permeabilization Buffer中,每检测管中加入0.5 μL APC-FOXP3抗体,4 ℃,避光30 min,用2 mL 预冷的Flow Cytometry Staining Buffer洗涤细胞(1 000 r/min,5 min),弃上清,用500 μL的流式固定液重悬细胞,待上机分析。
1.2.4流式细胞仪检测细胞因子 流式细胞仪激发光为氩离子激光488 nm及氦氖激光633 nm谱线,调节仪器电压及补偿,每一检测样品收集10 000个细胞,采用FACSuite软件获取分析细胞。以前向散射光(forward scatter,FSC)及侧向散射光(side scatter,SSC)设门区分淋巴细胞,Treg检测以CD4/SSC散点图设门区分CD4+细胞,检测CD4+细胞中CD25+/FOXP3+细胞的比例。胞内因子TNF-α检测以CD3/CD4散点图设门区分CD3+细胞,检测CD3+细胞中CD4+/TNF-α+细胞的比例。FL2及FL4荧光通道弱表达因子CD25及FOXP3均以相应同种型IgG染色细胞为阴性对照,并仔细设置FL1与FL2,FL1与FL4,FL2与FL4之间的荧光补偿。

2 结 果
2.1单细胞悬液获取
2.1.1研磨影响 小鼠脾脏研磨成功样品FSC/SSC中可见完整清晰的目的细胞群(图1A),研磨失败样品图中碎片很多,背景高,目的细胞群模糊不清(图1B);正常研磨和裂解红细胞后脾细胞获得较多大小均一,透亮的淋巴细胞,台盼蓝染色200倍(图1C);研磨过度的脾细胞,台盼蓝染色200倍可见细胞碎片,死细胞较多(图1D)。

A:研磨成功前向/侧向散点图; B:研磨失败前向/侧向散点图; C:研磨成功(台盼蓝染色 ×200); D:研磨失败(台盼蓝染色 ×200).图1 小鼠脾细胞研磨效果的分析Fig 1 The effect analysis on mice splenocytes with successful and failed disaggregation
2.1.2红细胞裂解影响 小鼠脾细胞样品红细胞裂解成功,FSC/SSC图中可见清晰的目的细胞群;反之,红细胞裂解失败,图中只有碎片(图2)。

FSC:前向散射光; SSC:侧向散射光. A:红细胞裂解成功;B:红细胞裂解失败.图2 小鼠脾细胞裂解红细胞成功及失败的前向/侧向散点图Fig 2 The successful and failed red blood cell depleting FSC/SSC dot plots of mice splenocytes
2.2新鲜、冻存脾脏细胞表达影响 新鲜脾脏细胞淋巴细胞得率、CD3+T淋巴细胞得率及TNF-α表达率与冻存脾脏细胞比较,差别无统计学意义(P>0.05,图3,表1)。
2.3不同刺激剂对结果的影响 胞内因子TNF-α检测,PMA/Ionomycin刺激组与anti-CD3/CD28刺激组表达率显著高于未刺激组(P<0.05),二者联合刺激表达率也显著高于其他各组(P<0.05,图4~5)。
2.4破膜对检测结果的影响 Treg实验中,破膜成功样品FSC/SSC图可见清晰的目的细胞群,后续表达分析正常;破膜失败样品FSC/SSC图中碎片很多,背景高,目的细胞群模糊不清,后续表达分析失败。

表1 新鲜及冻存小鼠脾脏细胞的淋巴细胞得率、CD3+T淋巴细胞得率及TNF-α表达率
2.5上机检测
2.5.1补偿调节影响 正确补偿,PE-A Median值相等;补偿不到位,FITC荧光漏到PE检测器中;过度补偿,FITC阳性群体压线(图7,表2)。
2.5.2胞内低含量细胞因子检测的细胞补偿及Beads补偿的比较分析 低表达因子FOXP3 细胞样品用APC单染,表达图几乎看不到阳性群,补偿调节困难;用补偿beads的样品则可以看到很强的阳性群体,补偿调节容易。

FSC:前向散射光; SSC:侧向散射光. A:新鲜脾脏细胞;B:冻存脾脏细胞.图3 新鲜及冻存脾脏细胞小鼠脾细胞TNF-α(Q2:CD4+/TNF-α+)的表达Fig 3 Expression of TNF-α(Q2:CD4+/TNF-α+)in fresh and frozen mice splenocytes
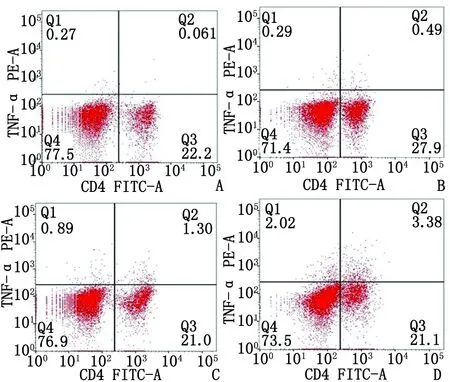
A:未刺激组,3 μg/mL BFA 作用6 h;B:50 ng/mL PMA、0.5 μg/mL Ionomycin及3 μg/mL BFA 作用6 h; C:2 μg/mL anti-CD3、1 μg/mL anti-CD28及3 μg/mL BFA 作用6 h; D:50 ng/mL PMA、0.5 μg/mL Ionomycin、2 μg/mL anti-CD3、1 μg/mL anti-CD28及3 μg/mL BFA作用6 h.图4 不同体外刺激条件下小鼠脾细胞的TNF-α的(Q2:CD4+/TNF-α+)表达Fig 4 Expression of TNF-α (Q2:CD4+/TNF-α+) in mice splenocytes with different in vitro stimulation
2.5.3对照设置 不染色对照,FSC/SSC图可见清晰的细胞群,后续表达图均显示为阴性群体,对照正常。同型对照1和2的前向/侧向Treg散点图细胞经破膜处理,细胞群体变小,但目的细胞群依然清晰可见,后续表达图CD25及FOXP3为阴性。将CD25及FOXP3表达线设在阴性位置,处理组表达图依据前面的空白及同型对照画门位置,确定阳性群体表达的位置,本研究(Q2:CD4+/CD25+/FOXP3+)表达率为7.29%。

与未刺激组(只用3 μg/ mL BFA 作用6 h)比较,△:P<0.05; PMA/Ionomycin+ anti-CD3/CD28联合刺激组与PMA/Ionomycin刺激组比较, a:P<0.05. PMA/Ionomycin+ anti-CD3/CD28联合刺激组与anti-CD3/CD28刺激组比较,b:P<0.05.图5 不同体外刺激条件下小鼠脾细胞的TNF-α表达率Fig 5 TNF-α expression rate of splenocytes under different stimulation in vitro

A:破膜成功;B:破膜失败.图6 调节T细胞检测破膜成功与失败的表达图Fig 6 Analysis of regulatory T cells in the successful and failed permeabilization of cell membrane
表2FITC单染管各调节状态图补偿中位值
Tab2Each state diagram adjusted median compensation of FITC staining tube

群 体正确补偿PE⁃AMedian补偿不到位PE⁃AMedian过度补偿PE⁃AMedianQ4695Q36163-33
3 讨 论
流式细胞术检测胞内细胞因子是一种相对快速、重复性好并能准确定量的方法。但由于胞内分析步骤复杂,涉及变异因素多,可能会出现结果不稳定,较难重复等问题。笔者综合近几年的实验经验,以小鼠脾细胞Treg及胞内因子TNF-α检测为例,从单细胞样品的制备、细胞刺激及培养、细胞染色、上机分析等几方面的经验谈谈心得。
实体组织的单细胞悬液制备通常有机械-打散法和机械-酶消化法[3]。机械分散法主要包括剪碎法、网搓法、研磨组织法使细胞从紧密联结的组织中释放出来,机械-酶消化法是先用机械法将组织初步分散再用酶进一步消化分离;脾脏主要还是通过物理研磨方法获取单细胞悬液[4-5],分离过程中研磨操作动作应轻柔快速,若研磨太久,细胞不易培养,完整形态细胞比例低(图1)。

A:正确补偿; B:补偿不到位; C:过度补偿.图7 FITC单染管各调节状态图补偿图Fig 7 Compensation images of FITC staining tube under different conditions
研磨后的脾脏细胞含红细胞,而流式分析的是经荧光标记的单细胞悬液,因此样品需要进行除红细胞处理,可以用红细胞裂解液进行裂红处理。红细胞裂解液有商品化的,也可以自行配置,主要成分是氯化铵[6],一般以10倍母液的浓度存放,否则会形成碳酸铵而失效。工作液最好当天用当天配,隔天效果不好,此外裂解的效果还跟混匀及时长有很大关系,实验前应摸索最佳作用方案,否则可能导致淋巴细胞破碎(图2)。小鼠的脾细胞培养一般为基础1640培养液同时添加HEPES、谷氨酰胺及丙酮酸钠,热失活胎牛血清和巯基乙醇[7-10]。

A:FOXP3-APC细胞补偿; B:FOXP3-APC补偿beads补偿.图8 低表达因子FOXP3的细胞补偿及补偿beads的补偿图Fig 8 Cellular compensation and compbeads compensation of low expression factor FOXP3
免疫平衡实验,从建模成功取新鲜脾脏组织到最终的上机检测,需要很大的工作量,包括取新鲜脾脏、研磨组织获取单细胞悬液、刺激或不刺激直接染色等操作。样本量大的情况下,经常要通宵实验,耗费体力又导致实验结果不理想,因此可以考虑将获取的单细胞悬液冻存,待时间较充裕时再进行刺激或染色等操作。本研究比较了新鲜及冻存小鼠脾细胞对检测的影响,结果表明,新鲜脾脏细胞淋巴细胞得率、CD3+T淋巴细胞得率及TNF-α表达率与冻存脾脏细胞比较,差别无统计学意义。因此可以考虑将获取的单细胞悬液冻存,后续再检测。临床样品分批收集的特性,更有必要如此操作,通常都是将外周血样品分离单个核细胞后冻存再复苏刺激或直接染色。
未激活的淋巴细胞不产生(或产生极低水平)细胞因子,流式细胞仪很难直接检测, 因此在检测前需人为刺激活化细胞。常用刺激剂有佛波酯和离子霉素、抗CD3单抗和抗CD28单抗、刀豆蛋白A、植物血凝素等。不同因子的适用刺激剂也不大一样。本研究以TNF-α检测为例,采用PMA/Ionomycin,anti-CD3/CD28以及两者联合刺激,结果表明,不加刺激剂几乎检测不到,单独使用PMA /Ionomycin,anti-CD3/CD28有表达,两者一起使用表达更高,具有协同效应(图4,5)。实验过程中,实验者可以根据实际情况参考文献并摸索最佳刺激方案。细胞内因子检测影响因素比较多,有没有激活和是否正确染色操作是关键,如果设置了各对照组,仍然为阴性结果,可以加表染分子CD69和胞内CD69做鉴定,确定细胞是否激活、通透,胞内染色是否正确进行,具体做法参考BD激活淋巴细胞胞内细胞因子检测说明书。
染色过程中,细胞固定和破膜打孔也十分重要。固定细胞可保持细胞形态并使之经受起破膜处理,破膜是用打孔液将细胞膜打孔,使抗细胞因子单抗穿过细胞膜,与胞内细胞因子特异性结合。破膜剂主要分胞内和核内两类,核内破膜剂基本上可以用于胞内染色,但胞内破膜剂不能用于核内染色,实际应用中,应尽量寻找一种对抗原影响与对物理参数影响小的破膜剂。Amidazdeh等对比过Tween-20、Triton X-100、NP-40、蛋白酶K、链球菌溶血素O、皂素等在检测贴壁细胞18S RNA中对细胞FSC/SSC的影响,发现Tween-20最好,皂素次之,而其他影响较明显[11]。此外,操作过程还应注意控制温度时间等条件,避免破膜过度导致细胞破碎导致实验失败。
流式细胞术的优点是同时可以进行多参数检测,快速并且信息量大。然而,荧光染料的发射光谱往往有很宽的范围,同时使用不同的荧光素,发射的荧光信号在很多波段都不可避免会发生重叠现象。多色实验时,如果不对这种现象进行适当的修正,就会造成每个荧光检测器接收到的是多个抗体荧光发出的混合荧光信号,从而导致假阳性的结论,也影响对细胞群体的判断。因此,要保证多色荧光的分析就必须设置细胞仪各荧光检测器之间的补偿。荧光补偿设置中流式抗体单染色的样本首选通常是细胞,但是当细胞数量有限,无多余细胞用于抗体单染或感兴趣的表面抗原表达较低,阳性分群不明显导致调节补偿困难时,建议选择补偿微球。补偿微球能如细胞一样与抗体稳定结合,阴性、阳性群体区分清晰,并能与正式实验所用相同的抗体同步进行染色、孵育、洗涤等,能有效反映所用抗体的荧光染色效果,从而达到对补偿正确评判计算的目的。
流式实验中会用到各种对照,如空白对照(未染色对照)、单色对照、同型对照、荧光扣除对照(fluorescence minus one,FMO)等。未染色对照可确定染色背景或自发荧光;单色对照用于设置目的细胞的补偿;同型对照可以去除抗体非特异结合而形成的本底,但多色试验中不能定义由其他荧光通道渗漏而来的荧光;FMO对照则可以去除由于荧光渗漏而引起的本底信号。简言之,同型对照和FMO对照是最为常用的设门对照,但并不是在检测任何指标时都需设立这些对照,若阳性和阴性细胞可明显分群,可用空白对照。胞内因子检测,未刺激对照、同型对照、空白对照均可用来界定阳性阴性群体表达线,但未刺激对照与同型对照更优。

A:不染色对照;B:同型对照1(CD4-FITC,CD25-Iso type,FOXP3-APC);C:同型对照2(CD4-FITC,CD25-PE,FOXP3-Iso type);D:处理组表达图(CD4-FITC,CD25-PE,FOXP3-APC).图9 调节T细胞检测表达图Fig 9 Strategy for the analysis of T regulation cells
[1] 袁 芳. Th1/Th2和Th17/Treg平衡失调与宫颈癌发生发展关系及术后CD4+淋巴细胞亚群的改变[D]. 济南:山东大学医学院妇产科,2014.
[2] 李路远, 刘俊燕, 钟 岗,等. 流式细胞术检测小鼠脾细胞内细胞因子刺激方案的筛选[J].中国病原生物学杂志,2010,5(7):485-489.
[3] 任兴昌,方 黎,陈洪勋. 实体组织单细胞悬液制备方法[J].临床与实验病理学杂志, 2007,23(4):490-491.
[4] Peng H, Sun R, Zhang Q,etal. Interleukin 33 mediates type 2 immunity and inflammation in the central nervous system of mice infected with angiostrongylus cantonensis[J].JInfectiousDiseases,2012,207(5):860-869.
[5] 孙黎飞. 细胞免疫学实验研究方法[M].北京:人民军医出版社,2009:23-24.
[6] 陈朱波, 曹雪涛. 流式细胞术——原理·操作及应用[M].2版.北京:科学出版社,2014:52-55.
[7] Sheng H, Wang Y,Jin Y,etal. A critical role of IFNgamma in priming MSC-mediated suppression of T cell proliferation through up-regulation of B7-H1[J].CellResearch,2008,18(8):846-857.
[8] Krieg C, Han P, Stone R,etal. Functional analysis of B and T lymphocyte attenuator engagement on CD4+ and CD8+ T cells[J].JImmunology,2005,175(10):6420-6427.
[9] Li X, Murray F, Koide N,etal. Divergent requirement for Gαs and cAMP in the differentiation and inflammatory profile of distinct mouse Th subsets[J].JClinicalInvestigation,2012,122(3):963-973.
[10] Zago C A, Bortoluci K R, Sardinha L R,etal. Anti-IL-2 treatment impairs the expansion of Treg cell population during acute malaria and enhances the Th1 cell response at the chronic disease[J].PloSOne,2012,7(1):264-264.
[11] Amidzadeh Z, Behbahani A B, Erfani N,etal. Assessment of different permeabilization methods of minimizing damage to the adherent cells for detection of intracellular RNA by flow cytometry[J].AvicennaJMedBiotechnol,2014,6(1):38-46.
TheEmpiricalAnalysisofIntracellularCytokinesDetectionwithFlowCytometry
YANCailing1,ZHANGHui2,ZHOURuixiang1
1.SchoolofBasicMedicalSciences,FujianMedicalUniversity,Fuzhou350122,China;2.FujianCenterforSafetyEvaluationofNewDrug,FujianMedicalUniversity,Fuzhou350122,China
Objective To investigate factors that may affect the detection of intracellular cytokines with flow cytometry.MethodsSplenocytes from mice were disaggregated, and regulatory T cells (Treg) were detected by staining of CD4, CD25, and intranuclear transcription factor FOXP3. For the detection of TNF-α, splenocytes were stimulated with PMA/Ionomycin, anti-CD3/CD28 or PMA/Ionomycin plus anti-CD3/CD28, respectively. Following activation, the cells were stained with anti-CD3 APC and anti-CD4 FITC, then intracellularly stained to detect TNF-α after fixation and permeabilization. Controls were designed for both experiments.ResultsThe improper operations in the grinding, lysing erythrocytes, fixing and perming the cells all leaded to indistinct target cells of interest in the FSC/SSC dot plots, which affected the subsequent analysis. There were no significant differences in the percentages of lymphocytes, CD3+T lymphocytes, and TNF-α producing cells between the fresh and frozen samples(P>0.05). Expression of TNF-α in cells stimulated by PMA/Ionomycin, anti-CD3/CD28, or combined stimulation groups were significantly higher than controls(P<0.05).ConclusionMany factors may affect the detection of intracellular cytokines by flow cytometry,including the spleen, lysing erythrocytes in the preparation of splenocytes suspension, fixing and perming the cells during dyeing, adjusting the compensation values, designing controlled trials and so on. Therefore, attentions should be paid to explore and select the suitable conditions for studying intracellular factors before testing.
flow cytometry;cytokines;mice
R332; R341.1; R392.21; R977.6
A
1672-4194(2017)05-0303-08
2017-01-04
福建省科技计划项目(2012Y0033)
福建医科大学,福州 350122 1.基础医学院;2. 新药安全性评价中心
颜彩玲,女,实验师,发酵工程硕士
周瑞祥. Email: 1096330863@qq.com
(编辑:张慧茹)
