高脂诱导对小鼠血清中脂肪酸含量的影响
2017-11-09崔晓旭李春艳张秀英
王 通 , 崔晓旭 , 李春艳 , 张秀英
(东北农业大学动物医学学院 , 黑龙江 哈尔滨 150030)
高脂诱导对小鼠血清中脂肪酸含量的影响
王 通 , 崔晓旭 , 李春艳 , 张秀英
(东北农业大学动物医学学院 , 黑龙江 哈尔滨 150030)
本试验采用气相色谱方法检测小鼠血清中脂肪酸的含量,研究高脂诱导对小鼠血清中脂肪酸含量的影响。实验小鼠随机分为野生型对照组(WT-ND)和野生型高脂组(WT-HFD),每组10只,采用高脂饲料连续饲喂6周后眼球采血收集血液,分离血清,皂化衍生后采用气相色谱检测脂肪酸含量。结果显示,与对照组相比,饲喂高脂后小鼠血清中C12∶0、C14∶0、C15∶0、C16∶0、C18∶0、C18∶1、C18∶2、C18∶3、C20∶1、C20∶2和C20∶3的含量呈上升趋势,而C17∶0、C20∶4和C22∶6呈下降趋势。结果表明,高脂诱导能使血清中脂肪酸含量发生明显变化,会加重脂肪酸代谢类疾病发展过程。
脂肪酸 ; 气相色谱 ; 野生型ICR小鼠 ; 高脂饲料
脂肪酸是天然油脂与水发生分解反应生成的脂肪族羧酸化合物,是脂类的重要组成部分。目前发现的天然脂肪酸有200多种,广泛存在于动植物油脂中[1]。根据碳原子双键的数目(饱和度),可分为饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA);根据甲基端第一个双键所连接碳原子的编号可分为n-3 族、n-6 族、n-7 族、n-9 族[2]。
其中n-3族系列主要包含α-亚麻酸(C18∶3)、C20∶5(EPA)、C22∶5(DPA)和C22∶6(DHA)[3]。n-6族系列主要包含亚油酸(C18∶2)、γ-亚麻酸(C18∶3)和花生四烯酸(C20∶4,ARA)。两个系列都具有改善脂质代谢、预防心脑血管疾病、调节免疫系统、抗癌等作用,但是n-3族系列效果显著[1]。大量文献研究指出,n-6族和n-3族系列脂肪酸的比值会对脂代谢及免疫功能产生不同影响,因此确定合适的n-6族和n-3族比例是研究动物免疫功能的关键[4]。
脂肪酸去饱和酶存在于大多数生物中,在PUFA生物转化过程中起到重要作用。主要有Δ9、Δ6和Δ5 3种,分别在长链脂肪酸的特定位置去饱和变成双键[5]。目前直接测量去饱和酶的活性比较困难,但是去饱和酶在不同脂肪酸系列的代谢途径催化不同的去饱和反应,利用脂肪酸生成物与前体的比值评估去饱和酶的活性,大量实验已经证明该方法的准确性[6]。
Δ9-16去饱和酶=[16∶1(n-7)/16∶0] Δ9-18去饱和酶= [18∶1(n-9)/18:0] Δ6去饱和酶=[18∶3(n-6)/18∶2(n-6)] Δ5去饱和酶=[20∶4(n-6)/20∶3(n-6)] 脂肪生成指数=[18∶2(n-6)/16∶0]
1 材料与方法
1.1 试验材料
1.1.1 试验动物 8周龄野生型ICR雄性小鼠,体重18~20 g,SPF级,20只,购自于中国农业科学院哈尔滨兽医研究所实验动物中心,合格证号:008702。小鼠分笼饲养,自由饮水与进食。
1.1.2 试验药品与试剂 脂肪酸标准品和13%BF3-甲醇溶液由美国Sigma公司提供;色谱级正己烷由天津市化学试剂六厂分厂提供。
1.1.3 主要仪器 气相色谱仪(日本岛津公司);N2吹干仪(美国OA-SYS公司);梅特勒万分之一天平(上海梅特勒托利多仪器有限公司)。
1.1.4 脂肪酸标准品溶液的配制 分别精密称取C12∶0、C14∶0、C15∶0、C16∶0、C17∶0、C18∶0、C18∶1、C18∶2、C18∶3、C20∶0、C22∶0、C23∶0、C20∶1、C20∶2、C20∶3、C20∶4、C22∶6脂肪酸标准品各3 mg直接皂化衍生,所得脂肪酸甲酯用氮气吹干并密封,-20 ℃冰箱中备用,临用前用正己烷溶解。
1.2 试验方法
1.2.1 高脂饲料制作 按照普通饲料68.5%、猪油15%、胆固醇1%、胆盐0.5%和糊精15%的比例称取各种成分后,采用等量倍增的方法,将胆固醇与胆盐和普通饲料粉末混合均匀,加入经检验合格的猪体脂肪熬制好的猪油,待混合均匀后,加入糊精和一定比例的水固形,用制粒机压制成粒,烘干备用。
1.2.2 动物分组与处理 试验购进小鼠在适应性饲养1周后,随机进行分组,对照组小鼠饲喂普通饲料(Normal Diet, ND),高脂组小鼠饲喂高脂饲料(high fat diet, HFD);连续饲喂6周取材,自由采食,分别表示为WT-ND,WT-HFD。分组情况及处理如上表1。

表1 动物分组与处理
1.2.3 血清样本的采集与处理 试验开始后,在6周(w)末隔夜禁食,次日以眼球采血,全血37 ℃恒温培养30 min后,3 000 r/min离心10 min分离血清,-80 ℃冻存。
皂化衍生方法:精密称取100 μL冻存血清样本,加入0.5 mol/LKOH-甲醇溶液1 mL,充氮气密封,60 °C水浴10 min,加13%BF3-甲醇1.5 mL,60 ℃水浴30 min,取出置冷,加正己烷1.5 mL,涡流30 s提取。加饱和氯化钠2 mL,3 000 r/min离心10 min。取上层液,氮气吹干,-20 ℃冰箱中备用。临用前加1 mL正己烷全溶,1 μL进样,气相色谱分析。
1.2.4 色谱条件 毛细管色谱柱采用DB-23(30 m×0.25 mm×0.25 μm);载气为氮气(99.999%);进样l μL;分流比为1∶20;进样器温度240 ℃;检测器温度260 ℃;柱温程序升温:初始柱温50 ℃,保持2 min,升温速率20 ℃/min,升到170 ℃保持1 min,2 ℃/min升至240 ℃保持10 min。
1.2.5 数据处理 试验数据用平均值±标准误(mean±SD)表示,用 SPSS17.0 软件进行有关的统计分析,两组间采用独立样本的t检验,多组间试验数据的比较采用单因素方差分析。P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 检测方法的考察 17种脂肪酸线性关系良好;小鼠血清中平均回收率在81.53%~100.72%;精密度在0.53%~9.85%;脂肪酸的检测限在100~300 ng/mL;定量限在150~500 ng/mL。说明本方法测定组织中脂肪酸准确度好、重现性稳定、灵敏度较高,可以用于实际检测。
2.2 混合标准品保留时间与色谱图 混合脂肪酸标准品分离度(R>1.5)较好,出峰顺序依次为C12∶0、C14∶0、C15∶0、C16∶0、C17∶0、C18∶0、C18∶1、C18∶2、C18∶3、C20∶0、C20∶1、C20∶2、C20∶3、C20∶4、C22∶0、C23∶0、C22∶6,相应的保留时间依次为9.650、11.408、12.513、13.794、15.233、16.860、17.291、18.129、19.268、20.527、21.085、22.079、22.517、22.821、24.238、26.117、28.423 min。
2.3 血清中脂肪酸的色谱图 对照组小鼠血清中脂肪酸分离度较好,出峰顺序依次为C12∶0、C14∶0、C15∶0、C16∶0、C17∶0、C18∶0、C18∶1、C18∶2、C18∶3、C20∶1、C20∶2、C20∶3、C20∶4、C22∶0、C22∶6,相应的保留时间依次为9.711、11.482、12.594、13.882、15.334、16.983、17.398、18.272、19.392、21.056、22.027、22.591、22.945、24.345、28.637 min。
高脂组小鼠血清中脂肪酸分离度较好,出峰顺序依次为C12∶0、C14∶0、C15∶0、C16∶0、C17∶0、C18∶0、C18∶1、C18∶2、C18∶3、C20∶0、C20∶1、C20∶2、C20∶3、C20∶4、C22∶0、C22∶6,相应的保留时间依次为9.658、11.411、12.510、13.797、15.240、16.857、17.294、18.170、19.289、20.431、20.938、21.924、22.490、22.839、24.345、28.535 min,如图3。
2.4 血清中各种脂肪酸含量的检测 饲喂高脂后,血清中C12∶0、C14∶0、C15∶0、C16∶0、C18∶0、C18∶1、C18∶2、C18∶3、C20∶1、C20∶2和C20∶3的含量呈上升趋势,而C17∶0、C20∶4和C22∶6呈下降趋势。
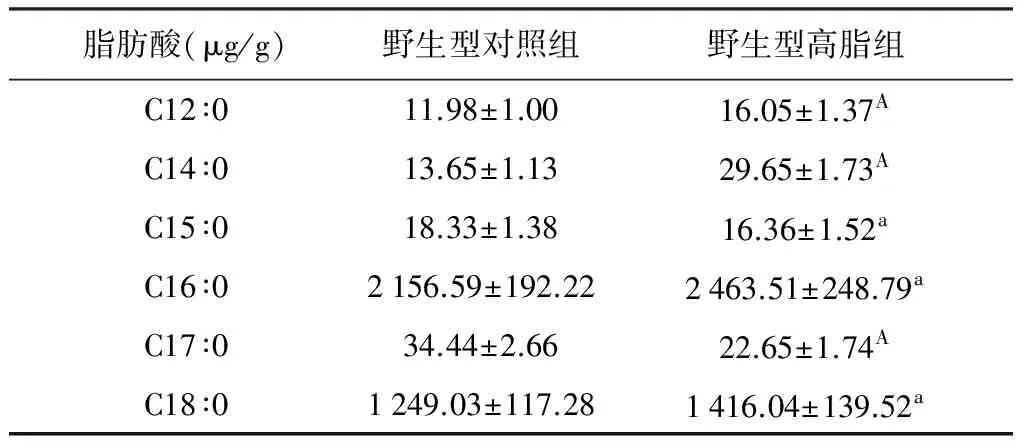
表2 血清中饱和脂肪酸的含量
注:高脂组与对照组相比,A代表P<0.01,a代表P<0.05,下表同
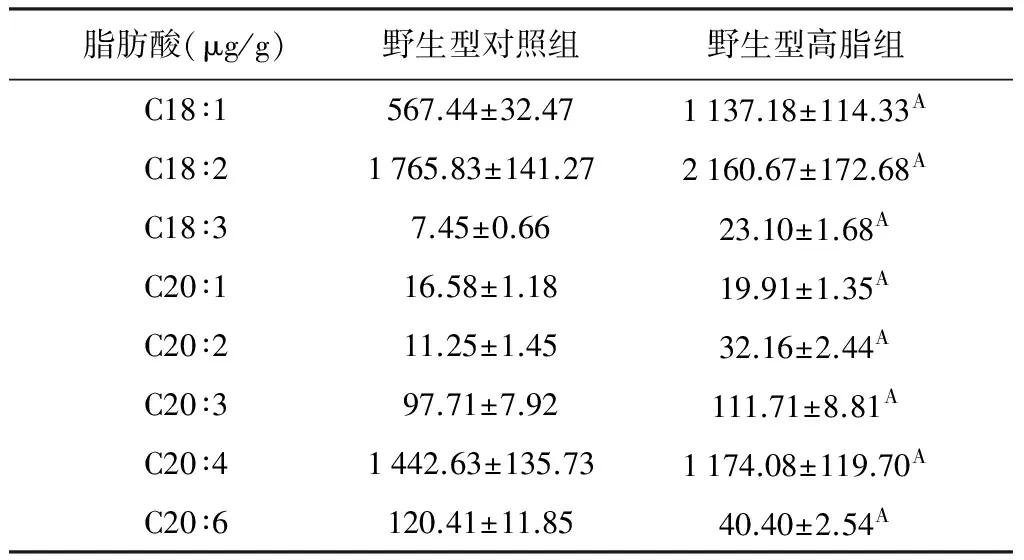
表3 血清中不饱和脂肪酸的含量
3 讨论
采用气相色谱方法,我们共检测了17种脂肪酸,在本检测条件下能检测到的有14种,分别是C12∶0、C14∶0、C15∶0、C16∶0、C17∶0、C18∶0、C18∶1、C18∶2、C18∶3、C20∶1、C20∶2、C20∶3、C20∶4和C22∶6,其中饱和脂肪酸有6种,不饱和脂肪酸有8种,而C20∶0、C22∶0和C23∶0的含量低于最低检测限,无法进行统计计算。与对照组相比,小鼠血清中C12∶0、C14∶0、C15∶0、C16∶0、C18∶0、C18∶1、C18∶2、C18∶3、C20∶1、C20∶2、C20∶3的含量在饲喂高脂饲料后都显著增多,而C17∶0、C20∶4和C22∶6显著减少。
高浓度的C16∶0和C18∶0可能是由于高脂饲料中含有15%的猪油,猪油含有丰富的SFA特别是C16∶0和C18∶0[7]。Barreyro等人发现在肝细胞中过多的SFA(C16∶0和C18∶0)积累可诱导Bim和FasL的表达,增加的内质网应激,并导致肝细胞损伤[8]。
有文献报道脂质中不饱和的脂肪酸越多,就会产生越多的活性氧,使细胞膜和线粒体的通透性改变,导致细胞凋亡/坏死[9]。本试验中与对照组相比,高脂组MUFA C18∶1 和C20∶1的含量增加,又通过C18∶1与C18∶0比值,我们估算出Δ9去饱和酶的活性在饲喂高脂饲料后升高。同样,较对照组比较,高脂组小鼠血清中PUFA也增多,如C18∶2、C18∶3、C20∶1、C20∶2、和C20∶3。
有试验证明,较低的n-6族与n-3族 PUFA的比例是预防NAFLD[11]的有效指标。本试验中二者比值升高,也是疾病进行的表现。
综上所述,高脂诱导能使血清中脂肪酸含量发生明显变化,同时会加重脂肪酸代谢类疾病发展过程。
[1] 郑淑容. 脂肪酸的营养功能[J]. 畜禽业,2012,09:55-57.
[2] 宋增廷,王华朗,杨荣,等. 脂肪酸功能及其在养猪生产中应用的研究进展[J]. 中国畜牧兽医,2015,42(12):3 253-3 260.
[3] 刘睿杰,王莉梅,常明,等. n-6/n-3多不饱和脂肪酸比例对HepG2细胞脂代谢的影响[J]. 现代食品科技,2017,33(01):1-7.
[4] Shapiro H,Tehilla M,Attal-Singer J,etal. The therapeutic potential of long-chain omega-3 fatty acids in nonalcoholic fatty liver disease[J].Clinical Nutrition,2011,30(1):6-19.
[5] 王颖. 表达ω-3脂肪酸去饱和酶基因的转基因鸡的研究[D].新疆:石河子大学,2016.
[6] Warensjo E,Rosell M,Hellenius M-L,etal.Associations between estimated fatty acid desaturase activities in serum lipids and adipose tissue in humans:links to obesity and insulin resistance[J].Lipids Health Dis,2009,8(37):10.1 186.
[7] 赵海珍,陆兆新,别小妹,等.高效液相色谱法测定猪油甘油三酯中的脂肪酸位置分布[J].色谱,2005,23(2):142-145.
[8] Barreyro F J,Kobayashi S,Bronk S F,etal.Transcriptional regulation of Bim by FoxO3A mediates hepatocyte lipoapoptosis[J].Journal of Biological Chemistry,2007,282(37):27 141-27 154.
[9] Catal A.Lipid peroxidation of membrane phospholipids generates hydroxy-alkenals and oxidized phospholipids active in physiological and/or pathological conditions[J].Chemistry and physics of lipids,2009,157(1):1-11.
[10] 蒋瑜,熊文珂,殷俊玲,等. 膳食中ω-3和ω-6多不饱和脂肪酸摄入与心血管健康的研究进展[J]. 粮食与油脂,2016,11:1-5.
Effectsofhighfatonfattyacidcontentinserumofmice
WANG Tong , CUI Xiao-xu , LI Chun-yan , ZHANG Xiu-ying
(College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
In this study, the content of fatty acids in serum was measured by gas chromatography, and the effects of high fat on serum fatty acid content were studied. The mice were randomly divided into two groups: wild-type control group (WT-ND) and wild-type high-fat group (WT-HFD). 10 rats in each group were fed with high-fat diet for six weeks. Blood was collected. The content of fatty acids was determined after saponification. The results showed that C12∶0, C14∶0, C15∶0, C16∶0, C18∶0, C18∶1, C18∶2, C18∶3,C20∶1,C20∶2 and C20∶3 were increased when compared with the control group, while C17∶0, C20∶4 and C22∶6 showed a decreasing trend. The results showed that high fat induction could change the content of fatty acids in serum and aggravate the development of fatty acid metabolic diseases.
fatty acid; gas chromatography; wild type ICR mice; high-lipid diet
ZHANG Xiu-ying
R458.5
A
0529-6005(2017)09-0100-03
2017-03-15
王通(1982-),男,博士生,研究方向为兽医药理学与毒理学,E-mail:1173136824@qq.com
张秀英,E-mail:zhangxiuying@neau.edu.cn
