HOG1对格特隐球菌应对压力应激、毒力因子和抗药性的影响
2017-11-06皇幼明樊一斌陶小华潘卫利
皇幼明 樊一斌 陶小华 潘卫利
·论著·
浙江省人民医院皮肤科,杭州医学院附属人民医院,浙江杭州,310014
潘卫利,E-mail:doctorpan163@163.com
HOG1对格特隐球菌应对压力应激、毒力因子和抗药性的影响
皇幼明 樊一斌 陶小华 潘卫利
目的明确HOG1基因对格特隐球菌应对压力应激、毒力因子产生和抗药性的影响。方法比较格特隐球菌原始株、hog1Δ菌株和重建株在含高渗透压培养基、抗真菌药物培养基中的生长差异,以及在YEPD培养基中荚膜的合成和咖啡因培养基中黑素产生的差异。结果hog1Δ菌株在高压力和抗真菌培养基中生长受限,在YEPD培养基中荚膜合成减弱,在咖啡因培养基中黑素生成减少。结论HOG1基因在格特隐球菌应对压力应激、毒力因子产生、抗药性中有重要作用。
格特隐球菌; HOG1基因; HOG-MAPK通路
隐球菌是担子菌类酵母真菌微生物,在自然界分布广泛。据统计,每年隐球菌病例约100万例,致死率50%以上,在非洲艾滋病患者中,隐球菌病已超过结核病成为最主要的致病病因[1]。隐球菌在宿主中生存和繁殖必须要适应外界环境应激如高渗、氧化反应。隐球菌对环境应激的调节通过多种信号途径来完成,而HOG-MAPK信号途径是其中之一。新生隐球菌是隐球菌病的主要致病菌,国外研究表明,该途径同样参与调控新生隐球菌对抗菌药物、温度等应激反应[2],同时也调控两个重要的隐球菌毒力因子——荚膜和黑素的生成[3]。而作为它的姐妹种属,格特隐球菌在形态特征、生化性质方面均有所不同。本文将通过比较格特隐球菌HOG1基因敲除后菌株对外界应激反应、毒力因子、对抗真菌药物的敏感性等方面的变化来验证HOG1在隐球菌致病机制中的作用。
1 材料和方法
1.1 材料
1.1.1 菌株 格特隐球菌(血清B型)临床株CZ2012原始株、hog1Δ菌株(缺陷株)和重建株(均来自第二军医大学隐球菌保藏中心)。
1.1.2 培养基 RPMI1640培养液、SDA及改良型SDA培养基、YEPD固体培养基、咖啡酸玉米培养基、尿素琼脂培养基等均按照标准配方配制。
1.1.3 主要试剂 两性霉素B、酮康唑、伊曲康唑、氟康唑和5氟胞嘧啶。
1.1.4 主要仪器和器材 2.5 μL、10 μL、100 μL、1000 μL 各式加样器;0.02 μm孔径过滤器滤头;pH计;血细胞计数板。
2 方法
2.1 对外界应激如渗透压、温度、氧化反应测试 配制用于不同应激反应测试的YEPD培养基(压力测试:含1 mol/L、1.5 mol/L KCl的YEPD固体培养基;氧化应激:含H2O25 mmol/mL的YEPD固体培养基;含20%甘油、20%葡萄糖、20%甘油果糖的YEPD培养基),配制各组菌悬液,并依次倍比稀释,取5 μL菌悬液点种相应的培养基中,3~5天后观察结果。
2.2 荚膜和黑素生成的测定 配制各组菌液,调整菌悬液至5×106个/mL,点种改良型SDA平板上,分别置于30℃、37℃条件下培养48 h,然后挑取菌落制备菌悬液,墨汁染色,显微镜下观察,拍照。利用photoshop软件计算菌体荚膜相对大小。然后SPSS 17.0软件进行分析;取同种菌液,调整同样浓度,点种于固体咖啡酸培养基上,分别于30℃、37℃温度下培养3 d、7 d后观察结果。
2.3 对尿素酶生成的影响 调整菌悬液浓度至5×106个/mL,离心,PBS纯化3次后,每组取5 μL点种于尿素培养基(Christensen urea agar),重复三次,分别30℃和37℃条件下培养,1~2 d后观察结果。
3 统计学分析
本实验中主要通过测量原始株、hog1Δ缺陷株和重建株之间的荚膜相对面积比,分析HOG1基因对荚膜的影响,因此采用单因素方差分析(one-way ANOVA analysis)比较三种菌株之间的差异,若三种菌株间存在差异(P<0.05),之后采用Bonfferoni检验方法比较两两菌株间的差异;本实验所用统计软件为SPSS 17.0。
4 结果
4.1 HOG1对外界应激如渗透压、温度、氧化反应的影响
4.1.1 三种菌株对5 mmol/L H2O2没有表现出明显的差异,hog1Δ菌株对1 mol/L KCl、1.5 mol/L KCl的抵抗能力明显减弱(图1)。
4.1.2hog1Δ菌株对抵抗唑类药物应激的敏感性升高,而5氟胞嘧啶的敏感性差别较小(图2)。
4.1.3hog1Δ菌株在高浓度甘油、高糖、高甘露醇应激下活力下降(图3)。
4.2 HOG1对荚膜和黑素生成的有正向调节作用
4.2.1 荚膜观察 在30℃和37℃条件下,hog1Δ菌株的荚膜生成能力明显减弱(图4、5)。
同样地,比较荚膜相对面积大小(30℃:WT 0.45、hog1Δ0.13、HOG1+hog1Δ0.41;37℃:WT0.43、hog1Δ0.10、HOG1+hog1Δ0.36),在30℃和37℃条件下,hog1Δ菌株在同等条件下荚膜相对面积较小,而原始株和重建株荚膜相比,差异有显著意义(图6;*:P<0.001,vshog1Δgroup)。
4.2.2 黑素生成比较 格特隐球菌CZ2012hog1Δ菌株与原始株和重建株相比,hog1Δ菌株在不同温度和不同时间点的黑素生成均明显减少(图7) 。
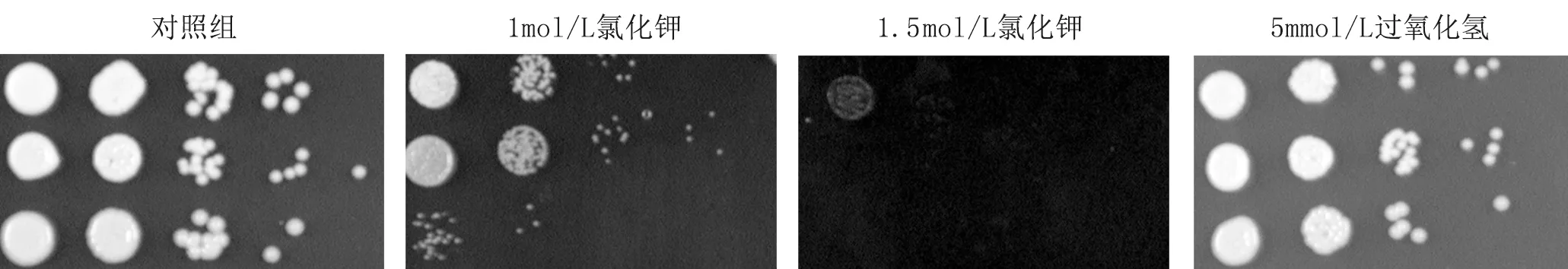
图1 上至下三种菌株分别为WT、hog1Δ、HOG1+hog1Δ
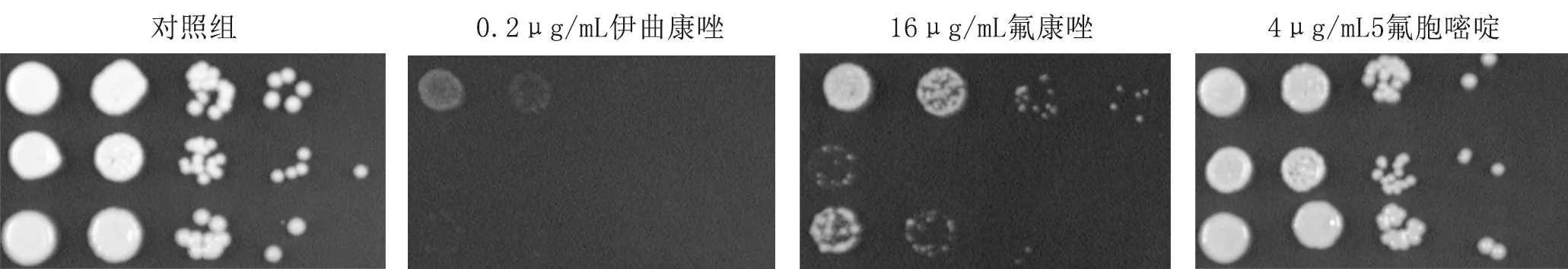
图2 上至下三种菌株分别为WT、hog1Δ、HOG1+ hog1Δ
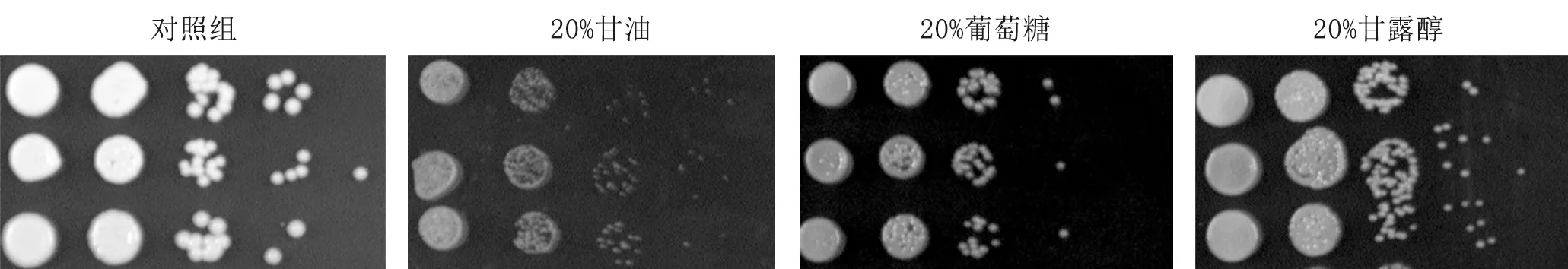
图3 上至下三种菌株分别为WT、hog1Δ、HOG1+ hog1Δ
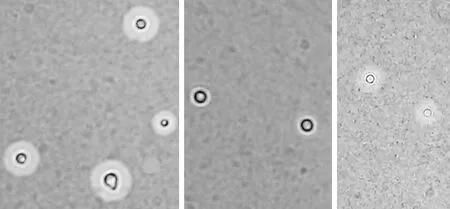
图4 30℃条件下,hog1Δ菌株的荚膜生成能力明显减弱
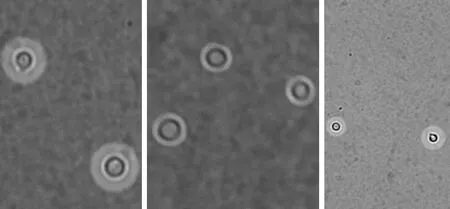
图5 37℃条件下,hog1Δ菌株的荚膜生成能力明显减弱
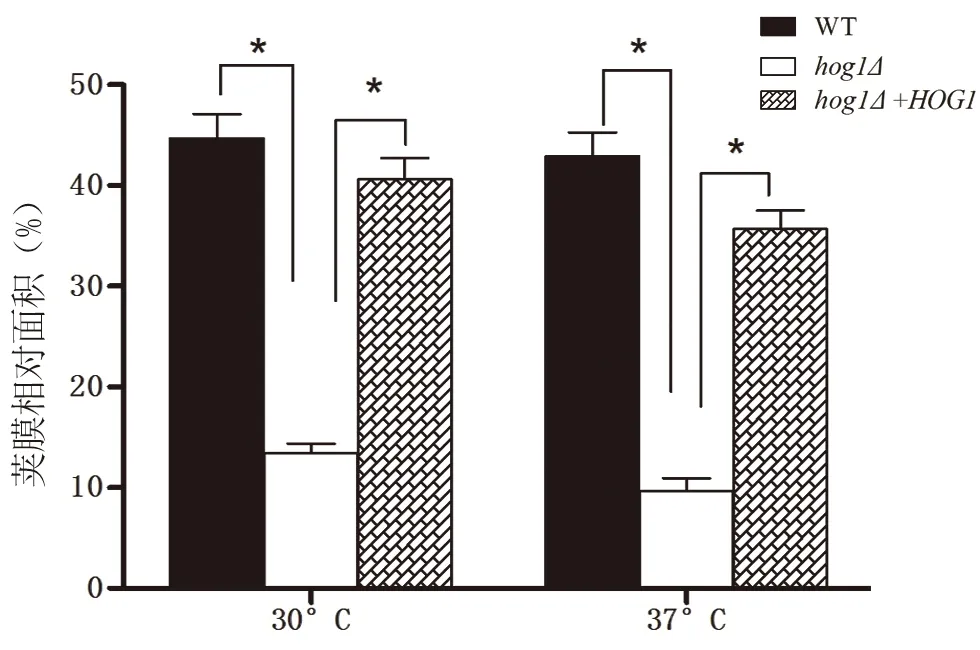
图6 在30℃和37℃条件下,hog1Δ菌株在同等条件下荚膜相对面积较小
5 讨论
格特隐球菌主要感染免疫正常人群。该病原菌以前被认为主要分布在热带和亚热带地区,而近来国内也有越来越多的格特隐球菌感染病例报道[4]。HOG-MAPK信号通路在国外的研究主要限于新生隐球菌,国内关于格特隐球菌致病性研究的试验研究尚少。在本研究中,我们通过比较格特隐球菌原始株、hog1Δ菌株及重建株的毒力方面的差异来验证HOG1在格特隐球菌致病中的作用。
通过观察hog1Δ菌株在正常条件和高渗条件下的生长情况,我们发现hog1Δ菌株对外部高渗透性离子、20%糖、20%甘露醇均表现为对高渗透压的抵抗力减弱,表明hog1Δ菌株对高渗透压表现出较强的敏感性。Jung等[5]在新生隐球菌H99中发现,hog1Δ菌株在富含高糖的高Na+、K+的YEPD培养基表现出明显的差别,低糖、低PH的高渗培养基中生长显著受限。所以,我们认为本实验的hog1Δ菌株对外部高渗应激的抵抗力明显降低,证实HOG1蛋白作为HOG-MAPK通路中重要的因子在细胞抵抗外界高渗压力中发挥着重要的作用。在新生隐球菌中,HOG-MAPK在菌体抵抗多种氧化应激损害中有重要作用,本研究中,hog1Δ菌株并没有表现出明显的变化,提示在菌株中,HOG1在菌体对外界氧化应激反应中发挥的作用有限,这可能与隐球菌有多个信号途径和调控机制在应对压力刺激时发挥作用有关。

图7 上至下三种菌株分别为WT、hog1Δ、HOG1+ hog1Δ
Hog1蛋白是HOG-MAPK通路的重要组分。目前已有国外相关学者对新生隐球菌该通路上游组分进行了相关研究[5,6]。荚膜和黑素主要由cAMP信号通路调控,是隐球菌区别于其他真菌的两个重要的毒力特征,HOG-MAPK信号通路通过与cAMP交叉作用参与荚膜和黑素的生成[7]。该通路的任何环节的突变都可能会造成荚膜和黑素生成的改变以及毒力的变化。而本实验hog1Δ缺陷株却表现为荚膜和黑素的合成明显减少,表明HOG1可以正向调节荚膜和黑素的合成。这与新生隐球菌的作用相反[7],而同样的研究中,新生隐球菌不同菌株间HOG1对荚膜和黑素的调控作用也存在差异,证明隐球菌种属间HOG1对荚膜和黑素的调控机制存在差异,可能HOG1基因缺失后引起HOG-MAPK 通路上下游组分发生变化或同时存在其他平行途径同时调控这荚膜和黑素的生成。
两性霉素B和唑类作为经典抗真菌药物常被用于隐球菌病的一线治疗。HOG-MAPK途径控制菌体细胞麦角固醇的合成,从而影响对两性霉素B和唑类抗真菌药物的敏感性。已有研究表明高渗透压力可导致真菌多种麦角固醇基因合成减少[8],这与我们在临床药物治疗后对隐球菌菌体在电镜下观察到的结果相似。低麦角固醇可引起细胞膜紧缩,灵活性减小,导致胞内甘油等渗透性物质流出减少。HOG-MAPK通路可能通过影响麦角固醇的生成,使新生隐球菌对抗真菌药物的敏感性产生影响。新生隐球菌耐药机制复杂,临床分离的耐药菌株多与菌体内麦角固醇生成有关[9],可能是该成分主要影响抗真菌药物(如多烯类和三唑类)的结合位点和细胞膜的通透性有关。本实验中, CZ2012hog1Δ菌株表现出对两性霉素B和5FC的敏感性减弱,而对唑类药物的敏感性增强,这与国外新生隐球菌的情况正好相反[10]。说明在格特隐球菌中可能存在其他的途径共同调节麦角固醇的合成进而影响抗真菌药物的敏感性,具体的机制尚需我们进一步进行研究。
总之,本研究主要从体外毒力表型来证实HOG1对新生隐球菌毒力调控的影响。结果HOG1基因敲除后,格特隐球菌对外界应激反应有明显变化,相关毒力因子如荚膜和黑素合成减少,对两性霉素B、5-FC的敏感性减弱,而对唑类药物的敏感性增强。因此,我们认为,HOG1在格特隐球菌应对外界应激变化和毒力调控中发挥着重要作用,但与其在新生隐球菌中的调控机制存在差异性,对该通路中相关靶点的具体作用机制尚需进一步的分子研究来证实。
[1] Park BJ, Wannemuehler KA, Marston BJ, et al. Estimation of the current global burden of cryptococcal meningitis among persons living with HIV/AIDS[J]. AIDS,2009,23(4):525-530.
[2] Lee KT, Byun HJ, Jung KW, et al. Distinct and redundant roles of protein tyrosine phosphatases Ptp1 and Ptp2 in governing the differentiation and pathogenicity of Cryptococcus neoformans[J]. Eukaryot Cell,2014,13(6):796-812.
[3] Huston SM, Ngamskulrungroj P, Xiang RF, et al. Cryptococcus gattii capsule blocks surface recognition required for dendritic cell maturation independent of internalization and antigen processing[J]. J Immunol,2016,196(3):1259-1271.
[4] Fang W, Fa Z, Liao W. Epidemiology of Cryptococcus and cryptococcosis in China[J]. Fungal Genet Biol,2015,78:7-15.
[5] Jung KW, Strain AK, Nielsen K, et al. Two cation transporters Ena1 and Nha1 cooperatively modulate ion homeostasis, antifungal drug resistance, and virulence of Cryptococcus neoformans via the HOG pathway[J]. Fungal Genet Biol,2012,49(4):332-345.
[6] Kim SY, Ko YJ, Jung KW, et al. Hrk1 plays both Hog1-dependent and -independent roles in controlling stress response and antifungal drug resistance in Cryptococcus neoformans[J]. PLoS One,2011,6(4):e18769.
[7] Bahn YS, Kojima K, Cox GM, et al. Specialization of the HOG pathway and its impact on differentiation and virulence of Cryptococcus neoformans[J]. Mol Biol Cell,2005,16(5):2285-2300.
[8] Wang M, Chen C, Zhu C, et al. Os2 MAP kinase-mediated osmostress tolerance in Penicillium digitatum is associated with its positive regulation on glycerol synthesis and negative regulation on ergosterol synthesis[J]. Microbiol Res,2014,169(7-8):511-521.
[9] Ngamskulrungroj P, Chang Y, Hansen B, et al. Characterization of the chromosome 4 genes that affect fluconazole-induced disomy formation in Cryptococcus neoformans[J]. PLoS One,2012,7(3):e33022.
[10] Ko YJ, Yu YM, Kim GB, et al. Remodeling of global transcription patterns of Cryptococcus neoformans genes mediated by the stress-activated HOG signaling pathways[J]. Eukaryot Cell,2009,8(8):1197-1217.
TheroleofHOG1geneinstress,virulencefactorsandanti-fungaldrugsensitivityofCryptococcusgattii
HUANGYouming,FANYibin,TAOXiaohua,PANWeili.
DepartmentofDermatology,ZhejiangProvincialPeople'sHospital,People'sHospitalofHangzhouMedicalCollege,Zhejiang310014,China
PANWeili,E-mail:doctorpan163@163.com
Objective: To determine the influence of HOG1 gene on stress, virulence factors and anti-fungal drug sensitivity ofCryptococcusgattii.MethodsThe growth difference ofCryptococcusgattii(wild strain,hog1Δstrain and reconstruction strain) in high osmotic pressure medium and antifungal medium, and the bacterial capsule size in the YEPD medium and melanin production in the caffeine medium were compared.Resultshog1Δstrain showed growth limitation in high osmotic pressure medium and antifungal medium, reduction of capsule synthesis in YEPD medium and less melanin production in caffeine medium.ConclusionHOG1 gene plays an essential role in the environmental stress, production of virulence factors and antifungal drug sensitivity ofCryptococcusgattii.
Cryptococcusgattii; HOG1 gene; HOG-MAPK pathway
(收稿:2017-03-05 修回:2017-07-04)
