重金属胁迫对罗非鱼血细胞DNA损伤的影响
2017-11-04张来军李晓梅陈永敢杭瑜瑜公维洁
张来军,李晓梅,陈永敢,陈 攀,杭瑜瑜,公维洁
(海南热带海洋学院 生命科学与生态学院,海南 三亚 572022)
重金属胁迫对罗非鱼血细胞DNA损伤的影响
张来军,李晓梅,陈永敢,陈 攀,杭瑜瑜,公维洁
(海南热带海洋学院 生命科学与生态学院,海南 三亚 572022)
为研究重金属对鱼类的毒性效应,将罗非鱼血细胞分别暴露于低、中、高三种不同浓度的四种重金属溶液Cr(VI)、Pb、Cu、Hg中2 h,采用单细胞凝胶电泳实验(彗星电泳)技术检测血细胞的DNA损伤程度,对照组不加任何重金属,检测指标包括尾部DNA含量、尾长、尾矩、Olive尾矩.结果显示,鱼血细胞对四种重金属胁迫均极为敏感,随重金属胁迫浓度的升高,DNA损伤程度增加.因此,罗非鱼可作为评价重金属污染遗传毒性损伤的敏感性生物标记物.
单细胞凝胶电泳;鱼血细胞;重金属污染;DNA损伤
0 引言
重金属污染,是指由重金属或其化合物造成的环境污染.随着城市现代化和工业化的加速发展,导致重金属污染物通过河流、排泄口、家庭污水管、大气迁移和沿海倾倒的废物进入海洋.由于重金属具有不易移动、难溶解,以及富集性的特性,很难在环境中降解,进入生物体后也难以被排出,从而造成生物体慢性中毒,以致水体中痕量重金属通过食物链的各个环节对生态系统造成危害并最终危及人类的健康.为了能准确、及时、全面地反映海洋环境质量现状及发展趋势,需要随时进行环境检测[1].
近年来,单细胞凝胶电泳(single cell gel eletrophoresis,SCGE),或彗星电泳(Comet assay)技术常被用于水环境污染遗传毒理学检测[2-4].这一技术最早用于动物细胞 DNA 损伤检测,具有简便、快速、灵敏等特点,现在已广泛应用于各种真核生物不同类型的细胞试验.外界环境中的理化因素会对细胞DNA造成损伤,进而可能引起基因突变或癌变,所以判断细胞DNA是否损伤是环境监测中重要的一环.在1999年举行的国际基因毒性检验程序专题学术讨论会中,单细胞凝胶电泳(pH>13)被定为确定某物质是否具有基因毒性的最佳方法[5].
罗非鱼生长于16~38℃的水域,为广盐性鱼类,海淡水中均可生存,耐低氧.本研究以罗非鱼为实验材料,采用单细胞凝胶电泳技术,检测四种重金属Cr6+、Pb2+、Cu2+、Hg2+胁迫对罗非鱼外周血细胞DNA 的损伤,为重金属胁迫的血液毒理学以及评价重金属对海洋环境中生物的影响提供参考资料.
1 材料与方法
1.1主要试剂与仪器
正常熔点琼脂糖(NMA, 西班牙),低熔点琼脂糖(LMA),Triton X-100,肌氨酸钠, DMSO,上述试剂均为Amresco分装产品.重铬酸钾、硫酸铜、醋酸铅和氯化汞均为国产分析纯.倒置荧光显微镜(德国Leica 公司DMI 3000),电泳仪(Tanon EPS 300),电泳槽(北京六一,DYCP-33A).
1.2实验动物
罗非鱼购自海南省三亚市荔枝沟农贸市场,为海水养殖鱼,体长不超过15 cm.试验前用曝气自来水加天然海水,配制成盐度为17‰~20‰的实验用水,驯养1 周,每天换水1次,试验时挑选健康正常个体进行处理.
1.3试验方法
用肝素处理的注射器鳃动脉无菌取血,血液用PBS缓冲液稀释到105~106cell/mL,等体积分到不同的离心管中.Cr6+、Pb2+、Cu2+、Hg2+离子胁迫浓度分别按《渔业水质标准》(GB 11607)最高限量值的100倍、500倍和1000倍设置成低浓度组、中浓度组和高浓度组三个胁迫浓度组,具体胁迫浓度如表1至表4中所示.空白对照组不加任何重金属离子,25 ℃胁迫2 h.胁迫结束后,血细胞以1000 r/m离心收集,再用PBS缓冲液冲洗1次,离心,重新加入PBS,调整细胞密度,观察细胞活力,准备电泳.
1.4单细胞凝胶电泳
按Zhang[6]等改良方法进行单细胞凝胶电泳.将洁净的载玻片在0.6%的常熔点琼脂糖中浸没后取出,置37 ℃烘箱烘烤过夜以备电泳;将血细胞悬液和1%低熔点琼脂糖等体积混合均匀,铺在预处理后的载玻片上,4 ℃固化5 min,将载玻片放入新鲜配制的裂解液(2.5 mol·L-1NaCl,0.1 mol·L-1EDTA,0.01 mol·L-1Tris,1%肌氨酸钠,pH 10,1% Triton X-100,10% DMSO)中,裂解1 h;蒸馏水冲洗后,再放入电泳缓冲液(0.3 mol·L-1NaOH,1mmol·L-1EDTA,pH>13)中,变性解旋20 min;电泳20 min(26 V,300 mA);400 mmol·L-1Tris缓冲液(pH 7.5)中和3次;从裂解到中和的所有过程需在4 ℃下进行.将载玻片置于冰冷的无水乙醇中,脱水10 min,室温晾干, EB(20 μg· mL-1)染色,镜检,照相.也可不经过脱水过程,直接染色观察.
1.5彗星图像分析和数据的统计分析
每个处理随机取约50个细胞图像,用CASP软件进行分析,可得到诸多反应DNA损伤程度的参数,本文选择尾部DNA含量(TDNA%)、尾长(TailLength,TL)、尾矩(TailMomen,TM)和Olive尾矩(Olive TailMoment,OTM)四种参数作为衡量细胞DNA损伤程度的评价指标.
用SPSS13.0 对数据进行单因素方差分析(ANOVA),比较各浓度组之间及其与对照组之间各组数据差异的显著性,实验重复3次.
2 结果与分析
2.1重金属Cu2+胁迫对罗非鱼血细胞DNA损伤的形态观察
图1为Cu2+胁迫对罗非鱼血细胞影响的几种典型彗星图像.其中图 1A是空白对照组,其血细胞核大小均匀,呈圆形荧光团,彗星头部DNA集中,亮度强,无拖尾或轻微拖尾现象;DNA 受损的血细胞由于其DNA链断裂,电泳时断片向阳极移动,产生彗星样拖尾,且随着Cu2+浓度的提高,DNA链断裂程度由轻到重,彗尾逐渐变长,并在一定程度下荧光强度增加;彗星头部逐渐变小,荧光强度逐渐变弱(图 1B、C、D).
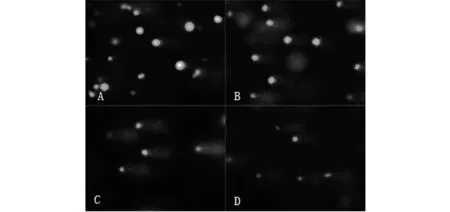
注:A:空白对照组;B:1 mg·L-1 ;C:10 mg·L-1;D:15 mg·L-1图1 不同浓度Cu2+引起罗非鱼血细胞 DNA 受损典型彗星电泳图像(×200)
2.2四种重金属对罗非鱼血细胞DNA损伤的影响彗星电泳结果
经彗星图像分析软件CASP软件处理彗星图像后,得到的 TDNA%、TL、TM、OTM四个参数数值经SPSS统计处理后,用Mean±SD表示.四种重金属离子Cr6+、Pb2+、Cu2+、Hg2+对鱼血细胞DNA损伤的分析结果以下列各表所示.
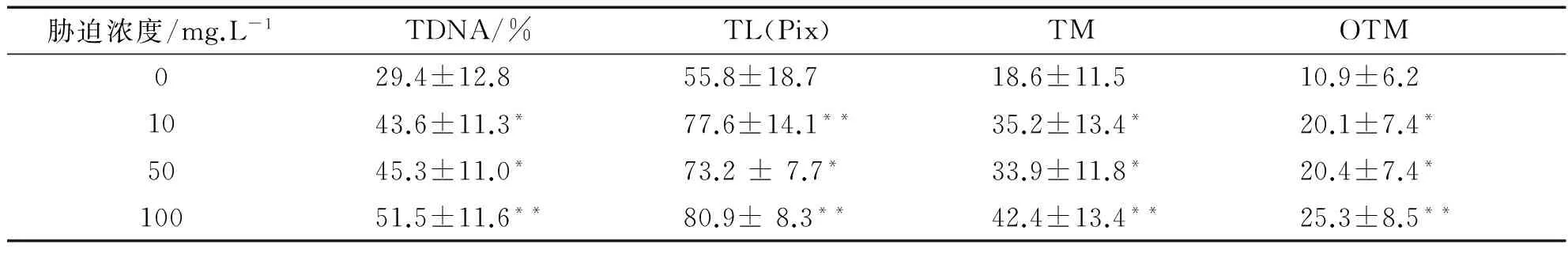
表1 不同剂量Cr6+对罗非鱼血细胞DNA损伤的彗星电泳结果
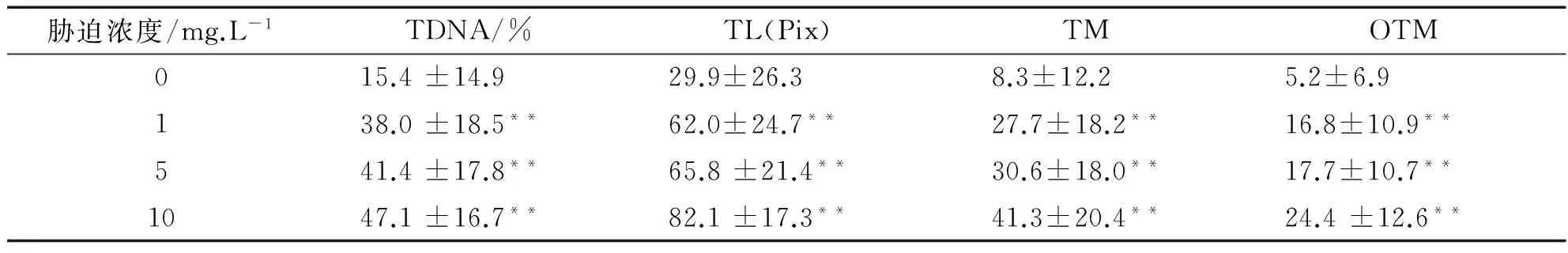
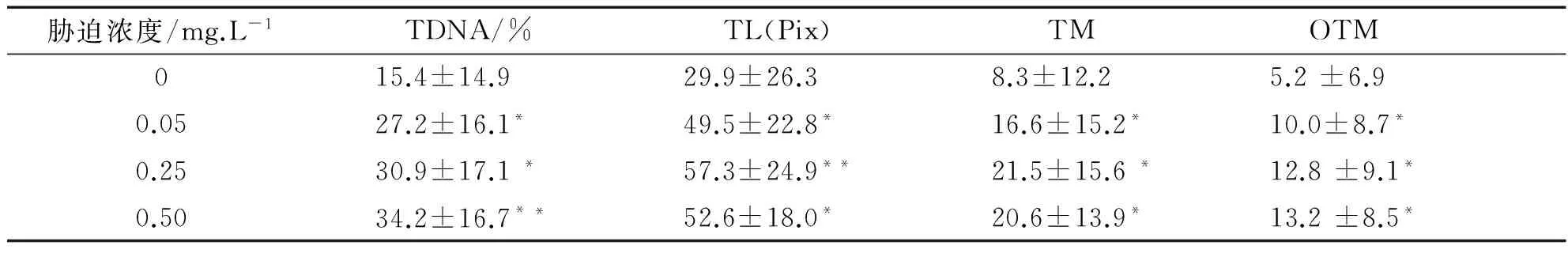
注:与对照组比较“*”表示差异显著(P<0.05),“**”表示差异极显著(0.05 由表1数据可知,低、中和高3个Cr6+浓度组的4项指标值显著高于对照组(P<0.05),其中高浓度组与对照组之间的差异达到极显著水平(P<0.01),且与低浓度组和中浓度组之间也具有差异(P<0.05).但是低浓度组与中浓度组之间比较差异不显著(P>0.05).因此随Cr6+胁迫浓度的提高,TDNA%、TL、TM和OTM的值也随之增加,鱼血细胞DNA损伤越严重.Cr6+胁迫浓度与DNA损伤程度二者间存在着明显的剂量-效应关系.四种参数中,TDNA%、TM和OTM最能够体现出剂量-效应关系. 表2 不同剂量Pb2+对罗非鱼血细胞DNA损伤的彗星电泳结果 注:“*”表示与对照组比较差异显著(P<0.05) 由表2可知,随Pb2+胁迫浓度的增加,TDNA%、TL、TM和OTM的值也随之增加.高浓度组的四项指标分别显著高于对照组和低浓度组(P<0.05),中浓度组的TDNA%和OTM与对照组比较也具有显著差异(P<0.05),而低浓度组除OTM高于对照组(P<0.05)外,其他指标与对照组比较没有差异(P>0.05).Pb2+胁迫浓度与DNA损伤程度二者间也存在着明显的剂量-效应关系. 表3 不同剂量Cu2+对罗非鱼血细胞DNA损伤的彗星电泳结果 注:与对照组比较“*”表示差异显著(P<0.05),“**”表示差异极显著(0.05 由表3可知,随Cu2+胁迫浓度增加,四项指标TDNA%、TL、TM和OTM的值也明显增加.低、中和高三个浓度组的4项指标与对照组各值比较均有极显著差异(P<0.01);且高浓度组的4项指标还显著高于中、低两个浓度组(P<0.05)(数据未显示).在实验所设浓度范围内,随Cu2+胁迫的浓度增加,鱼血细胞DNA损伤加重,Cu2+浓度与DNA损伤程度之间存在显著的剂量-效应关系. 表4 不同剂量Hg2+对罗非鱼血细胞DNA损伤的彗星电泳结果 注:与对照组比较“*”表示差异显著(P<0.05),“**”表示差异极显著(0.05 由表4可知,随Hg2+胁迫浓度的升高,TDNA%、TL、TM和OTM的值随之增加.高、中和低3个浓度组的4项指标均显著高于对照组(P< 0.05),其中高浓度组的TDNA%值显著大于中、低2个浓度组(P<0.05).在实验所设浓度范围内,随胁迫的Hg2+浓度增加,鱼血细胞DNA损伤加重,二者间存在明显的剂量-效应关系. 因此,鱼血细胞对四种重金属污染极为敏感,随重金属胁迫浓度升高血细胞DNA损伤严重.四种参数TDNA%、TL、TM、OTM中,TDNA%和OTM最能体现出重金属胁迫浓度与DNA损伤程度之间的剂量-效应关系. 重金属污染与其他污染相比,具有范围广、长期持久和不可逆等特点,可以长期留在水体和土壤中,再通过富集作用大量积累在植物体内,或通过食物链进入到动物体内.实验室条件下,海水中的镉能迅速而大量的蓄积于波纹巴菲蛤的内脏团、腮和肌肉组织中[7],而近江牡蛎的体内也具有蓄积大量铅的能力[8].进入动物体内的重金属影响生长发育,破坏正常的细胞活动,严重时引起死亡.重金属胁迫对动物DNA的影响表现为引起碱基损伤、DNA链断裂、链内或链间交联等,从而影响DNA的完整性,产生遗传毒性,因此检测动物细胞DNA损伤是评价环境污染物遗传毒性的一个重要参数.而单细胞凝胶电泳是迄今检测DNA损伤非常灵敏的方法;鱼类是首批与彗星电泳密切结合用于水环境毒理学领域研究的动物模型.Pandrangi等在1995最先将两种淡水鱼美洲洄鱼(Ameiurusnebulosus)和鲤鱼(Cyprinuscarpio)作为实验材料检测湖底沉积物中有毒废料的毒性效果[9].但是迄今为止海洋环境中应用于彗星电泳的鱼种类极为有限,仅有十多种.最常用的是鲽形目鱼类[10-11],细鳞鯻(Theraponjarbua)[12-13],杂斑盔鱼(Corisjulis)[14-15],以及海鲈鱼[16-17],分别用于检测重金属[13,17]、有机物[10-11]、农药[12]等污染物对鱼类的影响;我国仅有大弹涂鱼一种被用于彗星电泳研究,检测镉、铅、铬等重金属对其外周血细胞DNA损伤的影响[18-20].我国用于海洋污染监测的物种,包括鱼类,大多数未实验动物化和实现市场化供应,因此开展海洋污染物生物监测迫切需要建立标准化的实验动物. 罗非鱼作为彗星电泳的实验材料曾用于软骨藻酸(Domoic acid, DA)和苯并(a) 芘的毒性检测[21-22].本实验用四种重金属Cr6+、Pb2+、Cu2+、Hg2+胁迫罗非鱼血细胞,彗星电泳检测DNA损伤程度,发现四种重金属均引起了罗非鱼血细胞DNA损伤,且损伤的程度随重金属胁迫的浓度升高而加剧.说明罗非鱼对环境污染物,包括重金属污染较为敏感,可以将这种鱼类作为指示生物用于水环境污染生物检测研究. [1]阎铁,吕海晶.海洋环境污染生物监测规划的制定[J].海洋环境科学,1987,3(6):55-59. [2]SRUT M,TRAVEN L,STAMBUK A,et al.Genotoxicity of marine sediments in the fish hepatoma cell line PLHC-1 as assessed by the Comet assay [J].Toxicology in Vitro,2011,25(1):308-314. [3]SULLIVAN C,MITCHELMORE C L,HALE R C,et al.Induction of CYP1A and DNA damage in the fathead minnow (Pimephalespromelas) following exposure to biosolids [J].Science of the Total Environment,2007,384(1-3):221-228. [4]GUILHERME S,GAIVAO I,SANTOS M A,et al.European eel (Anguillaanguilla) genotoxic and pro-oxidant responses following short-term exposure to Roundup-a glyphosate-based herbicide [J].Mutagenesis,2010,25(5):523-530. [5]TICE R R,AGURELL E,ANDERSON D,et al.Single cell gel/ comet assay:guidelines for in vitro and in vivo genetic toxicology testing [J].Environmental and Molecular Mutagenesis,2000,35(3):206-221. [6]ZHANG L J,JIA JF,HAO J G,et al.A modified protocol for the comet assay allowing the processing of multiple samples [J].Mutation Research,2011,721(2):153-156. [7]于淑池,符修正,王昌昊,等.镉对波纹巴非哈(Paphiaundulata)的急性毒性及组织蓄积性研究[J].琼州学院学报,2016,23(2):35-39. [8]李晓梅,郭体环,张来军.铅对近江牡蝠的急性毒性研究[J].琼州学院学报,2015,22(5):77-80. [9]PANDRANGI R,PETRAS M,RALPH S,et al.Alkaline single cell gel (comet) assay and genotoxicity monitoring using bullheads and carp[J].Environmental and Molecular Mutagenesis,1995,26(4),345-356. [10]LE D,LACOSTE M,AKCHA F,DEVIER M H,et al.Comparative study of different exposure routes on the biotransformation and genotoxicity of PAHs in the flatfish species,Scophthalmus maximus [J].Environmental Science and Pollution Research International,2013,20(2):690-707. [11]WESSEL N,MENARD D,PICHAVANT-RAFINI K,et al.Genotoxic and enzymatic effects of fluoranthene in microsomes and freshly isolated hepatocytes from sole (Solea solea)[J].Aquatic Toxicology,2012,108(1):33-41. [12]DEVI V J,NAGARANI N,BABU M Y,et al.Genotoxic effects of profenofos on the marine fish,Therapon jarbua[J].Toxicology Mechanisms and Methods,2012,22(2):111-117. [13]NAGARANI N,DEVI V J,KUMARAGURU A K.Identification of DNA damage in marine fish Therapon jarbua by comet assay technique[J].Journal of Environmental Biology,2012:33(4):699-703. [14]TOMASELLO B,COPT C,PUVIRENTI V,et al.Biochemical and bioaccumulation approaches for investigating marine pollution using Mediterranean rainbow wrasse,Coris julis (Linneaus 1798)[J].Ecotoxicology and Environmental Safety,2012,86(4):168-175. [15]FASULO S,MARINO S,MAUCERI A,et al.A multibiomarker approach in Coris julis living in a natural environment [J].Ecotoxicology and Environmental Safety,2010,73(7):1565-1573. [16]SRUT M,STAMBUK A,PAVLICA M,et al.Cage exposure of European sea bas (Dicentrarchus labrax) for in situ assessment of pollution-related genotoxicity [J].Arh Hig Rada Toksikol,2010,61(1):29-36. [17]LABIENIEC M,MILOWSKA K,BALCERCZYK A,et al.Interactions of free copper (II) ions alone or in complex with iron (III) ions with erythrocytes of marine fish Dicentrarchus labrax[J].Cell Biology International,2009,33(9):941-948. [18]陈寅儿,徐镇.SCGE技术检测镉对大弹涂鱼外周血细胞DNA损伤[J].基因组学与应用生物学,2010,29(2):369-374. [19]梁亚芳,苗亮,李明云,等.铅、铬胁迫对大弹涂鱼血细胞遗传损伤的彗星实验检测[J].生物学杂志,2014,31(6):35-38. [20]金春华,李明云,刘伟成,等.镉胁迫对大弹涂鱼(Boleophthalmuspectinirostris)血细胞遗传损伤的研究[J].海洋与湖沼,2010,41(1):80-84. [21]CAVA T,KNEN S.In vivo genotoxicity testing of the amnesic shellfish poison (domoic acid) in piscine erythrocytes using the micronucleus test and the comet assay [J].Aquatic Toxicology,2008,90(2):154-159. [22]宋超,范立民,孟顺龙,等.苯并(a)芘对罗非鱼(GIFTOreochromisniloticus) 肝细胞DNA损伤的影响[J].生态环境学报,2013,22(9):1583-1587. DNADamageinHemocytesofTilapia(Oreochromisniloticus)InducedbyHeavyMetalswithSCGETechnique ZHANG Lai-jun, LI Xiao-mei, CHEN Yong-gan, CHEN Pan, HANG Yu-yu, GONG Wei-jie (School of Life Sciences and Ecology, Hainan Tropical Ocean University, Sanya Hainan 572022, China) To investigate the toxic effects of heavy metal on marine fish, hemocytes ofOreochromisniloticuswere respectively exposed to four kinds solution— Cr(VI), Pb, Cu and Hg, each with three concentrations.Then the DNA damage to hemolymph cells was detected by single cell gel electrophoresis(comet assay) after two hours, whereas the control group did not add any heavy metal.The detection indexes include tail DNA content, tail length, tail moment and Olive tail moment.Results showed that blood cells were highly sensitive to the four kinds of heavy metal.Furthermore, with the increase of the concentration of heavy metal, the degree of DNA damage increased.Therefore,Oreochromisniloticuscan be a sensitive biological marker to evaluate the genetic toxicity effects of heavy metals. single cell gel electrophoresis;Oreochromisniloticushemocytes; heavy metal; genetic damage 格式:张来军,李晓梅,陈永敢,等.重金属胁迫对罗非鱼血细胞DNA损伤的影响[J].海南热带海洋学院学报,2017,24(5):31-35. 2017-06-11 国家自然科学基金(31260139);海南省自然科学基金(313050) 张来军(1968-),女,甘肃庆阳人,海南热带海洋学院生命科学与生态学院副教授,博士,研究方向为细胞生物学. Q75;X55 A 2096-3122(2017) 05-0031-05 10.13307/j.issn.2096-3122.2017.05.06 (编校李由明)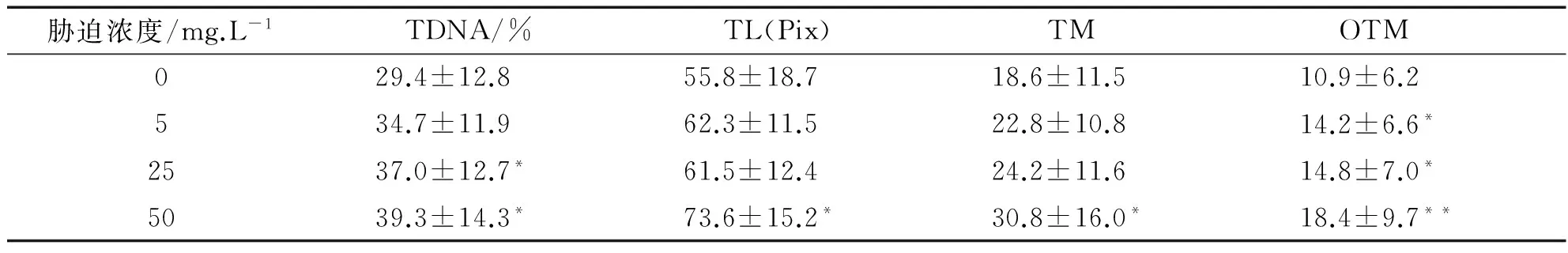
3 讨论
