几种水生蔬菜组织培养研究进展
2017-11-01刘娴徐旭李良俊
刘娴+徐旭+李良俊


摘 要:莲藕、慈姑、荸荠、芋等水生蔬菜长期无性繁殖,繁殖效率低,种性退化严重。利用植物组织培养技术,可培养和快速繁育无毒或少毒再生植株,恢复种性,提高繁殖系数。从外植体选择、分化培养、增殖培养、组培苗的生根、驯化及移栽等综述了莲藕、慈姑、荸荠和芋等组织培养技术,以期为该技术的提升和应用提供参考。
关键词:莲藕;慈姑;荸荠;芋;茎尖;组织培养
中图分类号:S645 文献标识码:A 文章编号:1001-3547(2017)18-0055-07
水生蔬菜是指生长在淡水中其产品用作蔬菜食用的维管束植物。中国水生蔬菜主要有莲藕、茭白、慈姑、荸荠、水芹、芡实、芋、菱、莼菜、豆瓣菜、蒲菜、水雍菜等十余种[1],栽培历史悠久,主要分布在长江流域及其以南地区,包括江苏、湖北、浙江、湖南、江西、广西等省[2]。目前,我国水生蔬菜栽培面积达73.3万hm2以上,年总产值约550亿元[2]。水生蔬菜在调整农业结构、改善生态环境、出口创汇、增加农民收入等方面发挥着重要作用。
水生蔬菜大多采用根、茎等营养器官进行无性繁殖,繁殖系数较低,一般仅有1∶(5~10),用种量大,成本高[3],且随着生长年限的增加,病虫害不断积累,导致水生蔬菜种性退化,严重影响产量和品质。近年来,随着组织培养技术在农业生产上广泛应用,利用茎尖培养技术不仅可以获得脱(少)毒种苗,而且能在短时间内快速增殖,获得大量组培苗,是无性繁殖水生蔬菜优质种苗的新途径[4]。为此,综述了莲藕、慈姑、荸荠和芋的组织培养技术,以期为应用该技术实现水生蔬菜种苗的脱(少)毒与快繁生产,促进水生蔬菜种苗生产水平的提升及水生蔬菜产业发展提供参考。
1 莲藕组织培养
1.1 外植体
①外植体类型 目前,莲藕(Nelumbo nucifera Gaertn.)组织培养多以茎尖为外植体。李良俊等[5,6]以江苏省主栽品种美人红为材料,探讨莲藕茎尖组织培养技术。另外,以不同地区、不同莲藕资源为试验材料,研究茎尖培养的快速繁殖技术,以提高莲藕的繁殖系数[7~9]。
此外,研究以莲藕幼胚为外植体,诱导愈伤组织形成再生植株,尽管该方法的增殖系数不高[10],但均成功诱导出再生植株[11,12]。潘大仁等[13]以幼胚为外植体,初步建立了9个不同品种的子莲组培快繁体系;Mahmad等[14]也以莲幼胚为试验材料,建立了莲离体再生体系。
②外植体采集时期 采集时期的选择对外植体的分化有很大的影响。莲藕萌发期的茎尖较休眠期、营养生长期和结藕期更利于分化,其中萌发期的茎尖转绿率和分化率均达到最大值,分别为86.7%和56.7%;处于休眠期的转绿率最低,为8.8%,且不易分化[5]。以莲藕幼胚为外植体时,花后2~8 d的幼胚易诱导产生愈伤组织,花后9~12 d的胚不易形成愈伤组织,花后2 d内和花后12 d后均不能产生愈伤组织[11]。
③外植体大小 在莲藕茎尖培养过程中,外植体的大小会影响分化培养及增殖培养的效果。在分化培養时,茎尖的大小与获取无菌苗的比例呈负相关,即取材时越接近茎尖顶端,带病原菌的概率就越小,因此以较小茎尖顶端为外植体较
好[16];在增殖培养时,外植体以1片展叶+1片未展叶+1个芽时增殖系数为3.67,此时增殖效果最佳[6]。
1.2 培养基与培养条件
莲藕组织培养的最适基本培养基为MS培养基(表1),根据培养阶段的不同,添加适合种类及浓度的外源激素,其中以6-BA和NAA配比最佳。此外,不同浓度的蔗糖对莲藕组织培养的各个阶段均有促进作用,而活性炭只适合在最后的生根培养时添加且浓度不宜过高。
莲藕组织培养的适宜培养条件为:最适培养温度为(25±2)℃,最适光照强度为2 000 lx[5],红光下莲藕组培苗生长势最强[21]。
1.3 影响莲藕组织培养的主要因素
①莲藕基因型对分化培养的影响 柯卫东等[19]在筛选出的最佳培养基MS+6-BA 1.5 mg/L+NAA
0.5 mg/L+3%蔗糖上,芽接种24 h后鄂莲4号的转绿率和萌动率达83.3%、58.3%,而鄂莲1号的转绿率和萌动率均较低,分别为71.4%和38.1%,49 h后这2种基因型的莲藕分化率差异不明显,鄂莲4号为58.3%,鄂莲1号为57.1%。将藕莲鄂莲1号、鄂莲4号与花莲红娃娃、案头春分别接种到MS+6-BA 1.5 mg/L+NAA 0.5 mg/L+3%蔗糖的培养基上,2个花莲品种的分化率显著高于藕莲[17]。
②培养基类型对莲藕茎尖分化及组培苗的影
响 将花莲案头春的茎尖分别接种至固体培养基和下层为固体上层为液体的固液培养基上,发现接种在固液培养基上芽的分化率为86.6%,显著高于固体培养基上芽的分化率70.0%,且固液培养基上茎尖的启动时间短,生长状态好,这可能是由于固液培养基更接近于花莲的自然生长环境,因此更利于碗莲茎尖的分化[15]。此外,固液培养基(液体∶固体=1∶2)中组培苗的生长势较固体培养基好,表现为根系较发达,地下茎和叶柄粗壮[9]。
③外源激素对不同培养阶段的影响 在茎尖分化培养基中添加6-BA 1.5 mg/L,鄂莲4号的转绿率和分化率达到最高,分别为88.57%和65.70%[19]。李良俊等[5]在莲藕茎尖分化培养时发现,ZT 0.4 mg/L或6-BA 1.6 mg/L对外植体的转绿和分化具有明显促进作用,其中ZT 0.4 mg/L的培养基中,外植体转绿率和分化率分别为94.1%和45.7%,6-BA 1.6 mg/L下的转绿率和分化率分别为87.8%和58.1%。转绿不等于分化,但它是分化的前提,所以相比较ZT 0.4 mg/L和6-BA 1.6 mg/L对茎尖分化的影响,最适的分化培养基为MS+6-BA 1.6 mg/L+3%蔗糖[5]。endprint
适量的外源激素6-BA、NAA和KT会影响莲藕增殖培养的效果。当6-BA浓度过低时,增殖系数较小,不利于快速繁殖,当6-BA的浓度较高时,增殖系数虽然较大,但组培苗的生长势弱,不利于后期生根培养,一般选择6-BA 0.5 mg/L为宜[17~19]。但与何碧珠等[20]在研究子莲品种建莲1号、建莲21号和太空莲19号增殖培养时筛选出的最适浓度6-BA
3.0 mg/L存在很大差异,这可能是因为莲藕基因型不同导致的。
④活性炭对莲藕茎尖培养的影响 彭静等[17]研究发现,随着活性炭浓度的增加,组培苗的增殖系数降低,生长势减弱,因此在莲藕增殖培养时不宜加入活性炭。但在莲藕的生根培养过程中,活性炭浓度逐渐升高,生根率呈现先升高后降低的趋势,当其浓度达到0.15%时,生根率达到最大值,可见适当浓度的活性炭有利于组培苗的生根生长[17,20]。其原因可能是活性炭的加入为组培苗提供了一个暗环境,避免了强光对根系造成伤害[22]。
⑤蔗糖对莲藕组培苗生长的影响 植物组织培养的培养基中添加糖为组培苗提供了生命活动必不可少的碳源和能源,同时兼具调节渗透压的作用。在莲藕茎尖培养过程中,不同培养阶段的培养基中均需添加一定浓度的蔗糖(表1),多数结果表明3%蔗糖有利于芽的分化和增殖[5,17,19],但曾明星等[9]通过测定不同浓度蔗糖下的地下茎长、茎粗、叶柄长、叶柄粗,结合增殖系数综合比较,发现5%蔗糖浓度下的培养苗生长势优于3%蔗糖浓度。同时在莲藕组培苗的生根培养基中,分别添加3%~8%的蔗糖,比较培养5 d、10 d和15 d的生根率及芽的生长率,发现5%蔗糖浓度下组培苗生根率最大,且移栽成活率最高,达97.3%[23,24](表2)。
2 慈姑组织培养
慈姑(Sagittaria sagittifolia L.)种子虽然有繁殖能力,但其所结球茎较小,商品性差,因此慈姑主要以球茎进行无性繁殖,繁殖系数约为1∶10,在生产上用种量大,成本高[25]。近年来,对慈姑组织培养技术的研究也已逐步开展。
2.1 外植体的选择与消毒
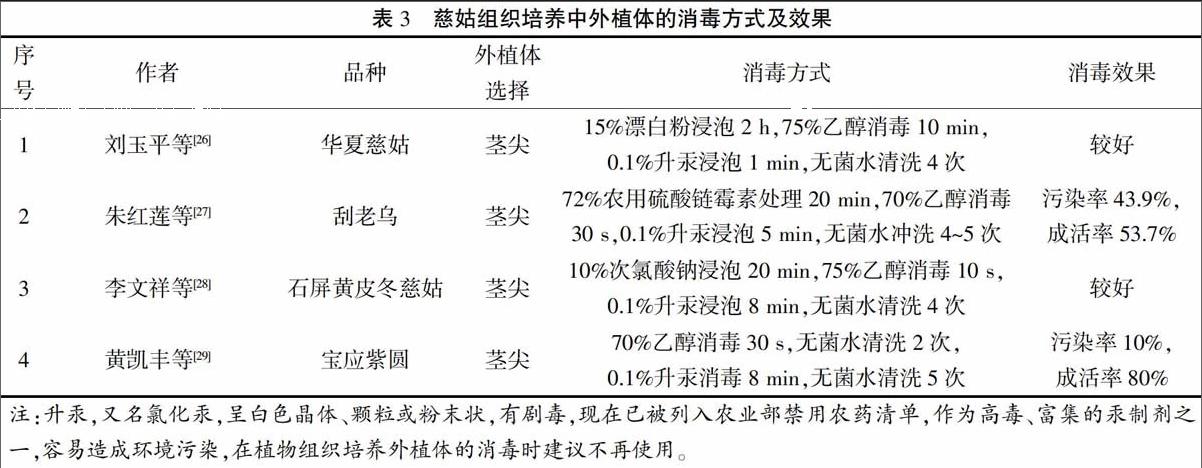
无菌外植体的获取是组织培养的第一步,也是离体培养成功的关键因素[25]。目前,慈姑组织培养均采用茎尖为(外植体)材料,因为慈姑茎尖长期处于淤泥中,虽被多层鳞片包裹但不紧密,易携带微生物,所以无菌茎尖材料的获取较困难,消毒方式也各有差异(表3)。
2.2 茎尖分化培养
慈姑茎尖分化通常以MS为基本培养基,添加6-BA 2 mg/L时,外植体先抽生地下根状茎,后向上长成小植株,而在6-BA 4 mg/L的培养基上茎尖直接分化形成小植株[26]。朱红莲等[27]通过不同浓度6-BA和NAA配比,筛选出慈姑茎尖的分化最适培养基为
MS+6-BA 1.0 mg/L+NAA
0.3 mg/L,分化率达88.1%,若维持6-BA浓度不变时,分化率随着NAA浓度呈现先上升后下降的趋势,说明较低或较高浓度的NAA均不利于慈姑莖尖的分化。
2.3 增殖培养
①不同浓度梯度的激素配比对增殖培养的影响 在培养基中同时添加外源激素6-BA和NAA,当NAA浓度维持不变时,增殖系数随着6-BA浓度的增加呈上升趋势;当6-BA浓度维持不变时,增殖系数随着NAA浓度的增加略有下降,最终筛选出慈姑的最适增殖培养基为MS+6-BA 3.0 mg/L+NAA 0.1mg/L[27]。以上研究表明,较高的6-BA浓度有利于慈姑组培苗的增殖。
②培养周期对增殖培养的影响 通过不同培养周期的梯度实验发现,培养1~3周的慈姑组培苗增殖缓慢,4~6周增殖迅速,且在第6周增殖系数达8.87±0.15,随后第7、8周组培苗的增殖系数虽略大于第6周但差异不显著,但其组培苗生长势较第6周的弱,这可能是因为在同一培养基中随着组培苗的大量增殖,营养物质不断消耗、有毒代谢物质不断积累所造成的[25]。因此,在慈姑的增殖培养中,最适的增殖周期为6周,增殖周期过短或过长都会影响增殖系数。
2.4 移栽定植
通常,组培苗进入生产实践前,需经历生根和驯化的过程,其中驯化是一个非常关键的环节,因为组培苗生长在恒温、高湿、无菌的环境下[30,31],如直接将其从培养基移栽至大田,组培苗很容易因组织分化不完善、光合能力弱、适应性差等因素而死亡,因此,组培苗通常必须经驯化才能提高成活率。慈姑的组培苗洗净根部的培养基后,直接移栽至苗床,随后控制好育苗期的水、光、温等外部环境,其移栽成活率可达90%左右[27]。
3 荸荠组织培养
3.1 外植体的选择
关于荸荠(Eleocharis tuberosa)组织培养的研究,主要集中在2个方面,一是通过茎尖培养获取无菌苗,二是球茎的再生。大多数研究以优质的、饱满的芽作为试验材料,探讨荸荠组织培养与快速繁殖技术[32~34];也有分别采集主芽和侧芽,研究不同部位的芽对荸荠组培的影响[35,36]。
3.2 茎尖诱导培养
①取材时期及取材部位对茎尖诱导培养的影响 春季萌发期较秋季成熟期和冬季休眠期取材,更有利于荸荠组培的研究[37](表4),主要表现在分化率高,组培苗的生长势较好,褐变发生较少,但由于组织生长旺盛,养分消耗快,如不及时更换培养基,很容易造成组培苗黄化。
林辉锋等[35]分别以主芽和侧芽为外植体进行培养,主芽10 d左右就能被诱导分化,而侧芽则需20 d,但是主芽的污染率略高于侧芽,依次为50.5%、43.5%,因此,以荸荠主芽为外植体材料,更有利于培养成苗。
②外源激素对茎尖诱导培养的影响 添加适宜浓度的6-BA对荸荠的茎尖分化有促进作用,当6-BA浓度达到2.0 mg/L时,分化率达78.6%[38];同时添加6-BA和NAA,培养基各组分配比为MS+endprint
6-BA 0.20 mg/L+NAA 0.02 mg/L+蔗糖3.0%时,荸荠的茎尖分化率达81.4%[39]。
3.3 增殖培养
在荸荠茎尖增殖培养时,培养基类型影响其增殖系数,液体培养基更利于荸荠幼芽的增殖,增殖系数为6~8,高于固体培养基的增殖系数3~5[34]。
6-BA和NAA组合最有利于荸荠增殖培养[41];陈利萍等[33]认为CPPU(氯吡苯脲)和6-BA对荸荠的增殖培养具有相似的效果,但CPPU的活性是
6-BA的10倍;王碧琴[42]在增殖培养基中添加0.25~1.0 mg/L的PP333,发现荸荠培养苗的生长势较好,且能有效提高荸荠的增殖系数,减少繁殖代数。
培养基中添加0.5%活性炭,组培苗的生长势较强,但增殖系数较低;不添加活性炭,组培苗的生长势较弱,但其增殖系数高[38]。
以四塘荸荠和郴州荸荠为试验材料,培养基不添加蔗糖时,2个品种均不能产生丛生芽;添加蔗糖时,增殖系数随着蔗糖浓度的增加先升高后降低,但不同品种的最大增殖系数所对应的蔗糖浓度不同,因此在荸荠增殖培养时,要选择适宜的蔗糖浓度[43]。
3.4 生根培养
荸荠生根培养基一般由MS基本培养基、外源激素、活性炭及蔗糖组成(表5),培养基中添加活性炭可以促进组培苗的生根,且植株生长健壮,还能有效防治褐化现象[38,40]。
4 芋组织培养
4.1 外植体的选择
芋[Colocasia esculenta (Linn.) Schott.]组织培养通常以顶芽饱满、充实完整的球茎为材料[45~48],外植体经消毒灭菌,然后在无菌条件下切去大小适宜的茎尖进行培养。外植体大小会影响茎尖的成活率,当外植体小于0.3 mm时,茎尖较难成活,在0.3~0.6 mm茎尖成活率在80%以上[49]。
4.2 初代培养
汤青林等[50]分别以6-BA、ZT和KT 3种细胞分裂素与NAA组合进行芋初代培养发现,6-BA与NAA配比组合分化率最大可达到83.8%,明显优于ZT和NAA组合(27%)、KT和NAA组合(40%);进一步研究6-BA与NAA配比时发现,过高或过低的6-BA浓度均不利于茎尖分化,其中当6-BA浓度为1.0 mg/L时最利于芋茎尖分化,同时添加低浓度的NAA有助于进一步提高茎尖分化率[45,46]。
4.3 继代培养
芋继代培养时外源激素的应用较多,有研究以TDZ和IBA组合,得到了较好的增殖效果[51];还有以6-BA和KT分别与NAA组合,发现6-BA的增殖效果要优于KT[52];张志勇[46]探讨6-BA与NAA不同浓度配比对增殖的影响,发现6-BA浓度的增加会提高增殖系数,但高浓度的6-BA会抑制组培苗的生长,而添加适量的NAA则有利于组培苗的生长,提出MS+6-BA 1.0 mg/L+NAA 0.2 mg/L为最适增殖培养基。
在芋增殖培养基上添加水解乳蛋白(LH)能有效提高芋芽的生长速度[53]。选用蔗糖、食用白糖、葡萄糖和麦芽糖这4种碳源分别加入芋继代培养基,其中麦芽糖的增殖效果最差,而其他3种碳源的效果无显著差异[53]。
4.4 组培苗的生根、驯化、移栽
生根培养选用MS为基本培养基,添加NAA对诱导生根效果好,植株长势更佳[45],因此,生根培养室一般会优先选用NAA[51,52]。
将根系生长健壮的组培苗置于缓冲室内驯化约10 d,随后取出并洗净根部的培养基,移栽到含有泥炭和珍珠岩(3∶2)的混合基质中,放置于覆有遮阳网的小拱棚内,浇透水,维持95%以上的相对湿度和25℃的棚温,期间注意喷施营养液和保持水分,最终可使芋组培苗的移栽成活率达95%以上[51]。
5 问题及展望
莲藕、慈姑、荸荠和芋等水生蔬菜的组织培养过程中,由于外植体灭菌、褐化现象、脱毒种苗的研制及组培苗快繁应用等问题,降低了组培效率,限制了组培苗的开发应用。
5.1 外植体的灭菌
外植体的灭菌是组织培养的第一步,外植体大小、消毒剂种类、消毒时间等因素均会影响组织培养的效果。通常茎尖培养时越接近茎尖顶端带菌、带毒率越低,但茎尖越小越不易培养成活,应根据具体的材料筛选出最佳的外植体大小。水生蔬菜材料带菌率高,外植体消毒普遍较困难,应选择适宜消毒剂、掌握精准的消毒时间,既避免灭菌不彻底,又要防止杀伤外植体。
5.2 褐化现象
褐化是指在组织培养中,外植体向培养基释放褐色物质,并逐渐导致自身生长势变弱甚至死亡的过程[54]。莲藕初代培养时外植体极易褐化,可能与莲藕中多酚氧化酶(PPO)的活性有关。在有氧条件下PPO会催化多酚类物质氧化成醌,再聚合成有色物质,从而发生褐变[16]。荸荠组织培养过程中褐化的发生也十分频繁,林辉锋等[35]发现在增殖培养的同时诱导生根能有效减少褐化的发生。很多研究认为组培中的褐化现象是决定植物组织培养成功与否的关键,因此探讨褐化的发生机理及解决办法也是组培领域的热门课题[55]。在研究水生蔬菜组织培养时,我们通常可以从外植体、培养基组成和培养条件等方面入手来抑制褐化现象。首先为避免外植体长时间暴露在空气中,应将切取的外植体迅速进行接种,其次在培养基中添加活性炭可吸附醌类物质,当進行增殖培养时,可适当缩减增殖周期或勤换培养基,均能有效抑制褐化现象[16]。
5.3 脱毒种苗的研制及快繁应用问题
植物组织脱毒技术有茎尖培养脱毒、愈伤组织脱毒、花药培养脱毒等[56]。水生蔬菜宜采用茎尖培养脱毒的方法,但茎尖培养获取的无毒或少毒植株仅仅是针对某种或某些病毒,而对水生蔬菜上病毒的研究较少,许多影响生长的病毒可能还是未知,因此,茎尖组培脱毒、生产脱毒种苗还需进一步研究[57]。其次,全面推广使用水生蔬菜组培(脱毒)种苗,还需进一步降低种苗的生产成本、提升包括驯化技术、微型种苗生产技术、种苗的繁育和应用技术体系及配套高效栽培技术等问题[58],这些问题都严重限制了目前水生蔬菜组培(脱毒)种苗的规模化推广应用。endprint
参考文献
[1] 赵有为.中国水生蔬菜[M].北京:中国农业出版社,1999.
[2] 柯卫东,黄新芳,李建洪,等.我国水生蔬菜科研与生产发展概况[J].长江蔬菜,2015(14):33-37.
[3] 曹碚生,江解增.我国水生蔬菜生产科研现状及发展对策[J].中国蔬菜,2002(5):1-3.
[4] 张建福,王锋.莲藕的组织培养现状与展望[J].上海农业科技,2000(4):10.
[5] 李良俊,何小弟,赵有为,等.莲藕茎尖培养技术的初步研究[J].江苏农学院学报,1995(3):31-34.
[6] 李良俊,赵有为.莲藕茎尖培养苗的快繁技术[J].南京农业大学学报,1998(1):113-115.
[7] 于文进,龙明华.莲藕组织培养及快速繁殖试验研究[J].
农业研究与应用,1999(2):9-11.
[8] 彭静,柯卫东,黄新芳.莲藕的组织培养与快速繁殖[J].植物生理学报,2001,37(1):38.
[9] 曾明星,何碧珠,罗银华.建莲藕茎尖离体培养快繁技术及应用[J].福建农业科技,2005(3):13-14.
[10] 赵芹,李效尊,徐国鑫,等.莲组织培养与分子生物学研究进展[J].分子植物育种,2016,14(6):1 587-1 594.
[11] 何子灿,刘士佳.莲胚愈伤组织诱导及植株再生的研究[J].水生生物学报,1987,11(3):278-280.
[12] 张建福,王锋.莲藕组织培养与微繁殖技术初探[J].上海农业科技,2002(6):17-18.
[13] 潘大仁,林龙云,柯文杰,等.不同品种子莲组培苗快繁技术初探[C].全国植物组织培养、脱毒快繁及工厂化生产学术研讨会,2004:5.
[14] Mahmad N, Taha R M, Othman R, et al. Effects of NAA and BAP, double-layered media, and light distance on in vitro regeneration of Nelumbo nucifera Gaertn. (lotus), an aquatic edible plant[J]. The Scientific World Journal, 2014(12): 1-8.
[15] 孔德政,毛瑞丽,孔德平.碗莲组培快繁技术初探[J].中国农学通报,2008,24(4):76-79.
[16] 陈江山,胡臣,冯陈龙,等.莲藕的组织培养研究[J].武汉轻工大学学报,2013(1):31-34.
[17] 彭静,柯卫东,刘玉平,等.莲藕的组织培养及其影响因素[C].全国植物组培、脱毒快繁及工厂化生产技术学术研讨会,2001.
[18] 汤泳萍,罗绍春,占丰溪,等.广昌太空莲组培快繁研究初报[J].江西农业学报,2001,13(4):58-61.
[19] 柯卫东,彭静,刘玉平,等.试管藕诱导技术研究[J].植物科学研究,2001,19(2):173-175.
[20] 何碧珠,曾明星,赵时端,等.建莲茎尖离体培养研究初报[J].福建农林大学学报:自然科学版,2002,31(1):59-61.
[21] 谢科.莲藕组培苗高效扩繁技术的研究[D].扬州:扬州大学,2005.
[22] 徐春明,赵兵,耿楠,等.植物激素和活性炭对新疆雪莲组培苗生根的影响[J].中国农学通报,2006,22(2):41-43.
[23] 李良俊,孙磊,潘恩超,等.培养基蔗糖浓度对莲藕试管苗驯化的影响[C].中国园艺学会会员代表大会暨学术讨论会,2005:5.
[24] 李良俊,孙磊,谢科,等.蔗糖浓度对莲藕试管苗质量的影响[J].中国蔬菜,2007(8):26-29.
[25] 朱红莲.试管慈姑誘导的初步研究[D]武汉:华中农业大学,2006.
[26] 刘玉平,柯卫东.慈姑的组织培养[J].植物生理学通讯,2002,38(3):244.
[27] 朱红莲,柯卫东,汪李平.慈姑茎尖组织培养与快速繁殖[J].中国蔬菜,2006(3):15-17.
[28] 李文祥,苏中,李增荣.冬慈姑组培育苗技术研究[J].云南农业科技,2010(2):18-19.
[29] 黄凯丰,时政.慈姑茎尖组织培养的研究[J].安徽农业科学,2011,39(2):8 848-8 849.
[30] 李浚明.植物组织培养教程.2版[M].北京:中国农业大学出版社,2002:267.
[31] 丰锋. 提高试管苗移栽成活率的技术研究[J]. 中国南方果树,2001,30(4):63-64.
[32] 李良俊,何小弟.荸荠的组织培养和快速繁殖[J].植物生理学通讯,1994(4):275-280.
[33] 陈利萍,吕家龙,唐永红,等.荸荠离体培养技术的初步研究[J].浙江大学学报:农业与生命科学版,1999(5):524-526.
[34] 杭玲,苏国秀,蒋慧萍,等.荸荠的组织培养和快速繁殖[J].南方农业科学,2005,36(4):306-307.
[35] 林辉锋,周辉明,周建金,等.荸荠的组织培养和快速繁殖探讨[J].浙江农业科学,2011(6):1 241-1 243.
[36] 蓝实.荸荠组织培养及其后代植株变异性状的研究[D].南宁:广西大学,2006.endprint
[37] 蔡佳燕.荸荠组织培养及其休眠的研究[D].杭州:浙江大学,2008.
[38] 彭静,柯卫东,李峰,等.荸荠的组培快繁与大田种植[J]. 中国蔬菜,2007(B08):33-35.
[39] 徐君,刘凤军,佘旭东,等.苏州荸荠组培快繁技术研究[J].园艺与种苗,2011(6):7-8.
[40] 赖小芳,陈银龙,王伯诚,等.荸荠店头三王高效组培快繁及驯化移栽技术[J].浙江农业学报,2011,23(6):
1 123-1 128.
[41] 蓝实,张慧英.荸荠试管苗配方试验[J].农业研究与应用, 2006(1):5-6.
[42] 王碧琴.PP333对荸荠试管苗增殖调控的研究[J].江西科学,2006,24(2):136-138.
[43] 张慧英,韦绍丽.荸荠试管苗的快速繁殖[J].基因组学与应用生物学,2007,26(S1):99-102.
[44] 吴桂容,李忠芳,陈春岚,等.马蹄组织培养中的外植体灭菌及培养基筛选研究[J].贺州学院学报,2007,23(2):126-127.
[45] 李云玲.白塔芋的组织快速繁殖技术研究[J].北京农业,2013(9):16.
[46] 张志勇.六月红早熟芋茎尖脱毒研究初报[J].广东农业科学,2008(10):30-32.
[47] 杨俊慧,孟庆军,李建东,等.芋的脱毒快繁及栽培研究[J].山东科学,2004,17(3):32-35.
[48] 毕可华,赵建萍,蒋小满,等.芋茎尖离体培养和快速繁殖[J].广西植物,1999,19(1):61-64.
[49] 柏新富,蒋小满,毕可华,等.芋组培脱病毒技术及其增产效益的研究[J].中国农学通报,2002,18(4):48-51.
[50] 汤青林,李渝,刘荣,等.芋离体快繁体系的优化[J].西南农业大学学报:自然科学版,2004,26(6):686-688.
[51] 林文丽,陈华.海门香沙芋组培技术研究与应用[J].农业科技通讯,2008(6):43-46.
[52] 姜秀芳,邓春霞,杨小丽,等.开封芋头组培快繁技术研究[C].中国园艺学会青年学术讨论会,2006:3.
[53] 汤青林,牛义,王志敏,等.芋芽继代培养中激素、水解乳蛋白、碳源的调节研究[J].西南农业学报,2006,19(5):928-930.
[54] 陈菲,李黎,宫伟.植物组织培養的防褐化探讨[J].北方园艺,2005(2):69.
[55] 冯代弟,王燕,陈剑平.植物组培褐化发生机制的研究进展[J].浙江农业学报,2015,27(6):1 108-1 116.
[56] 葛胜娟.植物组织培养中的快繁与脱毒技术及其应用[J].中国农学通报,2005,21(5):104-107.
[57] 柏新富,蒋小满,毕可华,等.芋脱毒苗的组培快繁及田间试验[J]. 应用于环境生物学报,2002,8(1):52-55.
[58] 杭玲,黄卓忠,廖首发,等.荸荠脱毒及组培快繁技术研究与应用[J].江苏农业科学,2007(6):143-144.
Advances of Study on Tissue Culture of Aquatic Vegetables
LIU Xian, XU Xu, LI Liangjun
( College of Horticulture and Plant Protection, Yangzhou University, Jiangsu 225009 )
Abstract: The aquatic vegetables such as lotus rhizome (Nelumbo nucifera Gaertn.), arrowhead(Sagittaria sagittifolia L.), water chestnut (Eleocharis tuberosa) and taro (Colocasia esculenta (Linn.) Schott) have been asexually propagated with low efficiency, and the species degeneration is serious. Using the plant tissue culturetechnique, we can culture and rapidly breed non-toxic or less toxic regenerated plants, then restore species and improve the reproductive coefficient.The tissue culture technique including the explant selection, differentiation culture, proliferation culture, rooting, domestication and transplanting of tissue culture seedlings of lotus rhizome, arrowhead, water chestnut and taro were reviewed in order to provide references for the promotion of technology and application in the present study.
Key words: Lotus rhizome; Arrowhead; Water chestnut; Taro; Shoot tip; Tissue cultureendprint
