心外膜脂肪细胞核因子(NF)-κB信号途径抑制在抗动脉粥样硬化中的作用分析
2017-11-01林伯理
林伯理
(信丰县人民医院,江西 赣州 341600)
心外膜脂肪细胞核因子(NF)-κB信号途径抑制在抗动脉粥样硬化中的作用分析
林伯理
(信丰县人民医院,江西 赣州 341600)
目的 分析在抵抗动脉粥样硬化过程中,心外膜脂肪细胞核因子(NF)-κB信号途径的抑制。方法 建立泡沫模型之后,采用油红染色O来判断模型是否建立成功,将其分成空白组,siRNA干扰组,转染试剂组,高脂组,高脂+SRT1720+siRNA干扰组,高脂+SRT1720组,分析其蛋白表达的分析均采用Western的方式。结果 模型被成功建立之后,从SIRT1蛋白表达量来看,高脂+SRT1720组相对于高脂组升高明显,其下游的靶向分子肿瘤坏死因子(TNF)-α蛋白表达量及(NF)-κB下降显著。SIRT1蛋白表达量高脂+SRT1720+siRNA干扰组比高脂+SRT1720组相比下降量更为显著,其下游的靶向分子肿瘤坏死因子(TNF)-α蛋白表达量及(NF)-κB升高更为显著。结论 泡沫细胞模型中(NF)-κB的信号通路上游是SIRT1,其作用为抑制心外膜脂肪细胞核因子(NF)-κB炎症信号途径,调节并参与帮助泡沫细胞的移除,从动脉粥样硬化的斑块当中。此种方式可以提供新的手段在预防及治疗动脉粥样硬化上,为广大临床患者获得更高的治疗途径。
心外膜脂肪细胞核因子(NF)-κB信号途径;抵抗动脉粥样硬化;作用分析
血管壁的纤维化与脂质沉积是发生在大动脉的一种慢性的炎症性的疾病,称为动脉粥样硬化(atherosclerosis,AS)[1]。有相关研究证明,其特征为由泡沫细胞(巨噬细胞衍生而来),积蓄在血管内壁中,由纤维细胞增生、炎症细胞聚集、血管生成、细胞外基质沉积、钙化以及纤维化等多种复杂的过程构成,出现管壁缺血缺氧、管腔狭窄等,以斑块形成为最终结果[2]。本研究旨在分析心外膜脂肪细胞核因子(NF)-κB信号途径的抑制,其在调节AS的发展形成的作用分析,现报道如下。
1 资料与方法
1.1 仪器试剂 由上海光密仪器有限公司生产的型号为GFM-550荧光显微镜、由普朗医疗设备有限公司提供型号为PUZS-300的全自动生化分析仪。美国SCIENCELL公司购置人单核细胞株,SIRT1、胎牛血清、RPMI1640型号细胞培养基均于澳大利亚Gibco公司。肿瘤坏死因子(TNF)-α与(NF)-κB购置于澳大利亚Gibco公司。
1.2 泡沫细胞模型的建立与染色 RPMI1640型号细胞培养在10%胎牛血清培养。放置12 h于37℃,5%二氧化碳培养箱中,加入青霉素100 mg/mL与链霉素100 U/mL,诱导分化巨噬细胞。调整浓度为1×106个/mL,接种数对长期细胞与6孔板上面加入软质酸钠调整浓度共育24 h,最终建立出泡沫细胞的模型。将诱导完成的巨噬细胞进行细胞玻片,以4%多聚甲醛固定后,行油红O染色。
1.3 分组 分为空白组,siRNA干扰组,转染试剂组,高脂组,高脂+SRT1720+siRNA干扰组,高脂+SRT1720组。常规培养为空白组;空白组+5μL转染试剂为转染试剂组;转染试剂组+6μmol/L的SIRT1干扰为siRNA干扰组;空白组+0.08 g/L的ox-LDL+0.2 mmol/L软脂酸钠为高脂组;高脂+SRT1720+6μmol/L的SIRT1干扰siRNA为高脂+SRT1720+siRNA干扰组。siRNA的干扰过程严格按照说明书进行。
1.4 蛋白表达及印记分析 采用4℃磷酸盐冲洗细胞1 min/次,2次/d。细胞冰上裂解、离心30 min后吸取上清液测定蛋白浓度。采用电化学发光法,进行系统分析。
1.5 统计学方法 应用SPSS 17.0软件进行分析,计计量资料采用“x±s”表示,组间比较采用t检验;计数资料用例数(n)表示,计数资料组间率(%)的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 泡沫细胞膜型建立 在诱导下的细胞形态出现明显的变化,大部分细胞分化良好出现伪足呈梭形贴近壁生长,则提示以分化称为巨噬细胞。由于ox-LDL及软脂酸钠的共同作用,细胞质显现红色脂质颗粒,与泡沫细胞特点形态一致,提示模型建立成功。见图1、图2。

图1 泡沫细胞(箭头处为典型改变,×200)
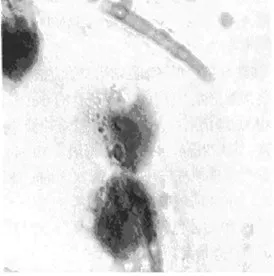
图2 巨噬细胞(×200)
2.2 (NF)-κB信号途径及Western印记的结果 高脂+SRT1720组相对于高脂组升高明显,其下游的靶向分子肿瘤坏死因子(TNF)-α蛋白表达量及(NF)-κB下降显著。SIRT1蛋白表达量高脂+SRT1720+siRNA干扰组比高脂+SRT1720组相比下降量更为显著,差异有统计学意义(P<0.05)。见表1。

表1 5组的(NF)-κB信号途径及Western印记的结果
3 讨论
动脉粥样硬化,急性发病或者其并发症是致死的重要因素,且随着我国生活水平的不断提高,油脂摄入过剩,此病发病也随之升高[3]。导致动脉硬化的生物学特征即是血管内斑块的形成与破裂,由于斑块内部的机构、血流等至其不稳定时出现。其急性并发症的发生、损伤及早期过程均有炎症的信号通路参与此类过程[4]。(NF)-κB是一种转录因子存在于细胞内部,可能是AS发生发展的主要因素之一。在斑块血管内壁细胞、巨噬细胞、血管平滑肌细胞均可以参与(NF)-κB的激活。其存在于静息的细胞浆液中以非活性的形式存在,当动脉发生硬化时,(NF)-κB细胞被刺激以激活,作用于靶向基因,使炎性因子释放于表达,可以促进其增值于迁移,而促成了AS的发生发展。AS的血管内壁(NF)-κB存在于内皮细胞、单核巨噬细胞、平滑肌细胞、泡沫细胞中,而可见轻微(NF)-κB活化存在于无动脉硬化的斑块当中[5]。有文献表明在AS的发展发生前期,部分损伤及内皮层相对完整的时候均可见活化的(NF)-κB[6]。有研究文献证实AS患者心脏外膜的脂肪当中(NF)-κB的表达情况有明显的增高,其炎性反应通过巨噬细胞表面的受体与结合,利用(NF)-κB信号传导途径参与[7]。动物实验中(NF)-κB亚基可使斑块明显的被缩小,以减少其泡沫细胞的含量,其通过(NF)-κB信号通路的调控,使炎症信号存在于泡沫细胞中受到一定的调节作用,可使AS斑块消退。从本研究中可明显看出,模型被成功建立之后,从SIRT1蛋白表达量来看,高脂+SRT1720组相对于高脂组升高明显,其下游的靶向分子肿瘤坏死因子(TNF)-α蛋白表达量及(NF)-κB显著下降[8]。SIRT1蛋白表达量高脂+SRT1720+siRNA干扰组比高脂+SRT1720组相比下降量更为显著,其下游的靶向分子肿瘤坏死因子(TNF)-α蛋白表达量及(NF)-κB升高更为显著。
综上所述,泡沫细胞模型中(NF)-κB的信号通路上游是SIRT1,其作用为抑制心外膜脂肪细胞核因子(NF)-κB炎症信号途径,调节并参与帮助泡沫细胞的移除,为广大临床患者获得更高的治疗途径。
[1] Gaisl T,Schlatzer C,Schwarz EI,et al.Coronary artery calcification,epi-cardial fat burden and cardiovascular events in chronic obstructive pulmonary disease[J].PLo S One,2015,10(5):e0126613.
[2] Saad Z,El-Rawy M,Donkol RH,et al.Quantificationofepicardialfat:Whichmethodcanpredict significant coronary artery disease[J].WorldJ Cardiol,2015,7(5):287-292.
[3] 陈卫东,丁志珍,常保超,等.尾加压素Ⅱ在糖尿病肾病大鼠动脉粥样硬化形成的表达及黄芪的干预[J].中国中西医结合肾病杂志,2012,13(5):402-405.
[4] 阎雨,何阳阳,方莲花,等.巨噬细胞在动脉粥样硬化中的研究进展[J].中国药学杂志,2014,49(1):7-10.
[5] 欧阳旭.血清N末端脑钠肽前体对心力衰竭的诊断[J].国际检验医学杂志,2011,32(12):1346-1348.
[6] 梁仪,陈艳,严金川,等.冠心病患者活化 T细胞、辅助性 T细胞亚群水平及 CXCR3 的表达[J].江苏医药,2013,39(21):2538-2540.
[7] 耿化之,马建群.急性冠状动脉综合征患者血清内脂素水平的变化及其临床意义[J].山东医药,2011,51(13):86-87.
[8] 张勇刚,陈亚红,马春艳,等.尾加压素Ⅱ的促丝裂作用[J].中国动脉硬化杂志,2013,9(1):14-16.
10.3969/j.issn.1009-4393.2017.30.060
