美国药品注册的电子提交
2017-11-01李莎
李 莎
(重庆药友制药有限责任公司,重庆 401121)
美国药品注册的电子提交
李 莎
(重庆药友制药有限责任公司,重庆 401121)
为顺应电子化的发展趋势,全球多个药政当局都陆续开始推行申报文件的电子提交,以美国食品药品监督管理局(FDA)、欧洲药品评审中心(EMA)、日本厚生劳动省(Ministry of Health,Labor and Welfare)为首,各国也相应开始着手规范药品电子递交系统。本文以美国FDA电子提交为例,重点介绍了电子提交软件的优劣势,及美国FDA对电子提交的规范程序。通过实际的操作案例及总结的编写经验,凸显了电子申报的各种优势,总结了提交过程的要点及常见的缺陷,以帮助各制药企业更顺利的完成电子提交,抢占欧美药品市场。
药品注册;电子提交;eCTD
1 电子提交全球现状
药品电子通用技术文件(eCTD)最早源于国际协调组织(ICH),该组织的M2专家工作组(EWG)于2003年10月制定并发布了关于药品电子提交的通用标准,并被美国食品药品监督管理局(FDA)、欧洲药品当局(EMA)、日本厚生劳动省(MHLW)以及加拿大等国广泛推行。其规定了申请人向药政当局提交电子文件的目录结构及文档格式,并采用XML语言的文件类型对整个递交及各申报文件的元数据进行管理,以组成综合的目录并提供相应的引索。同时简化了申报文件的创建、审核、生命周期的管理以及文件的储存。
为何电子递交的方式受到全球药政当局的推崇和支持,原因在于电子化的提交相比纸质文件更自动化和标准化;减少了纸质文件的打印、装订的人力物力;同时减少了对纸质文件的储存和管理的费用及空间;对于药政当局的评审人员来说更是增加了文件间的关联性及透明度,加快了其评审的速度和效率。
2 eCTD概述及构架
2003年,ICH Multi-disciplinary Group 2(M2)在CTD的基础上制定了eCTD的标准,eCTD可以说是电子化的CTD注册申报方式,是一个接口,用于行业与监管机构间信息的传输,以便于文件的创建、审查、生命周期管理和电子提交。其利用专门的软件进行编辑转化生成eCTD文件,通过与FDA建立专门的电子通道递交。
eCTD的结构包括XML骨架、枝干(各模块,如模块1到模块5)及枝叶(内容)三部分。每个枝干(模块)都有多枝叶文件组合而成,除模块2、模块4、模块5中有word或SAS格式的文件外,其余大部分枝叶文件均为PDF格式。申请人可以对已创建好的eCTD枝叶文件进行替换(Replace)、新增(Append)、删除(Delete)以维护整个电子文件的生命周期。XML主干实例如图1。
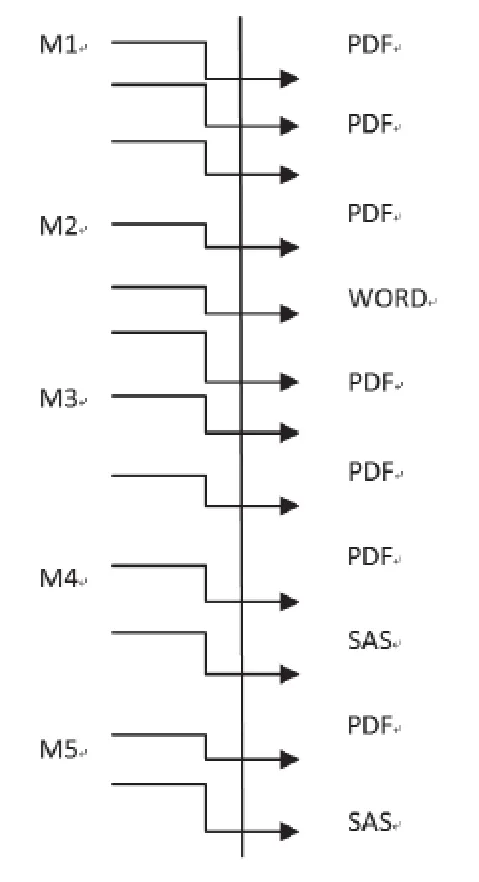
图1 XML主干实例Figue 1 XML Backbone
3 eCTD申报范例
3.1 软件选择及用户测评
药品注册申报从纸制时代走向电子时代, eCTD标准提交的软件产品也随之层出不穷,相关的软件可提供的功能包括罗列整个药品的序列(Sequence);管理整个药品注册的生命周期(LifeCycle);管理整个药品注册过程中的药政活动(Regulatory Activity),例如增补、变更、年报等等;对创建的eCTD文件的完整性进行验证(Validation)等等。申请人及当局的评审员都需要相关的软件予以支持。
如何选择适合自己公司的产品是各个厂家需要考虑的问题。衡量的关键点包括公司预算、服务器位置、技术支持程度、适用性及软件的兼容性等等几个方面。例如预进行电子提交的公司如果每年有充足的预算且每年有多个电子提交的项目,即可考虑引进大牌的软件;服务器的位置将决定递交FDA的速度,速度越快越能确保文件递交的顺畅度及完整性;从软件的售后服务来看,如果软件商能够提供较优越的服务,例如24小时在线答疑等,将会更便于申报人员应对递交过程中出现的突发状况。目前市场运用的电子提交软件较多,例如德国产的Extedo,该软件为EMA绝大多数欧盟成员国推行,包括瑞士、南非、阿拉伯等运用较广;德国的Lorenz,为欧洲的EDQM及少数几个欧盟成员国推行使用,另外还包括泰国、加拿大、澳大利亚等药政当局;印度制造的GlobalSubmit,是美国FDA推荐使用的软件;另外还有CSC,pharmaREADY,KnowledgeNet等等。药企在选择软件的同时需要对各软件的优劣进行分析评估,选择适合自己的才是最好的。
3.2 编制操作
选择好软件后,即通过软件模板,对各个章节进行了单独的编制。并对定稿的word版文件进行了适当的格式化,以确保FDA审阅文件时的美观性和可读性。在将word文档转换成PDF文档之后,按照FDA发布的PDF文档标准,需要对超过5页的PDF文件编制书签(bookmark),并建立文件内的交叉引用和超级链接,以节省FDA官员在审核文件时查找相关文件的时间。每个文件都必须包括目录、表格及图表清单,且所有的表格、图表、文献及附录都需以超级链接的形式体现在书签和目录中。
根据eCTD申报软件的标准创建电子申报文件,手动拖拽各独立单元(除质量综述中的word文件及模块4、模块5中的SAS格式文件外,大部分为PDF格式)进入相应的eCTD枝干框架中,以XML语言形式呈现各章节内容,再通过软件定位并设定web链接,锁定文件并提交生成。
申请人及FDA审核官员可通过IE打开相应的XML语言的申报文件,通过点击相应的web链接进行审核。
基西米河洪水控制工程于1954年启动,该工程不仅为流域上游区域提供防洪保障,而且保证了下游农业开发。但该工程也造成了基西米河运河化,对流域植被和物种多样性造成了破坏。
3.3 eCTD提交
按照FDA的要求,任何小于10GB的注册文件都必须通过FDA的电子递交通道(ESG)进行上传。而由于绝大部分的注册提交文件都是小于10GB的,为顺利完成提交工作,建议预进行电子提交申报的厂家应尽早申请获得FDA电子提交通道的账户。
获得电子提交通道账户的过程包括:(1)申请账户;(2)预备工作;(3)注册检测账户;(4)针对ESG调整电脑设置;(5)发送检测申请;(6)批准产品账户。其中设计的检测阶段,是用以确保FDA的电子提交通道能成功的接收你的电子文件以及你提交的文件是否符合指南的规定。检测由FDA电子提交通道的检测系统完成。一旦通过检测,即成功建立允许通过FDA电子提交通道的产品账户。
在获得电子提交通道账户并成功生成定稿的eCTD文件之后,即可通过电子提交通道向FDA提交eCTD文件。在上传eCTD文件前,按照FDA电子提交的3.2版DTD标准,需通过eCTD软件对生成的电子文档进行验证(Validation),通过提示的错误,对文件进行修改,以确保提交的资料的完整性及准确性。值得注意的是切勿重复递交已按纸质版或其他电子形式递交过的文件,仅提供新的或变更的信息即可。FDA在收到申请人的eCTD之后,即刻会给申请人反馈一封接收函,说明已成功接收到申报文件;随后FDA平台还会对递交的文件进行自动验证,如无问题,随即发送一封通过验证的通知函,告知申请人文件完整性无问题,即顺利进入递交文件的正式审查,持续时间大约为90天左右。
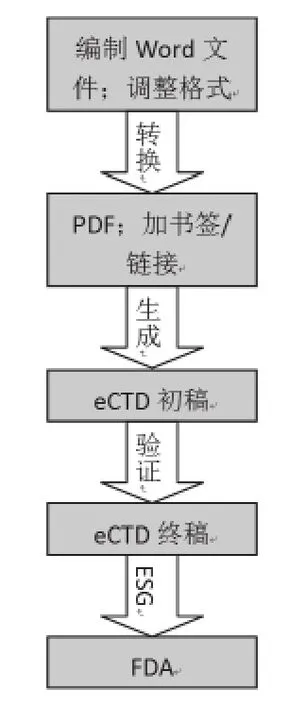
图2 eCTD创建及提交全过程Figure 2 Flow Chart of eCTD Creating and Submission
4 总 结
4.1 常见的eCTD缺陷及注意事项
电子文档的编制和准备是个极其复杂和繁琐的过程。在生成定稿电子申报文件之前,注册团队除了需要对申报资料内容进行重重审核外,还需要对电子文档的系统功能进行反复检验,以确保申报内容及电子文件的书签、链接的准确性。后期的工作对注册团队要求也较高,必须具备广泛的专业知识及熟练的计算技能。现如今FDA对各厂家申报文件的审查越发的严格,出现10个微小缺陷及1个重大缺陷即拒绝接收申报文件,例如批记录或图谱中出现未翻译的中文即有可能被FDA认为是重大缺陷而退审,不但从经济上造成企业的重大损失,也从时间上耽误了上市的有利时机。常见的eCTD缺陷包括如下。
(1)文件中带有未翻译的中文
(2)图片、图谱不清晰
(3)PDF书签
a)未对超过5页的PDF编制书签
b)书签不够详细,层次不够宣明
c)书签的名称不准确
(4)交叉引索及超级链接
a)未编制引索或链接
b)引索或链接失效或无效
c)文件目录无链接
d)链接未标示成蓝色字体(Blue text)
4.2 叶标题不够清楚
另还需注意每个独立的文件应标注页码;调整纸张方向时,可以竖页的尽量竖页,方便官员审核;签署的法规文件应加上公司页眉等等。在文件创建、上传过程中,申请人应选择较好的网络环境及递交时机,以避免网络断点等的递交失误。
4.3 电子提交的展望
电子提交对于申请人来说大大提高了注册效率,便于后期整个文件生命周期的管理,节约了纸质文件的打印装订的工序及成本并保证了文件的完整性及标准化;而对于药政当局的评审员来说,自动化的接收及审核方式为其节约了更多的时间及空间,确保了申报资料的安全、环保和有效利用,提高了药品技术审评的质量和效率。
现如今,FDA预将电子申报扩展到更广阔的领域,包括医疗器械的各种申报,药品登记,场地登记等等。电子提交以其明显的操作优势赢得了全球大部分药政当局的认可,中国也不例外。国务院办公厅在2007年4月下发的《国家食品药品安全“十一五”规划》,提出推进药品、医疗器械监管信息化进程。2013年4月18日,药品审评中心发布了《药审中心将试点开展药品注册申报资料电子提交工作》的新闻,明确指出为提升药品注册申报资料的管理水平,将试点开展药品注册申报资料电子递交工作。2015年11月27日,总局办公厅下发关于征求化学仿制药CTD格式申报资料撰写要求意见的通知。可见中国也在逐步的实施电子化递交的方式。未来随着医药企业信息化水平的提高,基于eCTD规范、运用专业的eCTD工具软件简化的申报、审核、储存流程,电子递交将迎来注册申报管理的新纪元。
[1] ICH technical specification,Electronic Common Technical Document Speci fi cation v3.2.2.
[2] Guidance for Industry Providing Regulatory Submissions in Electronic Format — Certain Human Pharmaceutical Product Applications and Related Submissions Using the eCTD Speci fi cations.
[3] Electronic Submissions Gateway.
R95
A
ISSN.2095-8242.2017.48.9478.02
本文编辑:吴 卫
