哈密瓜果实转录因子CmCBF1的克隆及表达分析
2017-11-01孟新涛郑素慧
张 婷,潘 俨,孟新涛,郑素慧,徐 斌
(新疆农业科院农产品贮藏加工研究所,乌鲁木齐 830091)
哈密瓜果实转录因子CmCBF1的克隆及表达分析
张 婷,潘 俨,孟新涛,郑素慧,徐 斌
(新疆农业科院农产品贮藏加工研究所,乌鲁木齐 830091)
目的研究CBF在哈密瓜果实采后抗冷过程中的调控功能,对转录因子CmCBF1进行克隆与表达分析,为进一步研究哈密瓜果实低温贮藏过程中的冷害发生机制提供理论依据。方法以新密3号采后离体果实为试材,根据已报道的甜瓜CBF1预测序列(XM_008440940),与基因组甜瓜组(https://melonomics.net)进行BLAST比对,确定基因编码区起始和终止位置,针对CBF1编码区设计特异性引物,通过对果实cDNA进行扩增,获得CBF1全长序列,利用实时荧光定量PCR(qRT-PCR)分析其在不同温度条件下的表达特性。结果克隆获得哈密瓜果实转录因子CBF1,命名为CmCBF1,该基因序列为639 bp(GenBank登录号为KT737742),编码212个氨基酸,蛋白质分子量为23.89 kDa,等电点为5.23;同源性分析表明,哈密瓜果实转录因子CmCBF1与草莓FaCBF1亲缘关系较近,达到85%。qRT-PCR分析结果显示,哈密瓜果实转录因子CmCBF1在1、3及5℃低温诱导条件下特异性表达,在20℃室温条件下几乎不表达。结论转录因子CmCBF1的表达与哈密瓜果实采后冷害发生负相关(r=-0.663)。
哈密瓜;CmCBF1;克隆;表达
0 引 言
【研究意义】哈密瓜(CucumismeloL.)对低温环境敏感,不适宜的低温贮藏环境易引起生理代谢失调而造成细胞伤害,即所谓的冷害(chilling injury)。冷害的发生严重影响了哈密瓜果实商品性、抗病性和耐藏性[1,2]。研究分析哈密瓜果实的采后冷害发生机理具有十分重要的意义。随着低温逆境信号传导及调控路径模型的提出,一批重要的逆境转录因子被相继克隆和鉴定,为采用基因工程手段进行植物抗寒育种及有关生理的研究提供了新的启示,克隆并鉴定调控抗冷功能基因表达的转录因子成为研究领域的热点之一[3]。【前人研究进展】CBF(C-repeatbinding factor) 基因是一类植物所特有的转录因子,是植物抗冷途径的枢纽,主要调控下游大量抗冷基因的表达,对增强植物的抗冷能力极为重要[4],CBF的作用已在拟南芥[5,6]、黄瓜[7]、番茄[8]、甜樱桃[9]、葡萄[10]及柑橘[11]等植物上证实。目前,有关CBF转录因子在植物抗冷作用的研究,大多以植物的种子、茎、叶片等器官为研究对象,以采后离体果实作为研究对象的报道甚少。近几年,陆续从番茄[12]、桃子[13]、猕猴桃[14]及芒果[15]等果实上分离并克隆得到转录因子CBF,发现转录因子CBF1与果实采后冷害发生关系密切。【本研究切入点】有关哈密瓜果实CBF的克隆与表达特性尚未见报道。研究CBF在哈密瓜果实采后抗冷过程中的调控功能,对转录因子CmCBF1进行克隆与表达分析。【拟解决的关键问题】研究以新密3号采后离体果实为研究对象,分离并克隆哈密瓜果实转录因子CBF,分析其在不同温度处理条件下的表达特性,为哈密瓜果实采后冷害研究提供分子生物学基础,也为研究CBF在哈密瓜果实采后抗冷过程中的调控功能奠定基础。
1 材料与方法
1.1 材 料
选用新密3号哈密瓜为试材,采收时果实可溶性固形物含量为11%~13%,于2014年7月21日采自新疆石河子地区121团,采后12 h内运回新疆农科院农产品贮藏加工研究所冷库。挑选大小均匀、色泽一致、网纹完整、无病虫害、无机械损伤的果实,分别置于械制冷库及室温中进行贮藏,冷库温度分别设置为1、3及5℃,相对湿度为80%~85%;室温温度为20℃。试验分为2组:
第1组:1、3、5及20℃分别选取27个果实,各温度每次取3个果实,3次重复,分别于各处理0、1、2、4、6、8、12、24和48 h,取赤道部位的果皮和果肉组织,切成小块混匀后放入液氮中冷冻,并于-80 ℃超低温冰箱保存,用于短时CmCBF1相对表达量的测定。
第2组:1、3及5℃分别选取64个果实,各温度每次取8个果实,其中5个果实用于贮藏0、7、14、21、28、35、42及49 d冷害指数的统计;另3个果实用于同一时间果皮及果肉组织的取样(用于长时CmCBF1相对表达量的测定),每组试验各3次生物学重复。
1.2 方 法
1.2.1 冷害指数
冷害等级的划分参考毕阳等的方法[16],冷害程度分为5级:0级,无冷害发生;1级,冷害发生面积≤10% ;2级,冷害发生面积11%~25%;3级,冷害发生面积25%~50%;4级,冷害发生面积≥50%。冷害指数(CII)=∑(冷害果实数×冷害级数)/(总果实数×最高冷害级数)
1.2.2 RNA的提取及cDNA 第一链的合成
采用TrizoL法提取哈密瓜果实中总RNA,用紫外分光光度计测纯度(OD260/OD230比值为1.70以上符合要求),并用1.0 %琼脂糖凝胶电泳检测RNA的完整度,将质量完好的RNA置于-80 ℃冰箱保存。取3 μL质量完整的总RNA进行反转录合成cDNA,随机引物和oligo dT各取1 μL与总RNA孵育,置于65 ℃下5 min,取出立即置于冰上2 min,加入8 μL 5 ×First-stand buffer,2 μL dNTPsMixture(10mM each),2 μL RNase Inhibiter,2 μL AMV Reverse Transcriptas,用dd H2O补至30 μL,合成40 μL体系的cDNA。42 ℃ 保温60 min,75 ℃保温15 min置于冰上冷却,得到cDNA溶液,-20 ℃保存备用。
1.2.3 PCR扩增及克隆测序
根据已报道的哈密瓜CBF1预测序列(XM_008440940),与哈密瓜基因组数据(https://melonomics.net)进行BLAST比对,确定基因编码区起始和终止位置,针对CBF1基因编码区设计特异性引物:上游5'-ATGGATTCTTTTTCAAATTTTTATGAAG-3',下游5' -TTAATAGCTCCATAAGGACACGTCAG-3'。引物送交上海生工合成。以合成的cDNA为模板,进行PCR扩增,PCR扩增采用如下体系:Primer Star DNA Polymerse(2.5 U/μL)0.5 μL,5×PS buffer 5 μL,dNTP(2.5 mmol/L)2 μL,上下游引物(10 pmol/μL)各0.5 μL,cDNA模板4 μL,ddH2O补至25 μL。反应程序:预变性98℃ 4 min;变性98℃ 10 s;退火60℃,15 s;延伸72℃ 3 min 35个循环;72℃ 10 min。PCR产物在1.5%的琼脂糖凝胶中电泳,按凝胶回收试剂盒(杭州博日)说明书回收目的片段。纯化产物取50与100 ng pEASY-T1 simple T载体(全式金)16℃过夜连接,采取热激法将连接产物转入DH5α感受态细胞。次日挑取单克隆,进行菌液PCR检测,将检测呈阳性的单克隆摇菌提取质粒,送上海生工生物工程有限公司进行测序。
1.2.4CmCBF1序列比对和系统进化树分析
通过NCBI数据库在线进行比对(http://blast.ncbi.nlm.nih.gov/Blast.cgi),找出与该基因同源性较高的其他物种的氨基酸序列;系统进化树由 MEGA6.1 构建,采用邻接法(Neighbor Joining Method)作图,重复计算次数设为1 000;利用NCBI( http: / /blast.ncbi.nlm.nih.gov)中的ORF-finder 软件找出哈密瓜CmCBF1的开放读码框,然后利用Expasy工具( http://au.expasy.org /tools/)中提供的Prot-Param 软件和ProtScale软件分别进行氨基酸残基数目、组成、蛋白质相对分子质量、理论等电点和亲/疏水性的预测分析。
1.2.5 实时荧光定量PCR(qRT-PCR)检测CmCBF1基因的检测与分析
采用CTAB[17]法分别提取1、3、5及20℃(室温)条件下短时贮藏(0、1、2、4、6、8、12、24及48 h)及长时贮藏过程中(0、7、14、21、28、35、42及49 d)哈密瓜果皮及果肉组织中的总RNA,取2 μL总RNA反转录成cDNA,然后取2 μL cDNA进行实时荧光定量PCR。根据已获得的CmCBF1的全长序列设计引物:上游5’-CGTCGCCCCATTTTCTCCGATG-3’,下游5’- GCCATCATCCCATTTTCCGTCCT -3’。选取哈密瓜EF1a作为其内参基因:上游5’-AAATACTCCAAGGCAAGGTACGAT-3’,下游5’-TCATGTTGTCACCCTCGAAACC AG-3’。实验在Realtime PCR仪(Light Cycler 480,Roche)上进行,每个样品设3次生物学重复,反应采用25 μL体系,包括2 μL cDNA,上、下游引物各0.5 μL,12.5 μL SYBR GREENⅠMaster Mix (Toyobo,Osaka,Japan),9.5 μL ddH2O。PCR扩增的具体程序为:95℃ 15 min,95℃ 10 s,58℃ 20 s,72℃退火20 s,55个循环。为了确认产物的质量和引物的特异性,对溶解曲线进行分析。分别将常温处理0 d的哈密瓜果皮和果肉组织中CmCBF1相对表达量设为1,按照2-ΔΔCT法[18]计算出CmCBF1的相对表达量,其它各时间点样品的基因表达量与其进行比较,即获得相对表达值,上述样品中CmCBF1相对表达量的测定进行3次重复。
1.3 数据处理
采用Excel 2003处理试验数据,SigmaPlot12.0作图,SPSS17.0软件ANOVA方法进行数据差异显著性分析,相关性分析使用Person双侧检验。
2 结果与分析
2.1哈密瓜果实转录因子CmCBF1克隆及序列
以哈密瓜果实cDNA第一链为模板,用引物CBF1-F/CBF1-R扩增出了639 bp左右的目的片段。测序结果显示该片段与哈密瓜基因组数据库中目的基因核酸序列的一致性为100%,表明已成功克隆到哈密瓜CBF1,命名为CmCBF1,GenBank 登录号为KT737742。测序结果显示,该基因的起始密码子为ATG,终止密码子为TAA,编码212个氨基酸。ProtScale软件分析结果显示,编码蛋白质分子量为23.89 kDa,等电点为5.23。图1,图2
对哈密瓜果实CmCBF推导的氨基酸序列与其他物种CBF/DREB蛋白进行比对分析,发现CmCBF1包含有一个高度保守的AP2/EREBPDNA结合结构域。CmCBF1在该结构域的上游和下游分别有两段保守序列:KK/RP AGRxKFxETRHP和DSAWR。此外,CmCBF1含有高度保守的第14位的撷氨酸(V)和第19位的谷氨酸(E),这是使CBF转录因子能够与DRE/CRT顺式作用元件结合的关键位点[19]。序列分析表明,CmCBF1和同其它物种的CBF/DREB蛋白一样,也具有CBF所有的序列特征。图3

M: 分子量标准, 1: cDNA的PCR结果
M: The molecular weight standard; 1: PCR products corresponding to cDNA samples
图1哈密瓜果实转录因子CmCBF1保守片段的PCR扩增
Fig.1 Agarose gel electrophoresis of PCRproductsofCmCBF1

ATG 为起始密码子;TAA为终止密码子;下划线为为特征序列KK/RP AGRxKFxETRHP和DSSWR
ATG indicate the start codon; TAA indicates the stop codon; Single underline indicate the characteristic sequence KK/RP AGRxKFxETRHP and DSSWR
图2哈密瓜果实转录因子CmCBF1cDNA的核苷酸序列(上排)及全推导氨基酸序列(下排)
Fig.2 Schematic representation of the nucleotide sequence (upper lines) and its deduced aminoacidsequence(glowerlines)ofCmCBF1cDNA
2.2哈密瓜果实转录因子CmCBF1的氨基酸系统进化树
将哈密瓜CmCBF1的核酸序列提交至NCBI,与其他物种的CBF1氨基酸序列进行在线同源比对分析。比对结果显示,哈密瓜CmCBF1氨基酸序列与草莓FaCmCBF1(ABV65907.2)的相似性较高,达到85%,其次为麻风树JcCmCBF1(XP_012090326.1)和番茄LeCmCBF1(AAK57551.1),相似度分别为52.21%和45.42%,与苹果MdCmCBF1(AAZ20446.1)、白桦BpCmCBF1(ADZ23479.1)、黄瓜CsCBF1(ABG38530.1)、拟南芥AtCBF1(ABV27083.1)及大麦HvCmCBF1(AF418204_1)等其他物种的CBF1蛋白相似度较低。图3,图4

注:黄瓜CsCBF1;拟南芥AtCBF1;草莓FaCmCBF1;白桦BpCmCBF1;番茄LeCmCBF1;苹果MdCmCBF1;大麦HvCmCBF1;麻风树JcCmCBF1)的多重比对。方框中为特征序列,划线部分为AP2/EREBP DNA结合结构域,保守的氨基酸残基用五角星号表示
Note:Cucumissativus,CsCBF1;Arabidopsisthaliana,AtCBF1;Fragariaananassa,FaCmCBF1;Betulaplatyphylla,BpCmCBF1;Lycopersiconesculentum,LeCmCBF1;Malusdomestica,MdCmCBF1;Hordeumvulgare,HvCmCBF1;JatrophacurcasJcCmCBF1).CBF/DREBsignature sequences were labeled in boxes. Black bold underline represented the conservedAP2/EREBPDNA-binding domain. The fourteenth and nineteenth amino acids ofAP2/EREBPdomain were marked by asterisks
图3哈密瓜果实转录因子CmCBF1与预测的蛋白序列与其他物种CBF/DREB蛋白
Fig.3AmultiplealignmentofpredictedCmCBF1proteinsequencewith8otherreportedCBF/DREBproteins

图4 哈密瓜果实转录因子CmCBF1与其他8个物种CBF/DREB蛋白序列同源进化树分析
Fig.4 Analysis of the homologous phylogenetic tree of CmCBF1 protein sequence and 8 other reported CBF/DREB proteins
2.3不同贮藏温度对哈密瓜果实冷害指数影响
研究表明,不同低温贮藏条件,新密3号果实均发生冷害,但冷害出现的时间和发生程度不同。1和3℃贮藏7 d,移至常温3 d后,新密3号果实出现明显的冷害症状,5℃贮藏14 d移至常温3 d后出现冷害,主要症状表现为:果皮出现褐斑,面积由小变大,至贮藏后期,整个果皮完全变色,甚至出现腐烂;然而整个贮期内,果肉组织未见明显的冷害症状。随着贮藏时间的延长,不同温度条件下新密3号果实冷害症状加重,冷害指数逐渐增大。整个低温贮藏过程中,5℃贮藏条件下,新密3号果实冷害指数显著低于1和3℃(P<0.05),而1和3℃条件下,果实冷害指数差异不明显(P>0.05)。可见,新密3号果实对低温较为敏感,5℃及以下温度贮藏均出现冷害症状。图5
2.4不同温度胁迫对哈密瓜果实转录因子CmCBF1短时相对表达量的影响
实时荧光定量qRT-PCR检测分析结果显示,不同温度胁迫条件下,新密3号果实转录因子CmCBF1短时相对表达量不同。研究表明,20℃常温放置2 h以后,新密3号果皮及果肉组织中的CmCBF1几乎不表达;1、3和5℃低温胁迫条件下的哈密瓜果实,果皮及果肉组织中的CmCBF1相对表达量均出现先上升后下降的趋势,分别在6和12 h达到高峰,且果皮组织中CmCBF1相对表达量显著高于果肉(P<0.05)。不同低温胁迫条件下的新密3号果皮及果肉组织中CmCBF1相对表达量不同,5℃胁迫条件下的新密3号果皮及果肉组织中的CmCBF1相对表达量显著高于1和3℃(P<0.05)。可见,新密3号果实转录因子CmCBF1受低温诱导特异性表达。图6
2.5不同贮藏温度对哈密瓜果实转录因子CmCBF1长时相对表达量的影响
研究表明,不同贮藏温度条件下,新密3号果皮及果肉组织中CmCBF1相对表达量也呈现先上升后下降的趋势,分别在贮藏14和21 d达到峰值,果皮组织中CmCBF1相对表达量也显著高于果肉组织(P<0.05)。随着贮藏温度的升高,新密3号果实冷害指数降低,5℃贮藏的新密3号果皮及果肉组织中CmCBF1相对表达量显著高于1和3℃,而1和3 ℃低温贮藏条件下的新密3号果皮及果肉组织中CmCBF1相对表达量差异不显著(P>0.05)。新密3号果实CmCBF1相对表达量与其冷害发生具有一定的相关性。图7

图5 不同贮藏温度下哈密瓜果实冷害指数变化
Fig.5 Effect of chilling injury index of Hami melon fruit under different temperatures
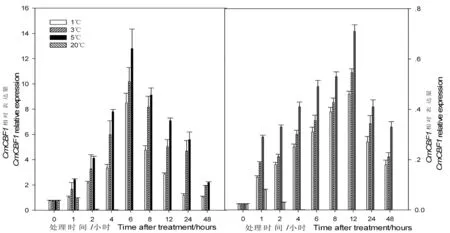
图6 不同贮藏温度胁迫下哈密瓜果实转录因子CmCBF1短时相对表达量变化

图7 不同贮藏温度下哈密瓜果实转录因子CmCBF1长时相对表达量变化
3 讨 论
CBF在植物中多以基因家族形式存在,不同物种家族成员的转录激活区差异很大,但它们都含有一个由60个左右氨基酸残基组成的DNA结合区(即AP2/EREBP结合域),在不同的植物中非常保守[20]。研究根据已公布的甜瓜基因组的网站https://melonomics.net,通过其它植物已知的CBF1,预测甜瓜CBF1序列(XM_008440940)设计引物,克隆得到了哈密瓜CmCBF1(GenBank登录号:KT737742),编码212个氨基酸。序列比对后,发现CmCBF1包含有一个高度保守的AP2/EREBP DNA结合结构域,表明其具有CBF所有的序列特征,即具有一个非常保守的AP2/EREB P结合域,由约58个氨基酸残基组成。在CmCBF1蛋白中,第14位的撷氨酸和第19位的谷氨酸的保守存在可能决定其蛋白对顺式作用元件ACCGAC和GCCGAC(CRT元件的核心序列)具有相同的结合活性[21]。
序列分析结果表明,CmCBF1结构域的上下游均含有保守序列KK/RPAGRxKFxETRHP和DSAWR,这在草莓FaCmCBF1(ABV65907.2)、麻风树JcCmCBF1(XP_012090326.1)、番茄LeCmCBF1(AAK57551.1)、苹果MdCmCBF1(AAZ20446.1)、白桦BpCmCBF1(ADZ23479.1)、黄瓜CsCBF1(ABG38530.1)、拟南芥AtCBF1(ABV27083.1)及大麦HvCmCBF1(AF418204_1)等其他物种的CBF1蛋白上均含有这两段多肽序列(图3),系统进化树分析结果显示,哈密瓜CmCBF1和草莓FaCBF1同源性较高,推测其进化过程中在功能上较为相似。
研究发现,新密3号果实在1、3及5℃低温贮藏条件下均有冷害发生,表明其对低温较为敏感,这与陈娟等[22]研究结果一致。为了研究哈密瓜果实对不同温度诱导过程中的响应机制,开展不同温度处理对CmCBF1的表达模式的研究。结果发现,新密3号果皮及果肉组织中的CmCBF1在常温(20℃)几乎不表达,而在1、3和5℃低温胁迫条件下被诱导表达,分别在6和12 h达到高峰,表明哈密瓜果实转录因子CmCBF1可被低温短时诱导,这一结果与拟南芥[5]、番茄[12]及桃子[13]等植物上的报道一致。
随着低温贮藏时间的延长,新密3号果皮及果肉组织中CmCBF1相对表达量呈现出先上升后降低的趋势,分别在贮藏14和21 d时达到峰值,之后逐渐下降,至贮藏末期,CmCBF1几乎不表达,表明CmCBF1对低温的响应有一定的时间期限,这与桃子[13]和猕猴桃[14]等果实上的报道较为相似。无论是短时低温诱导还是长时低温诱导,冷害指数较低的5℃贮藏条件下CmCBF1的相对表达量显著高于冷害指数较高的1和3℃,可以看出,CmCBF1相对表达量高的新密3号果实,冷害发生率低。由此推测,转录因子CmCBF1与哈密瓜果实采后冷害发生具有一定的相关性。为了进一步证实这一观点,对新密3号不同贮藏温度下果皮及果肉中CmCBF1的相对表达量与果实冷害指数进行了相关性分析,结果发现,果皮中CmCBF1相对表达量与哈密瓜冷害指数呈负相关关系(r=-0.633)。这一结果亦在番茄[12]、桃子[13]、猕猴桃[14]及芒果[15]等果实上被证实。此外,试验研究发现,果皮中CmCBF1的表达比果肉早6 h,且显著高于果肉(P﹤0.05),这可能由于哈密瓜果皮及果肉组织的结构差异导致其对温度感应不同所致[23]。
4 结 论
克隆获得哈密瓜果实转录因子CBF1,命名为CmCBF1,该基因序列为639 bp(GenBank登录号为KT737742),编码212个氨基酸;同源性分析结果表明,哈密瓜果实转录因子CmCBF1与草莓FaCBF1亲缘关系较近,达到85%。qRT-PCR分析结果显示,哈密瓜果实转录因子CmCBF1受低温诱导特异性表达,CmCBF1相对表达量与哈密瓜果实采后冷害发生负相关(r=-0.663),为进一步研究哈密瓜果实低温贮藏过程中的冷害发生机制提供理论依据。
References)
[1] 王坚.中国西瓜甜瓜[M].北京:中国农业出版社,2000.
WANG Jian. (2000).ChineseWatermelon[M]. Beijing: China Agriculture Press. (in Chinese)
[2] 刘同业,张婷,车凤斌,等.不同贮藏温度下西周密25号哈密瓜果实冷害生理的研究[J].新疆农业科学,2015,52(1):26-32.
LIU Tong-ye, ZHANG Ting, CHE Feng-bin, et al. (2015). Studies on Chilling Injury Physiology of 'Xizhoumi No.25' Hami Melon Fruits at Different Storage Temperature [J].XinjiangAgriculturalSciences, 52(1):26-32. (in Chinese)
[3] 李科友,朱海兰.植物非生物逆境胁迫DREB/CBF转录因子的研究进展[J].林业科学,2011,(47):124-134.
LI Ke-you ZHU Hai-la. (2011).Research progress Of DREB/CBF transcription factor in Response to abiotic-stresses in plants [J].ScientiaSilvaeSinicae, (47):124-134. (in Chinese)
[4] 吕胜男,申吉萍,赵丹莹,等. CBF基因调控植物抗冷径途的研究进展[J]. 西北植物学报, 2011, 31( 6) : 1 275-1 281.
LÜ Sheng-nan, SHEN Ji-ping, ZHAO Dan- ying, et al. (2011). Advances of plant cold-resistance pathway regulated by CBF gene [J].ActaBotanicaBoreali-OccidentaliaSinica, 31(6): 1,275-1,281. (in Chinese)
[5] Chiang, D. A., Keh, H. C., Huang, H. H., & Chyr, D. (2002). Transcription factor cbf4 is a regulator of drought adaptation in arabidopsis.PlantPhysiology, 130(2):639-648.
[6] Gilmour, S. J., Fowler, S. G., & Thomashow, M. F. (2004). Arabidopsis transcriptional activators cbf1, cbf2, and cbf3 have matching functional activities.PlantMolecularBiology, 54(5):767-781.
[7] 李丹,蒋欣梅,于锡宏.黄瓜中CBF1基因的克隆及其表达分析[J].植物生理学通讯,2010,46(3):245-248.
LI Dan, JIANG Xin-Mei, YU Xi-Hong. (2010).Cloning and Expression Analysis of CBF1 from Cucumber (Cucumis sativus L.) [J].PlantPhysiologyCommunications, 46(3): 245-248. (in Chinese)
[8] Zhang, X., Fowler, S. G., Cheng, H., Lou, Y., Rhee, S. Y., & Stockinger, E. J., et al. (2004). Freezing‐sensitive tomato has a functional cbf cold response pathway, but a cbf regulon that differs from that of freezing‐tolerant arabidopsis.PlantJournalforCell&MolecularBiology, 39(6):905-919.
[9] Kitashiba, H., Matsuda, N., Ishizaka, T., Nakano, H., & Suzuki, T. (2002). Isolation of genes similar to dreb1/cbf from sweet cherry (prunusaviuml.).EngeiGakkaiZasshi, 71(5): 651-657.
[10] Fernandez-Caballero, C., Rosales, R., Romero, I., Escribano, M. I., Merodio, C., & Sanchez-Ballesta, M. T. (2012). Unraveling the roles of cbf1, cbf4 and dehydrin 1 genes in the response of table grapes to high co2levels and low temperature.JournalofPlantPhysiology, 169(7): 744-748.
[11] He, L. G., Wang, H. L., Liu, D. C., Zhao, Y. J., Xu, M., & Zhu, M., et al. (2012). Isolation and expression of a cold-responsive gene ptcbf, in poncirus trifoliata, and isolation of citrus cbf, promoters.BiologiaPlantarum, 56(3): 484-492.
[12] Zhang, X., Fowler, S. G., Cheng, H., Lou, Y., Rhee, S. Y., & Stockinger, E. J., et al. (2004). Freezing‐sensitive tomato has a functional cbf cold response pathway, but a cbf regulon that differs from that of freezing‐tolerant arabidopsis.PlantJournalforCell&MolecularBiology, 39(6):905-919.
[13] Liang, L., Zhang, B., Yin, X. R., Xu, C. J., Sun, C. D., & Chen, K. S. (2013). Differential expression of the cbf, gene family during postharvest cold storage and subsequent shelf-life of peach fruit.PlantMolecularBiologyReporter, 31(6):1,358-1,367.
[14] Ma, Q., Suo, J., Huber, D. J., Dong, X., Han, Y., & Zhang, Z., et al. (2014). Effect of hot water treatments on chilling injury and expression of a new c-repeat binding factor ( cbf ) in 'Hongyang' kiwifruit during low temperature storage.PostharvestBiology&Technology, 97:102-110.
[15] Zhang, Z., Zhu, Q., Hu, M., Gao, Z., An, F., & Li, M., et al. (2017). Low-temperature conditioning induces chilling tolerance in stored mango fruit.FoodChemistry, 219: 76-84.
[16] Yang, B., Shiping, T., Hongxia, L., Jie, Z., Jiankang, C., & Yongcai, L., et al. (2003). Effect of temperature on chilling injury, decay and quality of hami melon during storage.PostharvestBiology&Technology, 29(2): 229-232.
[17] Chang, S., Puryear, J., & Cairney, J. (1993). A simple and efficient method for isolating rna from pine trees.PlantMolecularBiologyReporter, 11(2): 113-116.
[18] Livak, K.J., & Schmittgen, T. D. (2001). Analysis of relative gene expression data using real-time quantitativePCR and the 2(-Delta Delta C(T)) method.Methods, (25): 402-408.
[19] Sakuma, Y., Liu, Q., Dubouzet, J. G., Abe, H., Shinozaki, K., & Yamaguchishinozaki, K. (2002). Dna-binding specificity of the erf/ap2 domain of arabidopsis drebs, transcription factors involved in dehydration- and cold-inducible gene expression.Biochemical&BiophysicalResearchCommunications, 290(3): 998-1,009.
[20] Okamuro, J. K., Caster, B., Villarroel, R., Van, M. M., & Jofuku, K. D. (1997). The ap2 domain of apetala2 defines a large new family of dna binding proteins in arabidopsis.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 94(13): 7,076-7,081.
[21] Dubouzet, J. G., Sakuma, Y., Ito, Y., Kasuga, M., Dubouzet, E. G., & Miura, S., et al. (2003). Osdreb genes in rice, oryza sativa l. encode transcription activators that function in drought‐, high‐salt‐ and cold‐responsive gene expression.PlantJournalforCell&MolecularBiology,33(4):751-763.
[22] 陈娟,张婷,车凤斌,等. NO处理对哈密瓜果实采后冷害及渗透调节物质的影响[J].新疆农业科学,2015,52(12):2 238-2 244.
CHENG Juan, ZHANG Ting, CHE Feng-bin, et al. (2015). Effects of Nitric Oxide Fumigation Treatments on Chilling Injury and Osmotic Regulatory Metabolites Contents of Hami Melon Fruits during Cold Storage [J].XinjiangAgriculturalSciences, 52(12): 2,238-2,244. (in Chinese)
[23] 潘俨,车凤斌,吴斌,等. 2012. 预冷对哈密瓜采后乙烯释放和呼吸强度的影响[J]. 新疆农业科学, 49(8): 1 391-1 396.
PAN Yan, CHE Feng-bin, WU Bin, et al. (2012). Effect of Precooling on Ethylene Release and Respiration Rate of Hami Melon [J].XinjiangAgriculturalSciences, 49(8): 1,391-1,396. (in Chinese)
CloningandExpressionAnalysisofaCRT/DRE-bindingFactorGeneCmCBF1fromHamiMelonFruit
ZHANG Ting, PAN Yan, MENG Xin-tao, ZHENG Su-hui, XU Bin
(1.ResearchInstituteofAgriculturalProductsStorageandProcessing,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China)
ObjectiveIn order to make clear the regulatory function ofCBFgene in the cold tolerance of Hami melon fruits, the transcription factor namedCmCBF1was cloned and expression analysis was carried out.Method'Xinmi No.3' Hami melon postharvest fruit was selected as materials. The primers used to amplify the full-length coding sequences were designed based on the predictedCBF1gene sequence (XM_008440940). These sequences were used as the templates in blast searches against the melon genome databases (https://melonomics.net), and the ATG and TAA codons of the coding regions were determined. Specific primers were designed based on the conserved regions ofCBF1, The resulting cDNA was employed as a template for PCR reactions using gene-specific primers to amplify the coding regions ofCmCBF1, the expression ofCmCBF1was carried out in triplicate with different cDNA samples synthesized from tissue collected at each sampling time with PCR amplification.ResultTheCmCBF1gene from the cDNA contained an open reading frame of 639 bp, its GenBank accession number was KT737742, which encoded a polypeptide of 212 amino acids residues with a molecular mass of 23.89 kD and a pI of 5.23. The sequence homology comparison showed that theCmCBF1had a relatively close evolutionary relationship with Fragariaananassa,FaCmCBF1, which shared 85 %. RT-PCR analysis showed that the expression ofCmCBF1was induced by low temperature, including 1℃、3℃ and 5℃, but not expressed at room temperature at 20℃.ConclusionThere is a negative correlation between the relative expression of transcription factorCmCBF1and the incidence of chilling injury of Hami melon fruit, which provides the theoretical basis for studying the mechanism of the incidence of chilling injury of Hami melon fruit during the storage at low temperature.
Hami melon fruit;CmCBF1; gene cloning; gene expression
ZHANG Ting (1980-), female, native place: Meixian, Shanxi. Associate professor, research field: Postharvest physiology and molecular biology of fruit. (E-mail)zhangtingkikie@163.com
S652
A
1001-4330(2017)10-1765-10
10.6048/j.issn.1001-4330.2017.10.001
2017-08-14
新疆维吾尔自治区自然科学基金项目“哈密瓜抗冷途径中CBF转录因子基因的克隆与表达”(2014211B026)
张婷(1980-),女,陕西眉县人,副研究员,博士,研究方向为果品采后生理及分子生物学,(E-mail)zhangtingkikie@163.com
Supported by: The Natural Science Foundation of Xinjiang, China "Cloning and expression analysis of a CRT/DRE-binding factor gene CBF from Hami melon fruit during cold resistance pathway" (2014211B026)
