湖北地区克氏原螯虾白斑综合征病毒变异区ORF14/15、ORF23/24基因序列比较分析
2017-10-18刘文枝范玉顶曾令兵
杨 星,刘文枝,马 杰,周 勇,范玉顶,曾令兵
(1.华中农业大学水产学院,武汉430070;2.中国水产科学研究院长江水产研究所,武汉430223)
湖北地区克氏原螯虾白斑综合征病毒变异区ORF14/15、ORF23/24基因序列比较分析
杨 星1,2,刘文枝2,马 杰2,周 勇2,范玉顶2,曾令兵1,2
(1.华中农业大学水产学院,武汉430070;2.中国水产科学研究院长江水产研究所,武汉430223)
试验扩增、克隆了在湖北地区采集的19份克氏原螯虾(Procambarusclarkii)白斑综合征病毒(White spot syndrome virus,WSSV)阳性样品的变异区ORF14/15和ORF23/24基因,通过测序比较分析了湖北各WSSV毒株与GenBank公布的标准毒株间在变异区ORF14/15及ORF23/24基因的差异性。结果显示,19份WSSV阳性样品中有部分样品在变异区扩增出ORF14/15、ORF23/24基因片段,变异区基因序列分析发现,与GenBank已公布的标准毒株相比,存在大片段缺失。在变异区ORF14/15,有3个毒株扩增出1 442 bp的片段,4个毒株扩增出630 bp的片段,基于变异区ORF14/15构建的系统进化树显示,这些毒株归属两个不同的分支。在变异区ORF23/24,有2个毒株扩增出大小为2 096 bp的片段,进化分析发现这2个毒株在变异区ORF23/24的遗传距离较近。
克氏原螯虾(Procambarusclarkii);白斑综合征病毒;ORF14/15;ORF23/24;序列分析
Abstract:White spot syndrome virus (WSSV)gene variable regions,ORF14/15 and ORF23/24,have been employed as marks in a number of molecular epidemiology,prevalence and evolution studies of WSSV.In this study,19 WSSV positive samples collected from farmedProcambarusclarkiiin Hubei were cloned and sequenced for the WSSV Gene variable regions ORF14/15 and ORF23/24 then compared with the sequence of standard WSSV strain posted in GenBank.The results showed that these 19 positive samples were amplified by PCR with specific primers of ORF14/15 and ORF23/24,respectively,and in some of the positive samples the targeted products were generated in gene variable regions ORF14/15 and ORF23/24.After sequencing and multiple alignment analysis,the results showed that there were large segment deletions in the two gene variable regions.In ORF14/15,a product of 1 442 bp in length was amplified in 3 WSSV strains,while a product of 630 bp in length were amplified in another 4 WSSV strains.These WSSV strains were clustered in two different clusters based on ORF14/15 gene phylogenetic tree analysis.In ORF23/24,a product of 2 096 bp in length was amplified in two WSSV strains,the phylogenetic tree analysis showed that these two WSSV strains have a close genetic relationship.
Keywords:Procambarusclarkii;WSSV;ORF14/15;ORF23/24;sequence analysis
克氏原螯虾(Procambarusclarkii)俗称小龙虾,其分类地位属于节肢动物门甲壳纲十足目螯虾科原螯虾属[1]。克氏原螯虾是我国重要的淡水特色养殖品种,但随着克氏原螯虾养殖业的快速发展,其病害问题已十分突出。白斑综合征病毒(White spot syndrome virus,WSSV)感染养殖克氏原螯虾引起的白斑综合征,给克氏原鳌虾养殖产业造成了严重的经济损失。WSSV为双链DNA病毒,隶属于线头病毒科(Nimaviridae)白斑病毒属(Whispovirus)[2-5]。WSSV的主要宿主为虾、蟹等多种甲壳动物,广泛的宿主是造成WSSV迅速传播的重要原因[6]。
WSSV首先在中国台湾养殖的对虾中发现,并迅速传播至整个东南亚地区;1995年美国发现WSSV,随后中、南美洲也陆续暴发对虾白斑综合征;2002年,欧洲地区检测到WSSV[6]。到目前为止,GenBank上公布了4个WSSV分离株的全基因组序列,分别是台湾株(TW,AF440570)、中国大陆株(CN,AF332093)、泰国株(TH,AF369029)以及韩国株(Korea,JX515788)。4株WSSV全基因组序列长度差异在15kb之间,预示WSSV的基因序列中存在变异[7]。WSSV的基因组大小约300kb,编码184个开放阅读框,其中ORF14/15、ORF23/24为两个主要的变异区[8]。Pradeep等[9]将ORF14/15、ORF23/24这两个变异区列为WSSV分子流行病学、遗传进化追溯的首选对象。Marks等[6]通过对来源于泰国、中国大陆以及中国台湾地区的三株WSSV基因组全序列比对分析,发现这3株病毒差异性主要体现在以下5个方面:(1)大片段序列缺失区ORF23/24;(2)易于发生基因重组的变异区ORF14/15;(3)转座酶基因序列存在与否;(4)同源重复区内重复单元数目不等;(5)单核苷酸的缺失、插入及多态性。
本研究对本实验室保存的湖北地区的19份阳性克氏原螯虾样品进行WSSV检测,克隆了WSSV变异区 ORF14/15、ORF23/24基因,通过序列测定与比较,分析了湖北地区克氏原螯虾WSSV主要变异区基因的结构差异,旨在为查明WSSV各毒株间的差异性与分子流行病学特征提供资料数据。
1 材料与方法
1.1 样品采集
样品为本实验室保存的自湖北省克氏原螯虾主养地区采集的19份阳性样品。表1中是各样品的来源信息。
1.2 主要试剂和仪器
病毒DNA提取试剂盒购自美国OMEGA公司;琼脂糖凝胶回收试剂盒购自美国Promega公司;DNA聚合酶rTaq、克隆载体PMD19-T、感受态细胞DH5α、分子标准DL1000和DL2000均购自宝生物工程(大连)有限公司;LB肉汤购自上海博微生物科技有限公司;氨苄青霉素(Amp)购自德国Sigma公司。PCR仪为德国Biometra公司产品;凝胶成像系统和电泳仪均为美国Bio-Rad公司产品。
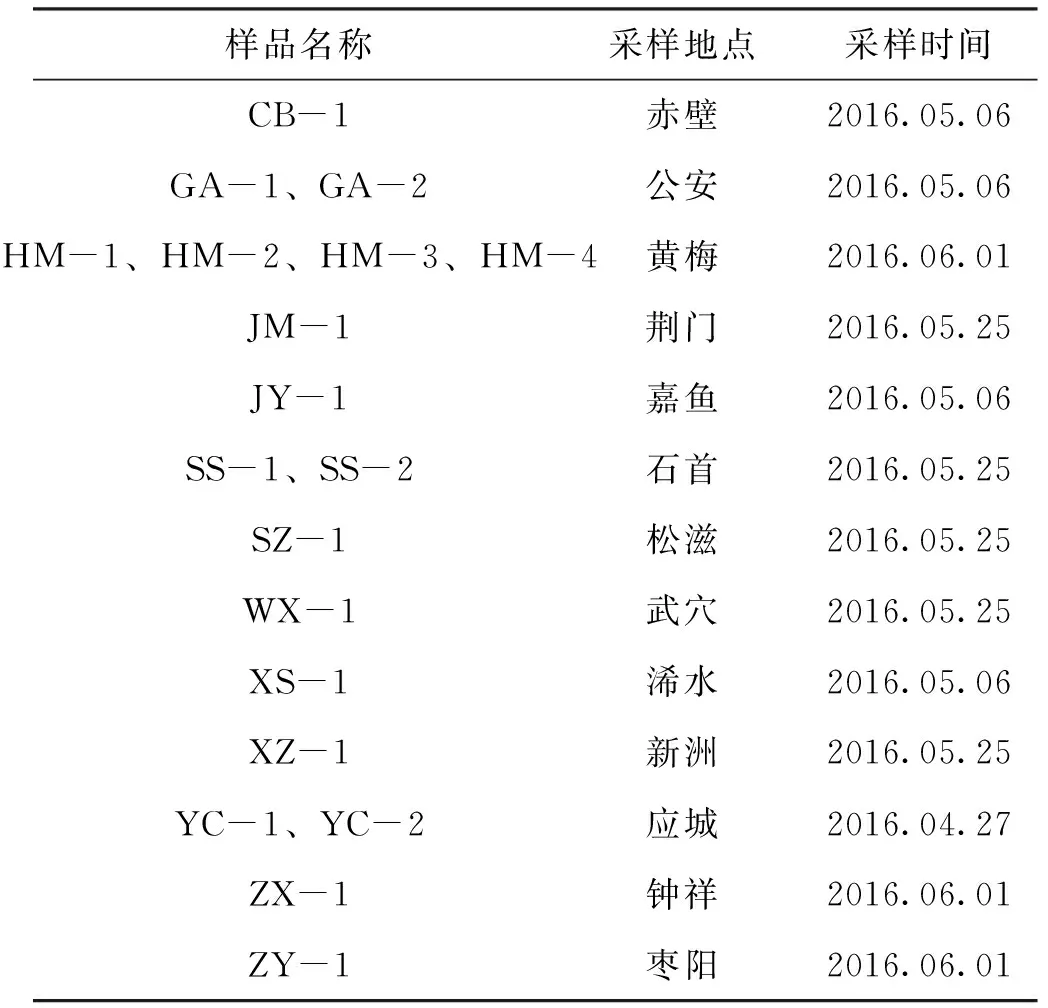
表1 湖北WSSV各毒株来源信息Tab.1 Information of the WSSV strains collected in Hubei
1.3 引物设计
WSSV检测所需的引物参照国家标准(GB/T28630.2);变异区基因扩增所需引物参照的文献[4,7],引物序列由武汉天一辉远生物科技有限公司合成,引物信息如表2所示。
1.4 WSSV巢式PCR检测
取克氏原螯虾鳃和肝胰腺组织匀浆,按照病毒DNA提取试剂盒说明书提取DNA并于-20 ℃保存。参照国家标准GB/T28630.2套式PCR法进行WSSV检测。25 μL反应体系:10×PCR缓冲液(无Mg2+) 2.5 μL,氯化镁溶液(25 mmol/L) 1.5 μL,dNTP (10 mmol/L) 0.5 μL,引物F1 (10 μmol/L)和R1 (10 μmol/L)各2.5 μL,Taq DNA聚合酶(5 U/ μL) 0.1 μL,模板1 μL,补充灭菌双蒸水至25 μL;PCR反应程序:94 ℃预变性4min、55 ℃退火1 min、72 ℃延伸2 min、1个循环;94 ℃变性1 min、55 ℃退火1 min、72 ℃延伸2 min,39个循环;72 ℃延伸5 min;4 ℃保温。取2.5 μL上述PCR产物,用引物F2 (10 μmol/L)和R2 (10 μmol/L)按上述反应体系和反应条件进行第二轮PCR扩增。
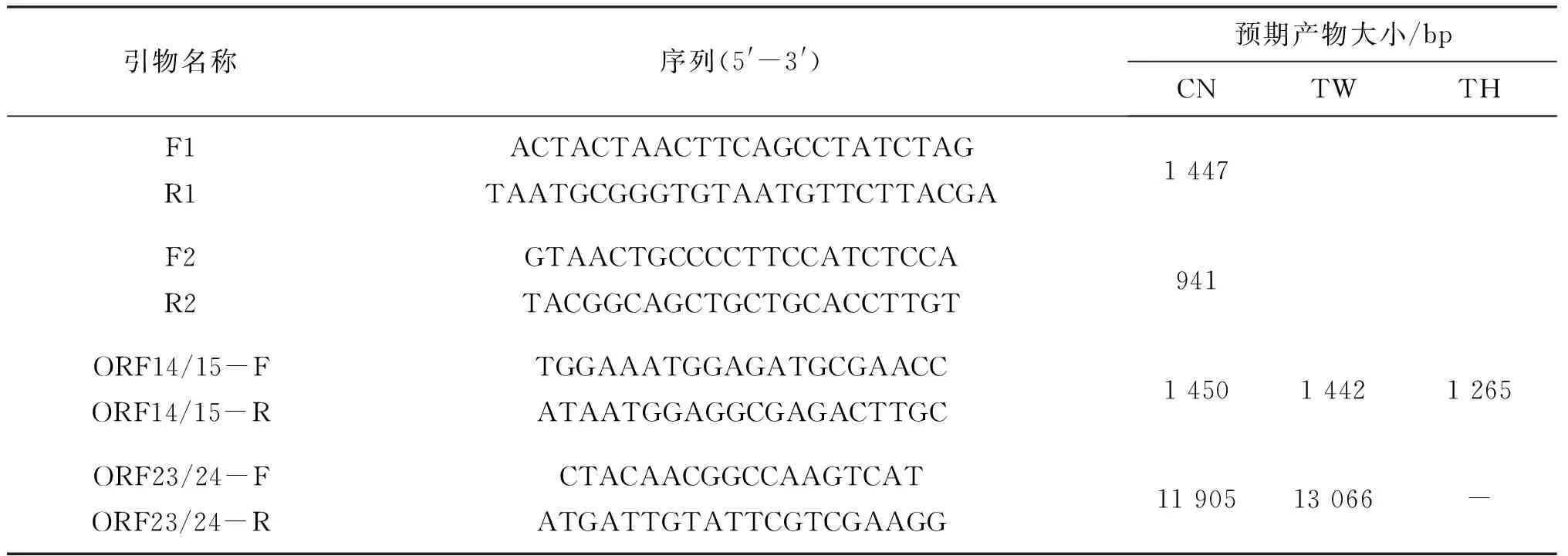
表2 WSSV检测和基因变异区扩增的引物信息Tab.2 Primers for the WSSV detection and the amplification of WSSV gene variable regions
1.5 WSSV变异区ORF14/15和ORF23/24基因扩增
将WSSV巢式PCR检测为阳性的样品,用于WSSV ORF14/15和ORF23/24的扩增,25 μL PCR反应体系:10×PCR缓冲液(含Mg2+) 2.5 μL,dNTP (10 mmol/L) 2 μL,引物ORF14/15 (ORF23/24)-F (10 μmol/L)和ORF14/15 (ORF23/24)-R (10 μmol/L)各0.5 μL,Taq DNA聚合酶(5 U/ μL) 0.25 μL,模板1 μL,补充灭菌双蒸水至25 μL。ORF14/15的扩增程序为:94 ℃预变性5 min;94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸90 s,5个循环;94 ℃变性30 s、53 ℃退火30 s、72 ℃延伸90 s,25个循环;72 ℃延伸10 min;4 ℃保温。ORF23/24的扩增程序为:94 ℃预变性5 min;94 ℃变性30 s、52 ℃退火1 min、72 ℃延伸3 min,35个循环;72 ℃延伸10 min;4 ℃保温。
1.6 WSSV变异区ORF14/15和ORF23/24基因的克隆及序列分析
将1.5中阳性PCR产物经琼脂糖凝胶回收纯化获得目的片段,连接pMD19-T载体,转化DH5α感受态细胞,并在含有IPTG、X-gal、Amp的LB平板培养基上培养,形成单菌落。挑取白色菌落接种于含有Amp的LB液体培养基中,37 ℃振荡过夜,取上述培养的菌液按照1.5所述PCR方法检测片段是否插入。PCR检测为阳性的菌液送至武汉天一辉远生物科技有限公司进行测序。用DNAstar软件对测序结果进行序列比对分析,分别以TH-96-Ⅱ株(AY753327)和TW株(AF440570)基因序列作为参照,比较分析克氏原螯虾WSSV 基因变异位置及大小,同时与GenBank公布的WSSV-TH、WSSV-CN、WSSV-Korea、WSSV-IN-05-I(印度株,EU327501)等毒株的ORF14/15和ORF23/24基因序列进行同源性分析,用MEGA5.1软件Neighbor Joining法构建其系统发育进化树。
2 结果与分析
2.1 WSSV巢式PCR检测结果
图1为克氏原螯虾样本巢式PCR第一轮检测电泳图;图2为克氏原螯虾样本巢式PCR第二轮检测电泳图。19份样品均检测为阳性。
2.2 WSSV 变异区ORF14/15基因扩增与序列分析
19份WSSV阳性样品中,有7份样品在ORF14/15区域扩增出目的片段,结果如图3所示。测序结果显示,在ORF14/15区域,GA-1、HM-2、HM-3扩增片段长度为1 442 bp,而GA-2、XZ-1、SZ-1、JM-1扩增片段长度为630 bp。将这7株湖北WSSV毒株与序列较为完整的WSSV-TH-96-Ⅱ及已经公布的WSSV-TW、WSSV-CN、WSSV-TH、WSSV-Korea、WSSV-IN-05-I的序列进行比对分析,比对结果见图4。与WSSV-TH-96-Ⅱ相比较,GA-1、HM-2、HM-3三个毒株在ORF14/15区均缺失了5 138 bp,但与公布的WSSV-TW序列一致;而GA-2、XZ-1、SZ-1、JM-1四个毒株在ORF14/15区缺失5 950 bp,但与公布的WSSV-IN-05-I的序列相似性高,仅存在几个碱基的差别。

图1 克氏原螯虾样品WSSV第一轮PCR检测电泳图Fig.1 Electrophoresis of the first round PCR products for detection of WSSV among P.clarkiiM:DL2000分子标准;1-19:被检测样品;P:阳性对照;N:阴性对照。图2同。
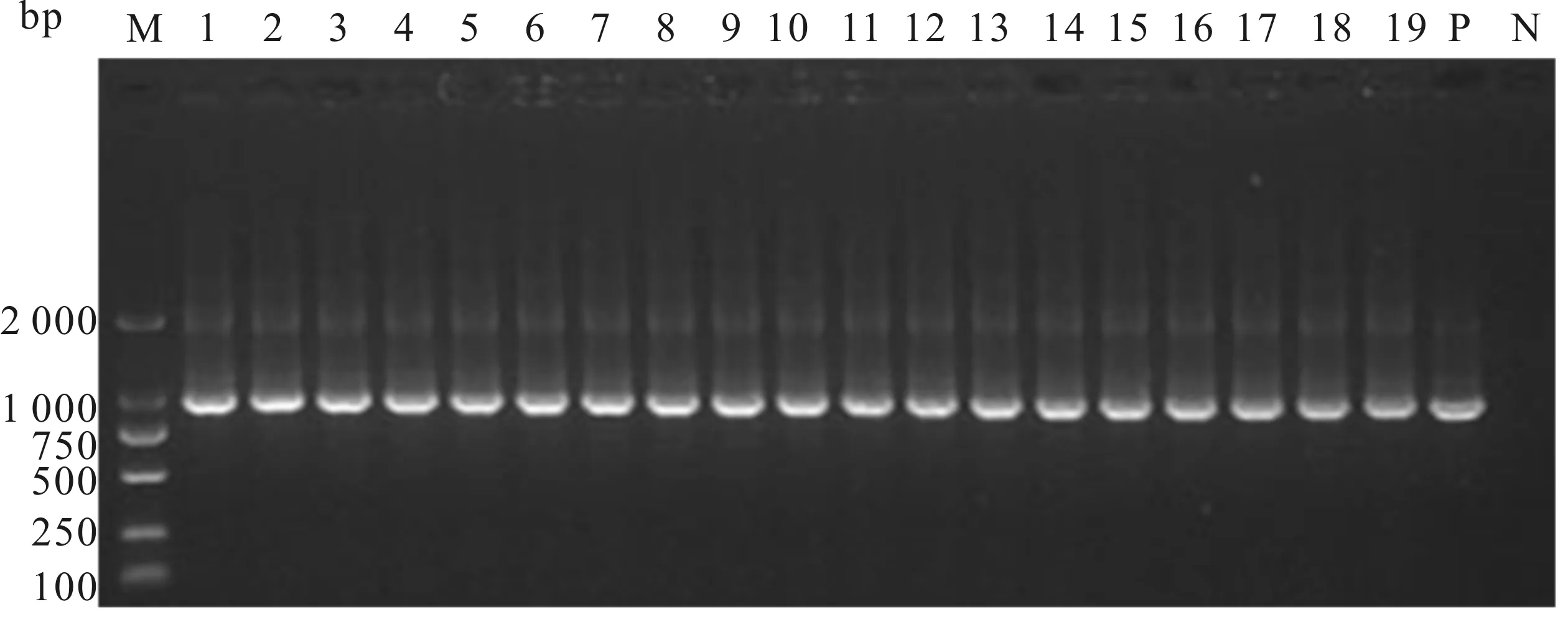
图2 克氏原螯虾样品WSSV第二轮PCR检测电泳图Fig.2 Electrophoresis of the second round PCR products for detection of WSSV among P.clarkii
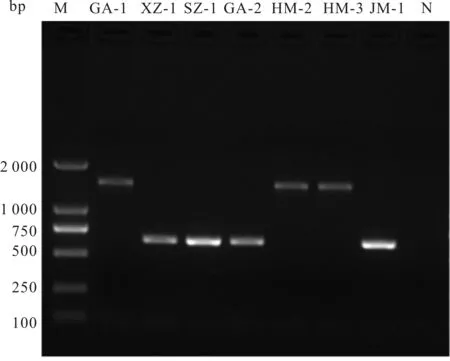
图3 WSSV ORF14/15基因变异区PCR扩增电泳图Fig.3 Electrophoresis of WSSV ORF14/15 gene variable regions amplified by PCRM:DL2000分子标准;N:阴性对照。图5同。
2.3 WSSV变异区ORF23/24基因扩增与序列分析
在ORF23/24区域,有2份样品中扩增出了相同大小的片段,结果见图5。扩增产物测序后与WSSV-TW、WSSV-CN、WSSV-TH进行比对分析,结果见图6。序列比较发现,GA-1、HM-4在ORF23/24区扩增出的片段大小一致,均为2 096 bp,与WSSV-TW相比中间均缺失了10 970 bp,与WSSV-CN相比中间缺失了9 802 bp。
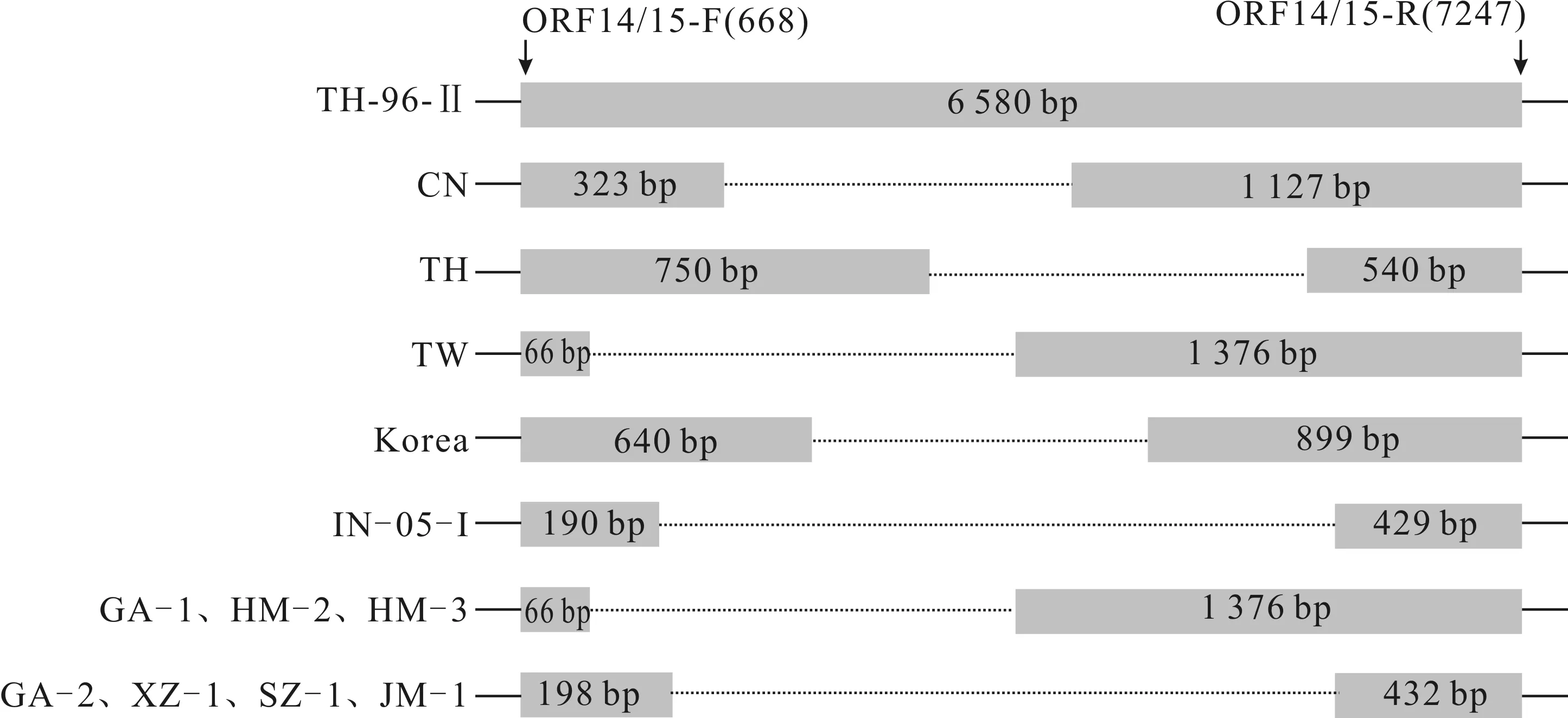
图4 WSSV不同毒株间ORF14/15基因变异区结构比对图Fig.4 Schematic representation of WSSV ORF14/15 gene variable regions among different strains 图中的矩形表示变异区两端的序列,矩形内的数字代表核苷酸的数目,引物后括号内的数字表示引物在TH-96-Ⅱ毒株上对应的位置,点状虚线表示与TH-96-Ⅱ相比缺失的部分,两侧的实线表示引物扩增区域之外的区域。
图5 WSSV ORF23/24基因变异区PCR扩增产物电泳图Fig.5 Electrophoresis of WSSV ORF23/24 gene variable region amplified by PCR
2.4 WSSV变异区进化树分析
遗传进化树分析发现,在ORF14/15区GA-1、HM-2、HM-3与WSSV-TH-96-Ⅱ、WSSV-CN、WSSV-TH、WSSV-TW、WSSV-Korea聚为一支,GA-2、XZ-1、SZ-1、JM-1与WSSV-IN-05-I同属一个大分支,在进化上呈现出一定的差异,基于WSSV变异区ORF14/15构建的系统发育进化树见图7。而WSSV湖北分离株在ORF23/24区的基因序列保持一致,且与WSSV-CN、WSSV-TH、WSSV-TW都属于一个分支(结果未展示),表明它们的遗传进化距离相近。
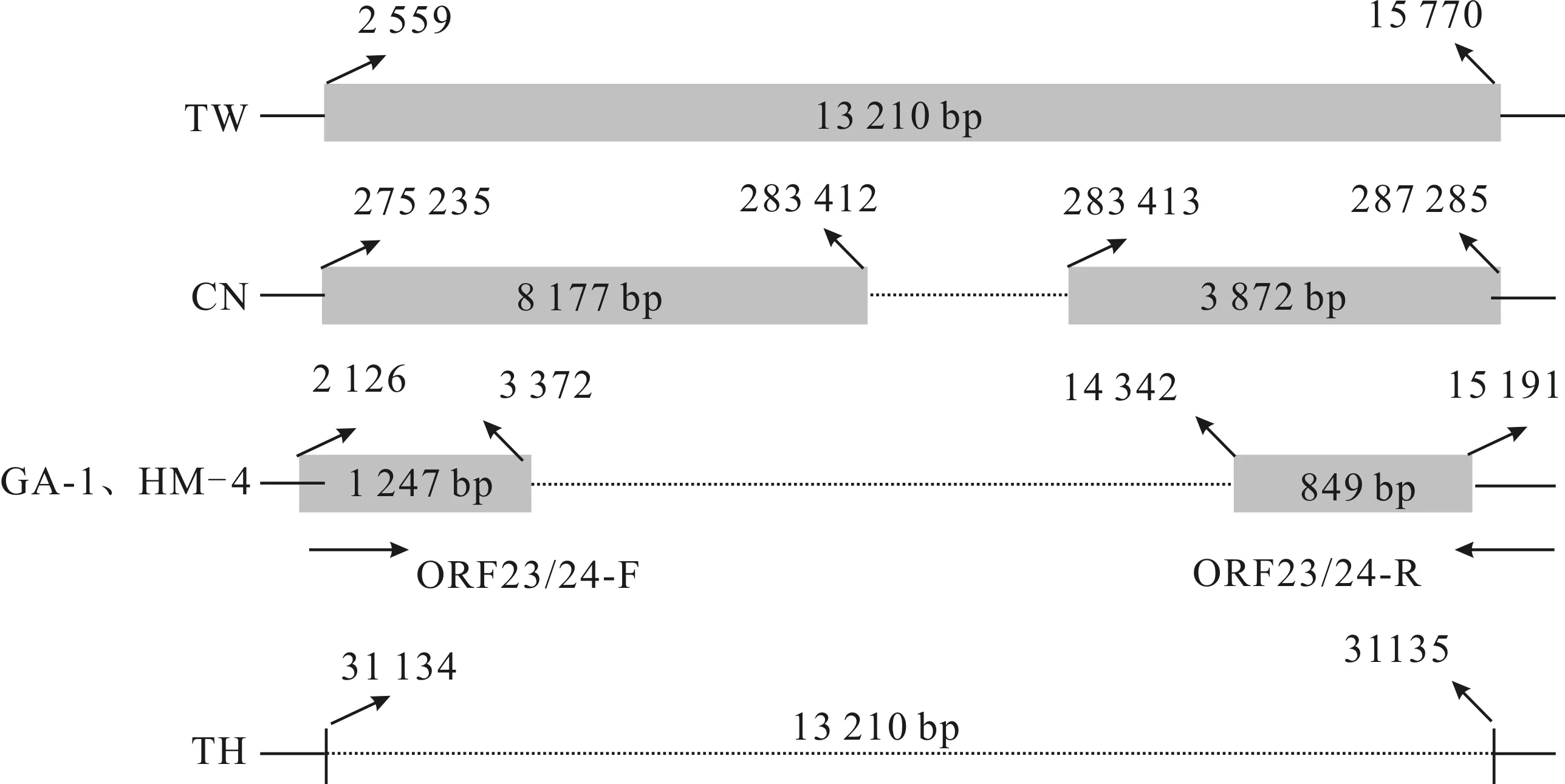
图6 WSSV不同毒株间ORF23/24基因变异区结构比对图Fig.6 Schematic representation of WSSV ORF23/24 gene variable region among different strains 图中矩形表示变异区两端的序列,矩形内的数字代表核苷酸的数目,TW、CN和TH毒株黑色箭头上方数字表示各自在NCBI数据库的对应位置,GA-1、HM-4 代表测序得到的2份湖北毒株,其黑色箭头上方的数字参考对应TW毒株,两侧的实线表示引物扩增区域之外的区域。

图7 WSSV ORF14/15基因变异区进化树分析
3 讨论
白斑综合征是目前危害养殖虾类最为严重的传染性疾病。在已报道的虾病毒中,白斑综合征病毒的毒性最强,且其地域及宿主分布广泛[10]。白斑综合征还可因养殖环境的温度、溶解氧、盐度等的变化以及多种病原因子与病毒共同作用而使病毒的毒力增强[11-13]。Wang等[14]通过比较虾的死亡率发现不同地区的WSSV各分离株的毒性存在一些差异,即各分离株间的差异可能影响WSSV的毒性。随着WSSV的全基因组测序研究的完成,对该病毒的研究进入基因功能的鉴定阶段[15]。遗传进化差异是分子流行病学的重要内容,在核苷酸序列上的差异必然会造成开放性阅读框和蛋白编码的改变。差异序列的存在,可能会使病毒自身更适应环境,更利于自身复制并建立感染。近年的研究发现,不同WSSV毒株间存在不同程度的变异[16-18]。因此,研究WSSV不同毒株之间的核苷酸序列差异,可为WSSV的分子流行病学研究提供重要的参考依据。
WSSV的变异位点常被用于研究WSSV的分子流行病学特征,有助于认识在虾养殖过程中WSSV迅速传播和演化等问题[19]。ORF14/15和ORF23/24是WSSV基因组上两个重要的变异区域,反映了WSSV各毒株间的遗传进化关系和分子流行病学特征[18]。本研究对19份湖北不同地区收集的WSSV阳性样品进行了 ORF14/15和ORF23/24基因PCR扩增,结果显示在ORF14/15区有7份样品能扩增出产物,且片段大小存在差异,而在ORF23/24区有2份阳性样品能扩增出相同大小的片段。19份阳性样品中仅有部分样品在变异区扩增出产物,造成这种现象的原因可能是这些毒株刚好缺失引物结合位点或者在这两个变异区缺失的片段大小大于这两个区域的最大长度[9]。
在ORF14/15区,已报道有4株亚洲毒株,即WSSV-TW,WSSV-CN,WSSV-TH,WSSV-Korea ORF14/15片段分别缺失5 138 bp、5 132 bp、5 316 bp和5 721 bp[20]。本研究中WSSV湖北株在ORF14/15区与薛晖等[4]检测到江苏株的缺失情况有所差异,江苏株扩增出了1 442 bp和384 bp,而本研究中GA-1、HM-2、HM-3片段大小为1 442 bp,与WSSV-TH-96-Ⅱ相比分别缺失了5 138 bp,这与WSSV-TW、江苏株的缺失情况一致,而 GA-2、XZ-1、SZ-1、JM-1为630 bp,与WSSV-TH-96-Ⅱ相比分别缺失了5 950 bp,Tang等[21]针对马达加斯加岛、莫桑比克和沙特阿拉伯地区毒株的实验中也发现序列缺失有5 950 bp,同样的缺失情况也出现在Hoa等[22]对印度和越南南部地区毒株的调查中。结合系统树进化分析,GA-1、HM-2、HM-3趋近于WSSV-TW,而GA-2、XZ-1、SZ-1、JM-1则与WSSV-IN-05-I聚为一支。这一研究结果表明,WSSV在湖北克氏原螯虾中的分布呈现一定的空间差异,这与Marks等[6,19]评估作为白斑综合征病毒空间传播特征分子标记的主要变异位点的研究结果相符。
在ORF23/24区,目前已知的WSSV-TH最大的缺失序列为13 120 bp,WSSV-Korea具有中等程度的缺失,为5 654 bp,而WSSV-CN缺失最小,仅1 169 bp[20]。而本研究中WSSV湖北株在ORF23/24区,GA-1、HM-4均扩增出大小为2 096 bp的片段,与WSSV-TW、WSSV-CN相比相比分别缺失了10 970 bp,9 802 bp,属于较大片段的缺失,且与童桂香等[7]测得的凡纳滨对虾WSSV广西株缺失片段的大小相同,推测二者的病毒来源可能相同。GA-1、HM-4在系统进化树中与WSSV-CN、WSSV-TH、WSSV-TW同属一个大分支,亲缘关系密切,未表现出明显的空间差异,这可能与虾的来源、环境等因素有关。而许多研究表明,WSSV在传播和进化过程中,ORF23/24区也呈现出时空差异,且WSSV的不同毒株的基因型的稳定性将影响病毒传播的方式和传播速度[6,19]。Dieu等[19]研究发现WSSV越南株在ORF23/24区,较小缺失的毒株出现在越南中部,较大缺失的毒株分布在南部和北部,存在明显的空间差异,且缺失片段的大小随时间推移逐步增大。Lan等[23]分析比较了两株WSSV中ORF23/24的差异性与WSSV的毒力的关系,发现在ORF23/24区缺失的片段越多的毒株,其致病性越强。由此推测,WSSV变异区不仅存在时空差异,变异区片段的缺失与病毒的毒性可能存在很大的关系。
WSSV变异区对于深入认识虾养殖过程中病毒传播和进化具有重要意义。在中国境内,不同地区的WSSV毒株就有很大的差别,如江苏株和广西株,在变异区ORF14/15、ORF23/24均存在较大的差异。目前对WSSV变异区的变异机制尚不能确定,环境选择压力可能是其原因之一[4]。WSSV湖北分离株变异区ORF14/15、ORF23/24的研究,有助于查明WSSV毒株世系间的变异差异,同时为探明WSSV变异区的分子流行病学特征提供了数据资料。
[1]兰江风,代云佳,林 蠡.养殖克氏原螯虾体内白斑综合征病毒的绝对定量分析[J].水产学报,2016,40(3):318-325.
[2]Mayo M A.A summary of taxonomic changes recently approved by ICTV [J]. Arch Virol,2002,147(8):1655-1663.
[3]康桦华,陆承平.对虾白斑综合征病毒中国地方株变异区基因的比较[J].病毒学报,2007,23(6):490-493.
[4]薛 晖,王晓丰,丁正峰,等.白斑综合征病毒江苏分离株变异区和缺失区基因的序列比较[J].中国水产科学,2011,18(5):1196-1201.
[5]于 力,李庆章.虾白斑综合征病毒的研究进展[J].中国预防兽医学报,2008,30(6):486-490.
[6]Marks H,Duijse J J A V,Zuidema D,et al.Fitness and virulence of an ancestral White Spot Syndrome Virus isolate from shrimp [J]. Virus Res,2005,110(1-2):9-20.
[7]童桂香,黎小正,韦信贤,等.白斑综合征病毒广西株缺失区基因的比较分析[J].上海海洋大学学报,2014,23(1):8-14.
[8]Van H M C W,Witteveldt J,Peters S,et al.The white spot syndrome virus DNA genome sequence [J]. Virology,2001,286(1):7-22.
[9]Pradeep B,Shekar M,Karunasagar I,et al.Characterization of variable genomic regions of Indian white spot syndrome virus [J]. Virology,2008,376(1):24-30.
[10]盖春蕾,许 拉,叶海斌,等.中国对虾和日本对虾对白斑综合征病毒(WSSV)敏感性的比较[J].水产科技情报,2013,(4):207-209.
[11]Hauton C,Hawkins L E,Hutchinson S.The effects of salinity on the interaction between a pathogen (Listonellaanguillarum) and components of a host (Ostreaedulis) immune system [J]. Comp Biochem Physiol Part B Biochem Mol Biol,2000,127(2):203-212.
[12]沈 辉,万夕和,王李宝,等.白斑综合征病毒对脊尾白虾的致病性研究[J].海洋科学,2013,37(5):55-60.
[13]Lee K K,Yang T I,Liu P C,et al.Dual challenges of infectious pancreatic necrosis virus and Vibrio carchariae,in the grouper,Epinephelus,sp [J]. Virus Res,1999,63(1-2):131-134.
[14]Wang Q,Nunan L M,Lightner D V.Identification of genomic variations among geographic isolates of white spot syndrome virus using restriction analysis and Southern blot hybridization [J]. Dis Aquat Org,2000,43(3):175-181.
[15]朱艳冰,吴成林,杨 丰.白斑综合征病毒膜蛋白VP124参与病毒的感染[J].集美大学学报(自然版),2007,12(3):193-197.
[16]孙新颖,万晓嫒,刘庆慧,等.白斑综合征病毒2014年中国毒株变异区的序列比较[J].渔业科学进展,2016,37(2):127-133.
[17]于洪涛.中国境内白斑综合征病毒(WSSV)分离株的序列差异分析[D].山东青岛:中国海洋大学,2008.
[18]童桂香,黎小正,韦信贤,等.凡纳滨对虾白斑综合征病毒广西株变异区基因的比较分析[J].病毒学报,2014,(1):51-56.
[19]Dieu B T,Marks H,Zwart M P,et al.Evaluation of white spot syndrome virus variable DNA loci as molecular markers of virus spread at intermediate spatiotemporal scales [J]. J Gen Virol,2010,91(5):1164-1172.
[20]孙新颖,刘庆慧,万晓媛,等.2014年中国不同地区对虾白斑综合征病毒ORF14/15和ORF23/24缺失区序列比较[J].渔业科学进展,2016,37(4):140-146.
[21]Tang K F,Le G M,Lightner D V.Novel,closely related,white spot syndrome virus (WSSV) genotypes from Madagascar,Mozambique and the Kingdom of Saudi Arabia [J]. Dis Aquat Org,2013,106(1):1-6.
[22]Hoa T T,Zwart M P,Phuong N T,et al.Indel-Ⅱ region deletion sizes in the white spot syndrome virus genome correlate with shrimp disease outbreaks in southern Vietnam [J]. Dis Aquat Org,2012,99(2):153-162.
[23]Lan Y,Wei L,Xun X.Genomic instability of prawn white spot bacilliform virus (WSBV) and its association to virus virulence [J]. Virus Res,2002,90(1-2):269-274.
SequencecomparisonofWSSVORF14/15andORF23/24genevariableregionsderivedfromProcambarusclarkiiinHubei
YANG Xing1,2,LIU Wen-zhi2,MA Jie2,ZHOU Yong2,FAN Yu-ding2,ZENG Ling-bing1,2
(1.CollegeofFisheries,HuazhongAgriculturalUniversity,Wuhan430070,China;2.YangtzeRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Wuhan430223,China)
2017-04-10;
2017-07-14
湖北省科技支撑计划项目(2015BBA234);农业部淡水渔业健康养殖重点实验开放课题(2016ZJK04)
杨 星(1993- ),女,硕士研究生,专业方向为鱼类病害。E-mail:yangxingxiao0220@163.com
曾令兵。E-mail:zlb@yfi.ac.cn
S945.4
A
1000-6907-(2017)05-0064-08
