不同黄颡鱼家系组注射嗜水气单胞菌后免疫相关指标的比较研究
2017-10-18王明华陈校辉蒋广震张世勇钟立强潘建林刘文斌
秦 钦,王明华,陈校辉,蒋广震, 张世勇,钟立强,潘建林,刘文斌
(1.江苏省淡水水产研究所,南京 210017;2.南京农业大学无锡渔业学院,江苏无锡 214081;3.南京农业大学动物科技学院,江苏省水产动物营养重点实验室,南京 210095)
不同黄颡鱼家系组注射嗜水气单胞菌后免疫相关指标的比较研究
秦 钦1,2,王明华1,陈校辉1,蒋广震3, 张世勇1,钟立强1,潘建林1,刘文斌3
(1.江苏省淡水水产研究所,南京 210017;2.南京农业大学无锡渔业学院,江苏无锡 214081;3.南京农业大学动物科技学院,江苏省水产动物营养重点实验室,南京 210095)
为了探究不同黄颡鱼(Pelteobagrusfulvidraco)家系组的免疫性能,选取Ⅰ(G♂×G♀)、Ⅱ(S♂×S♀)、Ⅲ(T♂×T♀),Ⅳ(G♂×S♀)和V(S♂×T♀)5个家系组130日龄的鱼种300尾/家系,试验鱼体重为(8.5±1.0)g,开展注射嗜水气单胞菌攻毒试验。在攻毒0 h及攻毒后6、24、48 h采样。测定累积死亡率(CM)及血浆、肝脏免疫相关指标,包括血浆总蛋白(TP)、乳酸(LA)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(AKP);肝脏超氧化物歧化酶(SOD)、丙二醛(MDA)。结果显示:各家系组间黄颡鱼种感染嗜水气单胞菌后,除血浆AKP之外的指标都表现出组间显著差异。攻毒48 h后,CM由高到低顺序为Ⅱ> V> Ⅲ> Ⅳ> I。攻毒24 h后血浆TP达到高峰然后逐步下降。在攻毒48 h后,家系组Ⅰ、Ⅳ保持了较高TP含量,与其他试验组差异显著。各家系组血浆LA指标呈先升高后降低的变化趋势,48 h家系组Ⅰ、Ⅳ的血浆LA显著低于其他家系组。攻毒后各家系组血浆转氨酶含量急剧上升,家系组Ⅰ、Ⅱ血浆ALT在24 h首先恢复到攻毒前水平。攻毒24 h后,肝脏中SOD水平达到顶峰,48 h家系组V肝脏中SOD水平最高,显著高于其他家系组。肝脏MDA水平呈逐渐升高的变化趋势,攻毒后6 h,家系组Ⅰ肝脏的MDA水平显著低于其他组,48 h家系组Ⅲ肝脏的MDA显著高于家系组Ⅰ、Ⅱ、Ⅳ。结果表明:各家系组表现出明显的免疫差别。家系组I(G♂×G♀)表现出较强的抗应激、非特异性免疫、肝脏抗氧化能力,在抗嗜水气单胞菌方面表现出抗病优势。
黄颡鱼(Pelteobagrusfulvidraco);家系;嗜水气单胞菌;注射;免疫指标
Abstract:In order to explored the immunity performance of different family groups,fivePelteobagrusfulvidracofamily groups:I(G♂×G♀),Ⅱ(S♂×S♀),Ⅲ(T♂×T♀),Ⅳ(G♂×S♀)and V(S♂×T♀)were selected as research items.300 juveniles per family group of 130 days were injectedAeromonashydrophila.At 0 h,6 h,24 h and 48 h points after injection,juveniles were observation and sampled for determined the Cumulative mortality rate(CM)and the biochemical parameters of serum and liver,containing Total protein(TP),lactic acid(LA),alanine aminotransferase(ALT),aspartate aminotransferase(AST),alkaline phosphatase(AKP)of serum and superoxide dismutase(SOD),malondialdehyde(MDA)of liver.The results showed that,all biochemical parameters except AKP were significantly different among the five groups after injection.At 48 h-point after injection,CM in the order from high to low is group Ⅱ>V>Ⅲ>Ⅳ>I.The serum TP level peaked at 24 h-point after injection,and then gradually decreased.At 48 h-point,TP levels of family group I and Ⅳ were significantly higher than the others.After injection,the serum LA index of each group showed a trend of increasing first and then decreasing.At 48 h-point,the serum LA of group Ⅳ and I were significantly lower than others.The serum transaminase levels increased sharply after injection.At 24 h-point,the ALT level of group I and Ⅱ recovered to 0 h level.The liver SOD level peaked at 24 h-point after injection.At 48 hour-point,the SOD of group V was the highest among all test groups.At 6 h-point,the liver MDA of group I was significantly lower than others.At 48 h-point,MDA of group Ⅲ was significantly higher than group I,Ⅱ and Ⅳ.The results indecated that the family groups ofP.fulvidracohad significant differences in immune levels.Family group I(G♂×G♀)in CM,TP,LA,ALT and MDA indicators showed strong anti-stress,nonspecific immunity,liver antioxidant ability,and showed resistance advantage in anti-A.hydrophila.
Keywords:Pelteobagrusfulvidraco;family;injecting;Aeromonashydrophila;immune parameter
黄颡鱼(Pelteobagrusfulvidraco)作为优质的淡水鱼类养殖品种,因其肉嫩味美、营养价值丰富、少肌间刺等特点,深受国内外广大消费者喜爱。市场销售价格一直高于大宗鱼类。随着黄颡鱼集约化养殖规模的扩大,人工放养密度的增加,养殖水体的污染,种质衰退等因素影响,鱼体的免疫力逐渐下降,病害频发,成为黄颡鱼养殖产业发展新的制约因素。
随着鱼类选育工作的逐步深入,人们越来越关心鱼类的抗病力,选择抗病能力强的新品种,成为鱼类养殖业发展的需要。Gjedrem等[1]自20世纪20年代开始利用选育的方法对鱼类进行遗传改良研究,培育鱼类抗病新品种。Haskin等[2]选择培育的第四代美洲牡蛎的抗单孢子虫病(MSX)品系,其抗病能力较野生群体提高了8~9倍。目前,具有明显抗病力优势的成熟品种仍然较少。
致病性嗜水气单胞菌可引起黄颡鱼细菌性败血症,该菌被认为是我国淡水养殖鱼类暴发性传染病的主要病原菌,我国每年因嗜水气单胞菌引起的细菌性败血症已经给淡水鱼类养殖户带来了巨大的经济损失[3]。本研究拟通过对5个黄颡鱼家系组注射嗜水气单胞菌后生理生化指标的比较,为选育抗病能力强的黄颡鱼新品系提供参考。
1 材料与方法
1.1 试验家系构建及苗种培育
2014年6-7月,选取滆湖(G)、石臼湖(S)和太湖(T)3个地理群体野生黄颡鱼2~3龄亲鱼3批,每批亲鱼数量40~60尾。要求鱼体体形、体色正常,体质健壮,无疾病伤残。采用混合催产剂催产亲鱼,使亲本同时达到排卵、排精效应期。设计建立5个繁育家系组,分别为群体内繁育组合I(G♂×G♀)、Ⅱ(S♂×S♀)和Ⅲ(T♂×T♀),群体间繁育组合Ⅳ(G♂×S♀)、V(S♂×T♀)。采取湿法受精的方式进行人工授精,受精卵静水充气分别孵化,孵化水温27~30 ℃,孵化用水溶解氧在6 mg/L以上,每组卵的孵化时间约48 h。建立家系组的编号及父、母本地理群体及生物学数据。随机选取1 000尾/家系苗种,投入培育车间的中间培育池(3.0 m×0.8 m×0.6 m),分别流水冲气培育,3~5 d以浮游动物做开口饵料,5~10 d开始逐步诱食人工配合粉料。整个培育过程中,注意保持培育环境和培育条件的一致性,消除环境误差。
1.2 试验设计与饲养管理
在家系鱼苗70 d时,挑选体格健壮、规格整齐(初始体质量(2.39±0.02) g)黄颡鱼幼鱼600尾/家系,每家系设3个平行。另随机选取幼鱼20尾/家系,-20 ℃冷冻保存,用于测定体组成。在室内流水培育池(规格为3.0 m×0.8 m×0.6 m)中养殖试验鱼,试验所用饲料为天邦牌黄颡鱼1号人工配合饲料。每天定时投喂3次,每次投喂时间为40 min,保证饲料被鱼充分摄食,剩饵捞出烘干,统计各养殖池的摄食量,养殖期为60 d。水温(27±3)℃,pH值7.3~7.5,保证溶解氧充足。
1.3 攻毒试验
菌种(AeromonashydrophilaHoshina)由江苏省淡水水产研究所鱼病室提供。为从患败血症的黄颡鱼脾脏中分离的嗜水气单胞菌,并通过16 S rDNA基因序列分析确定。病原菌先期开展预试验,确定半数致死浓度。将菌种在营养肉汤琼脂培养基中复壮2次。在菌体对数生长期,4 000 r/min离心1 min,沉淀菌体,使用灭菌生理盐水清洗菌体,再收集菌体梯度稀释,制备600 nm下吸光度OD值为0.2的菌体悬液(约5×107CFU/mL),4 ℃保存备用。
攻毒试验选取养殖试验末各家系组中规格基本一致的鱼种,体重范围(8.5±1.0)g,按家系组分组,每组设3个平行,60尾鱼/平行,每个家系组180尾,置于15个室内养殖缸内(规格为0.8 m×0.6 m×0.6 m)。按每100 g鱼腹腔注射菌液1.2 mL的比例进行攻毒,观察鱼体症状,记录死亡尾数。不投饵,水体充气、不循环。试验持续48 h,在攻毒前(0 h)及攻毒后6 、24、48 h采样,在每个采样时间点,随机取鱼3尾/缸,尾静脉采血。血样于4 ℃制备血浆,-20 ℃冻存。采血后立即剖开鱼腹腔,取肝脏,-20 ℃保存,用于常规分析。
另选择规格基本一致的鱼,每个家系组120尾,分4个平行,其中3个缸按每100 g鱼腹腔注射菌液1.2 mL的比例进行攻毒,另外 1个缸腹腔注射等量的生理盐水。分别放养于室内另外20个水族箱中(规格为0.8 m×0.6 m×0.6 m),保证充足的溶氧,观察鱼体出现症状,并及时捞出死亡个体,记录死亡尾数,在 0、6、24、34和48 h时间点统计鱼的累积死亡率(Cumulative mortality rate,CM)。
1.4 测定指标与方法
使用测定生化指标试剂盒(南京建成生物工程有限公司)和UV-752型紫外可见分光光度计测定各项生化指标,各样品指标均测3个重复。
1.4.1 血液生化指标
福林-酚试剂法测定血浆总蛋白(TP)含量[4]。乳酸(LA)、谷丙转氨酶(ALT)和谷草转氨酶(AST)采用赖氏法,碱性磷酸酶(AKP)采用磷酸苯二钠法等。
1.4.2 肝脏生化指标测定
肝脏抗氧化指标超氧化物歧化酶(SOD)活性测定采用邻苯三酚自氧化测定法;丙二醛(MDA)采用硫代巴比妥酸反应(Thiobarbituric acid,TBA)比色法测定。
1.5 结果计算
试验参数的计算公式如下:
累积死亡率CM =(攻毒试验结束时死亡鱼尾数/攻毒鱼尾数)×100%。
1.6 数据统计分析
采用SPSS 13.0 软件处理数据,以家系和采样时间为影响因子,对数据作单因素方差分析(One-way ANOVA),并进行Duncan’s多重比较。试验结果用“平均数±标准差(Mean±SD)”表示。P<0.05表明差异显著。
2 结果与分析
2.1 黄颡鱼攻毒后发病情况和CM
试验黄颡鱼经腹腔注射嗜水气单胞菌菌液后,大部分鱼体出现不同程度的感染表现,细菌毒力和致病力在黄颡鱼组织器官内迅速生长繁殖,产生大量的毒力因子,裂解血液中的红细胞,损伤机体的毛细血管系统,出现典型的细菌性败血症的症状,鳍基、鳃盖及口部充血,眼球外突,肠道空泡,肛门红肿,贫血,内脏充血,肝呈灰白色伴有出血点,腹腔积水,肾脏肿大。
试验黄颡鱼在注射菌液6 h后各家系组均未见明显死亡现象,6 h后每个家系组的CM呈逐渐升高的变化趋势,见图1所示。不同家系组黄颡鱼于攻毒后的24、34和48 h,CM由高到低排序为Ⅱ> V> Ⅲ> Ⅳ> Ⅰ。至攻毒后48 h,家系组Ⅰ、Ⅳ、Ⅲ的CM分别为38.89%、50.00%和63.33%;家系组Ⅱ、V的CM分别为91.11%和78.89%。各家系组间的CM比较存在显著的统计学差异(P<0.05)。
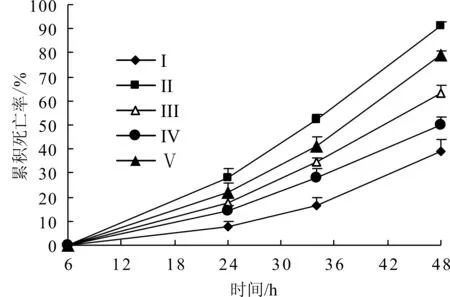
图1 各家系组黄颡鱼鱼种注射嗜水气单胞菌后的累积死亡率Fig.1 CM of Yellow catfish infected A.hydrophilain each family group
2.2 黄颡鱼攻毒后血浆中TP、LA和AKP变化
各家系组黄颡鱼鱼种感染嗜水气单胞菌后血浆中TP、LA和AKP的变化见图2 A、2 B和表1所示。从图2 A可知,攻毒后,随着时间的延长,血浆中TP含量呈先升高后降低的变化趋势,攻毒后24 h,血浆中TP含量达到顶峰,后逐渐降低,48 h恢复至攻毒前(0 h)水平。同一家系组在不同时间点比较,家系组Ⅰ、Ⅲ、Ⅳ攻毒后24 h,血浆中的TP含量最高,与其他时间点比较具有显著性差异。同一时间的不同家系组间比较,攻毒后0、6 h各组间TP的含量无显著性差异;攻毒后24 h,家系组Ⅰ、Ⅳ的血浆中TP含量显著高于其他三组;48 h家系组Ⅳ血浆中TP含量最高,显著高于其他家系组。
从图2 B可知,黄颡鱼感染嗜水气单胞菌后,血浆中LA含量也呈先升高后降低的变化趋势,攻毒后6 h,血浆中LA含量达峰值,后逐渐降低,48 h恢复至攻毒前(0 h)水平。同一家系组在不同时间点比较显示,家系组Ⅰ、Ⅱ、Ⅲ、Ⅳ在攻毒后6 h,血浆中的LA含量最高,与其他时间点比较具有显著性差异。同一时间的不同家系组间比较,攻毒后0 h、6 h和24 h各家系组间血浆中LA含量比较无显著性差异;攻毒后48 h,家系组Ⅳ血浆中LA含量最低,与家系组Ⅰ比较差异不显著,但显著低于其他家系组。从表1可知,攻毒后,血浆中AKP的含量变化不显著,各家系组间和不同时间点取样所测得的试验结果比较无统计学差异。
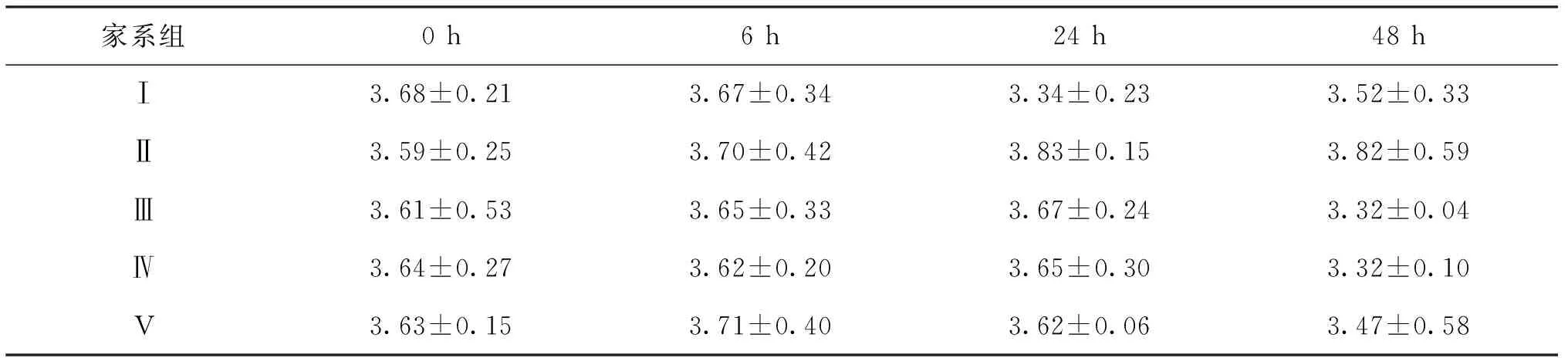
表1 各家系组黄颡鱼鱼种感染嗜水气单胞菌后血浆中AKP含量变化Tab.1 Change of serum AKP of yellow catfish infected with A.hydrophila in each family group U/L
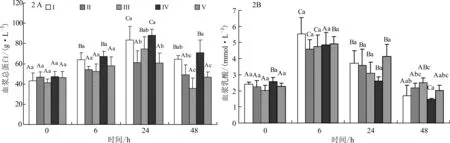
图2 各家系组黄颡鱼鱼种感染嗜水气单胞菌后血浆中TP(A)、LA(B)含量的变化Fig.2 Changes of serum TP(A)and LA(B)of different family groups of Yellow catfish infected with A.hydrophila注:不同大写字母表示同一组在不同时间点差异显著(P<0.05);不同小写字母表示不同组在同一时间点差异显著(P<0.05)。图3、4同
2.3 黄颡鱼攻毒后肝脏抗氧化力SOD和MDA变化
各家系组黄颡鱼鱼种感染嗜水气单胞菌后肝脏抗氧化能力SOD和MDA的变化见图3 A和3 B。从图3 A可知,黄颡鱼感染嗜水气单胞菌后,肝脏中SOD水平呈先升高然后降低的变化趋势,攻毒后24 h,肝脏中SOD水平达到顶峰,后逐渐降低。同一家系组在不同时间点比较,家系组Ⅳ不同时间点比较无显著性差异;家系组Ⅰ、V在攻毒后24 h显著高于其他时间点。同一时间的不同家系组间比较,攻毒后24 h和48 h,家系组V肝脏中SOD水平最高,显著高于其他家系组;攻毒后48 h,家系组Ⅰ的SOD水平最低,与家系组Ⅱ、Ⅲ间无显著差异,但是显著低于家系组Ⅳ和V,攻毒后48 h,家系组V的SOD水平最高,显著高于其他家系组。
从图3 B可知,黄颡鱼感染嗜水气单胞菌后,随着时间的延长,肝脏中MDA水平呈逐渐升高的变化趋势。同一时间的不同家系组间比较,攻毒后0、24 h各家系组间肝脏中MDA水平无显著性差异;攻毒后6 h,家系组Ⅰ的MDA水平显著低于其他组;攻毒后48 h,家系组Ⅲ的MDA水平最高,显著高于家系组Ⅰ、Ⅱ、Ⅳ,与家系组V比较差异不显著,家系组Ⅰ和Ⅱ此时MDA的水平较低。
2.4 黄颡鱼攻毒后血浆中ALT和AST活性变化
各家系组黄颡鱼鱼种感染嗜水气单胞菌后血浆中ALT和AST活性的变化见图4A和4B。从图4A可知,黄颡鱼在感染嗜水气单胞菌后,随着时间的延长,血浆中AST活性呈逐渐升高的变化趋势。同一家系组在不同时间点比较,家系组Ⅰ、Ⅳ在攻毒后24 h,血浆中AST活性最高。同一时间的不同家系组间比较,经攻毒后24 h,各家系组间血浆中AST活性无显著性差异,攻毒后48 h,家系组Ⅳ的AST活性最低,与家系组Ⅰ比较差异不显著,但显著高于家系组Ⅱ、Ⅲ、V的AST活性。
从图4 B可知,黄颡鱼在感染嗜水气单胞菌后,血浆中ALT活性呈先升高后降低的变化趋势。同一家系组在不同时间点比较,家系组Ⅱ、Ⅲ、Ⅳ在不同时间点血浆中ALT活性比较无显著性差异,家系组Ⅰ在攻毒后的6 h血浆中ALT活性显著高于其他时间点。同一时间的不同家系组间比较,经攻毒后6 h,各家系组间血浆中的ALT活性比较无显著性差异;攻毒后24 h,家系组Ⅰ、Ⅱ首先恢复至攻毒前(0 h)水平,且家系组Ⅰ的ALT活性最低。攻毒后48 h,家系组Ⅰ、Ⅱ的ALT活性显著低于Ⅲ、Ⅳ、V。
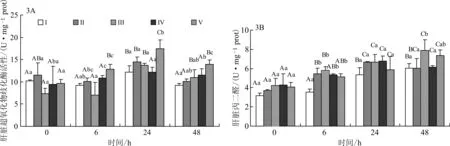
图3 各家系组黄颡鱼鱼种感染嗜水气单胞菌后血浆中SOD(A)、MDA(B)含量的变化Fig.3 Changes of serum SOD(A)and MDA(B)of different family groups of yellow catfish infected with A.hydrophila
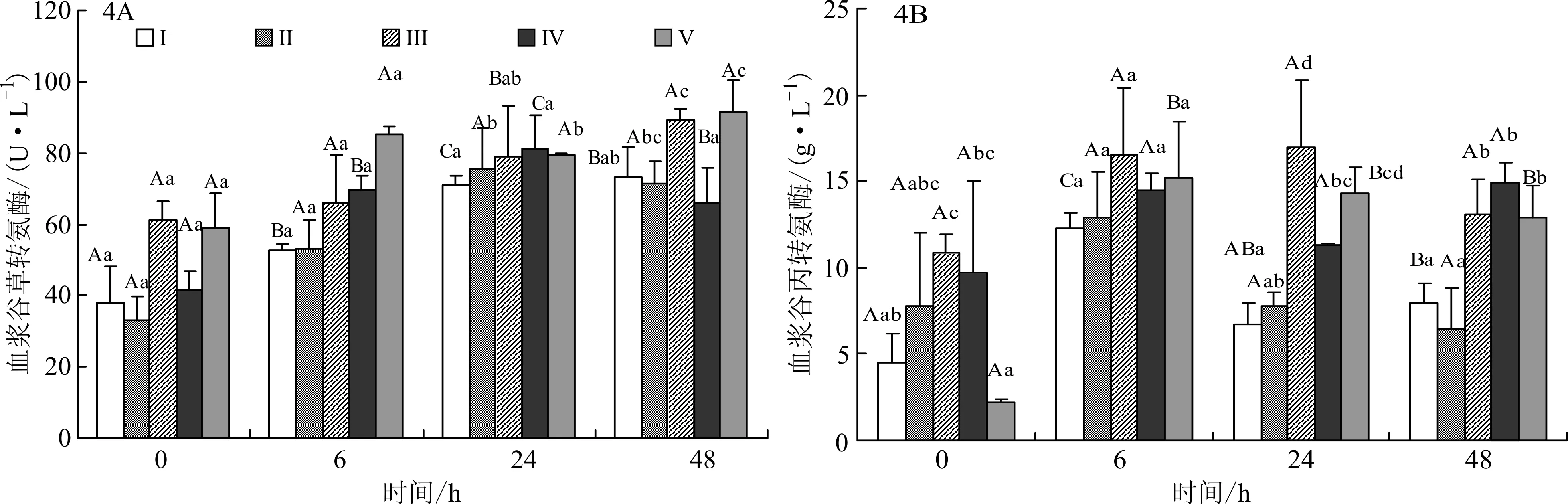
图4 各家系组黄颡鱼鱼种感染嗜水气单胞菌后血浆中AST(A)、ALT(B)含量的变化Fig.4 Changes of serum AST(A)and ALT(B)of different family groups of yellow catfish infected with A.hydrophila
3 讨论
3.1 不同家系黄颡鱼攻毒后CM分析
本研究观察了生长性能较好的5个家系组对嗜水气单胞菌的抗感染能力,家系组Ⅰ在注射嗜水气单胞菌后48 h的CM仅为38.89%,表现出了对嗜水气单胞菌很好的抵抗力。而家系组Ⅱ在攻毒后48 h,CM高达91.11%,一方面说明不同家系组对嗜水气单胞菌的抵抗力差异明显,在家系组选育过程中,针对抗病力的筛选可能获得较好的效果。另一方面,我们仅对不同地域亲本的子一代进行比较,并仅比较了3个地区5个子一代样本,即发现了抗病力的差异,说明鱼类基因库大,优良性状范围广。当然,相关抗病基因能否稳定遗传,还需要大量的试验来验证。
3.2 黄颡鱼攻毒后血浆中TP、LA和AKP变化分析
TP含量反应了鱼体的基本代谢水平,对病原感染前后血浆TP含量的比较,一定程度上可以体现鱼体非特异性免疫水平。现有的报道关于TP水平在病原感染后高低情况不一,可能和试验鱼种类、试验条件等因素有关。鱼类发生病菌感染后,鱼体发生免疫应激,短时间内大量免疫蛋白分泌到血液中,而后蛋白合成能力下降。不同品种在不同条件下血浆中TP水平达到高峰的时间不同,维持高水平的时间也有差异,这就导致了试验检测结果的不同。陈寅儿等[5]对鲈(Lateolabraxjaponicus)的研究发现,感染溶藻弧菌病后血浆中的TP水平升高,而郭松林等[6]报道美洲鳗鲡(Anguillarostrata)在感染后血浆中TP水平显著下降。本试验中,我们在攻毒后连续观察了48 h,在24 h血浆中TP水平达到高峰,然后逐步下降。家系组Ⅱ、V在攻毒后48 h恢复到攻毒前水平,家系组Ⅲ攻毒后48 h血浆中TP水平低于攻毒前水平。结果表明不同家系组对嗜水气单胞菌造成的免疫应激具有不同的反应,家系组Ⅰ可能利用血浆中较高的免疫蛋白,抑制了外源菌,使得免疫力提高,增加了存活率。
血浆中LA含量是鱼体无氧代谢情况的直接表现,鱼体处于应激状态下,可以充分的表现鱼体对应激情况的响应能力。本试验中,黄颡鱼在攻毒后,各家系组血浆中LA含量先显著上升,而后逐渐恢复到攻毒前水平。表明试验中各家系组对嗜水气单胞菌均表现出免疫应激反应,机体合成代谢大量增加,耗氧量增加,呼吸作用减弱,致使无氧酵解水平上升。在攻毒24 h后,家系组Ⅰ、Ⅳ血浆LA含量显著下降,首先恢复到攻毒前水平,表明试验鱼有氧呼吸作用恢复,LA被进一步降解,家系组Ⅰ、Ⅳ与其他家系组比较具有更强的对抗免疫应激能力。
AKP可直接参与磷酸基团的转移和钙磷代谢过程,对鱼类营养物质吸收利用也有重要作用。AKP还能通过改变病原体的表面结构,增强机体对病原体的识别和吞噬能力。攻毒后,黄颡鱼各家系组间的AKP水平差异均不显著,可能嗜水气单胞菌对黄颡鱼AKP合成作用影响较小,且在不同家系组表现差异较小。
3.3 黄颡鱼攻毒后血浆中ALT和AST活性变化分析
ALT和AST主要存在于肝脏中,血浆中含量极其微量。但在疾病、应激等条件下,肝细胞受损,ALT和AST释放到血液中[7]。本试验中,黄颡鱼在感染嗜水气单胞菌后,各家系组血浆转氨酶含量急剧上升,表明肝细胞受损发生。而家系组Ⅰ、Ⅱ血浆中ALT在攻毒后24 h首先恢复到攻毒前水平,说明家系组Ⅰ对抗嗜水气单胞菌导致的肝损伤方面强于其他家系组,这也与CM数据相一致。
3.4 黄颡鱼攻毒后肝脏中SOD和MDA变化分析
同一家系组黄颡鱼鱼种感染嗜水气单胞菌后,肝脏中SOD水平呈先升高然后降低的变化趋势,攻毒后24 h,肝脏中SOD水平达到顶峰。攻毒后24 h、48 h,家系组V肝脏中SOD水平最高,显著高于其他家系组(P<0.05)。各家系组黄颡鱼鱼种感染嗜水气单胞菌后,肝脏中MDA水平呈逐渐升高的变化趋势。攻毒后48 h,家系组Ⅲ的MDA水平最高,与家系组V间比较差异不显著(P>0.05),但显著高于其他家系组(P<0.05),表明家系组Ⅲ、V两个家系组感染嗜水气单胞菌后受损较大。
4 结论
各家系组黄颡鱼感染嗜水气单胞菌后,表现出明显的免疫差别。家系组Ⅰ在CM、TP、LA、ALT、MDA等指标方面表现出较强的抗应激、非特异性免疫、肝脏抗氧化能力,在抗嗜水气单胞菌方面表现出较强的抗病优势。
[1] Gjedrem T,Baranski M.Selective breeding in aquaculture:an introduction[J].Endocrinology,2009,10(6):570-572.
[2] Haskin H H,Ford S E.Development of resistance to minchinia nelsoni (MSX)mortality in laboratory-reared and native oyster stocks in Delaware Bay[J].Mar Fish Rev,1979,41(1):54-63.
[3] Xia C,Ma Z H,Rahman M H,et al.PCR cloning and identification of the β-haemolysin gene ofAeromonashydrophilafrom freshwater fishes in China[J].Aquaculture,2004,229(1-4):45-53.
[4] Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the folin phenol reagent[J].J Biol Chem,1951,193(1):265-275.
[5] 陈寅儿,金 珊,王国良.鲈鱼溶藻弧菌病的血液生理生化指标研究[J].应用海洋学学报,2005,24(1):104-108.
[6] 郭松林,关瑞章,冯建军,等.嗜水气单胞菌感染对美洲鳗鲡血液和生化指标的影响[J].集美大学学报:自然科学版,2010,15(2):93-97.
[7] Lun L M,Zhang S C,Liang Y J.Alanine aminotransferase in amphioxus:Presence,localization and up-regulation after acute lipopolysaccharide exposure[J].J Biochem Mol Biol,2006,39(5):511-515.
AcomparativestudyofimmuneparametersondifferentfamilygroupsofPelteobagrusfulvidracobyinjectingAeromonashydrophila
QIN Qin1,2,WANG Ming-hua1,CHEN Xiao-hui1,JIANG Guang-zhen3,ZHANG Shi-yong1,ZHONG Li-qiang1,PAN Jian-lin1,LIU Wen-bin3
(1.JiangsuInstituteofFreshwaterFisheries,Nanjing210017,China;2.WuxiFishetiesCollege,NanjingAgriculturalUniversity,Wuxi214081,JiangsuChina;3.KeyLabofAquaticAnimalNutritionandFeedScienceofJiangsuProvince,CollegeofAnimalScienceandTechnology,NanjingAgriculturalUniversity,Nanjing210095,China)
2017-01-10;
2017-08-02
现代农业产业技术体系专项资金(CARS-46);江苏省农业科技自主创新资金项目(CX(11)1036)
秦 钦(1980- ),副研究员,主要从事水产动物遗传育种及生态养殖方面研究。E-mail:qinqinapple1980@163.com
刘文斌。E-mail:wbliu@njau.edu.cn
S941.42
A
1000-6907-(2017)05-0040-07
