十全大补膏中芍药苷的含量测定
2017-10-12刘青刘波丁晓彦
刘青,刘波,丁晓彦*
(1.山东省中医药研究院,山东 济南 250014; 2.山东省千佛山医院,山东 济南 250014)
十全大补膏中芍药苷的含量测定
刘青1,刘波2,丁晓彦1*
(1.山东省中医药研究院,山东 济南 250014; 2.山东省千佛山医院,山东 济南 250014)
建立了高效液相色谱法测定十全大补膏中芍药苷含量的方法。采用Kromasil C18色谱柱(4.6 mm×250 mm, 5 μm),以乙腈-水(17∶83,V/V)为流动相,柱温30 ℃, 进样量10 μL,检测波长230 nm,流速 1.0 mL/min。结果表明,芍药苷在0.083 6~0.627 0 μg范围内线性关系良好(r= 0.999 8),加样回收率为98.98%~100.47%,相对标准偏差为0.65%(n=6)。本方法专属性强、灵敏度高、重现性好、操作简便,适用于十全大补膏的质量控制。
十全大补膏;芍药苷;高效液相色谱法;含量测定
LIU Qing1, LIU Bo2,DING Xiao-yan1*
Abstract∶A HPLC method for the determination of paeoniflorin in tonic semifluid extract of ten ingredients was established. The HPLC analysis was performed on Kromasil C18column (4.6 mm×250 mm, 5 μm), acetonitrile-water (17∶83,V/V) as the mobile phase, and the column temperature was 30 ℃, injection volume was 10 μL, the detective wavelength was at 230 nm, at a flow rate of 1.0 mL/min. Results revealed that paeoniflorin at the content of 0.083 6~0.627 0 μg showed good linearity(r= 0.999 8),the recovery rate was 98.98%~100.47%, RSD was 0.65% (n=6). This method is highly specific, sensitive, reproducible, and simple, which can be used for the quality control of this preparation.
Key words∶tonic semifluid extract of ten ingredients; paeoniflorin; HPLC; content determination
膏滋是采用中药饮片经过加水浸泡、煎煮、浓缩,再加冰糖或蜂蜜制成的一种稠厚半流体状或冻状制剂,民间俗称膏方或补膏,是传统中医药的主要剂型之一,具有补虚扶弱、防病治病、纠正亚健康、抗衰延年等功效。本研究选取的十全大补膏临床较为常用,具有温补气血的功效。处方主要由党参、炒白术 、酒白芍等10种中药组成[1]。 临床用于久病体虚、气短心悸、面色萎黄、气血两虚、头晕自汗、精神倦怠、体倦乏力、四肢不温、疮疡不敛、月经量多等[2]。白芍为方中君药,含芍药苷、芍药内酯苷、羟基芍药苷、蛋白质及三萜类成分,具有解热痉挛、扩张血管、镇痛镇静、抗炎抗溃疡、利尿的作用[3]。
目前文献有十全大补丸、十全大补颗粒、十全大补酒中芍药苷含量测定的报道,但采用高效液相色谱法测定十全大补膏中芍药苷含量的文献尚不多见。由于剂型不同,十全大补膏中除组方药材外还含有阿胶和糖类,所以供试品的制备和测定方法都有所不同。为了有效控制十全大补膏的质量,使其在临床使用中更加安全有效,本文采用高效液相色谱法测定十全大补膏中芍药苷的含量,为控制该制剂的质量提供参考依据。
1 仪器、试剂与试药
1.1仪器
高效液相色谱仪(包括e2695四元梯度泵、2996PDA检测器、Empower3色谱工作站,美国Waters);BP211D电子天平(德国Sartorius);KQ-100医用超声波清洗器(江苏昆山市超声仪器有限公司);MILLI-Q超纯水系统(德国Merck Millipore)。
1.2试剂
乙腈为色谱纯(上海星可高纯溶剂有限公司);乙醇、正丁醇为分析纯;水为超纯水。
1.3试药
芍药苷对照品(纯度96.4%,批号:110736-201438,中国食品药品检定研究院);十全大补膏及阴性样品(自制);处方药材(博康中药饮片有限公司)。
2 方法与结果
2.1色谱条件
以Kromasil C18为色谱柱(250 mm× 4.6 mm,5 μm);柱温:30 ℃;流动相:乙腈-水(17∶83,V/V);进样量:10 μL;检测波长:230 nm;流速:1.0 mL/min。按上述色谱条件,理论板数按芍药苷峰计算为4 227,芍药苷色谱峰与其他杂质峰分离良好,R>1.5。
2.2对照品溶液制备
精密称取对照品10.47 mg,置50 mL具塞量瓶中,加稀乙醇溶解并定容,摇匀,作为对照品储备液(质量浓度为209 μg/ mL),精密量取5 mL,置25 mL具塞量瓶中,加稀乙醇稀释至刻度,摇匀,即得(质量浓度为41.80 μg/ mL)。
2.3供试品溶液的制备
精密称取十全大补膏约1.0 g,置250 mL具塞三角瓶中,加稀乙醇200 mL,密塞,称定,超声提取40 min,放冷,用稀乙醇补足失重,摇匀,离心5 min,取上清液100 mL蒸干,加入80 ℃热水40 mL,使其溶解,放冷,用水饱和正丁醇萃取3次,每次40 mL,合并上清液置于蒸发皿,水浴挥干,加稀乙醇溶解残渣,转移至5 mL容量瓶定容并过滤,取续滤液,作为供试品溶液。
2.4空白对照溶液的制备
根据十全大补膏处方工艺,取除白芍以外其他药材和辅料,制成不含白芍的阴性样品,再按2.3项下方法制备,得空白对照溶液。
2.5专属性考察
取上述对照品溶液、供试品溶液和空白对照溶液,经0.45 μm微孔滤膜过滤,按2.1项下色谱条件分别进样并测定,结果供试品溶液在与芍药苷色谱峰相应位置处有相同色谱峰出现,而阴性对照溶液在此位置处无色谱峰出现,说明十全大补膏中其他组分对芍药苷测定无干扰,表明本实验方法专属性良好。结果见图1。
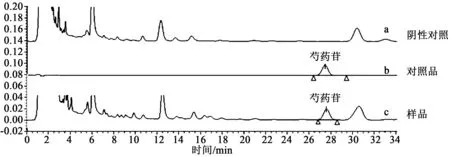
图1 芍药苷HPLC色谱图Fig.1 HPLC chromatogram of paeoniflorin
2.6方法学考察
2.6.1 线性关系考察
分别精密吸取芍药苷对照品溶液2、5、7、10、15 μL进样,以进样量(μg)对数为横坐标,峰面积为纵坐标进行回归,得标准曲线Y=23 565X+325.32,r= 0.999 8。结果显示,芍药苷进样量在0.083 6~0.627 0 μg范围内线性关系良好。
2.6.2 精密度实验
精密吸取已知浓度的芍药苷对照品溶液,在2.1项色谱条件下重复进样6次,测得芍药苷峰面积相对标准偏差为0.67%,表明仪器精密度符合要求。
2.6.3 重复性实验
取十全大补膏样品6份(批号:140122),每份约1.0 g,按2.3项下方法制备供试品溶液,进样分析,计算芍药苷平均含有量为0.448 7 mg/g,相对标准偏差为1.11%,表明本法的重复性良好。
2.6.4 稳定性实验
精密吸取十全大补膏供试品溶液适量,室温放置,于0、2、4、、8、12、24 h进样10 μL,所测峰面积相对标准偏差为0.97%。表明供试品溶液室温下放置24 h内稳定性良好。
2.6.5 加样回收实验
精密称取十全大补膏样品(批号:140122)约0.5 g,平行6份,分别加入一定质量的芍药苷对照品,按2.3项下方法制备供试品溶液,进样10 μL,测定计算芍药苷平均回收率为99.58%,相对标准偏差为0.65%。见表1。
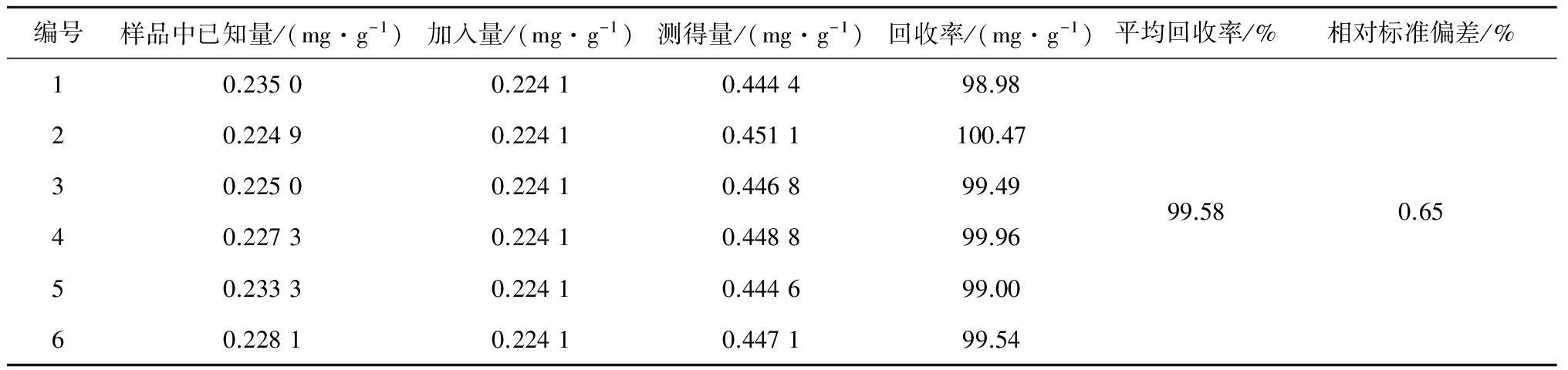
表1 加样回收率考察结果(n=6)
2.7样品含量测定
取十全大补膏5个批号的样品,每批3份,按2.3项下方法制备样品溶液,再按2.1项色谱条件测定,结果见表 2。
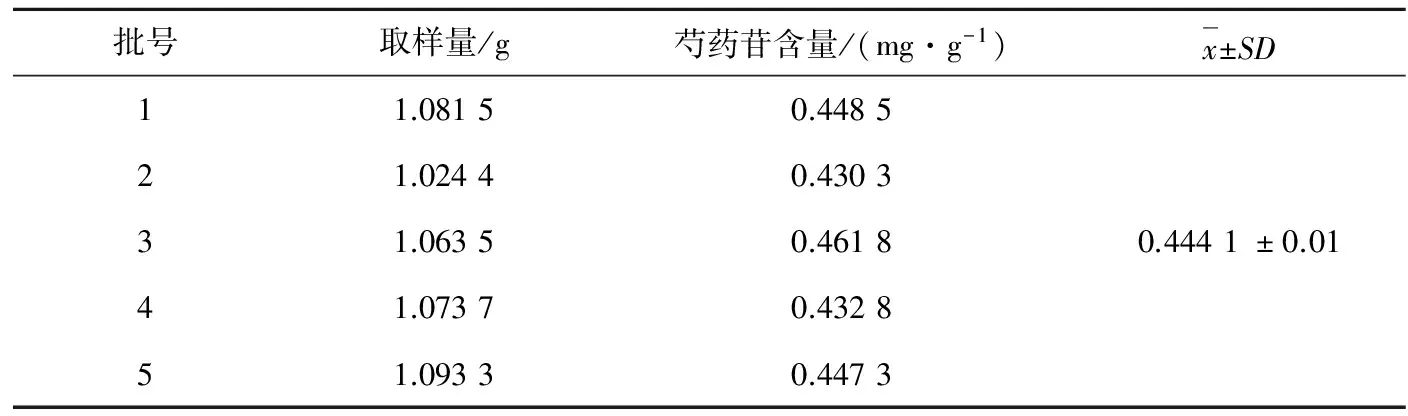
表2 芍药苷含量测定结果
3 讨论
本文参考相关文献资料[4-6],对比了甲醇、乙醇、不同比例乙醇-水等溶剂条件下的提取方法对十全大补膏中芍药苷成分提取效率的影响,发现采用稀乙醇作为提取溶剂时芍药苷含量高,且杂质干扰少。故选择稀乙醇为提取溶剂。
采用Agilent Zorbax C18(250 mm×4.6 mm,5 μm)、大连依利特C18(250 mm×4.6 mm,5 μm)、Kromasil C18(250 mm×4.6 mm,5 μm)3种不同品牌色谱柱对样品进行测定,流动相为乙腈-水(17∶83,V/V)。结果发现后者分离度高且峰型对称,故选用Kromasil C18色谱柱。
本实验先后采用乙腈-水、乙腈-0.05%磷酸、乙腈-0.1%磷酸、甲醇-水为流动相进行分离,比较之后发现乙腈-水较其他体系分离时间短,有机相用量少,柱压低,色谱峰峰型对称,分离度和拖尾因子均符合要求,理论板数高,故选用乙腈-水溶液系统。对乙腈-水的比例(体积比从10∶90到20∶80)也进行了比较,结果发现二者体积比17∶83时分离效果较好,因此采用该乙腈-水溶液系统为流动相[7-10]。
本文通过对提取溶剂、色谱柱、流动相组成和流动相比例分别进行比较,建立了十全大补膏中芍药苷的含量测定方法,本方法分离度高,重现性好,可用于十全大补膏的质量控制,同时也对其质量标准的进一步完善提供了参考。
[1]国家药典委员会.中华人民共和国药典2010年版二部 [M].北京:中国医药科技出版社,2010:419.
[2] 胡增峣,徐岚,闫蓉,等.芍药苷作用于神经系统的研究进展[J].中国中药杂志,2013,38(3) : 297-301.
[3] 李玉云,姚闽.RP-HPLC法测定十全大补颗粒中芍药苷的含量[J].中药新药与临床药理,2008,19(1) : 59-60.
[4] 周文娟,詹常森,黄昕明. HPLC法同时测定肠安颗粒中的3种成分[J].中成药,2016,38(5):1048-1051.
[5] 陈镭,郭青. 参梅养胃颗粒质量标准的研究[J].中成药,2016,38(6):1279-1284.
[6] 聂晓洁,尹云泽,赵欣,等.清心牛黄片中芍药苷含量测定方法的探索[J].天津药学,2016,28(4):15-17.
[7] 毛爱丽.HPLC法同时测定清胃黄连丸中5种成分的含量[J].中国药房,2015,26(33):4740-4742.
[8] 朱冬可,吴佩颖, 高崎,等.乳腺消郁颗粒的质量控制[J].中成药,2015,37(6):1375-1379.
[9]李进飞,郭景文,史宪海.HPLC法同时测定腰痛片中芍药苷、川续断皂苷Ⅵ、补骨脂素和异补骨脂素含量[J]. 药物分析杂志,2015,35(6):1099-1104.
[10]余捷婧,吴金雄,梁亚凤,等.HPLC同时测定赤芍和白芍中没食子酸等6种成分的量[J]. 中草药,2015,46(11):1673-1677.
Content determination of paeoniflorin in tonic semifluid extract of ten ingredients
(1.Shandong Academy of Chinese Medicine, Jinan 250014,China;2.Qianfoshan Hospital of Shandong Province, Shandong University, Jinan 250012,China)
R284.1
A
1002-4026(2017)05-0028-04
10.3976/j.issn.1002-4026.2017.05.005
2017-03-13
山东省中医药科技发展计划(2011-168)
刘青(1969—),女,副研究员,研究方向为中药分析。E-mail:wangboyavip@163.com
*通信作者,丁晓彦(1983—),女,助理研究员,研究方向为中药分析及中药质量控制。E-mail:kate-66@163.com
