电针对术后认知功能障碍大鼠认知功能及海马TNF-α和IL-1β表达的影响
2017-10-12刘佩蓉张瑜桂敏刁枢
刘佩蓉,张瑜,桂敏,刁枢
(上海中医药大学附属第七人民医院,上海 200137)
·动物实验·
电针对术后认知功能障碍大鼠认知功能及海马TNF-α和IL-1β表达的影响
刘佩蓉,张瑜,桂敏,刁枢
(上海中医药大学附属第七人民医院,上海 200137)
目的 观察电针对术后认知功能障碍大鼠认知功能及海马TNF-α和IL-1β表达的影响,探讨电针的作用机制。方法 将90只健康SD雄性老龄大鼠,随机分为假手术组(C组),手术组(S组),电针组(Z组),每组30只。每组又分为术后1 d、术后3 d和术后7 d 3个亚组。采用Morris水迷宫检测认知功能,免疫组化法检测大鼠海马TNF-α和IL-1β的变化。结果 与C组同时点比较,S组术后1 d、3 d、7 d找到平台的潜伏期延长,穿越平台次数减少(P<0.05),以术后3 d最为明显;与S组同时点比较,Z组术后1 d、3 d、7 d找到平台的潜伏期缩短,穿越平台次数增多(P<0.05)。与 C组同时间点比较,S组 TNF-α和 IL-1β术后阳性表达数量增加(P<0.05);与 S组同时间点比较,Z组各亚组阳性表达数量降低(P<0.05)。结论 电针调节能改善肝左叶切除大鼠术后学习和记忆能力,可能与抑制海马TNF-α和IL-1β的过度表达有关。
电针;认知障碍;Morris水迷宫;TNF-α;IL-1β;大鼠;消化系统外科手术
术后认知功能障碍(postoperative cognitive dysfunction, POCD)是手术麻醉后常见的中枢神经系统并发症,导致患者记忆、注意力、语言和抽象思维能力显著降低[1]。POCD常见于手术麻醉后的老年患者,约14%的老年人在手术后3个月内经历过认知能力下降[2]。POCD增加老年患者的病死率,所以发展潜在的预防或治疗 POCD的策略非常迫切[3]。近年来,各种临床研究发现了许多POCD的危险因素,如麻醉类型、患者年龄、手术应激、手术创伤和术后疼痛等[4-6]。手术创伤后海马促炎因子的过度表达是 POCD的发病机制之一[7-9]。电针调节能减轻非手术创伤大鼠脑组织炎症反应[10-11],进而改善学习记忆能力,但对于手术创伤大鼠是否同样有效,目前尚无定论。本研究采用肝左叶切除术模拟中等手术创伤建立POCD模型[12],旨在探讨电针调节对 POCD大鼠认知功能的改善作用以及与海马促炎因子TNF-α和IL-1β表达的关系。
1 材料与方法
1.1 实验动物
健康SD雄性老龄大鼠,18~20月龄,体重300~350 g,购自中科院上海实验动物中心。
1.2 实验动物分组与处理
90只健康SD雄性老龄大鼠随机分为假手术组(C组)、手术组(S组)、电针组(Z组),每组30只。每组根据不同时间点分为术后1 d、术后3 d和术后7 d 3个亚组(n=10)。
根据文献建立POCD模型[12],S组和Z组肝左叶切除术,10%水合氯醛(0.04 mL/10 g)腹腔注射麻醉,待大鼠翻正反射消失后仰卧位固定,腹部消毒,于上腹部正中线做一小切口,游离切除左侧肝叶,彻底止血,逐层关腹。C组腹腔注射麻醉后在上腹部正中线相同部位仅做表皮切开缝合术,不切除肝左叶。
Z组参照《实验动物穴位图谱》[13],取百会穴(在头顶正中线中点头骨中央),双侧内关穴(位于腕至肘间下1/6处前肢内侧,离腕关节约3 mm的尺桡骨缝间),双侧合谷穴(位于前肢第一、二掌骨之间)。采用0.35 mm×13 mm不锈钢毫针,平刺约2.5 mm。然后百会穴连接韩氏穴位神经刺激仪(与百会穴形成环路的另一电极,连接于百会穴后5 mm的非穴点)。电针频率2/10 Hz,强度4 mA,疏密波持续刺激。术前30 min至手术结束,术后每日1次,每次30 min,连续7 d。C组和S组不予电针干预。
1.3 观察指标
1.3.1 行为学测定
采用Morris水迷宫测定学习记忆能力,具体包括定位巡航实验和空间探索实验。Morris水迷宫测定时,室温及水温均保持在24~26℃。迷宫上方安置与电脑系统连接的摄像机,同步记录。于术前5 d进行Morris水迷宫训练,每天4次。定位巡航实验,将大鼠从离平台最远的象限1/2弧度处轻放于水中,让其找到水中的平台,记为潜伏期(设定最长游动时间为90 s)。空间探索实验,定位巡航实验后撤除平台,选定和平台相对的象限中点为入水点,记录90 s内老龄大鼠为搜索平台而穿过平台区的次数。大鼠经训练后,能连续3次在90 s内从起始点找到平台,作为训练成功的大鼠,进入后面的试验。分别记录术后1 d、3 d、7 d老龄大鼠的逃避潜伏期及穿越平台次数。
1.3.2 海马TNF-α和IL-1β的测定
于术后1 d、术后3 d和术后7 d 3个时间点麻醉后取大鼠海马组织,-85℃冰箱保存,运用免疫组化染色海马TNF-α和IL-1β。组织切片放入3%过氧化氢溶液(双氧水:纯水=1:9),室温避光孵育25 min,阻断内源性过氧化物酶,PBS液冲洗5 min×3次;加入3%BSA,室温封闭30 min;加入一抗,4℃孵育过夜,PBS液冲洗5 min×3次;滴加与一抗相应种属的二抗(HRP标记)覆盖组织,室温孵育50 min,最后用DAB显色,苏木素复染,脱水、透明、中性树胶封片,苏木素染细胞核为蓝色,DAB显出的阳性表达为棕黄色。
1.4 统计学方法
运用SPSS15.0统计软件对资料进行统计分析,计量资料以均数±标准差表示,多组间比较采用方差分析,两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠行为学测定结果比较
与C组同时点比较,S组术后1 d、3 d、7 d找到平台的潜伏期延长,穿越平台次数减少(P<0.05),以术后3 d最为明显;与S组同时点比较,Z组术后1 d、3 d、7 d找到平台的潜伏期缩短,穿越平台次数显著增多(P<0.05);Z组与C组术后同时点比较,差异无统计学意义(P>0.05)。详见表1。
表1 3组大鼠行为学测定结果比较 (±s,个)
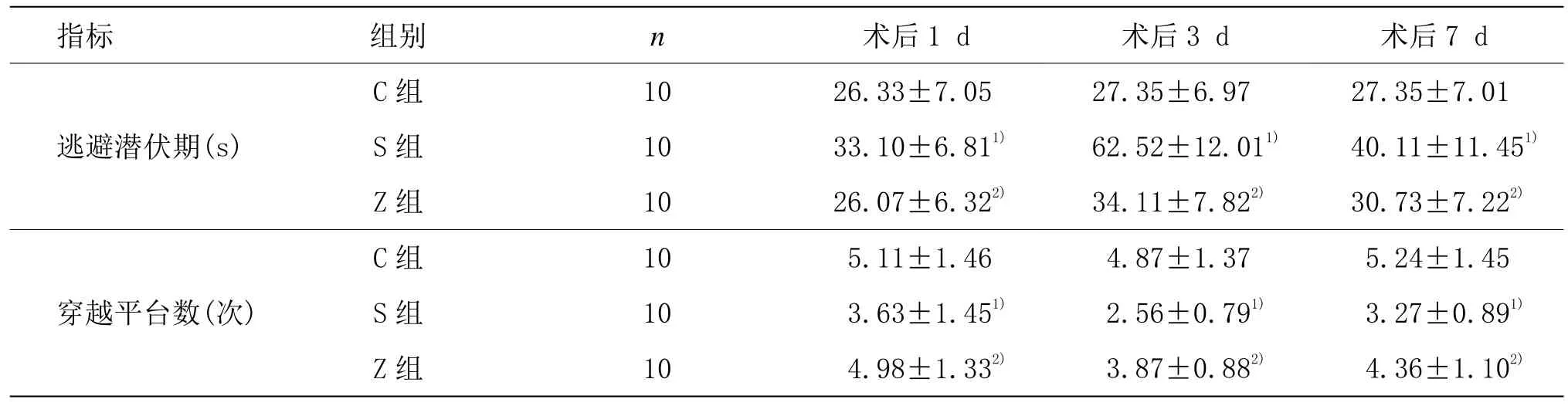
表1 3组大鼠行为学测定结果比较 (±s,个)
注:与C组同时点比较1)P<0.05;与S组同时点比较2)P<0.05
指标 组别n术后1 d 术后3 d 术后7 d C 组 10 26.33±7.05 27.35±6.97 27.35±7.01逃避潜伏期(s)穿越平台数(次)S 组 10 33.10±6.811)62.52±12.011)40.11±11.451)Z 组 10 26.07±6.322)34.11±7.822)30.73±7.222)C 组 10 5.11±1.46 4.87±1.37 5.24±1.45 S 组 10 3.63±1.451)2.56±0.791)3.27±0.891)Z 组 10 4.98±1.332)3.87±0.882)4.36±1.102)
2.2 3组大鼠海马区TNF-α、IL-1β阳性细胞数比较
与C组同时间点比较,S组TNF-α和IL-1β术后阳性表达数量增加(P<0.05),其中TNF-α以术后1 d最为明显;IL-1β以术后3 d最为明显;与S组同时间点比较,Z组各亚组 TNF-α、IL-1β阳性表达数量显著降低(P<0.05)。与C组比较,Z组术后 1 d TNF-α阳性表达数量增加(P<0.05),术后3 d恢复;术后1 d和术后 3 d IL-1β阳性表达数量增加(P<0.05),术后 7 d恢复。详见表2。
表2 3组大鼠海马区TNF-α、IL-1β阳性细胞数比较 (±s)
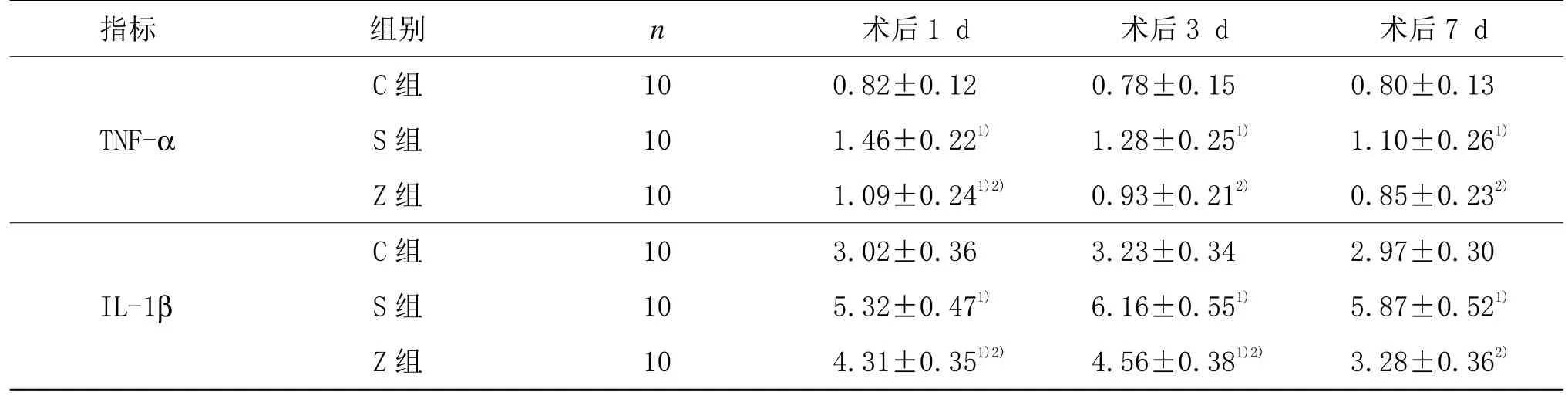
表2 3组大鼠海马区TNF-α、IL-1β阳性细胞数比较 (±s)
注:与C组同时点比较1)P<0.05;与S组同时点比较2)P<0.05
指标 组别n术后1 d 术后3 d 术后7 d C 组 10 0.82±0.12 0.78±0.15 0.80±0.13 TNF-αS 组 10 1.46±0.221)1.28±0.251)1.10±0.261)Z 组 10 1.09±0.241)2)0.93±0.212)0.85±0.232)C 组 10 3.02±0.36 3.23±0.34 2.97±0.30 IL-1βS 组 10 5.32±0.471)6.16±0.551)5.87±0.521)Z 组 10 4.31±0.351)2)4.56±0.381)2)3.28±0.362)
3 讨论
POCD是老年患者手术麻醉后常见的并发症,主要表现为学习和记忆能力的可逆性损害[14],部分甚至发生痴呆,严重影响患者的生活质量,并带来沉重的经济和社会负担。
结合传统经络理论及相关基础研究,电针能双向调节神经-内分泌-免疫系统,抑制炎症的过度表达。根据POCD的临床表现,当属中医学“健忘”范畴,甚至“痴呆”。中医学认为,POCD的病位主要在于心脑,治疗需立足疏经通络、醒神开窍。百会位居巅顶,穴归属督脉,是调节大脑功能的要穴[15-16]。内关属手厥阴心包经的络穴,为八脉交会穴,善治精神疾患[16-17]。合谷是手阳明大肠经的原穴,疏经通络,是头面部疾患中常用的穴位[18]。因此,本研究选取百会穴、双侧合谷穴和双侧内关穴行电针调节。
Morris水迷宫是测定大鼠学习记忆能力的重要工具,通过受试大鼠找到迷宫中的平台位置来反映空间记忆功能。Morris水迷宫广泛应用于评价大鼠和小鼠的认知功能[19-24]。故本研究采用Morris水迷宫测定大鼠术后认知功能的变化。
炎症反应在手术创伤和麻醉引发的认知功能障碍中起着重要的作用[25-26]。POCD的发病机制中,炎症反应可能起到重要的作用[7-9]。生理状态下促炎因子和抗炎因子处于脆弱的平衡,这种平衡很容易被手术创伤打破,引起局部和全身炎症反应。手术创伤激活外周免疫系统释放各种炎性因子,外周炎性因子透过血脑屏障激活小胶质细胞和血管内皮细胞,导致海马区长时程增强效应的破坏,介导认知功能的损伤;与年龄相关的胶质细胞活性的改变也会加剧老年患者炎症反应的程度[8-9]。在POCD大鼠海马组织中,各种炎症细胞因子水平显著升高,包括TNFα、IL-1α/β、IL-6和IL-8等[27]。这些炎症细胞因子能进一步激活小胶质细胞、破坏血脑屏障的通透性,最终引起脑损伤和认知功能障碍[28-29]。本次研究显示,与C组同时间点相比,S组术后TNF-α和IL-1β阳性表达数量增加(P<0.05),与行为学测定在时间上吻合,证实存在有神经炎症反应,与以往研究一致[7-9]。
近期研究显示,电针刺激能改善血管性痴呆大鼠学习记忆能力,降低海马组织中的IL-1β、TNF-α含量,缓解脑缺血后炎症反应[10]。电针可以抑制阿尔茨海默病大鼠海马区IL-1β、TNF-α的过度表达,减轻脑组织炎症反应,进而改善学习记忆能力[11]。这表明,抑制炎症反应是电针治疗认知功能障碍的一种机制。多个研究报道,抑制TNFα或IL-1α/β信号通路能有效改善老龄大鼠术后认知功能障碍[30-34]。本研究中与C组同时间点比较,S组TNF-α和IL-1β阳性表达数量显著增加(P<0.05);Z组与S组同时间点比较,TNF-α和IL-1β阳性表达数量降低(P<0.05);Z组与C组同时间点比较,TNF-α术后3 d恢复,IL-1β术后7 d恢复;并且,海马炎症因子表达与行为学测定一致。本研究结果提示,电针调节可能通过抑制手术创伤大鼠海马促炎因子的过度表达,起到改善学习记忆的作用。
综上所述,电针调节能改善肝左叶切除大鼠术后学习和记忆能力,可能与抑制海马TNF-α和IL-1β的过度表达有关。
[1]Bekker AY, Weeks EJ. Cognitive function after anaesthesia in the elderly[J].Best Pract Res Clin Anaesthesiol,2003,17(2):259-272.
[2]Norkienė I, Samalavičius R, Misiūrienė I,et al. Incidence and risk factors for early postoperative cognitive decline after coronary artery bypass grafting[J].Medicina(Kaunas), 2010,46(7):460-464.
[3]Deiner S, Silverstein JH. Postoperative delirium and cognitive dysfunction[J].Br J Anaesth, 2009,103(Suppl 1):i41-i46.
[4]Wuri G, Wang DX, Zhou Y,et al. Effects of surgical stress on long-term memory function in mice of different ages[J].Acta Anaesthesiol Scand, 2011,55(4): 474-485.
[5]Kalenka A, Gross B, Maurer MH,et al. Isoflurane anesthesia elicits protein pattern changes in rat hippocampus[J].J Neurosurg Anesthesiol, 2010,22(2):144-154.
[6]Shoair OA, Grasso Ii MP, Lahaye LA,et al. Incidence and risk factors for postoperative cognitive dysfunction in older adults undergoing major noncardiac surgery: A prospective study[J].J Anaesthesiol Clin Pharmacol,2015,31(1):30-36.
[7]Wan Y, Xu J, Ma D,et al. Postoperative impairment of cognitive function in rats: a possible role for cytokine-mediated inflammation in the hippocampus[J].Anesthesiology, 2007,106(3):436-443.
[8]Cibelli M, Fidalgo AR, Terrando N,et al. Role of interleukin-1beta in postoperative cognitive dysfunction[J].Ann Neurol, 2010,68(3):360-368.
[9]Terrando N, Eriksson LI, Ryu JK,et al. Resolving postoperative neuroinflammation and cognitive decline[J].Ann Neurol, 2011,70(6):986-995.
[10]忽浩杰,朱广旗,葛成慧,等.不同时期电针对血管性痴呆大鼠海马组织IL-1β、TNF-α含量及其学习记忆能力的影响[J].贵阳中医学院学报,2009,31(3):50-53.
[11]朱书秀,周丽莎,孙国杰.电针对阿尔茨海默病模型大鼠行为学及海马区IL-1β、TNF-α的影响[J].陕西中医学院学报,2008,31(4):55-57.
[12]任冬青,阎文军,岳海源,等.茯苓多糖对肝叶部分切除老年大鼠术后认知功能障碍的影响[J].国际麻醉学与复苏杂志,2016,37(8):714-717,731.
[13]林文注,王佩.实验针灸学[M].上海:上海科学技术出版社,1994:286.
[14]张素素,钱燕宁.术后认知功能改善的研究进展[J].国际麻醉学与复苏杂志,2015,36(11):1012-1015.
[15]劳宁,熊利泽,路志红,等.百会穴在电针刺激预处理诱导脑缺血耐受中的作用[J].第四军医大学学报,2003,24(5):418-420.
[16]陈少仁,高红涛,茹永刚,等.针刺百会、内关穴治疗血管性痴呆的临床疗效观察[J].四川中医,2007,25(3):98-99.
[17]周洁,赵嫣红,王祥瑞.电针刺内关穴对不停跳冠脉搭桥患者术后认知功能的影响[J].临床麻醉学杂志,2011,27(12):1188-1189.
[18]陈凤英,沈智威,关计添,等.手法针刺合谷穴得气与脑功能激活关系的探讨[J].磁共振成像,2011,2(2):112-117.
[19]王绪平,呙登俊,陈宇,等.Morris水迷宫实验评价血管性痴呆大鼠模型的学习记忆能力[J].中华中医药学刊,2013,31(1):99-100.
[20]武海霞,吴志刚,刘红彬,等.Morris水迷宫实验在空间学习记忆研究中的应用[J].神经药理学报,2014,4(5):30-35.
[21]李斌,谢淑玲,彭丽燕,等.3种拟痴呆动物模型在Morris水迷宫行为学测试中学习记忆行为的差异[J].医学研究生学报,2014,27(7):683-685.
[22]孔林林,张军,乔枫,等.基于小鼠Morris水迷宫和Y迷宫联合试验的多任务行为学测试研究[J].神经解剖学杂志,2013,29(4):365-368.
[23]刘金凤,聂坤,栗振杰,等.Morris水迷宫测评方法的改进及对快速老化痴呆小鼠SAMP8认知功能的再评价[J].中国中医急症,2013,22(1):5-7,22.
[24]封敏,卢圣锋,张承舜,等.国内大鼠Morris水迷宫实验现状与分析[J].辽宁中医杂志,2011,38(11):2170-2172.
[25]Cao XZ, Ma H, Wang JK,et al. Postoperative cognitive deficits and neuroinflammation in the hippocampus triggered by surgical trauma are exacerbated in aged rats[J].Prog Neuropsychopharmacol Biol Psychiatry,2010,34(8):1426-1432.
[26]Callaway JK, Jones NC, Royse AG,et al. Memory impairment in rats after desflurane anesthesia is age and dose dependent[J].J Alzheimers Dis, 2015,44(3):995-1005.
[27]Yu L, Sun L, Chen S. Protective effect of senegenin on splenectomy-induced postoperative cognitive dysfunction in elderly rats[J].Exp Ther Med, 2014,7(4):821-826.
[28]Dong X, Luo M, Huang G,et al. Relationship between irradiation-induced neuro-inflammatory environments and impaired cognitive function in the developing brain of mice[J].Int J Radiat Biol, 2015,91(3):224-239.
[29]Wardill HR, Mander KA, Van Sebille YZ,et al. Cytokine-mediated blood brain barrier disruption as a conduit for cancer/chemotherapy-associated neurotoxicity and cognitive dysfunction[J].Int J Cancer, 2016,139(12):2635-2645.
[30]Ma Y, Cheng Q, Wang E,et al. Inhibiting tumor necrosis factor-α signaling attenuates postoperative cognitive dysfunction in aged rats[J].Mol Med Rep, 2015,12(2):3095-3100.
[31]Yang N, Liang Y, Yang P,et al. TNF-α receptor antagonist attenuates isoflurane-induced cognitive impairment in aged rats[J].Exp Ther Med, 2016,12(1):463-468.
[32]Sun D, Yang L, Wu Y,et al. Effect of intravenous infusion of dobutamine hydrochloride on the development of early postoperative cognitive dysfunction in elderly patients via inhibiting the release of tumor necrosis factor-α[J].Eur J Pharmacol, 2014,741:150-155.
[33]Terrando N, Monaco C, Ma D,et al. Tumor necrosis factor-alpha triggers a cytokine cascade yielding postoperative cognitive decline[J].Proc Natl Acad Sci U S A, 2010,107(47):20518-20522.
[34]Barrientos RM, Hein AM, Frank MG,et al. Intracisternal interleukin-1 receptor antagonist prevents postoperative cognitive decline and neuroinflammatory response in aged rats[J].J Neurosci, 2012,32(42):14641-14648.
Effect of Electroacupuncture on Cognition and Hippocampal TNF-α and IL-1β Expressions in Rats with Postoperative Cognitive Dysfunction
LIU Pei-rong,ZHANG Yu,GUI Min,DIAO Shu.Seventh People’s Hospital of Shanghai University of TCM,Shanghai200137,China
Objective To observe the effect of electroacupuncture (EA) on the cognition and hippocampal tumor necrosis factor (TNF)-α and interleukin (IL)-1β expressions in rats with postoperative cognitive dysfunction (POCD),and discuss the action mechanism of EA. Method Ninety healthy male senile Sprague-Dawley (SD) rats were randomized into a sham operation group (group C), an operation group (group S) and an EA group (group Z), 30 rats in each group. Each group was then further divided into 3 subgroups: postoperative day 1, postoperative day 3 and postoperative day 7. The Morris water maze was adopted to evaluate the cognitive function, and immunochemistry method was used to detect the changes of TNF-α and IL-1β. Result Compared with group C at the same time points, the latent period was significantly longer and the crossing times were lower in group S on postoperative day 1, day 3 and day 7 (P<0.05), and the differences were most significant on postoperative day 3;compared with group S at the same time points, the latent period was significantly shorter and the crossing times were higher in group Z on postoperative day 1, day 3 and day 7 (P<0.05). Compared with group C at the same time point,the positive expressions of TNF-α and IL-1β were significantly higher in group S (P<0.05); compared with group S at the same time points, the positive expressions were significantly lower in each subgroup of group Z (P<0.05).Conclusion EA can improve the learning and memory of rats after left lateral segmentectomy of the liver, which ispossibly related to the inhibition of the over-expressions of TNF-α and IL-1β.
Electroacupuncture; Cognitive impairment; Morris water maze; TNF-α; IL-1β; Rat; Digestive system surgical procedures
R2-03
A
2017-05-14
10.13460/j.issn.1005-0957.2017.09.1116
1005-0957(2017)09-1116-05
上海市卫计委面上项目(20134286);上海市浦东新区学科带头人培养计划(PWRd2016-17)
刘佩蓉(1976—),女,副主任医师,硕士,Email:lpeir@126.com
刁枢(1963—),男,主任医师,Email:diao_shu@126.com
