证明稀盐酸与氢氧化钠发生反应的实验探究
2017-09-28张莉
张莉
摘要:酸碱中和反应是无机化学学习中的常见的一类复分解反应,其中盐酸与氢氧化钠最具有代表性,但是两者反应没有明显的现象出现,本文通过与同学们的共同设计与探究,实验验证了两者的反应,最终取得了良好的教学效果。
关键字:PH值、酸碱指示剂、温度
· 【中图分类号】G633.8
化学课程改革以培养学生科学素养为宗旨,积极倡导让学生亲身经历以探究为主的学习活动,而化学实验就属于科学探究的一种重要方式和途径,学生掌握基本的实验方法,具备一定的化学实验技能和实验能力,是进行科学探究活动的基础和保证。
酸碱反应是无机化学学习中比较常见的一类复分解反应,其中盐酸与氢氧化钠反应最具有代表性。但是它们之间的反应和一般的化学反应不同,没有明显的现象。那如何才能确定两者之间发生了反应,是教学中的重点与难点。
一、实验探究过程
1、教师指导
稀盐酸、氢氧化钠以及两者反应后的产物都是无色物质,所以即使两者已经发生化学反应了,也没有明显的试验现象体现出来。那么,我们可以采取酸碱指示劑的方法证明两者发生了化学反应,比如使用无色的酚酞指示剂。因为无色的酚酞试剂遇到碱性溶液会变红色,所以先在参加反应的无色氢氧化钠溶液中滴入几滴酚酞试剂,此时溶液变红色。然后在上述红色溶液中逐滴滴加稀盐酸,会观察到原来的红色的液体逐渐褪色直至无色(既然溶液已经没有颜色,证明其不再呈现碱性,说明溶液中不再含有氢氧化钠了,继而说明盐酸与氢氧化钠的确发生了化学反应!)当红色突然变成无色是说明稀盐酸和氢氧化钠溶液恰好完全反应,继续滴加盐酸的话,盐酸过量,溶液呈酸性。
采用酸碱滴定法进行试验,取一定量的氢氧化钠加入几滴酚酞,见溶液变红,然后慢慢的滴加稀盐酸,见溶液从红色变为无色,即证明氢氧化钠跟稀盐酸发生中和反应。酸碱指示剂除了酚酞以外,我们也可以采用用石蕊指示剂等。
2、实验小组开始实验
笔者所在学校1405班的同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
设计方案一(第一小组制定):测PH值
在进行氢氧化钠与盐酸两者的化学反应前,先用PH试纸测定氢氧化钠溶液的PH值,再进行滴加盐酸的试验操作,边滴加盐酸边振荡试管,保持混合液的均匀,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应。NaOH溶液与稀盐酸发生反应的化学方程式是:
NaOH+HCl═NaCl+H2O
实验过程中需要注意:
(1)用pH试纸测定溶液的pH值的正确操作是:用玻璃棒蘸取待测液,滴在pH试纸上,再与标准比色卡对照,即可得溶液的pH值。
(2)解释测得的pH值由大于7到逐渐变小到小于7的理由:没有反应时,碱液浓度最大PH值最大,随着反应进行碱液越来少,氢氧根离子的浓度在变小,试验检测的PH值在变小,直到溶液中盐酸过量时,溶液呈酸性,此时溶液的pH小于7。
设计方案二(第二小组制定):借助酸碱指示剂
先将酚酞试液滴加在氢氧化钠溶液中,然后再加入稀盐酸,在此实验过程中观察溶液颜色变化(未加稀盐酸前是红色,随着稀盐酸的逐滴加入,红色逐渐褪去直至消失),从而能证明稀盐酸与氢氧化钠溶液的确发生了化学反应。
同学们在向NaOH溶液中滴加酚酞试剂时,发现了一个特殊现象:在氢氧化钠溶液中滴入酚酞试剂后,溶液变成了红色,过了一会儿红色就消失了.该小组对这种意外现象的原因作了如下猜想:
①可能是空气中的氧气与酚酞试剂发生化学反应,使得溶液红色消失;
②空气中的二氧化碳气体与氢氧化钠溶液反应,使得溶液红色消失。氢氧化钠溶液与二氧化碳反应的化学方程式:2NaOH+CO2═Na2CO3+H2O
在二组组长带领下,同学们呢为了为验证猜想①,做了如下验证实验:
将配制好的氢氧化钠溶液加热后,滴加一些植物油,然后在冷却后的溶液中滴入酚酞溶液.实验中“加热”的目的是赶去氢氧化钠溶液中的空气,而“滴入植物油”目的是防止空气再次进入到氢氧化钠液体当中。实验结果表明酚酞溶液红色消失与空气中的氧气物质无关。
在副组长的带领下,为了验证猜想②,同学们继续进行探究:取一定量的Na2CO3溶液,在其中滴入酚酞试剂,发现溶液不是想象的不变色,而是变为红色,由此同学们总结出以下两点结论:①Na2CO3的水溶液呈碱性;②滴加酚酞试剂后,红色消失与空气中的二氧化碳无关。
向同学们布置作业,要求查阅资料得出出现这一现象的真实原因。经过一个礼拜的查阅后,同学们得知:当配置的氢氧化钠溶液浓度很大时,就会出现上述意外现象。向同学们解释出现此现象的真实原因:酚酞(Phenolphthalein)是一种弱有机酸,在pH<8.2的溶液里为无色的内酯式结构,当PH>8.2为醌式结构,酚酞的变色范围是8.2~10.0,当大于10.0后会因结构破坏形成无色羧酸盐。(酚酞的醌式或醌式酸盐,在碱性介质中很不稳定,它会慢慢地转化成无色羧酸盐式;遇到较浓的碱液,会立即转变成无色的羧酸盐式。所以,酚酞试剂滴入浓碱液时,酚酞开始变红,很快红色退去变成无色)。
同学们再次对所查到的资料进行验证:向上述验证试验中所用的一样浓度的氢氧化钠溶液中滴几滴酚酞试液,可观察到溶液先变红色,过一会红色消失。再向溶液中加入水进行稀释,观察现象:溶液又变成红色。
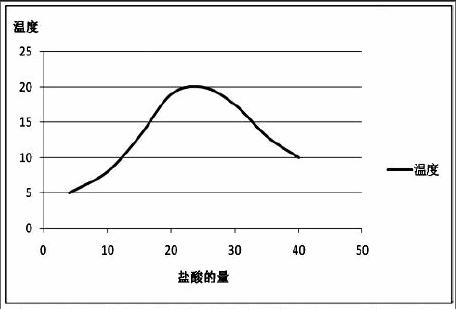
实验方案三(第三小组制定):测定反应前后的温度
方法:在氢氧化钠溶液中不断滴加稀盐酸,测定滴加不同滴数后混合体系的温度。
解释:由于酸碱中和反应是放热反应,所以随着反应的进行温度逐渐升高。当反应温度为最大值时,两者恰好反应。
二、 试验探究教学需要注意的问题
(1)探究的选题要注意适度、能引起学生兴趣和具有可操作性。第一,选择的探究内容对于学生来讲难度适宜,要求探究的内容具有适度的不确定性,其变量的多少要以学生能够掌握和控制为限度。第二,能够引起学生兴趣。随着问题的解决,学生的好奇心得到了满足,也同时感受到了成就感,这些成为他进一步探究的动力所在。
(2)以学生为主体,教师是学生学习的高级合作者,是引导者、组织者、促进者。探究教学在实质上是一种模拟性的科学研究活动。具体说来它包括两个相互联系的方面:一是有一个以“学”为中心的探究学习环境。二是教师给学生提供必要的帮助和指导,使学生在探究中能明确方向。
在本次试验探究过程中,由于实验、讨论是以小组形式进行,可充分调动每个学生参与的积极性,比传统教学要求学生承担更多的管理任务,使他们真正成为自主的思考者和学习者,从而取得了良好的教学效果。endprint
