静脉注射大肠杆菌制备高动力型感染性休克犬模型
2017-09-27韩叶叶刘思伯
崔 嵩,韩叶叶,刘思伯
(大连医科大学附属大连市中心医院,重症医学科,辽宁 大连 116033)
研究报告
静脉注射大肠杆菌制备高动力型感染性休克犬模型
崔 嵩,韩叶叶,刘思伯
(大连医科大学附属大连市中心医院,重症医学科,辽宁 大连 116033)
目的通过静脉注射大肠杆菌方法制备高动力型感染性休克犬模型。方法杂种犬22只,随机分为对照组(n=11)和实验组(n=11)。麻醉犬后,经右股静脉置入双腔中心静脉导管,对照组使用微量泵向犬股静脉内泵入生理盐水,实验组以同样方法泵入大肠杆菌,经右股动脉置入PICCO导管,在0~48 h各时点应用PICCO监测全身血流动力学情况。结果实验组的心率(HR)、心排量(CO)、每搏量(SV)在12 h均显著升高(P< 0.05),收缩压(SBP)、外周血管阻力(SVR)在12 h显著降低(P< 0.05),而其他血流动力学指标如中心静脉压(CVP)、肺动脉楔压(PAWP)、氧输送(DO2)、氧消耗(VO2)、氧摄取率(O2ER)差异均无显著性(P> 0.05)。实验组从12 h起即可观察到明显的尿量减少;动脉收缩期峰值血流速度(PSV)和阻力指数(RI)与对照组相比差异均有显著性(P< 0.05)。结论运用微量泵向犬股静脉泵入活大肠杆菌可以成功制备高动力型感染性休克犬模型,可为研究感染性休克提供实验基础。
感染性休克;动物实验;犬;大肠杆菌;血流动力学
脓毒症是ICU中危重症患者的主要死亡原因之一,其血流动力学的复杂性使其治疗比其他类型的休克困难,因此,对其血流动力学的的病理生理学的研究也更显重要。本实验想要通过静脉注射活大肠杆菌的方法制备出脓毒症休克犬的动物模型,希望为研究脓毒症患者血流动力学改变提供理想的实验动物模型。
1 材料和方法
1.1实验动物
杂种雄性犬22只,1~2周岁成年犬,购自大连医科大学实验动物中心[SCXK(辽)2008-0002],随机分为2组,每组11只,体重18~20 kg,两组实验犬体重差异无显著性。实验前应用统一犬粮喂养1周[SYXK(辽)2008-0002],术前禁食12 h,禁水4 h。动物实验经由实验动物使用与管理委员会(IACUC)批准(AEE15003)。
1.2细菌制备
大肠杆菌菌株ATCC25922由大连医科大学微生物研究室提供,首次稀释菌株分于50支2.0 mL冻存管(Corning Incorporated公司,430659型号)内,每管内含有菌液0.2 mL和20%甘油0.8 mL,同一时间密封标记后置于-80℃深低温冰箱。每次取出1支冻存管,以保证每次实验注射用大肠埃希菌基因型和致病力相同。
培养基由3 g营养肉汤粉和1.8 g琼脂粉(天津市致远化学试剂有限公司)加蒸馏水至100 mL制成,高压蒸汽锅灭菌维持30 min。灭菌后,待培养基冷却后制成固体培养基。取1支含菌液冻存管,置于37℃水浴箱(上海医用恒温设备厂,WS2-261-79型号)内10 min进行细菌复苏。复苏后,用已灭菌接种棒蘸取适量菌液均匀涂布于各培养基表面。培养皿倒置于37℃恒温空气浴振荡器内培养12 h后取出各培养皿,分别用生理盐水洗脱表面菌落,收集于同一试剂瓶内。从试剂瓶内取少量菌液,采用稀释平板计数法计数,计算出原菌液中菌落形成单位(CFU/mL),稀释至1×109CFU/mL置于4℃冰箱内备用。1.3模型制备
1.3.1 麻醉及机械通气
戊巴比妥钠(购自美国Sigma公司)3 g溶解于97 mL生理盐水配置成3%浓度溶液。首剂麻醉使用1.5 mL/kg肌肉注射,之后以1~3 mL/h经微量注射泵(Fresenius Kabi公司,Injectmat型号)持续静脉泵入。待麻醉后将犬固定于动物解剖台上。经口气管插管,连接呼吸机(Drager Medical GmbH公司,Evita XL型号)辅助通气,初始呼吸参数设定:SIMV(容量控制),潮气量(tidal volume,VT)=8~10 mL/kg,吸入氧浓度(fraction of inspiration O2,FiO2)=30%~50%,呼气末正压(positive end expiratory pressure,PEEP)=0 mmHg,吸气时间1.2 s,呼吸频率(f)=15~20次/min。
1.3.2 动静脉置管,连接监护设备
颈部和腹股沟区备皮后常规消毒、铺无菌单,超声引导下分别行动、静脉穿刺置管。颈内静脉留置12 Fr三腔导管(Arrow International Inc公司,REF CS-12123-F型号)一枚,细腔连接压力传感器后与心电监护仪(GE Medical Systems Information Technologies Inc公司,TRAM-RAC 4A型号)连接用于监测中心静脉压(central venous pressure,CVP)。股静脉留置7 Fr双腔导管(Arrow International Inc公司,REF CV-17702-E型号)一枚,一腔用于连接PICCO注射液温度探头容纳管,另一腔作为输液和麻醉剂泵入通路。股动脉留置PICCO热稀释导管,通过压力传导系统与PICCO机器(Pulsion Medical Systems公司,PC 8100型号)连接,持续监测并记录收缩压(systolic blood pressure,SBP)、平均动脉压(mean arterial pressure,MAP)、心率(heart rate,HR)、心输出量(cardiac output,CO)、心指数(cardiac index,CI)、每搏量(stroke volume,SV)、每搏量指数(stroke volume index,SVI)、外周血管阻力(systemic vascular resistance,SVR)、外周血管阻力指数(systemic vascular resistance index,SVRI)、每搏量变化(stroke volume variation,SVV)、氧输送(oxygen delivery,DO2)、氧消耗(oxygen consumption,VO2)。脉氧夹固定于犬舌,连接心电监护仪,持续进行氧饱和度监测。
1.3.3 大肠杆菌注射
将犬固定于解剖台后,待心率及血压稳定(血压波动范围不超过±10 mmHg)30 min作为基线0 h。之后,对照组经股静脉以0.5 mL/(kg·h)持续泵入生理盐水至48 h后处死。实验组以同样速度泵入活大肠杆菌(E.coli,1×109CFU/mL),当出现感染性休克时(MAP ≤ 60 mmHg或者SBP < 90 mmHg)改为持续泵入生理盐水。每1 h记录尿量。每6 h校正PICCO,每次校正前关闭双腔管另一输液腔,通过注射液温度探头容纳管注射15 mL且温度小于8℃的生理盐水,3 s内注射完毕。
1.4全身血流动力学监测
通过心电监护仪及PICCO仪监测并记录48 h内SBP、MAP、HR、CO、SV、SVI、SVR、SVRI、SVV、CVP、DO2、VO2等血流动力学参数。
1.5肾脏血流动力学监测
每隔6 h使用彩色多普勒超声仪(color Doppler flow imaging,CDFI;深圳迈瑞生物医疗电子股份有限公司)分别测量右侧肾动脉(main renal artery,MRA)的动脉收缩期峰值血流速度(peak systolic velocity,PSV)和阻力指数(resitance index,RI),每次测量取连续3个波形均值。
1.6统计学方法

2 结果
2.1血流动力学改变
对照组和实验组犬的所有血流动力学指标在基线0 h差异均无显著性(P> 0.05)。实验组SBP在0 h为(169.01±12.50) mmHg,12 h时SBP出现明显降低,HR、CO明显升高并伴SVR的降低,呈现“高排低阻”血流动力学表现,和对照组相比差异有显著性(P< 0.05),在36 h时CO达到最大,并随着时间延长,CO和SVR都逐渐降低,逐渐呈现出“低排低阻”(表1)。其他血流动力学指标如CVP、肺动脉楔压(pulmonary artery wedge pressure,PAWP)、DO2、VO2、氧摄取率(oxygen extraction rate,O2ER)与对照组相比差异均无显著性(P> 0.05)。

表1 对照组和实验组血流动力学参数的对比分析
2.2心输出量与肾血流动力学关系
实验组12 h即可出现PSV的增加,36 h达最大,而RI在12 h即可见明显减少,与对照组相比,差异有显著性(P< 0.05)。PSV与CO呈正相关(回归方程为Y=0.642 + 0.005X,R2=0.785,P< 0.01)(图1),PSV随CO增加而增加。RI与CO呈负相关(回归方程为Y=4.013-1.836X,R2=0.812,P< 0.01)(图2),RI随CO增加而减少。

图1 PSV与CO的相关性Fig.1 Correlation between PSV and CO
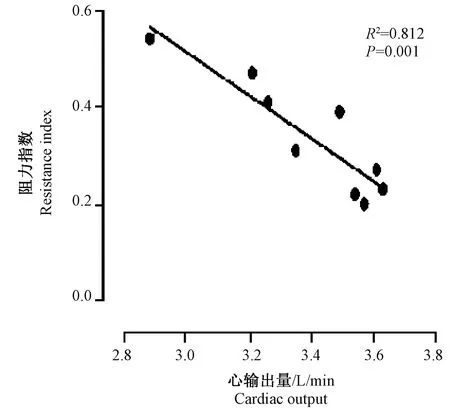
图2 RI与CO的相关性Fig.2 Correlation between RI and CO

图3 高动力型感染性休克犬模型Fig.3 The dog model of hyperdynamic septic shock
3 讨论
脓毒症是重症监护病房的主要死亡原因之一[1, 2]。一项来自高收入国家的流行病学资料显示,从2008年到2012年脓毒症患病人数从346/10万上升到436/10万[3],全球脓毒症患病人数估计约3150万,严重脓毒症约1940万,脓毒症死亡人数约530万[4],一项来自法国的ICU的流行病学资料显示脓毒症休克的病死率高达45%,因此,脓毒症的高发病率及病死率使其成为研究的热门[5]。2016年第三次国际共识(Sepsis 3.0)定义脓毒症为“严重感染引起的宿主反应失调(失控的炎症反应)导致的致命性器官功能障碍”[2]。Giantomasso[6, 7]认为血流动力学的改变参与多器官功能障碍的发展,是患者死亡的主要原因。临床上,脓毒症休克可根据血流动力学特点分为高排-低阻(暖休克)和低排-低阻(冷休克)两种类型。
目前存在多种脓毒症休克动物模型制备方法,较公认的感染性休克模型制备方法有内毒素(lipopolysaccharide,LPS)诱导、活菌注射、盲肠结扎穿孔等,选择物种包括兔子、鼠、猪等,各种模型都包含了循环系统、组织代谢、激素反应等方面指标的改变[8, 9]。本实验通过股静脉注射活菌的方法制备感染性休克模型,模拟临床上感染早起最常见的“高动力”休克模型,实验组CO在12~36 h各时间点分别出现不同程度的上升,而SBP和SVR在12~48 h各时间点分别出现不同程度的下降,显示高动力循环感染性休克模型制备成功。我们同时还发现PSV与CO呈正相关,RI与CO呈负相关,这与最新研究高动力型感染性休克时肾血流量增加、肾血管阻力下降一致[10]。
运用微量泵向犬静脉内泵入活大肠杆菌制备高动力型感染性休克犬模型,结果符合临床上感染性休克早期高动力型血流动力学表现,可以很好地模拟临床情况,为更加准确地研究感染性休克病理生理变化提供了理想的实验动物模型。
[1] Gullo A, Foti A, Murabito P, et al. Spectrum of sepsis, mediators, source control and management of bundles [J]. Front Biosci, 2010, 2: 906-911.
[2] Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3) [J]. JAMA, 2016, 315(8): 801-810.
[3] Stoller J, Halpin L, Weis M, et al. Epidemiology of severe sepsis: 2008-2012 [J]. J Crit Care, 2016, 31(1): 58-62.
[4] Fleischmann C, Scherag A, Adhikari NK, et al. Assessment of global incidence and mortality of hospital-treated sepsis. Current estimates and limitations [J]. Am J Respir Crit Care Med, 2016, 193(3): 259-272.
[5] Lygidakis NJ, Jain S, Sacchi M, et al. Reappraisal of a method of reconstruction after pancreatoduodenectomy [J]. Hepatogastroenterology, 2005, 52(64): 1077-1082.
[6] Garrido AG, Poli de Figueiredo LF, Rocha e Silva M. Experimental models of sepsis and septic shock: an overview [J]. Acta Cir Bras, 2004, 19(2): 82-88.
[7] Di Giantomasso D, May CN, Bellomo, R. Vital organ blood flow during hyperdynamic sepsis [J]. Chest, 2003, 124(3): 1053-1059.
[8] Hollenberg SM, Dumasius A, Easington C, et al. Characterization of a hyperdynamic murine model of resuscitated sepsis using echocardiography [J]. Am J Respir Crit Care Med, 2001, 164(5): 891-895.
[9] Karzai W, Cui X, Mehlhorn B, et al. Protection with antibody to tumor necrosis factor differs with similarly lethalEscherichiacoliversusStaphylococcusaureuspneumonia in rats [J]. Anesthesio-logy, 2003, 99(1): 81-89.
[10] Wan L, Bagshaw SM, Langenberg C, et al. Pathophysiology of septic acute kidney injury: What do we really know? [J]. Crit Care Med, 2008, 36(4 Suppl): S198-S203.
EstablishmentofadogmodelofhyperdynamicsepticshockbyintravenousinjectionofEscherichiacoli
CUI Song, HAN Ye-ye, LIU Si-bo
(Department of Intensive Care Medicine, Dalian Municipal Central Hospital Affiliated of Dalian Medical University, Dalian 116033, China)
ObjectiveTo establish a dog model of hyperdynamic septic shock by intravenous injection ofEscherichiacoli.MethodsTwenty-two hybrid dogs were randomly divided into control group (n=11) and experimental group (n=11). A double-cavity central venous catheter was inserted into the right femoral vein of the dogs after anesthesia. Physiological saline was continuously pumped into the femoral vein of the dogs in the control group by the micro-pump, while the dogs of the septic shock group were pumped withE.coliin the same way. The catheter of PICCO (pulse indicator continuous cardiac output) was inserted into the right femoral artery and the systemic hemodynamics of the dogs was monitored at all of the time points from 0 to 48 h.ResultsCompared with the control group, the heart rate (HR), cardiac output (CO) and stroke volume (SV) of the experimental group were significantly increased at 12 h (P< 0.05), and the systolic blood pressure (SBP) and systemic vascular resistance (SVR) were significantly decreased at 12 h (P< 0.05). However, other hemodynamic parameters such as the central venous pressure (CVP), the pulmonary artery wedge pressure (PAWP), the oxygen delivery rate (DO2), the oxygen consumption rate (VO2), and the oxygen extraction rate (O2ER) were not significantly different (P> 0.05). Moreover, significant decrease in urine output was observed in the septic shock group since 12 hours, and the peak systolic velocity (PSV) and the resistance index (RI) of the systolic artery were significantly different from those in the control group (P< 0.05).ConclusionsThe dog model of hyperdynammic septic shock can be successfully established by intravenous injection ofEscherichiacoliinto the femoral vein by a micro-pump. This model provides an experimental basis for further study of septic shock.
Septic shock; Animal experiments; Canine;Escherichiacoli; Hemodynamics
R-33
A
1671-7856(2017) 09-0048-05
10.3969.j.issn.1671-7856. 2017.09.009
2017-01-20
大连市卫计委2013年课题项目(课题名称:《亚低温治疗感染性休克所致ARDS的实验研究》)。
崔嵩(1978-),男,副主任医师。E-mail: cuisong2008@qq.com
