水稻对穗枯病的抗病机理初步研究
2017-09-23李路徐以华梁梦琦王玲刘连盟侯雨萱黎起秦黄世文
李路 徐以华梁梦琦王玲刘连盟侯雨萱 黎起秦黄世文,*
(1广西大学 农学院,南宁 530003;2中国水稻研究所,杭州 310006;*通讯联系人,E-mail:qqli5806@gxu.edu.cn;huangshiwen@caas.cn)
水稻对穗枯病的抗病机理初步研究
李路1,2徐以华1,2梁梦琦2王玲2刘连盟2侯雨萱2黎起秦1,*黄世文1,2,*
(1广西大学 农学院,南宁 530003;2中国水稻研究所,杭州 310006;*通讯联系人,E-mail:qqli5806@gxu.edu.cn;huangshiwen@caas.cn)
【目的】水稻在孕穗期比苗期更容易感染穗枯病(Bacterial panicle blight of rice)并出现病症。本研究旨在探究水稻不同时期对穗枯病的抗性机理,为培育抗病水稻品种奠定基础。【方法】采用喷雾法和注射法分别对苗期和孕穗期的抗、感病水稻品种接种颖壳伯克氏菌(Burkholderia glumae),测定处理组与对照组的3种抗氧化酶(POD、CAT、SOD)活性的差异,并利用实时荧光定量PCR测定5种防卫反应基因(PR1a、PR10b、Rcht、LOX、PAL)的表达量。【结果】B. glumae的侵染能引起水稻活性氧的积累,提高抗氧化酶活性,使部分防卫反应基因大量表达,但是苗期和孕穗期的应答有较大区别。水稻孕穗期的抗氧化酶(SOD、CAT和POD)活性和防卫反应基因(PR10b、Rcht和PAL)的表达量比苗期高,但PR1a和LOX的表达量却低于苗期。【结论】B. glumae能诱导孕穗期的水稻产生更多抗病反应,参与抗病反应的主要是水杨酸信号传导途径。
水稻;穗枯病;抗氧化酶;防卫反应基因;实时荧光定量PCR
水稻穗枯病(Bacterial panicle blight of rice,BPBR)又称水稻细菌性谷枯病(Bacterial grain rot of rice),由Goto等[1]于1956年在日本发现,随后在亚洲、南北美洲和非洲的20多个国家和地区均有报道[2],可造成水稻大幅减产。2007年,水稻穗枯病被我国列为检疫性病害[3],但近几年水稻穗枯病的发生越来越严重[4]。颖壳伯克氏菌(Burkholderia glumae)是穗枯病的病原菌,在水稻苗期和穗期分别引起水稻烂秧、谷粒变色和稻穗枯死[4]。当病原菌群体数量不大时,被侵染的苗期水稻不会表现明显的病症,病原菌潜伏在稻株内,到孕穗期才爆发,引起稻穗枯死,但少量病原菌侵染稻穗,却可以迅速引起谷粒变色[5]。同一种病原菌在寄主不同生长期侵染不同部位,以及寄主在不同生长期的抗性差异还鲜有报道。
植物在抵御病原菌侵染时能产生并积累活性院所基本科研业务费专项(2014RG005-2);浙江省三农六方项目(CTZB-F160728AWZ-SNY1-4)。氧(reactive oxygen species,ROS)。过多的ROS使植物体内产生氧化胁迫,导致细胞膜脂质的过氧化,蛋白质、色素、酶、核酸的氧化损伤,甚至植物死亡[6]。植物本身的防御机制,如一些酶促反应对ROS的累积进行清除,使ROS处于低水平的动态平衡,以此来维持植物的正常形态[7]。其中,超氧化物歧化酶(superoxide dismutase,SOD)可将超氧阴离子自由基(O2·-)歧化成H2O2和O2,过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)催化H2O2向H2O的转化[8-9]。POD还是木质素合成的关键酶,它参与木质素的合成,促进伤口愈合,参与富含羟脯氨酸糖蛋白(HRGP)结构的形成和将酚类物质氧化为醌,增强植株对病原菌的抗性[10]。
防卫反应基因在植物体内快速累积和大量表达是植物抵抗病原菌侵染的必要条件。防卫反应相关基因主要包括与植保素合成相关基因(如苯丙氨酸解氨酶基因PAL、脂氧合酶合成基因LOX)、病程相关基因(如几丁质酶基因Rcht、PR1酸性蛋白基因PR1a、类似核糖核酸酶基因PR10b)、与结构抗性有关的基因(木质素合成有关基因)、核糖体失活蛋白(RIP)基因等。其产物直接作用于病原菌,限制病原的扩展、增殖和对寄主的破坏[11]。病程相关基因(PR基因)的表达是一种广谱、非专性的抗性[12]。PR基因的诱导和表达与植物信号传导途径的启动有关。目前研究较多的有茉莉酸(jasmonic acid, JA)信号传导途径和水杨酸(salicylic acid, SA)信号传导途径。JA途径是亚麻酸通过脂氧合酶(lipoxygenase, LOX)等酶的反应生成茉莉酸甲酯。SA途径源于苯丙烷类代谢途径,苯丙氨酸解氨酶(phenylalanine ammonialyase, PAL)是与苯丙烷代谢酶途径相关的关键酶[13],PAL活性增强则进一步促进植物内源SA的合成[14]。PAL还参与木质素、植保素和酚类化合物的合成,与植物抗病性有密切联系[15]。
本研究选用高感穗枯病和中抗水稻品种,通过喷雾法接种幼苗以及注射法接种幼穗,测定了受病原菌侵染后,苗期和穗期的水稻植株抗氧化酶的活性,以及防卫反应基因的表达变化,初步探讨了水稻不同时期对穗枯病的抗病机理差异。
1 材料与方法
1.1 供试材料与培养
1.1.1 水稻材料和菌种来源
经两年的接种鉴定,我们筛选出对穗枯病表现中抗的水稻品种鄂宜105以及高感品种辐恢838。所用水稻种子由国家水稻种质资源中期库提供。LMG2196(B.glumae)由浙江大学谢关林教授提供。
1.1.2 水稻秧苗培育及种植
水稻种子用3 %过氧化氢消毒24 h,灭菌水浸泡24 h后催芽。播种到含有灭菌土的塑料盒(18 cm×14 cm×12cm)中,置温室(30℃)中培养。需长至穗期的水稻在苗龄25 d左右进行移栽。
1.1.3 菌悬液配制
将已活化的菌株接种至LB液体培养基中28℃下振荡培养18 h,此时LMG2196处于生长对数期。4000 r/min下将菌体离心至管底,加0.9%灭菌生理盐水稀释,用分光光度计(UnicoUV-4802,中国)调菌液浓度至7×108CFU·mL-1(OD600= 0.517)。
1.2 接种及取样
1.2.1 喷雾接种
于水稻2叶期,将浓度7×108CFU·mL-1的菌悬液均匀喷施在水稻叶片上,以喷施等体积生理盐水的水稻为对照。
1.2.2 注射接种
水稻孕穗期时,用5 mL注射器将浓度7×108CFU·mL-1的菌悬液注射进穗苞,至穗苞顶部有菌悬液溢出,以注射等体积生理盐水的水稻为对照。
1.2.3 取样
试验设8个时间点取样,分别为接种后0、6、12、24、48、72、96和120 h。水稻苗期取茎叶,孕穗期取幼穗。样品取完后放液氮速冻,置-80℃下保存。
1.3 抗氧化酶活性测定
1.3.1 酶液的制备
称取0.1 g样品,加0.9 mL灭菌生理盐水,冰浴匀浆后,4℃、2500 r/min下离心10 min,取上清备用。
1.3.2 过氧化物酶(POD)活性的测定
用POD测定试剂盒(南京建成生物工程研究所,中国)测定样品中POD的活性。利用POD催化H2O2反应的原理,用分光光度计(UnicoUV-4802,中国)测定420 nm处的OD值,根据以下公式计算POD活性:
POD活性(U/mg)=(A测定管-A空白管)/(12×样品蛋白浓度) ×4000/3
1.3.3 过氧化氢酶(CAT)活性的测定
用CAT测定试剂盒(南京建成生物工程研究所,中国)测定样品中CAT的活性。CAT分解H2O2可被H8MoN2O4迅速中止,剩余的H2O2与H8MoN2O4产生淡黄色络合物,测定其在405 nm处的OD值,根据以下公式计算CAT的活性。

表1 荧光定量PCR的引物Table 1. Specific primers for real-time PCR
CAT活力(U/mg)=(A对照管-A测定管)/60×271/(取样量×样品蛋白浓度)
1.3.4 超氧化物歧化酶(SOD)活性的测定
用SOD测定试剂盒(南京建成生物工程研究所,中国)测定样品中SOD的活性。O2·-氧化羟胺形成亚硝酸盐,加入显色剂后呈现紫红色。测定其在550 nm处的吸光值,根据以下公式计算总SOD活力。
总SOD活力(U/mg)=2×(A对照管-A测定管)/ A对照管×反应液总体积/(取样量×样品蛋白浓度)
1.4 防卫基因表达量分析
1.4.1 RNA提取及检测
采用Trizol法提取叶片的总RNA[16]。叶片用液氮研磨后加入1 mL的Trizol(Invitrogen,美国)混匀,12 000 r/min、4℃下离心5 min,取上清加500 μL氯仿混匀,12 000 r/min、4℃下离心15 min,取上清加入500 μL异丙醇混匀,12 000 r/min、4℃下离心10 min,弃上清,加入1 mL 80 %乙醇(-80℃提前预冷)混匀,12 000 r/min、4℃下离心2 min,弃乙醇,加入适量 DEPC ddH2O溶解。取1 μL用Nanodrop 2000(ThermoScientific,美国)测定RNA的浓度。剩余RNA 保存于-80℃下备用。
1.4.2 cDNA合成
根据反转录试剂盒说明书(ReverTra Ace qPCR RT Master Mix with gDNA Remover kit, ToYoBo,日本)的步骤,将总RNA加DEPC水至12 μL,65℃下变性后放冰上冷却2 min,加4 μL 4倍浓度的降解预混液(4× DNA Master Mix)与基因组DNA清除剂(gDNA Remover)的混合物,37℃下放置15 min,去除总RNA中的gDNA,加4 μL 5倍浓度的反转录预混液(5×RT Master Mix Ⅱ),37℃下放置15 min,50℃下放置5 min,最后98℃下放置5 min。
1.4.3 目的基因的实时PCR扩增
试验所用的引物列在表1,其中泛素基因(Ubq)为内参基因。PCR扩增反应体系为20 μL,其中包括1 μL模板,10 μL 2倍浓度的SYBR Green染色法PCR预混液( 2×SYBR Green PCR Master Mix, VazymeAceQTM,中国),0.2 μL引物(10 μmol/L)和8.6 μL ddH2O。扩增条件如下:95℃下5 min;95℃下5 s,55℃/58℃ 下10 s,72℃下15 s,40个循环。扩增结束后,Bio-Rad FX96荧光定量PCR(Bio-Rad,德国)自动显示Ct值。
1.4.4 数据分析
水稻苗期以未接种病原菌的处理(-Bg)为对照,采用相对定量2-△△Ct法[17]计算接种病原菌处理(+Bg)中各基因的相对表达量。孕穗期以苗期表达量为对照,计算孕穗期相对苗期的各基因表达量变化。取3个重复的平均值计算样品和对照处理的差异表达比率。
2 结果与分析
2.1 苗期和穗期不同抗性水稻品种抗氧化酶的活性
2.1.1 POD的活性
接种病原菌后,两个水稻品种的POD活性总体高于同期对照。苗期,非亲和反应比亲和反应的POD活性更强且相对于对照的净增加值也更大。非亲和反应在接种6 h和96 h有两次高峰,而亲和反应只在6 h有最高峰(图1-A)。水稻孕穗期的POD活性高于苗期,亲和反应与非亲和反应的POD在接种后24 h有最高活性,非亲和反应在72 h后有上升趋势(图1-B)。说明水稻孕穗期的POD活性净增加量高于苗期,非亲和反应中的POD活性高于亲和反应。
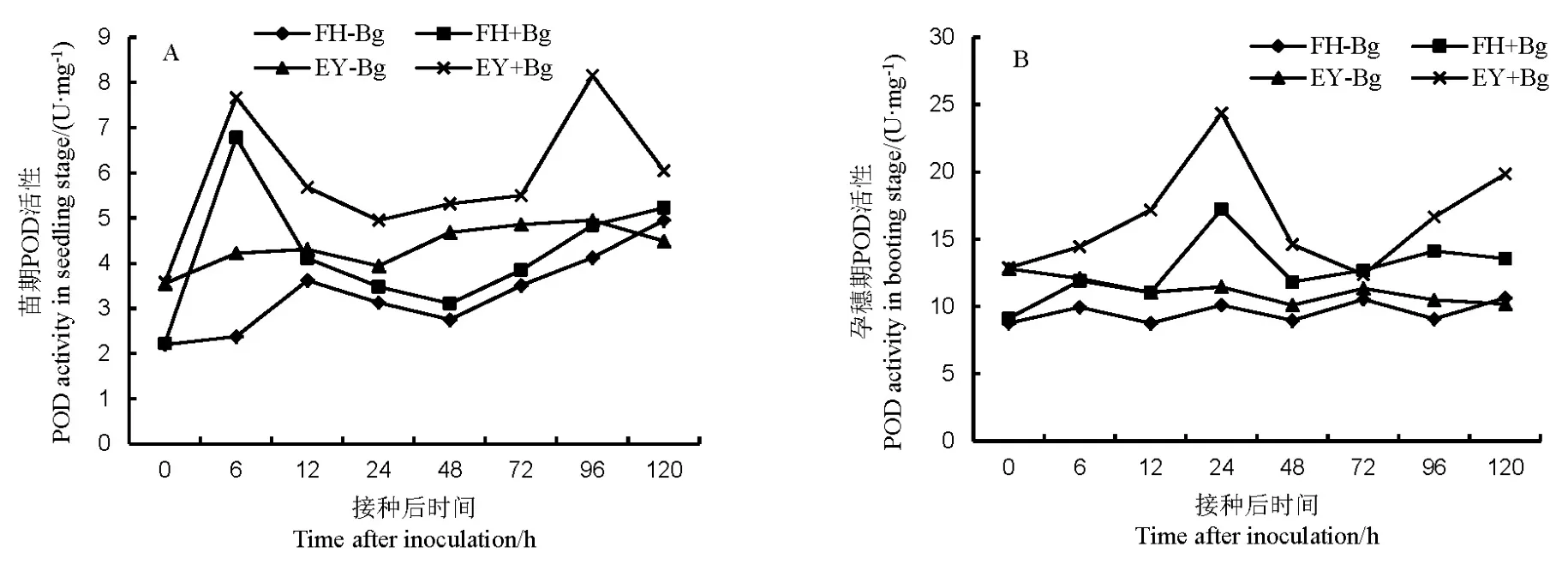
图1 不同抗性水稻品种中过氧化物酶(POD)的活性Fig. 1. Activity of peroxidase(POD) in rice varieties with different resistance to bacterial panicle blight.
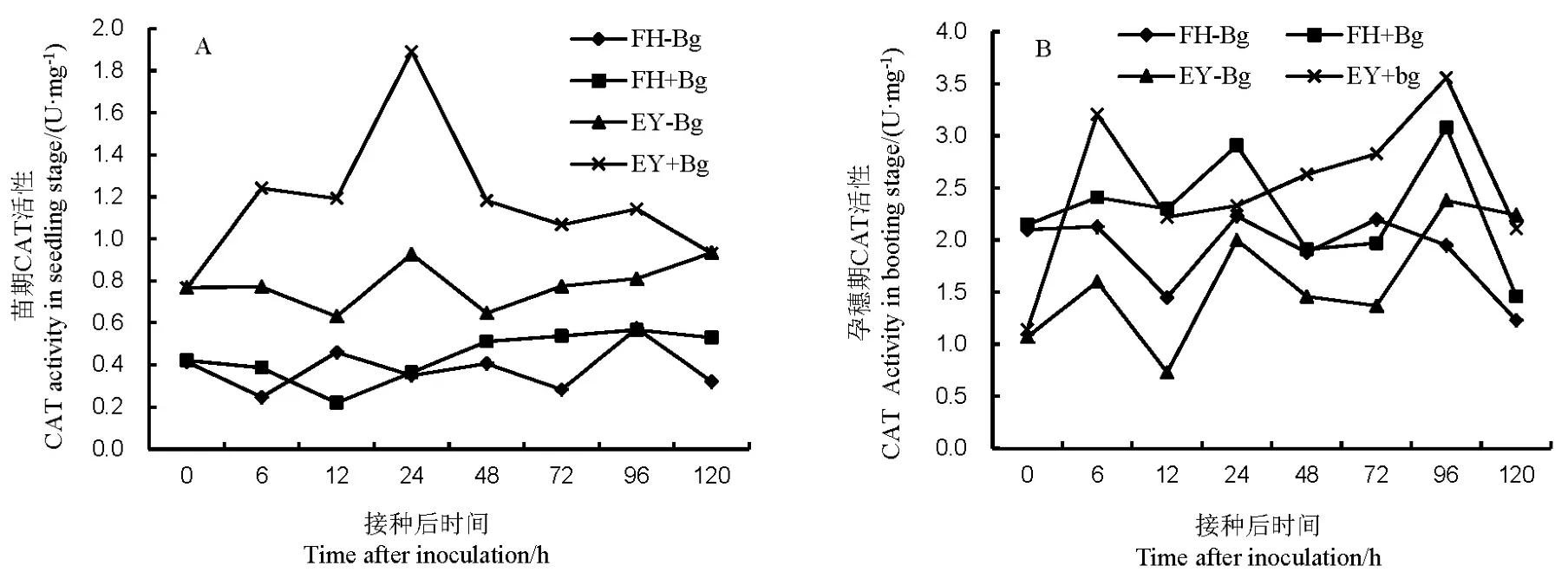
图2 不同抗性水稻品种中过氧化氢酶(CAT)的活性Fig. 2. Activity of catalase(CAT) in rice varieties with different resistance to bacterial panicle blight.
2.1.2 CAT的活性
接种B. glumae后,水稻苗期和孕穗期的CAT活性都处于低水平,非亲和反应中的活性更高,净增加值更大。苗期接种后,非亲和反应的CAT活力在24 h有最高峰,亲和反应相比对照的增幅不大(图2-A)。在孕穗期接种后,非亲和反应在6 h和96 h有较高活性,亲和反应在24 h和96 h的活性较高,但增长量小于非亲和反应(图2-B)。说明非亲和反应中CAT活性的增强比亲和反应更快,净增加量更高;水稻孕穗期的CAT活性高于苗期。
2.1.3 SOD的活性
苗期接种后,两个水稻品种的SOD活性均在6~12 h较高,此后亲和反应的变化与对照相似,而非亲和反应在48~120 h中高于对照(图3-A)。孕穗期接种后,亲和反应的SOD在72 h有最大活性,非亲和反应在24 h活性最高,并从72 h开始呈上升趋势(图3-B)。说明非亲和反应中的SOD活性上升速度更快,净增加量也高于亲和反应;水稻孕穗期的SOD净增加量高于苗期。
2.2 苗期和穗期不同抗性水稻品种防卫基因的表达2.2.1 PR1a的表达量
苗期接种后,非亲和反应的PR1a在接种后6~12 h的表达量均为对照的1.5倍以上,而亲和反应在病原菌侵染前期都处于低水平,120 h才约为对照1.7倍。孕穗期接种后,非亲和反应与亲和反应的PR1a均为下调表达(图4)。说明苗期的非亲和反应比亲和反应中PR1a的表达量更高,表达时间更早;B. glumae的侵染对PR1a的诱导作用不大。

图3 不同抗性水稻品种中超氧化物歧化酶(SOD)的活性Fig. 3. Activity of superoxide dismutase(SOD) in rice varieties with different resistance to bacterial panicle blight.

图4 不同抗性水稻品种中PR1a相对表达量Fig. 4. Relative expression of PR1a in rice varieties with different resistance to bacterial panicle blight.

图5 不同抗性水稻品种中PR10b相对表达量Fig. 5. Relative expression of PR10b in rice varieties with different resistance to bacterial panicle blight.
2.2.2 PR10b的表达量
苗期接种后,非亲和反应的PR10b在6 h表达量约为对照的9倍,在24~48 h和96 h也有很高的表达;而亲和反应在12 h和120 h约为对照1.8倍。孕穗期接种后,非亲和反应的PR10b在6~96 h比苗期有更高的表达量;亲和反应在6~72 h的表达也高于苗期(图5)。以上结果说明,B. glumae的侵染能诱导水稻PR10b的大量表达,且孕穗期的表达量高于苗期;非亲和反应比亲和反应中PR10b的表达量更高且表达时间更早。
2.2.3 Rcht的表达量
苗期接种后,非亲和反应中Rcht在6~12 h的表达量是对照的2.31~3.78倍,而亲和反应在72~96 h才有高水平表达。孕穗期接种后,非亲和反应中Rcht在6~24 h和72~120 h的表达均高于苗期,而亲和反应仅在6 h和96 h有约为苗期2倍的表达量(图6)。可见,B. glumae与水稻互作时能诱导Rcht的大量表达,其表达量与水稻品种和生长时期有关,非亲和反应比亲和反应的Rcht表达量更高且表达时间更早,水稻孕穗期的表达量高于苗期。
2.2.4 LOX的表达量
苗期接种后,非亲和反应的LOX在接种24 h后有对照1.86倍的表达量;亲和反应在接种后6 h的表达量为对照的1.53倍。两个组合中的LOX在孕穗期的表达都显著低于苗期(图7)。说明B. glumae不能通过诱导LOX的表达来启动水稻的JA信号传导途径。
2.2.5 PAL的表达量
苗期接种后,非亲和反应的PAL的表达量与对照相似;但亲和反应在24和72 h的表达量分别为对照1.63和1.58倍。孕穗期接种后,PAL的表达量显著高于苗期。非亲和反应中PAL的表达在0~96 h均显著高于苗期;亲和反应中PAL在0~24和96 h也有很高表达,但表达量小于非亲和反应(图8)。可见,孕穗期的PAL在两个水稻品种中都有很高的表达,且非亲和反应的表达量高于亲和反应。可推断PAL参与的SA信号传导途径在水稻孕穗期抵抗B. glumae的侵染中有重要作用。

图6 不同抗性水稻品种中Rcht相对表达量Fig. 6. Relative expression of Rcht in rice varieties with different resistance to bacterial panicle blight.
3 讨论
植物体内的抗氧化性酶主要由SOD、CAT和POD等组成,SOD清除O2·-、POD和CAT都能分解H2O2,酶活较低时,植物大量积累O2·-,与H2O2发生Harber-Weiss反应,产生更具毒性的·OH,引起膜脂过氧化反应,从而使寄主表现病症[18-19]。由于寄主与病原物的不同组合,植物的抗病机制会有所差异[20]。在稻瘟菌(Magnaporthe grisea)与水稻互作过程中,POD的活性与抗稻瘟病的能力正相关,但其他酶的作用说法不一。宋海超等[20]提出,早期的SOD和CAT活性与抗稻瘟病的能力呈负相关。而葛秀春等[21]的结果表明SOD和CAT活性与对照相似。杨民和等[22]对稻瘟菌(M. grisea)侵染的水稻组织中的CAT进行了定位观察,发现CAT主要产生于细胞壁、细胞质和囊泡膜上,并且非亲和性互作中的累积量更高。植物在生长过程中,各种酶的活性都是动态变化的,并且不同生育期的水稻抗氧化酶活性也有差异[15]。本研究以未接种病原菌的水稻作为对照,排除了水稻自身氧化酶表达变化的影响。研究发现,POD、SOD和CAT在非亲和反应中的净增加量高于亲和反应,并且水稻孕穗期的活性更高。各类酶在水稻苗期出现的最高值时间与水稻品种无关,但SOD和CAT在孕穗期的非亲和反应中上升速度更快。因此,推测水稻孕穗期的抗病反应比苗期更强,抗病品种与感病品种的抗病性差异在孕穗期更为明显。

图7 不同抗性水稻品种中LOX相对表达量Fig. 7. Relative expression of LOX in rice varieties with different resistance to bacterial panicle blight.
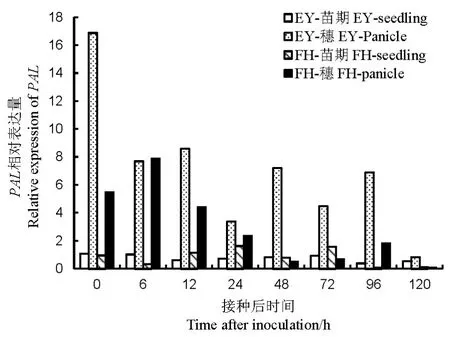
图8 不同抗性水稻品种中PAL相对表达量Fig. 8. Relative expression of PAL in rice varieties with different resistance to bacterial panicle blight.
本研究中,CAT的活性在接种病原菌后的增量并不高。Baker等[9]报道,细胞中H2O2水平很低时,CAT的清除能力也很低。因此对两个时期接种后的水稻H2O2水平进行测试,发现两个时期的H2O2含量均处于低水平,且孕穗期的H2O2含量比苗期高,非亲和反应高于亲和反应(数据未发表)。推测CAT的低活性可能是因为水稻体内H2O2的含量不够高。
稻瘟病菌(M. grisea)侵染后,水稻的LOX和PAL都能高度表达,因此JA和SA信号传导途径能迅速启动[13],而细条病菌(Xanthomonas. oryzae pv. oryzicola)侵染后的水稻只能启动JA信号途径[23]。本研究发现,JA途径的关键酶脂氧合酶的基因表达量非常低,而SA途径的关键酶苯丙氨酸解氨酶的基因表达量非常高,这个现象在孕穗期尤其明显。因此,推测SA途径是水稻抵御颖壳伯克氏菌(B. glumae)侵染的过程中的主要信号传导途径。但B. glumae侵染后的水稻是否能通过其他通路诱导启动JA途径还需要更多研究去证实。据报道,SA与具有CAT活性的蛋白(SABP)结合能抑制CAT活性,使其失去催化H2O2的能力[24]。这可能是本研究中CAT活性较低的另一个原因。
与其他寄主与病原菌互作过程相似,B. glumae侵染水稻后,PR基因能不同程度地被诱导表达来激活防御反应,非亲和反应中的表达水平高于亲和反应,并且表达时序也有差异。B. glumae能诱导PR10b和Rcht的显著上调表达,但对PR1a的诱导作用不大。说明水稻与B. glumae互作的前期,不是所有抗病基因都能被诱导表达。但前期未表达的基因能否在后期被诱导,还需要进一步验证。
在寄主与病原互作时,植物的生长与其抗病性的关联性还不清楚[25]。Hugot等[26]报道,烟草被霜霉(Peronospora tabacina)侵染时,其抗性从营养期到生殖期表现出增加的趋势。Kus[27]研究发现,成熟的拟南芥植株比幼苗对丁香假单胞菌(Pseudomonas syringae)的抗性更强,但是Chen等[28]的试验没有发现这个差异。本研究中,水稻孕穗期的抗病性比苗期更强,这个现象可能与植物不同生育期的抗病性有关,也可能与B. glumae的侵染方式有关。据报道,水稻孕穗期之前,若病原菌群体数量不大,B. glumae侵入稻株后可以潜伏在水稻体内,对水稻不会造成较大伤害,但在孕穗期开始急剧增殖并对寄主造成毁灭性破坏[5]。说明病原菌的群体数量或者群体感应对寄主的抗病性有重要作用。因此,不同时期的水稻对穗枯病的抗性差异可能与B. glumae的侵染方式有关。水稻苗期抗穗枯病而穗期感病的机制揭示,对培育抗穗枯病的水稻材料具有科学借鉴意义。
[1] Goto K, Ohata K. New bacterial diseases of rice (brown stripe and grain rot). Ann Phytopathol Soc Japan, 1956, 21: 46-47.
[2] CABI/EPPO. Distribution Maps of Plant Diseases, No.732. Wallingford, 2013, UK: CAB International.
[3] 罗金燕, 徐福寿, 王平, 徐丽慧, 谢关林. 水稻细菌性谷枯病病原菌的分离鉴定. 中国水稻科学, 2008, 22(1): 82-86. Luo J Y, Xu F S, Wang P, Xu L H, Xie G L. Isolation and identification of the causal organism of bacterial grain rot from rice. Chin J Rice Sci, 2008, 22(1): 82-86 (in Chinese with English abstract)
[4] 李路, 刘连盟, 王国荣, 汪爱娟, 王玲, 孙磊, 黎起秦,黄世文. 水稻穗腐病和穗枯病的研究进展. 中国水稻科学, 2015, 29(2): 215-222. Li L, Liu L M, Wang G R, Wang A J, Wang L, Sun L, Li Q Q, Huang S W. Research progress of spikelet rot disease and bacterial panicle blight of rice. Chin J Rice Sci, 2015, 29(2): 215-222 (in Chinese with English abstract)
[5] Li L, Wang L, Liu L M, Hou Y X, Huang S W, Li Q Q. Infection process of Burkholderia glumae before booting stage of rice. J Phytopathol, 2016, 164: 825-832.
[6] 何俊瑜, 任艳芳, 朱诚期, 蒋德安. 镉胁迫对镉敏感水稻突变体活性氧代谢及抗氧化酶活性的影响. 生态环境学报, 2008, (3): 1004-1008. He J Y, Ren Y F, Zhu C Q, Jiang D A. Effects of cadmium stress on reactive oxygen species metabolism and antioxidant enzyme activities in Cd-sensitive mutant rice seedlings. Ecol Environ Sci, 2008, (3): 1004-1008. (in Chinese with English abstract)
[7] 宋凤鸣, 郑重, 葛秀春. 活性氧及膜脂过氧化在植物-病原物互作中的作用. 植物生理学通讯, 1996, 32(5): 377-385. Song F M, Zheng Z, Ge X C. Role of active oxygen and membrane lipid peroxidation in plant-pathogen interactions. Plant Physiol Comm, 1996, 32(5): 377-385 (in Chinese with English abstract)
[8] 王娟, 李德全. 逆境条件下植物体内渗透调节物质的积累与活性氧代谢. 植物学通报, 2001, 18(4): 459-465. Wang J, Li D Q. The accumulation of plant osmoticum and activated oxygen metabolism under stress. Chinese Bull Bot, 2001, 18(4): 459-465 (in Chinese with English abstract)
[9] Baker C J, Orlandi E W. Active oxygen in plant pathogenesis. Ann Rev Phytopathol, 1995, 33: 299-321.
[10] Christensen J H, Boerjan W. Purification and characterization of peroxidases correlated with lignification in poplar xylem. Plant Physiol, 1998, 118(1):125-135.
[11] 赵长江. 纹枯病菌侵染后水稻防御反应相关基因的表达分析. 福州:福建农林大学, 2005. Zhao C J. Defense gene expression analysis on infection process of rice sheath blight. Fuzhou: Fujian Agriculture and Forestry University, 2005 (in Chinese with English abstract)
[12] Ponciano G, Yoshikawa M, Lee J L, Ronald P C, Whalen M C. Pathogenesis-related gene expression in rice is correlated with developmentally controlled Xa21 -mediated resistance against Xanthomonas oryzae pv. oryzae. Physiol Molecul Plant Pathol, 2006, 69:131-139.
[13] 乐关旺, 陈实, 潘庆华, 曾任森, 刘迎湖, 骆世明. 水稻和稻瘟病菌互作中的信号传导及防御反应基因诱导表达的研究. 植物病理学报, 2007, 37(1): 42-49. Le G W, Chen S, Pan Q H, Zeng R S, Liu Y H, Luo S M. Induced expression of signaling pathway and related genes in interaction between rice and Magnaporthe grisea. Acta Phytopathol Sin, 2007, 37(1): 42-49 (in Chinese with English abstract)
[14] 余朝阁, 李天来, 杜妍妍, 周娣, 魏爽. 植物诱导抗病信号传导途径. 植物保护, 2008, 34(1): 1-4. Yu C G, Li T L, Du Y Y, Zhou D, Wei S. Signaling pathways in plant-induced resistance. Plant Prot, 2008, 34(1): 1-4 (in Chinese with English abstract)
[15] 于方明, 刘可慧, 刘华, 邓华, 周振明, 陈朝述, 李明顺. 镉污染对水稻不同生育期抗氧化系统的影响. 生态环境学报, 2012, 21(1):88-93. Yu F M, Liu K H, Liu H, Deng H, Zhou Z M, Chen Z S, Li M S. Antioxidative responses to cadmium stress in the leaves of Oryza saliva L. in different growth period. Ecol Environ Sci, 2012, 21(1):88-93 (in Chinese with English abstract)
[16] 李思未, 罗桂花, 乔枫, 王法军, 赵开军, 王春连. 白叶枯病菌 PX099 对 CBB23 抗氧化酶活性和防御基因表达的影响.应用与环境生物学报, 2013, 19(6): 980-985. Li S W, Luo G H, Qiao F, Wang F J, Zhao K J, Wang C L. Influence of Xanthomonas oryzae pv. oryzae PX099 inoculation on antioxidant enzyme activity and defense gene expression in CBB23. Chin J Appl Environ Biology, 2013, 19(6): 980-985 (in Chinese with English abstract)
[17] 范锃岚. 硅对不同抗感纹枯病水稻品种的生理生化和分子机制影响. 南宁:广西大学, 2012. Fan Z L. Effect of silicon on the physiology and biochemistry and molecular mechanism of different resistance level varieties to the sheath blight (Rhizoctonia solani). Nanjing: Guangxi University, 2012 (in Chinese with English abstract)
[18] 胡泽友, 邓小波, 彭喜旭, 何艳, 刘文海, 戴光宇, 王海华. 外源钙对镍胁迫下水稻幼苗抗氧化酶活性及膜脂过氧化的影响. 中国水稻科学, 2007, 21(4): 367-371. Hu Z Y, Deng X B, Peng X X, He Y, Liu W H, Dai G Y, Wang H H. Effects of external calcium on activities of antioxidant enzymes and membrane lipid peroxidation in rice seedlings under nickel stress. Chin J Rice Sci, 2007, 21(4): 367-371 (in Chinese with English abstract)
[19] 杜秀敏, 殷文璇, 赵彦修, 张慧. 植物中活性氧的产生及清除机制. 生物工程学报, 2001, 17(2): 121-125. Du X M, Yin W X, Zhao Y X, Zhang H. The production and scavenging of reactive oxygen species in plants. Chin J Biotechnol, 2001, 17(2): 121-125 (in Chinese with English abstract)
[20] 宋海超, 史学群. 稻瘟菌侵染后水稻抗氧化酶类的变化与抗病性的关系. 海南大学学报自然科学版, 2006, 24(4): 378-382. Song H C, Shi X Q. The relationships of changes in antioxidant enzymes of rice seedling infected by Magnaporthe grisea to the blast resistance. Natural Science J Hainan Univ, 2006, 24(4): 378-382 (in Chinese with English abstract)
[21] 葛秀春, 宋凤鸣, 郑重. 稻瘟菌侵染后水稻幼苗活性氧的产生与抗病性的关系. 植物生理学报, 2000, 26(3): 227-231. Ge X C, Song F M, Zheng Z. Active oxygen production in rice seedlings infected by Magnaporthe grisea is involved in the blast resistance. Acta Phytophysiol Sin, 2000, 26(3): 227-231(in Chinese with English abstract)
[22] 杨民和, 郑重, Leach J E. 水稻受稻瘟病菌侵染后过氧化物酶定位的超微观察. 中国水稻科学, 2002, 16(1): 57-62. Yang M H, Zheng Z, Leach J E. Histochemical and ultrastructural demonstration of peroxidase activity during infection of rice by Magnaporthe grisea.Chin J Rice Sci, 2002, 16(1): 57-62 (in Chinese with English abstract)
[23] 王丽娟. 水稻病程相关基因XIOsPR10的功能研究. 厦门:厦门大学, 2011. Wang L J. Functional study on a pathogenesis related protein gene XIOsPR10 from rice. Xiamen: Xiamen University, 2011 (in Chinese with English abstract)
[24] 汪尚, 徐鹭芹, 张亚仙, 曾后清, 杜立群. 水杨酸介导植物抗病的研究进展. 植物生理学报, 2016, 52(5): 581-590. Wang S, Xu L Q, Zhang Y X, Zeng H Q, Du L Q. Recent advance of salicylic acid signaling in plant disease resistance. Plant Physiol J, 2016, 52(5): 581-590 (in Chinese with English abstract)
[25] Whalen MC. Host defence in a developmental context. Mol Plant Pathol, 2005, 6: 347–360.
[26] Hugot K, Aime S, Conrod S, Poupet A, Galiana E. Developmental regulated mechanisms affect the ability of a fungal pathogen to infect and colonize tobacco leaves. Plant J, 1999, 20: 163–170.
[27] Kus JV, Zaton K, Sarkar R, Cameron R K. Age-related resistance in Arabidopsis is a developmentally regulated defense response to Pseudomonas syringae. Plant Cell, 2002, 14: 479–490.
[28] Chen C, Chen Z. Potentiation of developmentally regulated plant defense response by AtWRKY18, a pathogen-induced Arabidopsis transcription factor. Plant Physiol, 2002, 129: 706–716.
A Primary Study on the Mechanism Behind Resistance to Bacterial Panicle Blight of Rice
LI Lu1,2, XU Yihua1,2, LIANG Mengqi2, WANG Ling2, LIU Lianmeng2, HOU Yuxuan2, LI Qiqin1,*, HUANG Shiwen1,2,*
(1College of Agronomy, Guangxi University, Nanning 530003, China;2China National Rice Research Institute, Hangzhou 310006,China;*Corresponding author, E-mail: qqli5806@gxu.edu.cn, huangshiwen@caas.cn)
【Objective】Rice is more susceptible to bacterial panicle blight at the booting stage than seedling stage. The objective of the study is to understand the resistant mechanism in different growing stage of rice and lay a basis for breeding rice varieties with high resistance.【Method】The spraying and injection method were used to inoculate seedlings and panicles of resistant and susceptible rice with Burkholderia glumae, respectively. The activities of three antioxidant enzymes (peroxidase, catalase and superoxide dismutase) of treatments and control were investigated. Real-time PCR was used to detect the expression of five defense response genes (PR1a, PR10b, Rcht, LOX and PAL).【Result】The infection of B. glumae induced the accumulation of reactive oxygen species, the increase of antioxidant enzymes activities and the higher expression of some defense genes. However, the defense response was different at the seedling stage and booting stage of rice. At the booting stage, the activities of antioxidant enzymes (peroxidase, catalase and superoxide dismutase) and the expression of PR10b, Rcht and PAL were higher, but the expression levels of PR1a and LOX were lower than those at the seedling stage.【Conclusion】B. glumae could induce more defense response of rice in booting stage, salicylic acid signaling pathway played an important role during the defense.
rice; bacterial panicle blight; antioxidant enzyme; defense gene; real-time fluorescence quantitative PCR
S435.111.4+5
A
1001-7216(2017)05-0551-08
2016-12-20;修改稿收到日期:2017-02-14。
国家重点研发计划资助项目(2016YFD0200801);中国农业科学院科技创新工程资助项目(CAAS-ASTIP-2013-CNRRI);中央级公益性科研
