ATP硫酸化酶基因MoMET3在稻瘟病菌生长发育和致病过程中的功能分析
2017-09-23冯向阳张震柴荣耀邱海萍王教瑜毛雪琴王艳丽孙国昌
冯向阳 张震, 柴荣耀 邱海萍 王教瑜 毛雪琴 王艳丽 孙国昌,
(1浙江农林大学 林业与生物技术学院, 杭州 311300;2浙江省农业科学院 植物保护与微生物研究所, 杭州 310021;*通讯联系人, E-mail:zzhangcn928@sina.com)
ATP硫酸化酶基因MoMET3在稻瘟病菌生长发育和致病过程中的功能分析
冯向阳1,2张震2,*柴荣耀2邱海萍2王教瑜2毛雪琴2王艳丽2孙国昌2,*
(1浙江农林大学 林业与生物技术学院, 杭州 311300;2浙江省农业科学院 植物保护与微生物研究所, 杭州 310021;*通讯联系人, E-mail:zzhangcn928@sina.com)
【目的】真菌对硫元素的利用始于ATP硫酸化酶对硫酸根离子的活化。对稻瘟病菌ATP硫酸化酶在病菌生长发育和致病过程中的功能进行分析,可为稻瘟病的防治提供药物靶标。【方法】采用同源重组方法构建基因敲除载体,并对突变体的表型进行分析。【结果】MoMET3基因是病菌营养生长和分生孢子形成所必需的,但不是毒力因子。稻瘟病菌ATP硫酸化酶编码基因MoMET3缺失后,突变体营养生长速率减慢,产孢量降低,但是突变体对寄主的毒力不受影响;虽然基因缺失不影响突变体分生孢子萌发和附着胞成熟,但突变体在硫营养限制时孢子萌发后次生菌丝的生长明显受抑。MoMET3基因互补后,突变体恢复正常生长,能利用硫酸盐。【结论】无机硫的还原对分生孢子的萌发和附着胞的成熟并不是必需的,分生孢子内储存的还原态硫化合物可以满足这一过程中硫营养的需求,但病菌侵入寄主组织后需要吸收利用寄主源还原态硫以利于侵染菌丝的扩展。
稻瘟病菌;ATP硫酸化酶;MoMET3;功能分析
硫元素是生物体内一些重要化合物和大分子(蛋白质,脂类,电子载体,中间代谢物)的组成物质,是生命体生长所必需的元素之一。真菌可从不同形态的含硫物质中获取硫元素,但自然界中无机硫酸盐的同化仍是多数真菌硫元素获取的最主要途径。无机硫酸盐被真菌吸收后,被ATP硫酸化酶还原成腺苷酰硫酸 (adenosine-5'-phosphosulfate, APS),而后通过一系列还原过程,合成半胱氨酸。半胱氨酸在转硫作用下逐渐转化合成胱硫醚,高胱氨酸,最后合成甲硫氨酸;而甲硫氨酸可通过S-腺苷甲硫氨酸(SAM)转化为高胱氨酸,后者可在反转硫作用下重新形成半胱氨酸[1]。这一过程实现真菌硫元素在细胞内的同化和循环利用。
在酿酒酵母(Saccharomyces cerevisiae)、粗糙脉孢菌(Neurospora crassa)、构巢曲霉(Aspergillus nidulans)等真菌中已经鉴定了硫代谢相关基因MET1、MET2、MET3、MET6、MET13等[2-5]。对病原真菌硫代谢相关基因的研究发现,硫代谢的相关基因在病菌生长发育和致病过程中也发挥着重要作用。在白色念珠菌(Candida albicans)中,甲硫氨酸合成酶编码基因MET6是病菌生长所必需的,添加外源甲硫氨酸也无法恢复MET6缺失突变体的正常生长[6]。在禾谷镰刀菌(Fusarium graminearum)中,甲硫氨酸合成酶基因MET6缺失,导致突变体致病性丧失[7]。在新型隐球菌(Cryptococcus neoformans)中,ATP硫酸化酶基因MET3突变体耐热性降低,致病性丧失[8];甲硫氨酸合成酶基因MET6突变体致病性丧失[9]。当前研究证据显示,这些硫代谢基因具有成为新药物靶点的研究价值。
稻瘟病是由稻瘟病菌(Magnaporthe oryzae)引起的,是水稻生产中最重要的病害之一。稻瘟病菌是植物与病原真菌互作的模式生物之一[10],稻瘟病菌基因功能的研究可为潜在的药物靶点的发掘提供理论依据,也可为其他植物病原真菌相关研究提供借鉴。稻瘟病菌的侵染过程中,孢子的萌发、侵染结构的形成、侵染菌丝的生长,需要利用必要的营养物质。稻瘟病菌硫代谢相关的研究表明,含硫氨基酸的合成在病菌生长和致病过程中发挥着极其重要的作用。稻瘟病菌MoMET1基因编码胱硫醚γ合成酶,参与半胱氨酸到胱硫醚的合成过程,MoSTR3基因编码胱硫醚β裂解酶,将胱硫醚裂解为高半胱氨酸,MoMET1和MoSTR3突变体均表现致病性明显下降[11-12];MoMET6基因编码甲硫氨酸合成酶,参与从高半胱氨酸到甲硫氨酸的合成过程,突变体致病性丧失[13]。这些基因主要集中在细胞内有机态还原硫间的互相转化,而无机硫酸盐的同化对稻瘟病菌生长发育和致病过程中的作用至今未有报道。为此,我们就稻瘟病菌ATP硫酸化酶在病菌生长发育和致病过程中的功能开展了相关研究。
1 材料与方法
1.1 菌株与质粒
稻瘟病菌野生型菌株Guy11、MoMET3基因缺失突变体、MoMET3随机插入突变体均由本实验室保存;根癌农杆菌(Agrobacterium tumefaciens)菌株AGL1,用于稻瘟病菌的遗传转化;供试质粒pCAMBIA1300,用于敲除载体构建;pBARGPE1携有BAR抗性标记,用于扩增BAR表达盒。
1.2 基因序列分析
根据酿酒酵母ATP硫酸化酶的氨基酸序列,在稻瘟病菌的基因组数据库(http://www. broadinstitute. org/annotation/genome/magnaporthe_comparative/Mu ltiHome.html)中进行BLAST_P检索,获得其在稻瘟病菌中的同源序列。采用ClastW程序进行蛋白序列联配。
1.3 敲除载体的构建
稻瘟病菌菌株于液体CM培养基中[14],28℃、150 r/min下振荡培养5 d后,收集菌丝,采用CTAB法[14]提取基因组DNA。以稻瘟病菌菌株Guy11的基因组DNA为模板,用引物对APSP11/APSP12 PCR扩增获得MGG_15027基因的上游片段(大小约1.5 kb),用引物对APSP17/APSP18 PCR扩增获得MGG_15027基因的下游片段(大小约1.5 kb);以质粒pBARGPE1为模板,用引物对BAR-F/BAR-R扩增BAR表达盒(大小约0.9 kb);用限制性核酸内切酶XhoⅠ和PstⅠ对质粒pCAMBIA1300进行双酶切,琼脂糖凝胶电泳回收约6.8 kb的骨架片段。采用Vazyme公司ClonExpress®II One Step Cloning Kit一步法将上述4个DNA片段做连接反应,连接产物转化大肠杆菌后提取质粒,经酶切和DNA测序验证,获得基因敲除载体pKOMET3。上述所用PCR引物见表1。
1.4 基因缺失突变体的获得
稻瘟病菌的遗传转化采用农杆菌介导的遗传转化方法(Agrobacterium tumefaciens-mediated transformation,AtMT)进行,具体操作方法参考Wang等[15]。分别取1×106个/mL的野生型Guy11的孢子悬浮液与携有pKOMET3的农杆菌AGL1菌液(OD660≈0.6~0.8)100 µL,混合后涂布于IM培养基承载的硝酸纤维素膜上,23℃下共培养48 h后将膜剪成细条贴于含有50 μg/mL盐酸四环素、50 μg/mL头孢噻肟钠和200 μg/mL草铵膦的CM平板上培养,待有转化子出现时,将其转移至含有草铵膦的CM平板上复筛1次,将能正常生长的转化子转移至CM平板上进行培养。刮取转化子菌丝,提取基因组DNA,采用PCR法验证基因同源重组事件的发生情况。首先,以引物对BAR-CF/BAR-CR扩增BAR表达盒,验证T-DNA是否整合进稻瘟病菌基因组;其次,以引物对APSP41/APSP42扩增MoMET3基因部分片段,以引物对APSP45/APSP46扩增包含MoMET3完整编码区的DNA片段,根据PCR产物的有无或大小判断MoMET3基因是否被同源替换,最终获得基因缺失突变体。所用引物见表1。

表1 本研究所用引物Table 1. Primers used in this study.
1.5 基因缺失突变体表型鉴定
1.5.1 突变体营养生长和分生孢子产量的测定
野生型和突变体菌株在CM平板上28℃下暗培养3 d后,于菌落边缘处切取约为2 mm×2 mm的菌块,接种到直径6 cm的CM平板上,28℃、12 h光暗交替条件下培养6 d,观察并记录菌落形态、菌落直径。用适量的双蒸水洗刷平板后通过双层擦镜纸过滤收集分生孢子,在显微镜下观察其形态及大小,并利用血球计数板统计孢子数量。
1.5.2 ##突变体对硫营养的利用情况#
孢子悬浮液准备:野生型和突变体菌株在CM平板上28℃下培养3 d后,于菌落边缘处切取约为2 mm×2 mm的菌块,接种在直径9 cm的CM平板上,28℃下黑暗培养7 d,用无菌水刷去菌丝后,于28℃、12 h光暗交替条件下培养48 h。用无菌水洗刷平板,收集分生孢子,并将浓度调至1×105个/mL待用。
取5 µL的孢子悬浮液点接种到MM平板和分别含有1 mmol/L甲硫氨酸、半胱氨酸和亚硫酸钠的MM平板上,28℃、12 h光暗交替条件下培养6 d,观察并记录菌落形态。
将野生型和突变体的孢子悬浮液浓度调至1×104个/mL,取2 µL的的孢子悬浮液点接种于MM平板上,28℃保湿暗培养,分别于24 h、48 h、72 h观察孢子萌发及菌丝的生长情况。
1.5.3 突变体侵染相关形态的分析
孢子萌发率和附着胞形成率测定:将野生型和突变体的孢子悬浮液浓度调至1×105个/mL,分别取20 µL孢子悬浮液置于塑料盖玻片(购于Thermo Fisher Scientific公司)上,28℃下黑暗保湿培养一定时间后显微镜下统计孢子萌发率及附着胞形成率。
附着胞膨压的测定:分别取20 µL野生型和突变体孢子悬浮液(1×105个/mL)置于塑料盖玻片(购于Thermo Fisher Scientific公司)上,28℃黑暗保湿培养24 h后,分别用不同浓度的甘油溶液置换水溶液,并在10 min后在显微镜下统计不同甘油处理下附着胞的塌陷率。
1.5.4 致病性测定
大麦离体叶片点接种:剪取生长8 d的大麦(品种为ZJ-8)叶片,分别取20 µL梯度稀释的突变体和野生型孢子液,点接种于大麦叶片上,在光照培养箱中28℃下黑暗保湿培养24 h后,光照培养,直至野生型接种处理显现典型症状。比较并记录各菌株的发病程度。
1.6 基因互补子的获得
以稻瘟病菌菌株Guy11的基因组DNA为模板,用引物对APSP49/APSP50扩增获得MGG_15027基因片段(包含启动子和编码区,大小约3.6 kb);用限制性核酸内切酶XhoⅠ和EcoRⅠ对质粒pHKO(已连接HPH表达盒)进行双酶切后,琼脂糖凝胶电泳回收约8.2 kb的骨架片段。采用Vazyme公司ClonExpress® Ⅱ One Step Cloning Kit一步法将上述2个DNA片段做连接反应,连接产物转化大肠杆菌后提取质粒,经酶切和DNA测序验证,获得基因互补载体pHMET3。所用引物见表1。
取1×106个/mL的敲除突变体M7的孢子悬浮液与携有pHMET3质粒的农杆菌AGL1菌液(OD660≈0.6~0.8)各100 µL,混合后涂布于IM培养基承载的硝酸纤维素膜上,23℃下共培养48 h,将膜剪成细条贴于含有50 μg/mL盐酸四环素、50 μg/mL头孢噻肟钠和200 μg/mL潮霉素的CM平板上培养,待有转化子出现时,将其转移至含有潮霉素的CM平板上复筛,并将能正常生长的转移至CM平板上进行培养。刮取转化子菌丝,提取基因组DNA,筛选能扩增到MoMET3基因的转化子用于后续研究。
1.7 数据统计和分析
办好中国的事情,关键在党,全面从严治党是实现党的历史使命的必然要求。习近平总书记指出:“没有规矩不成其为政党,更不成其为马克思主义政党。”对于一个拥有8900多万党员、450多万党的基层组织的执政党,如果纪律不严,就是一盘散沙。党的十八大以来,以习近平同志为核心的党中央把纪律建设作为从严治党的重要抓手,实现了全面从严治党的重大突破。习近平总书记在多次讲话中都突出强调纪律建设对全面从严治党的重要性,提出了 “党要管党、从严治党,纪律建设是治本之策。”“纪律不严,从严治党就无从谈起。”“全面从严治党,重在加强纪律建设。”等一系列重要的论述,切实把党的纪律建设摆在了从严治党的突出位置。
突变体表型鉴定中的所有实验,每个菌株均设置3个重复,相同实验重复3次。用Excel 2010对数据进行记录与统计,用SPSS 19.0进行显著性差异分析。
2 结果与分析
2.1 MoMET3基因序列分析
利用酿酒酵母MET3基因编码氨基酸序列于稻瘟病菌基因组数据库(http://www.broad-institute. org/annotation/genome/magnaporthe_comparative/Mu ltiHome.html)中进行同源检索,得到与MET3蛋白最为相似的同源蛋白,MGG_15027。MGG_15027基因全长1721 bp,编码由573个氨基酸组成的蛋白,无内含子。生物信息学分析显示,MGG_15027基因编码蛋白包含2个结构域,即nt_trans和NK结合域,与酵母MET3蛋白结构一致。其氨基酸序列与酿酒酵母(S. cerevisiae)的MET3同源率约为63%(GenBank登录号X06413),与粗糙脉孢菌(N. crassa)ATP硫酸化酶的同源率最高,约为87%(GenBank登录号为EAA35113),且结合域相同。与构巢曲霉(A. nidulans)的ATP硫酸化酶同源率约为78%(GenBank登录号为AJ292542),与白色念珠菌(C. albicans)的同源率约为57%(GenBank登录号为AF164103),与粟酒裂殖酵母(Schizosaccharomyces pombe)的同源率约为59% (GenBank登录号D83992),与人类病原真菌新型隐球菌(C. neoformans)CnMET3的同源率约为65% (GenBank登录号为AY035556)。由此推断,MGG_15027基因编码是稻瘟病菌ATP硫酸化酶,暂命名为MoMET3。
2.2 MoMET3基因缺失突变体的获得
为了研究MoMET3在稻瘟病菌中的生物学功能,利用同源重组技术对其进行定向敲除。经AtMT转化后,获得了85个能在草胺膦平板上生长的转化子,提取转化子基因组DNA,以PCR扩增的方法筛选MoMET3基因敲除突变体。MoMET3基因邻
近基因组片段及pKOMET3限制性内切酶酶切图谱、预测的同源重组事件及扩增用引物位置如图1-A所示。以引物对BAR-CF/BAR-CR进行扩增,85个转化子中均能扩增到0.9 kb片段,表明各转化子均有T-DNA插入。预期的MoMET3同源重组事件发生时,对于基因缺失突变体,引物对APSP41/APSP42不能扩增到0.8 kb的MoMET3基因片段,引物对APSP45/APSP46仅能扩增到2.0 kb的片段;而随机插入突变体用上述引物对均可扩增到相应片段,且引物对APSP45/APSP46还能扩增到2.7 kb的目的片段,结果显示有34个转化子发生了同源重组事件。PCR验证结果以部分转化子为例(具体见图1-B、1-C和1-D)。理论上候选基因缺失突变体均表现为相同的生物学表型,因此我们从中随机选取了生长表型相对一致的2个突变体(M7和M17)和随机插入突变体R11用于后续的基因功能研究。
2.3 MoMET3缺失影响稻瘟病的菌丝生长和产孢量
为了明确MoMET3基因缺失是否影响稻瘟病菌的营养生长和产孢,突变体和野生型菌块接种到CM平板上28℃、12 h光暗交替条件下培养6 d后,观察突变体和野生型的菌落形态,并测量菌落直径和产孢量。结果显示,相较于野生型菌株,突变体在完全培养基上生长速率显著减缓,产孢量显著降低,仅为野生型的35.3%。MoMET3基因缺失影响了稻瘟病菌在CM平板上的营养生长和产孢(图2)。

图1 MoMET3基因缺失突变体的获得Fig. 1. Generation of the MoMET3 deletion mutants.
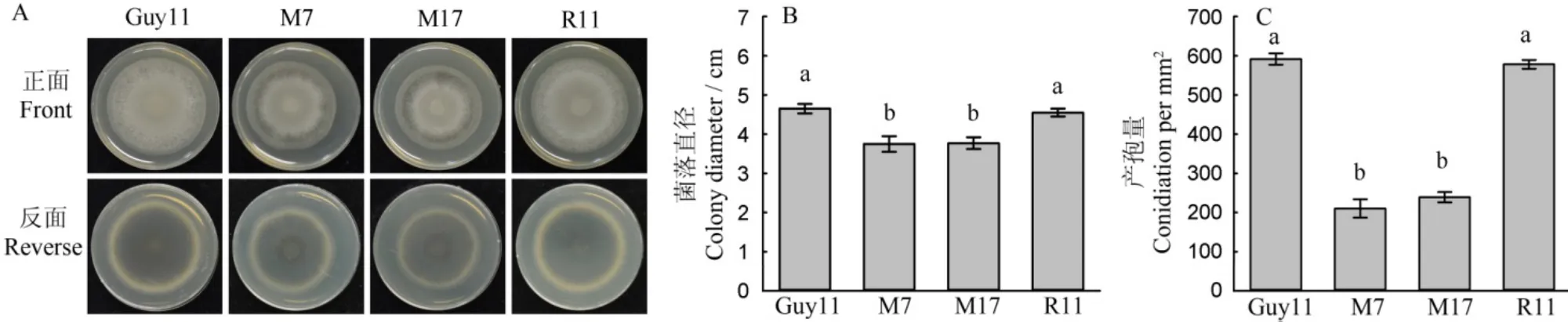
图2 供试菌株在CM平板上的菌落形态与产孢情况(Mean±SD, n=6)Fig. 2. Morphology and conidiation of the tested M. oryzae strains on CM medium(Mean±SD, n=6).
2.4 MoMET3基因缺失突变体的生长特性
MET3基因编码ATP硫酸化酶,将SO42-活化为APS,起始硫还原利用过程。为了明确MoMET3基因参与的硫酸盐同化对病菌生长的影响,将5 µL突变体和野生型的孢子液(每1 mL含1×105个孢子)点接种于基本培养基上,于28℃、12 h光暗交替条件下培养6 d。结果显示,与野生型和随机插入突变体相比,基因缺失突变体在基本培养基上无法形成菌落;当在基本培养基中分别添加亚硫酸钠、半胱氨酸和甲硫氨酸后,基因缺失突变体恢复生长并形成菌落(图3)。结果表明,MoMET3缺失仅阻断了突变体对硫酸盐的利用。

图3 供试菌株对硫营养的利用情况Fig. 3. Utilization of sulfur compounds of the tested M. oryzae strains on minimal medium.
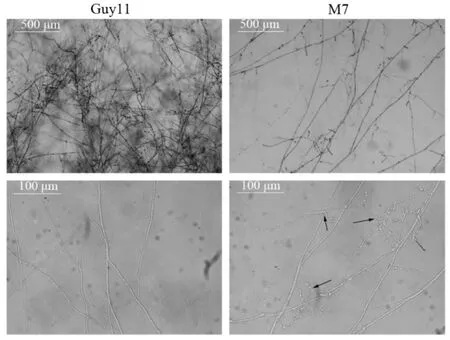
图4 供试菌株在基本培养基上的菌丝形态Fig. 4. Morphology of M. oryzae on minimal medium.
为了进一步分析MoMET3基因对菌丝生长的影响,将2 µL突变体和野生型的孢子液(每1 mL含1×104个孢子)点接种于基本培养基平板上,观察孢子萌发及菌丝的生长情况。结果显示,突变体与野生型的分生孢子一样能在固体基本培养基中正常萌发,且在最初24 h内,初生菌丝的生长与野生型无明显差异,但后续基因缺失突变体次生菌丝的生长和分枝受到影响,在培养至72 h时,野生型的菌丝分枝多且密集,呈辐射状向外扩展;突变体的菌丝分枝少且稀疏,分枝菌丝呈螺旋状卷曲(图4)。上述结果表明,MoMET3缺失不影响突变体分生孢子萌发和初生菌丝的生长,但次生菌丝的生长受到硫酸盐利用缺陷的限制。
由于MoMET3基因缺失不影响分生孢子的萌发,为了明确MoMET3基因缺失对稻瘟病菌附着胞分化的影响,将20 µL突变体和野生型的孢子液(每1 mL含1×105个孢子)分别点接于塑料盖玻片上,28℃暗培养,在培养2 h、4 h、8 h、12 h、24 h后统计分生孢子萌发率和附着胞形成率。结果显示,相较于野生型,基因缺失突变体能分化形成形态正常的附着胞(图5-A)。数据统计分析也显示,突变体分生孢子萌发率、附着胞形成率和附着胞塌陷率与野生型相比均无明显差异(图5-B~D)。上述实验结果表明MoMET3基因缺失不影响分生孢子的萌发和附着胞的分化成熟,同时也表明,稻瘟病菌分生孢子内源的还原态硫物质足以满足分生孢子萌发和附着胞的成熟。

图5 供试菌株分生孢子的萌发和附着胞的分化(Mean±SD, n=8)Fig. 5. Conidial germination and appressorial formation of MoMET3 deletion mutants(Mean±SD, n=8)

图6 MoMET3基因缺失突变体的致病性Fig. 6. Pathogenicity test of MoMET3 deletion mutants.
2.5 MoMET3基因缺失不影响稻瘟病菌的致病性
为了明确MoMET3基因缺失对致病性的影响,分别用2 mL突变体和野生型的分生孢子液(每1 mL含1×105个孢子)喷雾接种对苗龄4周的水稻幼苗。结果表明,突变体接种水稻幼苗后能形成典型的稻瘟病病斑,且与野生型相比,发病严重度基本一致(图6-A)。为了进一步分析MoMET3缺失对毒力的影响,将突变体和野生型梯度稀释的孢子悬浮液点接种于大麦叶片上。结果显示,在不同孢子接种量水平下,突变体的毒力与野生型相比均无明显差异(图6-B)。上述结果表明,MoMET3基因缺失不影响突变体的毒力。
2.6 MoMET3互补恢复了缺失突变体对硫酸盐的利用能力
我们将完整的MoMET3基因(包括启动子和编码区)重新导入突变体M7,获得了互补子M7-C,并与Guy11和M7同时接种到CM平板和MM平板上培养。结果显示,互补子M7-C恢复了在CM和MM平板的生长速度(图7)。结果表明,突变体M7在CM生长速度减慢和对硫酸盐利用能力的丧失是由MoMET3基因缺失引起。
3 讨论
硫元素是合成许多化合物和大分子所必需的的重要元素之一,其中硫元素来源于无机硫的同化或者有机硫间的转化。对于多数真菌,无机硫酸盐同化是硫元素获取的主要途径。本研究通过对稻瘟病菌ATP硫酸化酶基因MoMET3靶向敲除,分析了稻瘟病菌硫酸盐同化在病菌生长发育和致病中作用。稻瘟病菌MoMET3基因缺失导致突变体菌丝生长减慢,产孢降低,但突变体对寄主的致病性不受影响。MoMET3基因互补后,突变体恢复正常生长,能利用硫酸盐。表明无机硫的还原对分生孢子的萌发和附着胞的成熟并不是必需的,分生孢子内储存的还原态硫化合物可以满足这一过程中硫营养的需求,但病菌侵入寄主组织后需要吸收利用寄主源还原态硫以利于侵染菌丝的扩展。
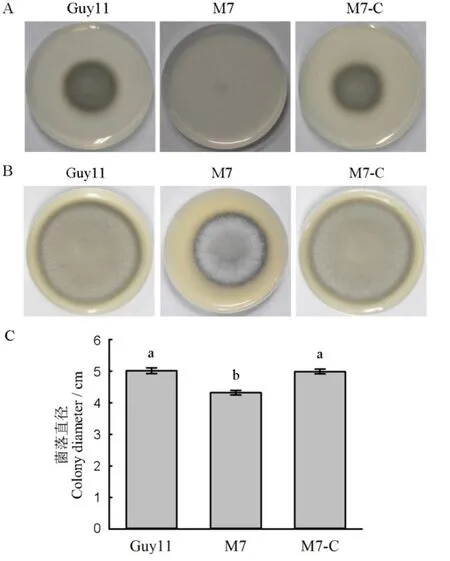
图7 供试菌株对硫营养的利用情况和在CM平板上的菌落形态Fig. 7. Utilization of sulfur compounds of the tested M. oryzae strains on minimal medium and the morphology of the tested M. oryzae strains on CM medium.
稻瘟病菌利用储存在分生孢子中的营养物质用于孢子的萌发和附着胞的分化[16,17]。稻瘟病菌MoMET3基因缺失不影响突变体分生孢子的萌发和附着胞的成熟,揭示了稻瘟病菌分生孢子内可能存储着非硫酸盐形态的硫源,且可以满足这一过程的硫营养需求。除硫酸盐形态外,细胞内硫元素可以多种化合物和大分子物质存在。研究显示,硫酸胆碱被认为是真菌中一种重要的硫存储物质[18-20],它是3'-磷酸腺苷-5'-磷酰硫酸与胆碱的反应产物,它在胆碱脂酶的作用下释放硫酸盐。细胞内硫酸胆碱中硫的利用,仍需经历MET3参与的硫同化过程。稻瘟病菌分生孢子萌发和附着胞成熟过程中所需要的硫显然与此无关。虽然其他形态的含硫物质作为细胞硫营养至今未有明确的报道,但不排除稻瘟病菌利用这些含硫物质满足附着胞成熟过程中硫营养需求。
MoMET3基因缺失突变体在基本培养上次生菌丝的生长受无机硫营养利用缺陷所抑制,而且突变体对寄主毒力未受影响,暗示着稻瘟病菌侵染寄主细胞时侵染菌丝的迅速增殖需要从寄主组织中吸收含硫物质。硫在植物体内主要以无机硫酸盐和有机还原硫的形成积累,有机还原硫主要包括β-硫代葡萄糖苷、谷胱甘肽和SAM[21,22]。此外,植物组织中也有含硫氨基酸的存在[17,23,24]。虽然,无机硫酸盐是真菌首选硫源,真菌也能吸收利用外源有机还原态的硫。酵母和粗糙脉孢霉等真菌中,已经
鉴定了多个硫化合物转移酶,包括甲硫氨酸渗透酶、半胱氨酸渗透酶和S-腺苷基甲硫氨酸渗透酶[25-29],生物信息学分析显示这些基因在真菌中普遍存在。稻瘟病菌MoMET3基因缺失虽然丧失了利用无机硫酸盐的能力,但是由于真菌利用硫源的多样化,这种硫利用途径可被其他硫源利用途径所补充。
综上所述,稻瘟病菌ATP硫酸化酶参与的硫酸盐还原对于病菌致病性是非必要的。但鉴于硫元素是生命活动的重要性,后续从稻瘟病菌分生孢子存储的或利于从寄主吸收的硫营养的利用着手,开展相关基因功能的研究并明确它们在病菌发育和致病过程中的作用,有利于以硫营养利用为靶点开发新药剂奠定理论依据。
[1] Paietta J V. 12 Regulation of Sulfur Metabolism in Filamentous Fungi. Springer International Publishing, 2016: 305-319.
[2] Jakubowski H, Goldman E. Methionine-mediated lethality in yeast cells at elevated temperature. J Bacteriol, 1993, 175(17): 5469-5476.
[3] Thomas D, Surdin-Kerjan Y. Metabolism of sulfur amino acids in Saccharomyces cerevisiae. Microbiol Mol Biol Rev, 1998, 61(4): 503-532.
[4] Borkovich K A, Alex L A, Yarden O, Freitag M, Turner G E, Read R D, Seiler S, Bell-Pedersen D, Paietta J, Plesofsky N, Plamann M, Goodrich-Tanrikulu M, Schulte U, Mannhaupt G, Nargang F E, Radford A, Selitrennikoff G, Galagan J E, Dunlap J C, Loros J J, Catcheside D, Inoue H, Aramayo R, Polymenis M, Selker E U, Sachs M S, Marzluf G A, Paulsen I, Davis R, Ebbole D J, Zelter A, Kalkman E R, O’Rourke R, Bowring F, Yeadon J, Ishii C, Suzuki K, Sakai W, Pratt R. Lessons from the genome sequence of Neurospora crassa: Tracing the path from genomic blueprint to multicellular organism. Microbiol Mol Biol Rev, 2004, 68(1): 1-108.
[5] Natorff R, Brzywczy J, Paszewski A. The Aspergillus nidulans metR gene encodes a bZIP protein which activates transcription of sulphur metabolism genes. Mol Microbiol, 2003, 49(4): 1081-1094.
[6] Suliman H S, Appling D R, Robertus J D. The gene for cobalamin-independent methionine synthase is essential in Candida albicans: A potential antifungal target. Arch Biochem Biophys, 2007, 467(2): 218-226.
[7] Seong K, Hou Z, Tracy M, Kistler H C, Xu J R. Random insertional mutagenesis identifies genes associated with virulence in the wheat scab fungus Fusarium graminearum. Phytopathology, 2005, 95(7): 744.
[8] Yang Z, Pascon R C, Alspaugh A, Cox G M, Mccusker J H. Molecular and genetic analysis of the Cryptococcus neoformans MET3 gene and a met3 mutant. Microbiology, 2002, 148(8): 2617-2625.
[9] Pascon R C, Ganous T M, Kingsbury J M, Cox G M, Mccusker J H. Cryptococcus neoformans methionine synthase: expression analysis and requirement for virulence. Microbiology, 2004, 150(9): 3013-3023.
[10] Ebbole D J. Magnaporthe as a model for understanding host-pathogen interactions. Phytopathology, 2007, 45(45): 437-456.
[11] Balhadère P V, Foster A J, Talbot N J. Identification of pathogenicity mutants of the rice blast fungus Magnaporthe grisea by insertional mutagenesis. Mol Plant-Microb Interact, 1999, 12(2): 129-142.
[12] Wilson R A, Fernandez J, Quispe C F, Gradnigo J, Seng A, Moriyama E, Wright J D. Towards defining nutrient conditions encountered by the rice blast fungus during host infection. PloS One, 2012, 7(10): e47392.
[13] Saint-macary M E, Barbisan C, Gagey M J, Frelin O, Beffa R, Lebrun M H, Droux M. Methionine biosynthesis is essential for infection in the rice blast fungus Magnaporthe oryzae. PloS One, 2015, 10(4): e0111108.[14] Talbot N J, Ebbole D J, Hamer J E. Identification and characterization of MPG1, a gene involved inpathogenicity from the rice blast fungus Magnaporthe grisea. Plant Cell, 1993, 5: 1575-1590.
[15] Wang J, Zhang Z, Wang Y, Li L, Chai R, Mao X, Jiang H, Qiu H, Du X, Lin F, Sun G. PTS1 peroxisomal import pathway plays shared and distinct roles to PTS2 pathway in development and pathogenicity of Magnaporthe oryzae. PloS One, 2013, 8(2): e55554.
[16] Wilson R A, Talbot N J. Under pressure: investigating the biology of plant infection by Magnaporthe oryzae. Nat Rev Microbiol, 2009, 7(3): 185-195.
[17] Fernandez J, Marroquinguzman M, Wilson R A. Mechanisms of nutrient acquisition and utilization during fungal infections of leaves. Ann Rev Phytopathol, 2014, 52(1): 155-174.
[18] Mcguire W G, Marzluf G A. Developmental regulation of choline sulfatase and aryl sulfatase in Neurospora crassa. Arch Biochem Biophys, 1974, 161(2): 360-368.
[19] Ferreira M E D S, Marques E D R, Malavazi I, Torres I, Restrepo A, Nunes L R, de Oliveira R C, Goldman M H, Goldman G H. Transcriptome analysis and molecular studies on sulfur metabolism in the human pathogenic fungus Paracoccidioides brasiliensis. Mol Genet Genom, 2006, 276(5): 450-463.
[20] Kertesz M A, Cook A M, Leisinger T. Microbial metabolism of sulfurand phosphorus-containing xenobiotics. Fems Microbiol Rev, 1994, 15(2-3): 195-215.
[21] Bourgis F, Roje S, Nuccio M L, Fisher D B, Tarczynski M C, Li C, Herschbach C, Rennenberg H, Pimenta M J, Shen T L, Gage D A, Hanson A D. S-methylmethionine plays a major role in phloem sulfur transport and is synthesized by a novel type of methyltransferase. Plant Cell, 1999, 11(8): 1485-1498.
[22] James F, Nolte K D, Hanson A D. Purification and properties of S-adenosyl-L-methionine: L-methionine S-methyltransferase from Wollastonia biflora leaves. J Biol Chem, 1995, 270(38): 22344-22350.
[23] Solomon P S, Oliver R P. The nitrogen content of the tomato leaf apoplast increases during infection by Cladosporium fulvum. Planta, 2001, 213(2): 241-249.
[24] Solomon P S, Tan K C, Oliver R P. The nutrient supply of pathogenic fungi: A fertile field for study. Mol Plant Pathol, 2003, 4(3): 203-210.
[25] Rouillon A, Surdin-Kerjan Y, Thomas D. Transport of sulfonium compounds characterization of the S-adenosylmethionine and S-methylmethionine permeases from the yeast Saccharomyces cerevisiae. J Biol Chem, 1999, 274(40): 28 096-28 105.
[26] Kaur J, Bachhawat A K. Yct1p, a novel, high-affinity, cysteine-specific transporter from the Saccharomyces cerevisiae. Genetics, 2007, 176(2): 877-890.
[27] Marzluf G A. Molecular genetics of sulfur assimilation in filamentous fungi and yeast. Ann Rev Microbiol, 1997, 51(1): 73-96.
[28] Piłsyk S, Natorff R, Sieńko M, Paszewski A. Sulfate transport in Aspergillus nidulans: A novel gene encoding alternative sulfate transporter. Fung Genet Biol, 2007, 44(8): 715-725.
[29] Thomas D, Surdin-Kerjan Y. Metabolism of sulfur amino acids in Saccharomyces cerevisiae. Microbiol Mol Biol Rev, 1998, 61(4): 503-532.
Functional Analysis of MoMET3 in Growth, Development and Pathogenicity of Magnaporthe oryzae
FENG Xiangyang1,2, ZHANG Zhen2,*, CHAI Rongyao2, QIU Haiping2, WANG Jiaoyu2, MAO Xueqin2, WANG Yanli2, SUN Guochang2,*
(1School of Forestry and Biotechnology, Zhejiang Agricultural and Forestry University, Hangzhou 311300, China;2Institute of plant protection and microbiology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China;*Corresponding authors, E-mail: zzhangcn928@sina.com)
【Objective】 Sulfur is generally made biologically available by activation with ATP in a reaction catalyzed by ATP sulfurylase in fungi. The function of ATP sulfurylase in the growth and pathogenecity of Magnaporthe oryzae was analyzed to lay a foundation for target determination for rice blast prevention.【Method】The knockout vector was constructed by homologous recombination method, and the phenotype of the mutant was analyzed.【Result】MoMET3 was required for vegetative growth and conidiation, but not a virulence factor. The growth rate and conidiation of MoMET3-deleted mutants were significantly decreased in complete medium. Loss of MoMET3 did not affect conidial germination and appressiorial formation, but the growth of secondary hyphae was inhibited in the minimal medium. After complementation of MoMET3 gene, the mutant returned to normal growth and can utilize sulfate. 【Conclusion】These evidences revealed that the reduction of inorganic sulfur is not necessary for the process of conidial germination and appressiorial formation. The endogenous reduced sulfur in conidia was sufficient to meet the sulfur needs in the process of conidial germination and appressiorial formation, and utilization of host-derived reduced sulfur played an important role in the hypha expansion of the blast fungus in hosts.
Magnaporthe oryzae; ATP sulfurylase; MoMET3; functional analysis
Q785; S435.111.4+1 文献标记码:A
1001-7216(2017)05-0542-09
2017-02-13;修改稿收到日期:2017-05-23。
国家自然科学基金资助项目(31170136);国家自然科学基金资助项目(31470249);浙江省公益技术研究农业项目(2013C32019)。
