乳腺原位实性乳头状癌的磁共振表现
2017-09-19张丽娜张维升宋清伟刘爱连王绍武
张丽娜,张维升,宋清伟,刘爱连,王绍武
(1.大连医科大学附属第一医院放射科,辽宁 大连 116011;2.大连医科大学附属第二医院放射科,辽宁 大连 116023)
乳腺原位实性乳头状癌的磁共振表现
张丽娜1,张维升1,宋清伟1,刘爱连1,王绍武2*
(1.大连医科大学附属第一医院放射科,辽宁 大连 116011;2.大连医科大学附属第二医院放射科,辽宁 大连 116023)
目的探讨乳腺实性原位乳头状癌(SPC)的MR影像表现。方法回顾性分析5例经手术病理证实的乳腺原位SPC患者的资料,观察其术前常规MR平扫、动态增强扫描及DWI表现。结果原位SPC病灶T1WI脂肪抑制梯度回波(FSPGR)序列平扫表现为等和/或稍低信号,FSE T2WI、短时反转恢复(STIR)序列平扫表现为等和/或稍高信号;动态增强MRI表现为边界清楚的椭圆形或不规则形强化,病灶内部强化均匀或不均匀。时间信号强度曲线早期快速上升,晚期呈平台型或流出型。DWI病灶均表现为高信号,ADC值1.34×10-3~1.96×10-3mm2/s。结论原位SPC的MRI表现具有一定特征,可为其诊断及与其他浸润性乳腺癌的鉴别提供参考信息。
乳腺肿瘤;癌,乳头状;扩散磁共振成像
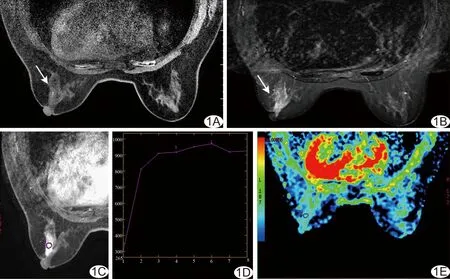
图1 患者71岁,左侧乳腺SPC(病例1) A.T1 FSPGR序列平扫肿块呈等、稍低信号(箭); B.STIR序列平扫肿块呈等、稍高信号(箭); C.增强扫描肿块呈椭圆形,边界清楚,病灶内部呈均匀强化; D.TIC表现为早期快速上升和晚期平台型; E.DWI(b=800 s/mm2)示病灶ADC值为1.42×10-3 mm2/s
实性乳头状癌(solid papillary carcinoma, SPC)是一种特殊类型的乳头状癌,具有独特的病理组织学特征和生物学行为[1-2],既往归类于导管内乳头状癌,2012版WHO乳腺肿瘤分类将其归为乳头状癌中单独的一类[1,3-5]。目前临床和病理学研究[1-3]认为,SPC是一种低级别乳头状导管原位癌(ductal carcinoma in situ, DCIS)变异型,具有进展为其他类型乳腺浸润性癌的潜能,但其预后较导管内乳头状癌好。有关SPC的影像学研究报道主要集中于超声方面,但超声诊断特异性较差[3]。目前,MRI虽已广泛应用于乳腺各类型乳头状肿瘤的诊断[4-5],但鲜见SPC的MRI研究,且现有研究多限于常规MRI表现[6-8]。本研究回顾性分析5例原位SPC患者的常规MRI及DWI表现,探讨SPC的MR影像特征。
1 资料与方法
1.1一般资料 回顾性分析2010年1月—2016年12月我院收治的5例乳腺原位SPC患者的资料,均为女性,年龄68~71岁,平均(69.4±1.14)岁。5例均无乳腺手术病史。术前所有患者均因乳腺X线摄影或超声检查无法准确定位或定性接受MR检查。
1.2仪器与方法
1.2.1 MR检查 采用GE Signa Excite HDx 1.5T全身MR扫描仪,8通道乳腺专用线圈。检查时嘱患者取俯卧位,先行常规MR平扫,扫描序列包括:轴位T1WI脂肪抑制梯度回波(fat-saturation spoiled gradient recalled echo, FSPGR)序列、矢状位脂肪抑制快速自旋回波 FSE T2WI、轴位短时反转恢复(short-tau inversion recovery, STIR)序列,各序列主要扫描参数见表1。增强扫描时,经肘正中静脉以2.0 ml/s流率团注对比剂Gd-DTPA,剂量 0.1 mmol/kg体质量,采用轴位三维T1WI FSPGR动态增强序列,注射对比剂后25 s开始第1次增强序列图像采集,共8期,采集时间57秒/期,其中第1期为蒙片。动态增强前行高b值(b=800 s/mm2)DWI,TR 5 950 ms,TE 88.3 ms,层厚5 mm,层间距1 mm,FOV 30 cm×32 cm,矩阵256×256。
1.2.2 图像分析 将所有MR图像数据均传至GE AW 4.5工作站,由2名从事乳腺MR诊断工作5年以上的医师共同阅片,意见有分歧时经讨论达成共识。参照美国放射学会(American College of Radiology, ACR)乳腺影像报告与数据系统(breast imaging reporting and data system, BI-RADS)分类标准分析病灶MRI特征,记录病灶T1WI FSPGR、FSE T2WI、STIR序列信号表现,观察并测量动态增强MRI病灶形态、最大径及时间信号曲线(time intensity curve, TIC),测量DWI病灶ADC值。
2 结果
2.1临床表现及病理 3例(病例2、3、5)病灶位于乳腺内上象限,2例(病例1、4)病灶位于乳腺外上象限;1例(病例1)出现乳头溢液无导管扩张,1例(病例5)出现乳头溢液和导管扩张,时间分别是1个月和6个月。5例患者均经保乳手术(病例2、5)或改良根治术(病例1、3、4)后病理证实为原位实性SPC,其中2例(病例2、5)病理显示伴有黏液成分。5例中3例分期为PT1N0M0(病例2、3、4),2例分期为PT2N0M0(病例1、5)。所有患者均无淋巴结转移,术后1年无转移或复发表现。
2.2MR影像特征 5例患者病灶最大径0.7~2.4 cm,T1 FSPGR序列病灶均表现为等和/或稍低信号(图1A、2A),FSE T2WI、STIR序列病灶均表现为等和/或稍高信号(图1B)。MRI动态增强扫描表现为椭圆形(病例1、2、4,图1C、2B)或不规则形(病例3、5)强化,边界清楚(图1C、2B),病灶内部呈均匀(病例1、3,图1C)或不均匀(病例2、4、5,图2B)强化。TIC均表现为早期(<90 s)快速强化,晚期呈平台型(病例1、2、4,图1D)或流出型(病例3、5)。5例患者DWI均表现为高信号,ADC值分别为:1.42×10-3mm2/s(病例1,图1E)、1.56×10-3mm2/s(病例2,图2C)、1.34×10-3mm2/s(病例3)、1.90×10-3mm2/s(病例4)、1.96×10-3mm2/s(病例5)。

表1 常规MRI平扫各序列扫描参数
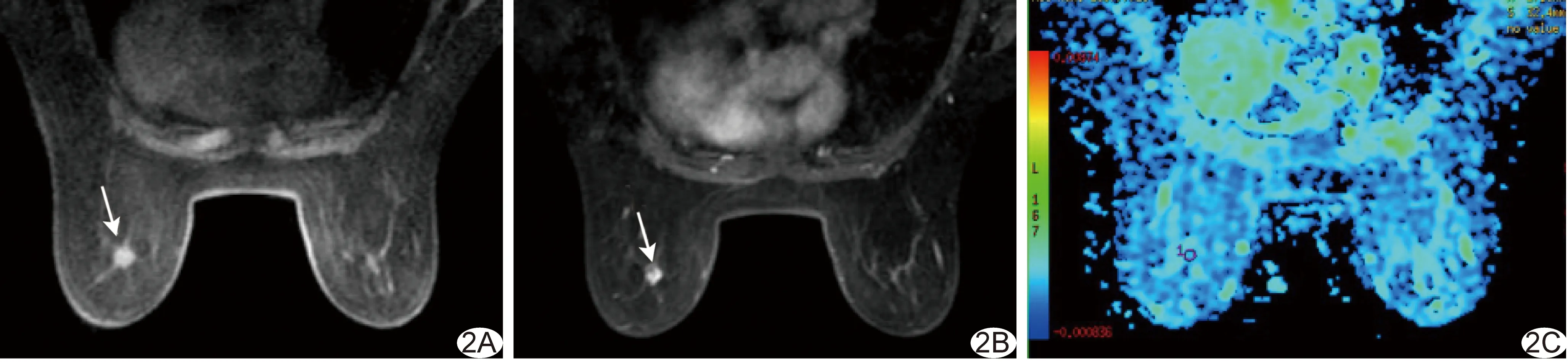
图2 患者68岁,左侧乳腺SPC(病例2) A.T1 FSPGR序列平扫肿块呈等、稍低信号(箭); B.T1 FSPGR序列增强扫描肿块呈椭圆形,边界清楚,病灶内部呈不均匀强化(箭); C.DWI(b=800 s/mm2)示病灶ADC值为1.56×10-3 mm2/s
3 讨论
乳头状癌约占女性乳腺癌的1%~2%,SPC是一种少见的新划分为乳头状癌的独立亚型,其病理表现为圆形、边界清楚的结节,与导管内乳头状癌的分层柱状细胞覆盖乳头状结构形成均一的细胞核浓染不同[1,2-4],SPC由纤维血管间质分离的致密低级别导管细胞构成,低倍显微镜下表现为实性形态学特征[1-2]。免疫组化显示神经内分泌分化特征更易出现在SPC而非导管内乳头状癌[1,4]。2012年WHO乳腺肿瘤分类中将其分为原位SPC和SPC伴浸润2类,对于SPC呈膨胀性结节、形态规则且边缘光滑者,尤其是免疫组化染色显示肌上皮细胞阳性者,应将其归为原位癌,其预后与普通的低级别导管原位癌类似[2]。本组5例患者术后病理均为原位SPC,无淋巴结肿大,术后1年均无复发,符合低度恶性肿瘤预后相对较好的特点[4,6]。
本组5例均为绝经后妇女,既往研究[4-6,9]关于SPC多见于老年女性,且多晚发于普通型浸润性乳腺癌,好发年龄约10岁左右的报道相符。有研究[4-7,9]报道原位SPC最大径1~15 cm,本组病灶最大径0.7~2.4 cm。与既往研究[4-7,10]报道SPC常位于乳腺中央区(乳晕后区)且发病时无特殊临床表现不同,本组病例中2例患者出现乳头溢液,其中1例患者出现导管扩张且病灶远离乳头,符合病理上肿瘤具有导管内实性乳头状结构的特点。
既往有关SPC的MRI研究较少,本研究结果显示5例原位SPC T1WI FSPGR序列均表现为等和/或稍低信号,FSE T2WI或STIR序列均表现为等和/或稍高信号,考虑与病灶内含有出血或黏液成分有关,而与病灶大小无关。Yoshimura等[6]报道1例SPC的MRI表现,增强T1WI表现为弥漫性结节。尤超等[7]分析了SPC的增强MRI表现,但仅采集4个增强时相且单期采集时间过长(180 s)。本组采集7个增强时相且单期采集时间仅57 s,观察增强早期(<90 s)的强化特征,发现本组5例TIC均表现为早期快速强化,早期强化表现符合多数乳腺癌的强化特征(早期快速上升型)[3-4,7]。本组所有病例动态增强MRI均表现为肿块样强化,且形态为椭圆形或不规则形,边界清楚,病灶内部强化特征为均匀或不均匀性强化,与既往研究[3-5,11]报道的其他乳头状肿瘤的MRI表现相仿,提示SPC与经典乳头状肿瘤形态相似[2-3]。
有研究[3,12]报道ADC值可鉴别乳腺良恶性肿瘤,其中高分化肿瘤、正常的乳腺腺体组织和良性病变ADC值相对较高[11,13-14]。本研究结果显示原位SPC的ADC值范围1.34×10-3~1.96×10-3mm2/s。Woodhams等[15]研究认为黏液癌的ADC值高于纤维腺瘤等良性肿瘤的原因为水分子在黏液中的扩散较纤维腺瘤组织间质更容易。SPC的ADC值位于相对高值的原因,考虑与SPC独特的病理结构有关,其既含囊性或黏液性成分又具有实性肿瘤细胞结构(肿瘤细胞呈乳头状、巢状排列)。因此,高ADC值有可能为原位SPC与其他类型浸润性乳腺癌的鉴别提供线索。但本组病例数较少,尚需大样本进一步研究。
综上所述,原位SPC的MRI表现有一定特征,病灶内呈不均匀信号,动态增强表现为肿块强化,边界清楚,呈椭圆或不规则形,动态增强早期为快速强化型;DWI表现为高信号,ADC值较高。MRI特征有助于鉴别原位SPC与其他浸润性导管癌。
[1] 郑小草,葛荣,蒙伶俐,等.乳腺实性乳头状癌的临床病理研究.中国癌症杂志,2014,24(3):208-211.
[2] 齐晓伟,姜军.2012年第4版《WHO乳腺肿瘤组织学分类》介绍.中华乳腺病杂志(电子版),2012,6(5):62-64.
[3] Tan BY, Thike AA, Ellis IO, et al. Clinicopathologic characteristics of solid papillary carcinoma of the breast. Am J Surg Pathol, 2016,40(10):1334-1342.
[4] 孙琨,严福华,柴维敏,等.乳腺恶性乳头状病变的MRI征象.中国医学影像技术,2013,29(11):1765-1768.
[5] Sarica O, Uluc F, Tasmali D. Magnetic resonance imaging features of papillary breast lesions. Eur J Radiol, 2014,83(3):524-530.
[6] Yoshimura N, Murakami S, Kaneko M, et al. Synchronous bilateral solid papillary carcinomas of the breast. Case Rep Surg, 2013,2013:812129.
[7] 尤超,顾雅佳,彭卫军,等.乳腺实性乳头状癌的影像表现及病理特征.中华放射学杂志,2014,48(3):193-196.
[8] 罗娅红.乳腺癌的影像学诊断进展和研究方向.中国医学影像技术,2017,33(5):645-646.
[9] Saremian J, Rosa M. Solid papillary carcinoma of the breast: A pathologically and clinically distinct breast tumor. Arch Pathol Lab Med, 2012,136(10):1308-1311.
[10] 陈昊宾,侯波,张敏.乳腺实性乳头状癌的病理分析.医学研究杂志,2014,43(7):148-151.
[11] Lorenzon M, Zuiani C, Linda A, et al. Magnetic resonance imaging in patients with nipple discharge: Should we recommend it? Eur Radiol, 2011,21(5):899-907.
[12] Ei Khouli RH, Jacobs MA, Mezban SD, et al. Diffusion-weighted imaging improves the diagnostic accuracy of conventional 3.0T breast MR imaging. Radiology, 2010,256(1):64-73.
[13] Yili Z, Xiaoyan H, Hongwen D, et al. The value of diffusion-weighted imaging in assessing the ADC changes of tissues adjacent to breast carcinoma. BMC Cancer, 2009,9:18.
[14] Kinoshita T, Yashiro N, Ihara N. Diffusion-weighted half-Fourier single-shot turbo spin echo imaging in breast tumors: Differentiation of invasive ductal carcinoma from fibroadenoma. J Comput Assist Tomogr, 2002,26(6):1042-1046.
[15] Woodhams R, Kakita S, Hata H, et al. Diffusion-weighted imaging of mucinous carcinoma of the breast: Evaluation of apparent diffusion coefficient and signal intensity in correlation with histologic findings. AJR Am J Roentgenol, 2009,193(1):260-266.
MRIcharacteristicsofsolidpapillarycarcinomasinsituofbreast
ZHANGLi'na1,ZHANGWeisheng1,SONGQingwei1,LIUAilian1,WANGShaowu2*
(1.DepartmentofRadiology,theFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China; 2.DepartmentofRadiology,theSecondAffiliatedHospitalof
DalianMedicalUniversity,Dalian116023,China)
ObjectiveTo evaluate MRI characteristics of solid papillary carcinomas (SPCs) in situ of the breast.MethodsA retrospective study included 5 patients with pathologically confirmed SPC in situ was performed. MRI data before operation including conventional MRI, dynamic contrast enhanced MRI (DCE-MRI) and DWI were analyzed.ResultsAll the lesions showed iso/hypointensity on T1FSPGR sequence, iso/hyperintensity on FSE T2WI sequence and STIR sequence. Mass enhancements were observed for all lesions with oval or irregular shapes on DCE-MRI. The margin of lesions were circumscribed, and internal enhancements were homogeneous or heterogeneous. Time intensity curve appeared a rapid increase in initial contrast phases and platform or outflow types in delayed phases. All the lesions on DWI showed slightly hyperintensity with the ADC value range from 1.34×10-3mm2/s to 1.96×10-3mm2/s.ConclusionMRI manifestations of SPC are characteristics, which may provide valuable information to distinguish SPC in situ from other invasive breast carcinomas.
Breast neoplasms; Carcinoma, papillary; Diffusion magnetic resonance imaging
张丽娜(1979—),女,山东滨州人,硕士,副主任医师。研究方向:乳腺影像诊断。E-mail: zln201045@163.com
王绍武,大连医科大学附属第二医院放射科,116023。E-mail: wsw_2003@163.com
2017-02-18 [
] 2017-07-09
10.13929/j.1672-8475.201702020
R737.9; R445.2
A
1672-8475(2017)09-0539-04
