诱导性多能干细胞在心血管疾病中的研究进展
2017-09-19胡海燕陈志衡赵明一
胡海燕,朱 平,陈志衡,何 微,杨 雷,赵明一
(1南方医科大学,广东 广州510000;2广东省心血管病研究所,广东省人民医院,广东省医学科学院,广东广州510010;3中南大学湘雅三医院,湖南长沙410006)
诱导性多能干细胞在心血管疾病中的研究进展
胡海燕1,2,朱 平2,陈志衡3,何 微3,杨 雷2,赵明一3
(1南方医科大学,广东 广州510000;2广东省心血管病研究所,广东省人民医院,广东省医学科学院,广东广州510010;3中南大学湘雅三医院,湖南长沙410006)
心血管疾病已成为危害人类健康与生命的头号死因,每年约有756万人发病,且发病率呈年轻化趋势并逐年上升.近年来,干细胞移植再生医学的出现和迅猛发展拓宽了心血管疾病领域的治疗策略.诱导性多能干细胞(iPSCs)是由已分化的成体细胞重编程诱导产生的一种干细胞类型,其能分化为针对患者自体细胞的特异性治疗细胞,运用疾病特异性iPSCs建立体外疾病模型可以在不受环境因素影响下进行重复分析,目前已用于心血管疾病的分子基础模型研究、移植治疗以及药物筛选.关于iPSCs的研究打开了对心血管疾病治疗和再生医学的新篇章,但该研究尚处于实验探索阶段,在真正了解这项技术之前,是否应该提早将其用于临床?本文就目前对iPSCs的研究现状、存在的问题和解决方法,以及其在心血管疾病方面临床应用的相关新进展作以综述.
诱导性多能干细胞;重编程;心血管疾病;再生医学;干细胞移植
0 引言
干细胞(stem cell)移植是一种新兴的细胞生物工程技术,其通过把健康的干细胞移植到患者体内,修复或替换受损细胞或组织,从而达到治愈疾病的目的.干细胞移植治疗的运用范围较广,如神经系统疾病、免疫系统疾病、循环系统以及其他一些内外科疾病等.近年来,干细胞移植已逐渐应用于心血管疾病的治疗中,并取得了一定的突破.最新研究发现,缺血性心脏病、中风、慢性阻塞性肺病和癌症(肝,胃和肺)是当前威胁中国人生命健康的最大杀手.其中心脏衰竭、慢性缺血性心肌病与急性心肌梗死是缺血性心脏病中三种最常见的死亡原因[1].到目前为止,临床上尚无药物可以彻底修复受损的心肌,心脏移植虽然能够解决部分患者的心功能衰竭,但由于供体稀缺和免疫排斥等相关问题,使之难以大规模开展于临床.将供体干细胞移植入受损的心肌组织中,生长并重建心肌以代替受损心肌纤维组织,进而刺激血管再生,改善局部微循环,从而使心脏功能得到改善.
目前用于制备自体多能干细胞的主要方法有如下几种.①体细胞核转移(体细胞克隆);②细胞融合;③体外培养法;④将无分化潜能的细胞去分化成多能干细胞,即诱导性多能干细胞(induced pluripotent stem cells,iPSCs).然而,有效性、制备难题、破坏胚胎以及对生殖细胞进行基因操作所引发的伦理问题等[2-3]引起了广泛的争议(表1).因此,人们期待寻找一种可替代胚胎干细胞的多能性细胞,而iPSCs的出现则避免了上述问题,成为目前最具潜能的干细胞制备策略.

表1 多能干细胞制备方法比较
iPSCs由体细胞通过去分化重编程诱导而来,其在形态、基因和蛋白表达、表观遗传修饰状态、细胞倍增能力等方面都与胚胎干细胞相似,理论上可以分化为体内所有的细胞类型,可作为胚胎干细胞的替代物,为干细胞治疗的再生医学带来希望.在基础研究方面,iPSCs可作为疾病实验模型,如创造人类特异性骨骼疾病模型模拟罕见的骨骼肌障碍,以了解异常骨骼形成和骨骼系统疾病[4];构建精神分裂症模型,阐明精神分裂症患者神经元功能损害机制[5];建立癌症模型,剖析癌基因在癌细胞形成过程中的作用[6];制备肿瘤转移抑制基因蛋白(Nm23蛋白)小鼠敲除模型,探讨细胞外Nm23蛋白与急性骨髓性白血病(acute myelocytic leukemia,AML)之间的联系[7].在实际应用方面,iPSCs可用于细胞替代性治疗、发病机理的研究以及新药筛选.其可分化为针对患者自体细胞的特异性治疗细胞,运用疾病特异性iPSCs建立体外疾病模型,其可以在不受环境因素影响的情况下进行重复分析,尤其在心血管疾病等疾病的治疗上具有巨大的潜在价值.
2 iPSCs的制备及特性
2006年,日本科学家山中伸弥(Shinya Yamanaka)[8]将Oct3/4,Sox2,c-Myc和Klf4四种转录因子基因克隆入病毒载体,导入胚胎小鼠的成纤维细胞后,将细胞转移到胚胎干细胞培养基培养,结果发现可将其诱导转化为一种在形态、基因、蛋白表达、表观遗传修饰状态、细胞倍增能力,分化能力等方面均与胚胎干细胞相似的iPSCs(图1).这一重大发现在世界著名学术杂志《Cell》上率先报道,Yamanaka也因此获得了2012年诺贝尔生理学或医学奖.iPSCs的多能性可以通过畸胎瘤的形成来证实.不同诱导方法得到的iPSCs在遗传变异和表观遗传学特征上有所不同,从而使iPSCs的分化能力存在显著差异.目前报道[9]了几个影响这种分化差异的因素:①亲代细胞中残留的DNA甲基化标记,即表观遗传学记忆;②供体细胞间的遗传差异;③重编程过程中获得的差异,如重编程相关的异常DNA甲基化.
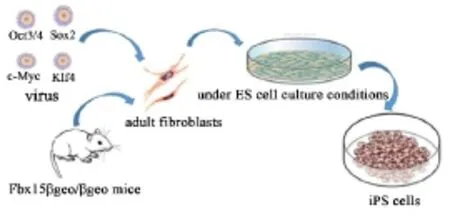
图1 iPSCs细胞制备过程
由于诱导过程中使用的是供体自身的成熟体细胞,绕过了胚胎干细胞涉及的伦理问题,将iPSCs应用于细胞替代治疗,可诱导机体免疫耐受而不引发排斥反应,打破了体细胞不可逆转的传统观念,为医学科研领域的研究提供了更多的方向.这一突破性的发现在生物学和医学领域掀起了巨浪,各领域的科学家均对此展开了多方面的研究.虽然iPSCs的制备方法和全能性已得到证实,但这仅是人们探索复杂生命科学研究中崭新的开始,若要将其应用于临床,造福于人类,尚面临着许多亟需解决的问题.
2.1 寻找合适的供体细胞 除成纤维细胞外,其他自体细胞是否能诱导生成iPSCs?针对这一问题,科学家们做了许多尝试.从理论上来说,任何体细胞均可以经诱导重编程为iPSCs,如从脱落的乳牙、牙胚、牙周韧带等组织中得到的牙干细胞,小鼠胚胎皮肤细胞、成年小鼠胃细胞、尾巴皮肤细胞以及肝脏细胞等[10-11].但取材来源不同的细胞在诱导率、致癌率上存在一定的差异.目前较常用的供体细胞是皮肤成纤维细胞、淋巴细胞和脂肪细胞等.Wolfrum等[12]将
羊水细胞转化为iPSCs,且与其它细胞类型相比较,重编程羊水细胞更加便捷.同年,Oda等[13]利用Oct3/4,Sox2和Klf4的逆转录病毒转导(而不用与癌变有关的c-Myc)源自人第三磨牙(智齿)的间充质基质细胞(mesenchynal stem cells,MSCs),成功诱导出iPSCs.有趣的是,与其它来源的MSCs和成纤维细胞相比,来源于智齿的MSCs产生iPSCs的效率提高了30~100倍.大多数情况下,供体细胞的获取均为有创操作,且需要进行细胞分离.Zhou等[14]用尿液中脱落的肾上皮细胞(epithelial cell)产生iPSCs.此分离具有简单、成本低、普遍、高效便捷等优势.Fuerstenau-sharp等[15]用外周血单核细胞(peripheral blood mononuclear cell,PBMC)诱导出iPSCs,进一步分化得到心肌细胞,纯度显著提高到90%以上.
2.2 安全性 安全性是阻碍iPSCs走向应用领域的另一个重大难题.c-Myc是一种广为人知的致癌基因,Klf4也有一定的致癌性,科学家做了许多相关研究以减少其致癌性.Yamanaka将与癌症相关的转录因子注入体细胞诱导出iPSCs,但研究过程中大鼠发生了癌变.数月后,他又发现即使不使用c-Myc基因,仍然能够得到iPSCs,并能降低癌变的发生率.2008年,Werning[16]和Nakagawa等[17]仅用 Oct4,Sox2和Klf4三个转录因子即成功地诱导出 iPSCs.后来,Feng等[18]用Essrb代替c-Myc和Klf4,与Oct4、Sox2共同作用也能成功将胎鼠的成纤维细胞诱导为iPSCs.Tan等[19]利用TGF-β特异性抑制剂SB431542抑制TGF-β信号通路,发现其能够取代Oct4的作用,诱导细胞发生重编程.此外,抑制TGF-β信号可以通过调节FGF/MEK/ERK的信号传导来维持iPSCs的多能性.Liu等[20]发现癌基因c-Jun能激活间充质相关基因,广泛抑制多能性基因,并在重编程过程中抑制间质向上皮转换,是iPSCs形成的障碍.而c-Jun抑制因子不仅能促进重编程,还能替代Yamanaka因子中最为重要的Oct4.结合多年以来在重编程机理上的研究结果,他们组建了一套不包含Yamanaka因子的全新的iPSCs诱导因子.研究人员发现还可以将已整合的外源基因从iPSCs的基因组中清除[21-22]或用一些小分子化合物代替转录因子[23].即使没有使用致癌基因,实验动物仍能产生肿瘤,这说明致癌性不仅仅是由诱导因子引起的.使用逆转录病毒将诱导因子整合到细胞内的同时,也将外源基因随机插入宿主细胞的基因组内,存在插入突变、激活癌基因的潜在危险,也有可能使基因产生变异,引发肿瘤,寻找其它载体是避免这种致癌性的方法,如用腺病毒代替逆转录病毒或直接使用转录因子的蛋白质诱导和用质粒作为载体等方法也能获得iPSCs[24].
2.3 诱导率低 iPSCs制备过程中的另一个重大问题即诱导率过低,有关数据显示,iPSCs的诱导率一般为0.01%~0.20%[25].研究员尝试了多种方法来提高诱导率,如通过降低培养环境的氧浓度[26],但氧浓度低于1%时会引起部分细胞死亡.另外,Esteban等[27]发现天然化合物维生素C可促进人和鼠iPSCs的生成.Zhu等[28]将转录共激活因子YAP的转录激活结构域(TAD)和Oct4,Sox2,Nanog分别进行融合.这种融合了激活结构域的诱导方法可以在转染后约24 h即可观测到Oct4-GFP报告基因的表达,3~4 d就能初步形成iPSCs的克隆,6~7 d即可将iPSCs克隆进行建系传代,诱导率较传统方法提高100倍左右.
2.4 伦理学争议 iPSCs技术虽然不涉及破坏胚胎细胞带来的伦理问题,但仍不可避免地在一定程度上带来伦理、法律和社会问题.从法律角度上来看,人类iPSCs研究涉及了细胞捐赠者的隐私等一系列权利问题.iPSCs源自生命体,包含了供体大量的信息,如疾病遗传易感性等,若这些信息保护不当,就会侵犯到细胞捐赠者的隐私,还会带来社会、经济或其他风险.另外,iPSCs被用于制造人类生殖细胞(精子或卵细胞)虽然可以用来解决不孕不育的问题,但用于生殖性目的的iPSCs技术仍存在安全性、捐赠者同意,以及孩子权利等伦理问题.
3 iPSCs在心血管疾病中的应用
心肌再生需要一种增殖能力强和分化潜能好的多能干细胞,在各种干细胞中,iPSCs被认为是最理想的细胞来源,可用于心血管疾病的分子基础模型研究、移植治疗及药物筛选等.
3.1 iPSCs用于移植治疗 iPSCs技术的出现为器官损伤修复再生医学开启了一个更广阔的发展前景.将重编程的iPSCs分化成心血管细胞替代受损死亡的细胞,有望恢复心脏功能.Schenke等[29]用小鼠成纤维细胞(fibroblast)诱导的iPSCs通过形成胚状体(embryoid bodies,EBs),进而分步诱导出了功能性心肌细胞、平滑肌细胞、内皮细胞和造血细胞.这种由iPSCs诱导出来的心肌细胞不仅具有典型的心肌细胞标志物,而且还能产生收缩反应.随后,Nelson等[30]将iPSCs植入子宫,观察到iPSCs在子宫内分化为心脏细胞.将这些心脏细胞植入受损心脏后,发现重新构建的心脏、血管平滑肌、内皮组织具有心肌细胞的收缩性、心室壁厚度和电位稳定性等特征,遗憾的是,并未进一步测试其临床治疗潜能.此外,Zhang等[31]利用 Oct4,Sox2,Nanog和 Lin28诱导产生的iPSCs与胚胎干细胞(embryonic stem cells,ESCs)在向心肌分化的潜能方面进行了比较,发现在经过定向诱导后,这两种细胞均具有分化为心房、心室和窦房结等心脏结构的潜能,并且β-肾上腺素受体经刺激后都显示出自发速率增加和动作电位持续时间减少.由此推断,iPSCs作为自体细胞对自身心脏的修复是一个更为有利的细胞来源.
为了实现iPSCs用于心脏再生的治疗,必须要建立一种有效的方法将 iPSCs诱导为心肌细胞.Li等[32]将未分化的iPSCs直接注射到猪心梗模型中,发现移植到心肌中的iPSCs能分化为血管细胞,使梗死心脏中的新生血管增加,减少了梗死面积,改善了左心室功能和灌注.Fujiwara等[33]将环孢菌素 A (Cyclosporin-A,CsA)加入到实验鼠的iPSCs中,发现心肌细胞数量增加了10倍以上,且表达各种心脏标志物,具备同步钙瞬变,心肌细胞样动作电位,药理反应和心肌细胞特有的超结构特征.为了同时诱导血管细胞和心肌细胞,Masumoto等[34]在中胚层时期加入血管内皮细胞生长因子(vascular endothelial growth factor,VEGF),首次成功培育出由心肌和血管等数种细胞组成的心脏组织细胞层,并在大鼠心肌梗死模型中表现出恢复心脏功能的潜力.移植后4周,超过40%的心肌细胞是由移植的iPSCs分化而来.移植后8周,未发生致命的心律失常,无肿瘤形成,进一步证实这种来源细胞治疗的安全性.Amirabad等[35]利用患者的成纤维细胞建立了心血管疾病特异性诱导多能干细胞(CVD-iPSCs),并将CVD-iPSCs接种在支架上,在心肌细胞诱导因子中培养,暴露于电脉冲中.与使用随机纤维支架的多方向电刺激相比,单向电刺激显著增加了心肌肌钙蛋白 T(cardiac troponin T,cTnT)阳性细胞的数量,证实以单向电刺激模拟心脏中电刺激的单向波,可以增加CVD-iPSCs的心肌细胞的衍生.诱导iPSCs分化成心肌细胞需要复杂的培养基,Burridge等[36]使用仅由三个组分[基础培养基RPMI 1640,L-抗坏血酸 2-磷酸酯(L-ascorbic acid 2-phosphate)和水稻重组人血清白蛋白(rice-derived recombinant human serum albumin)]组成的化学成分培养基产生的cTnT+心肌细胞纯度高达95%.心肌梗死后Ⅰ型和Ⅲ型胶原蛋白(procollagen)沉积,梗死区域纤维化和瘢痕形成,影响干细胞的植入.Huang等[37]发现miR-29b过表达能显著降低心肌梗死后瘢痕的形成,促进iPSCs渗透到梗死区域,改善心脏功能.组织工程化血管(tissue engineering blood vessel,TEBV)作为患病血管组织替代物已广泛运用于临床.然而,获得足够数量的功能性平滑肌细胞(smooth muscle cell,SMC)来构建患者特异性TEBV仍然是一个巨大的挑战.Wang等[38]运用主动脉成纤维细胞建立iPSCs,并将其诱导分化为SMC,植入裸鼠皮下后显示有血管组织形成,为TEBV提供了大量的细胞来源.
3.2 iPSCs用于建立心血管疾病模型和新药研发小鼠模型和体外培养心肌细胞是目前用于模拟心血管疾病和药物测试的常用方法,但小鼠心肌细胞的电生理特性和人心肌细胞有很大差别,而人原代心肌细胞取样和培养非常困难.患者特异性iPSCs来源的心肌细胞不受疾病引起的体内代偿变化的影响,有利于更精确地分析疾病表型和药物反应[9].影响心肌细胞收缩频率和收缩性的药物对iPSCs来源的心肌细胞能产生同样的效应,这表明iPSCs可以用于研究心血管病药物对个体水平的影响并实现心血管疾病患者的个体化治疗[39].药物诱导的QT间期延长可导致心源性猝死,是药物行业的主要安全问题.由iPSCs分化成的心肌细胞能通过体外实验准确反应体内心肌细胞的QT间期延长作用,避免了传统研究方法的假阴性结果,这也证明在某些药物的安全性测试中iPSCs可能会反应出更为真实的情况[40].阿霉素(doxorubicin)是常见的化疗药物,具有与剂量相关的心脏毒性,可导致部分患者心脏衰竭.但是,哪些患者会发生阿霉素引起的心脏毒性是不可预测的,Burridge等[41]运用患者特异性iPSCs衍生的心肌细胞,在细胞水平预测患者是否发生心脏毒性.但是这项研究有如下局限性.首先,入组病例数少;其次,联合化疗可能会使结果产生偏倚,因此需要增加患者数量,以检测不同程度和早晚期患者的心脏毒性作用.传统的方法将iPS-CM构建成心脏肌肉,通常每个组织需要>100万个细胞.Huebsch等[42]描述了一种名为“Micro-Heart Muscle”(μHM)的细胞排列方式,每个组织需要2000个iPS-CM.与具有相同细胞组成的单层组织相比,μHM的iPS-CM显示出单向收缩性和准确性,肌节组装强大,并且还能降低药物反应变异性和超敏反应.
最近,Mandegar等[43]将二十一世纪两种最为强大的工具结合在一起,将多西环素(doxycycline)诱导性失活的Cas9融合到KRAB抑制结构域形成改进的CRISPRi系统,修改了iPSCs基因组被读取的方式,CRISPRi可以特异性和可逆地抑制iPSCs和iPSCs衍生的心脏祖细胞、心肌细胞和T淋巴细胞中的基因表达.利用这种技术能够制造出心脏细胞以模拟疾病.这种疾病建模更有利于研究遗传病和潜在地鉴定出新的治疗靶标.钙调蛋白(calmodulin,CaM)是由三种不同的钙调蛋白基因(CALM1,CALM2和CALM3)编码的普遍存在的 Ca2+传感器分子,CALM1-3的突变与严重的早发型长QT综合征(long Q-T syndrome,LQTS)相关,但其中的机制是未知的.Yamamoto等[44]提取携带CALM2-N98S突变患者的外周血单个核细胞(peripheral blood moninuclear cells,PBMCs)制备LQT15-hiPSC,并将其分化为心肌细胞(LQT15-hiPSC-CM),进而采用CRISPR-Cas9系统(CRISPR interference,CRISPRi)特异性敲除突变的CaM基因.结果表明,突变等位基因能引起心脏L型钙通道(LTCC)失活的显性负抑制,导致AP持续时间延长.实验成功建立了LQT15的疾病表型,并解释了CALM2-N98S疾病模型中LTCC电流失活受损的原因.此外,科学家们还建立了Barth综合征(Barth syndrome,BTHS)、左心室发育不良综合征(hypoplastic left heart syndrome,HLHS)、致心律失常性心肌病(arrhythmogenic cardiomyopathy,ACM)、致心律失常性右心室发育不良(arrhythmogenic right ventricular dysplasia/cardiomyopathy,ARVD/C)、儿茶酚胺敏感性多形性室性心动过速(catecholaminergic polymorphic ventricular tachycardia,CPVT)和弗里德里希共济失调(Friedreich's ataxia,FRDA)等[45-51]心血管疾病模型,揭示了疾病发生机制、病理学基础,为治疗提供了新策略.
4 小结与展望
经过10年漫长而又短暂的发展,iPSCs技术已经取得了举世瞩目的进展.一个个的突破既给人类带来了喜悦,也带来了新的挑战.随着研究的进展,细胞重编程技术的问题也逐渐显现,安全性、诱导效率和诱导机制复杂多变是iPSCs用于临床治疗前必须突破的瓶颈和深入研究的领域.日本理化研究所早在2014年9月就实施了世界首例将人工iPSCs培育的视网膜细胞移植到“渗出型老年性黄斑变性”患者身上的手术,第二例手术由于患者的iPSCs发生基因突变而中断,并于2016年6月称将重启这项临床研究.京都大学干细胞研究所于2017年1月23日宣布,将停止向大学及企业等提供部分再生医疗用iPSCs.原因是有可能使用错误的试剂制造细胞,引起不确定的安全隐患.这表明,iPSCs用于临床试验仍然不成熟,还需在动物模型上进行长期随访,即使在局部应用,也应慎重考虑.
日本因为Yamanaka的诺贝尔奖效应,iPSCs及干细胞研究一直处于国际领先地位,包括这次仓促地将iPSCs应用于临床也是如此.作为一项新生技术,iPSCs用于心血管疾病的治疗已取得了卓越的进展,但其安全性仍然是目前阻碍iPSCs用于临床的最大难题.故在科学家对iPSCs完全了解之前,仍需慎重对待将iPSCs用于临床研究.
[1]Zhou M,Wang H,Zhu J,et al.Cause-specific mortality for 240 causes in China during 1990-2013:a systematic subnational analysis for the GlobalBurden of Disease Study 2013[J].Lancet,2016,387(10015):251-272.
[2]Assis AC,Carvalho JL,Jacoby BA,et al.Time-dependent migration of systemically delivered bone marrow mesenchymal stem cells to the infarcted heart[J].Cell Transplant,2010,19(2):219-230.
[3]Zeiler K,Malmquist A.Lesbian shared biological motherhood:the ethics of IVF with reception of oocytes from partner[J].Med Health Care Philos,2014,17(3):347-355.
[4]Barruet E,Hsiao EC.Using humaninduced pluripotent stem cells to model skeletal diseases[J].Methods Mol Biol,2016,1353: 101-118.
[5]Jacobs BM.A dangerous method?The use of induced pluripotent stem cells as a model for schizophrenia[J].Schizophr Res,2015,168(1-2):563-568.
[6]Semi K,Yamada Y.Induced pluripotent stem cell technology for dissecting the cancer epigenome[J].Cancer Sci,2015,106(10): 1251-1256.
[7]Lilly AJ,Khanim FL,Bunce CM.The case for extracellular Nm23-H1 as a driver of acute myeloid leukaemia(AML)progression[J].Naunyn Schmiedebergs Arch Pharmacol,2015,388(2):225-233.
[8]Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
[9]Yoshida Y,Yamanaka S.Induced pluripotent stem cells 10 years later for cardiac applications[J].Circ Res,2017,120(12): 1958-1968.
[10]Srijaya TC,Pradeep PJ,Zain RB,et al.The promise of human induced pluripotent stem cells in dental research[J].Stem Cells Int,2012,2012:423868.
[11]Miura K,Okada Y,Aoi T,et al.Variation in the safety of induced pluripotent stem cell lines[J].Nat Biotechnol,2009,27(8): 743-745.
[12]Wolfrum K,Wang Y,Prigione A,et al.The LARGE principle of cellular reprogramming:lost,acquired and retained gene expression in foreskin and amniotic fluid-derived human iPS cells[J].PLoS One,2010,5(10):e13703.
[13]Oda Y,Yoshimura Y,Ohnishi H,et al.Induction of pluripotent stem cells from human third molar mesenchymal stromal cells[J].J Biol Chem,2010,285(38):29270-29278.
[14]Zhou T,Benda C,Dunzinger S,et al.Generation of human induced pluripotent stem cells from urine samples[J].Nat Protoc,2012,7(12):2080-2089.
[15]Fuerstenau-Sharp M,Zimmermann ME,Stark K,et al.Generation of highly purified human cardiomyocytes from peripheral blood mononuclear cell-derived induced pluripotent stem cells[J].PLoS One,2015,10(5):e0126596.
[16]Wernig M,Meissner A,Cassady JP,et al.c-Myc is dispensable direct reprogramming of mouse fibroblasts[J].Cell Stem Cell,2008,2(1):10-12.
[17]Nakagawa M,Koyanagi M,Tanabe K,et al.Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts[J].Nat Biotechnol,2008,26(1):101-106.
[18]Feng B,Jiang J,Kraus P,et al.Reprogramming of fibroblasts intoinduced pluripotent stem cells with orphan nuclear receptor Esrrb[J].Nat Cell Biol,2009,11(2):197-203.
[19]Tan F,Qian C,Tang K,et al.Inhibition of transforming growth factor β(TGF-β)signaling can substitute for Oct4 protein in reprogramming and maintain pluripotency[J].J Biol Chem,2014,290(7):4500-4511.
[20]Liu J,Han Q,Peng T,et al.The oncogene c-Jun impedes somatic cell reprogramming[J].Nat Cell Biol,2015,17(7):856-867.
[21]Kaji K,Norrby K,Paca A,et al.Virus-free induction of pluripotency and subsequent excision of reprogramming factors[J].Nature,2009,458(7239):771-775.
[22]Soldner F,Hockemeyer D,Beard C,et al.Parkinson's disease patient-derived induced pluripotent ste m cells free of viral reprogramming factors[J].Cell,2009,136(5):964-977.
[23]Hou P,Li Y,Zhang X,et al.Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds[J].Science,2013,341(6146):651-654.
[24]Eggenschwiler R,Cantz T.Induced pluripotent stem cells generated without viral integration[J].Hepatology,2009,49(3):1048-1049.
[25]Ou L,Wang X,Zou F.Is iPS cell the panacea[J].IUBMB Life,2010,62(3):170-175.
[26]Yoshida Y,Takahashi K,Okita K,et al.Hypoxia enhances the generation of induced pluripotent stem cells[J].Cell Stem Cell,2009,5(3):237-241.
[27]Esteban MA,Wang T,Qin B,et al.Vitamin C enhances the generation of mouse and human induced pluripotent stem cells[J].Cell Stem Cell,2010,6(1):71-79.
[28]Zhu G,Li Y,Zhu F,et al.Coordination of engineered factors with TET1/2 promotes early-stage epigenetic modification during somatic cell reprogramming[J].Stem Cell Reports,2014,2(3):253-261.
[29]Schenke-Layland K,Rhodes KE,Angelis E,et al.Reprogrammed mouse fibroblasts differentiate into cells of the cardiovascular and hematopoietic lineages[J].Stem Cells,2008,26(6):1537-1546.
[30]Nelson TJ,Martinez-Fernandez A,Yamada S,et al.Repair of acute myocardial infarction by human stemness factors induced pluripotent stem cells[J].Circulation,2009,120(5):408-416.
[31]Zhang J,Wilson GF,Soerens AG,et al.Functional cardiomyocytes derived from human induced pluripotent stem cells[J].Circ Res,2009,104(4):e30-41.
[32]Li X,Zhang F,Song G,et al.Intramyocardial injection of pig pluripotent stem cells improves left ventricular function and perfusion:a study in a porcine model of acute myocardial infarction[J].PLoS One,2013,8(6):e66688.
[33]Fujiwara M,Yan P,Otsuji TG,et al.Induction and enhancement of cardiac cell differentiation from mouse and human induced pluripotent stem cells with cyclosporin-A[J].PLoS One,2011,6(2): e16734.
[34]Masumoto H,Yamashita J.Exploiting human iPS cell-derived cardiovascular cell populations toward cardiac regenerative therapy[J].Stem Cell Transl Investig,2016,3:e1226.
[35]Mohammadi Amirabad L,Massumi M,Shamsara M,et al.Enhanced cardiac differentiation of human cardiovascular disease patient-specific induced pluripotent stem cells by applying unidirectional electrical pulses using aligned electroactive nanofibrous scaffolds[J].ACS Appl Mater Interfaces,2017,9(8):6849-6864.
[36]Burridge PW,Matsa E,Shukla P,et al.Chemically defined generation of human cardiomyocytes[J].Nat Methods,2014,11(8): 855-860.
[37]Huang W,Dai B,Wen Z,et al.Molecular strategy to reduce in vivo collagen barrier promotes entry of NCX1 positive inducible pluripotent stem cells(iPSC(NCX1+))into ischemic(or injured)myocardium[J].PLoS One,2013,8(8):e70023.
[38]Wang Y,Hu J,Jiao J,et al.Engineering vascular tissue with functional smooth muscle cells derived from human iPS cells and nanofibrous scaffolds[J].Biomaterials,2014,35(32):8960-8969.
[39]Yokoo N,Baba S,Kaichi S,et al.The effects of cardioactive drugs on cardiomyocytes derived from human induced pluripotent stem cells[J].Biochem Biophys Res Commun,2009,387(3):482-488.
[40]Asai Y,Tada M,Otsuji TG,et al.Combination of functional cardiomyocytes derived from human stem cells and a highly efficient microelectrode array system:an ideal hybrid model assay for drug development[J].Curr Stem Cell Res Ther,2010,5(3):227-232.
[41]Burridge PW,Li YF,Matsa E,et al.Human induced pluripotent stem cell-derived cardiomyocytes recapitulate the predilection of breast cancer patients to doxorubicin-induced cardiotoxicity[J].Nat Med,2016,22(5):547-556.
[42]Huebsch N,Loskill P,Deveshwar N,et al.Miniaturized iPS-cellderived cardiac muscles for physiologically relevant drug response analyses[J].Sci Rep,2016,6:24726.
[43]Mandegar MA,Huebsch N,Frolov EB,et al.CRISPR interference efficiently induces specific and reversible gene silencing in human iPSCs[J].Cell Stem Cell,2016,18(4):541-553.
[44]Yamamoto Y,Makiyama T,Harita T,et al.Allele-specific ablation rescues electrophysiological abnormalities in a human iPS cell model of long-QT syndrome with a CALM2 mutation[J].Hum Mol Genet,2017,26(9):1670-1677.
[45]Wang G,McCain ML,Yang L,et al.Modeling the mitochondrial cardiomyopathy of Barth syndrome with induced pluripotent stem cell and heart-on-chip technologies[J].Nat Med,2014,20(6): 616-623.
[46]Jiang Y,Habibollah S,Tilgner K,et al.An induced pluripotent stem cell model of hypoplastic left heart syndrome(HLHS)reveals multiple expression and functional differences in HLHS-derived cardiac myocytes[J].Stem Cells Transl Med,2014,3(4):416-423.
[47]Asimaki A,Kapoor S,Plovie E,et al.Identification of a new modulator of the intercalated disc in a zebrafish model of arrhythmogenic cardiomyopathy[J].Sci Transl Med,2014,6(240):240ra74.
[48]Kim C,Wong J,Wen J,et al.Studying arrhythmogenic right ventricular dysplasia with patient-specific iPSCs[J].Nature,2013,494(7435):105-110.
[49]Ma D,Wei H,Lu J,et al.Generation of patient-specific induced pluripotent stem cell-derived cardiomyocytes as a cellular model of arrhythmogenicright ventricular cardiomyopathy[J].Eur Heart J,2013,34(15):1122-1133.
[50]Hick A,Wattenhofer-Donzé M,Chintawar S,et al.Neurons and cardiomyocytes derived from induced pluripotent stem cells as a model for mitochondrial defects in Friedreich's ataxia[J].Dis Model Mech,2013,6(3):608-621.
[51]Maizels L,Huber I,Arbel G,et al.Patient-specific drug screening using a human induced pluripotent stem cell model of catecholaminergic polymorphic ventricular tachycardia Type 2[J].Circ Arrhythm Electrophysiol,2017,10(6).pii:e004725.
Research progressofinduced pluripotent stem cells on cardiovascular disease
HU Hai-Yan1,2,ZHU Ping2,CHEN Zhi-Heng3,HE Wei3,YANG Lei2,ZHAO Ming-Yi3
1Southern MedicalUniversity, Guangzhou 510000, China;2Guangdong Institute ofCardiovascularDisease,Guangdong Provincial People's Hospital,Guangdong Academy of Medical Sciences,Guangzhou 510010,China;3The Third Xiangya Hospital of Central South University,Changsha 410006,China
Cardiovascular disease has became the first important cause of death,about 7.56 million people were attacked annually,and the trend became younger and increased year by year.Over the past few years,regenerative medicine of stem cell transplantation has expanded the treatment strategy of cardiovascular disease.Induced pluripotent stem cells(iPSCs)are induced by reprogramming adult cells,which can differentiate into patient's specific treatment cells,and using the disease-specific iPSCs to establish a vitro disease model can analyze human cells repeatedly without being affected by environmental factors.It has been used for molecular model of cardiovascular disease,transplantation therapy and drug screening.The study of iPSCs opens a new chapter in cardiovascular disease and regenerative medicine.However,this technology is still in the experimental exploration stage,should it be used in clinical diseases early before total understanding of the technology?This review summarizes the current research status of iPSCs,the existing problems and solutions,as well as its advanced clinical application in cardiovascular disease.
induced pluripotent stem cells;reprogramming; cardiovasculardisease; regenerative medicine; stem cell transplantation
2095-6894(2017)08-76-04
R96
A
2017-06-20;接受日期:2017-07-08
广东省医学科研基金(A2016392);广东省科技计划项目(2014A020212234);中南大学湘雅三医院“新湘雅人才工程”资助项目(JY201524)
胡海燕.硕士生.研究方向:心血管疾病.E-mail:15914828403@163.com
赵明一.助理研究员,博士后.研究方向:心血管疾病.E-mail:36163773@qq.com
