兔肝VX2肿瘤射频消融后不同区带VEGF的表达和细胞凋亡
2017-09-18吕维富朱先海施长杲王亚光刘开才成德雷周春泽
刘 亚,吕维富,朱先海,施长杲,王亚光,刘开才,成德雷,周春泽,鲁 东
(安徽医科大学附属省立医院影像科,安徽 合肥 230001)
·基础与实验研究·
兔肝VX2肿瘤射频消融后不同区带VEGF的表达和细胞凋亡
刘 亚,吕维富*,朱先海,施长杲,王亚光,刘开才,成德雷,周春泽,鲁 东
(安徽医科大学附属省立医院影像科,安徽 合肥 230001)
目的分析兔肝VX2肿瘤射频消融(RFA)后不同区带血管内皮细胞生长因子(VEGF)的表达和肿瘤细胞凋亡情况。方法将48只兔肝移植VX2肿瘤,建立动物模型,分为实验组(n=42)和对照组(n=6)。对实验组行RFA,分别在术后即刻、1天、2天、1周、2周、3周各处死7只实验兔,留存肿瘤标本,进行HE染色、VEGF检测、Annexin V-FITC/PI标记和流式细胞仪检测,观察不同时间段、不同区带的VEGF变化及细胞凋亡情况。结果实验组RFA术后针道炭化区、热凝固区和消融边界区平均VEGF值差异均有统计学意义(P均<0.05);针道炭化区、热凝固区及边界区术后即刻与其他时间点间两两比较差异均有统计学意义(P均<0.05);针道炭化区及热凝固区VEGF在术后即刻达高峰,术后1天~3周呈整体下降趋势,消融边界区VEGF在术后即刻到1周呈上升趋势,2周后下降。术后针道炭化区、热凝固区和消融边界区平均肿瘤细胞凋亡率与对照组比较差异均有统计学意义(P均<0.05),各区带细胞凋亡率均在术后1天达高峰,后呈下降趋势。结论RFA后针道区和热凝固区内肿瘤细胞VEGF下降和肿瘤凋亡显著,而消融交界区仍可能有存活的肿瘤细胞;在RFA后第3周时,残留肿瘤细胞的增殖能力可恢复到术前状态,此时宜进一步采取相应的治疗措施。
兔;肝;VX2肿瘤;射频消融;血管内皮生长因子;凋亡
原发性肝细胞癌(hepatocellular carcinoma, HCC)是临床最常见的恶性肿瘤之一,我国是HCC的高发国家。发现HCC时已多属中晚期,加之多数患者合并肝硬化,仅20%的患者有手术切除机会[1]。因此,肝癌的微创治疗得以迅速发展。目前,射频消融(radiofrequency ablation, RFA)已广泛应用于临床[2]。有研究[3]报道单次RFA后残癌复发率约3%~52%。残癌复发与RFA后残余肿瘤组织细胞活性变化有关,残余肿瘤释放血管内皮生长因子(vascular endothelial growth factor, VEGF)对新生血管的形成及触发转移至关重要。探讨RFA后靶区内不同区带细胞的凋亡变化规律,有利于在肝癌的RFA治疗中制定科学的治疗方案,获得最佳的“安全边界”。因此,本研究旨在分析RFA后肿瘤不同区带VEGF的表达及肿瘤细胞凋亡的变化规律。
1 材料与方法
1.1模型制备 荷VX2瘤种兔1只,健康新西兰大白兔48只(由我院动物试验中心提供),3~5月龄,雌雄不限,体质量2.2~2.5 kg。切取种兔后腿VX2肿瘤边缘生长旺盛区,剪成直径约2 mm的小块,置于生理盐水保存。经耳缘静脉注射3%戊巴比妥钠(30 mg/kg体质量)对实验兔进行全身麻醉,开腹将VX2肿瘤种植于兔肝脏左叶深处,完成实验模型的制备。
1.2RFA方法 于肿瘤成功植入第14天行CT平扫和增强扫描,确定移植瘤生长情况。按照随机数字表法将48只实验兔随机分为2组:实验组(n=42),全身麻醉开腹后行RFA治疗(治疗模式:功率48 W,温度60~90℃,时间12 min)。分别于术后即刻和术后1天、2天、1周、2周、3周处死实验兔(每个时间点7只),取出病灶置于-80℃冰箱保存,行病理学及相关实验室检查。对照组(n=6),动物直接处死后取组织标本。
1.3病理学检查和流式细胞仪检测 首先取大体病理标本进行观察,同时实验组根据RFA消融后瘤体呈现的3个区带(即针道炭化区、热凝固区、消融边界区)进行组织提取,对照组取瘤体生长旺盛部分组织(各3块)分别行HE染色、VEGF表达、膜联蛋白-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)染色。并进行荧光显微镜和流式细胞仪检测。VEGF表达强度以强度评分(intersity score, IS)[4]表示,每张切片中随机选取10个视野,将细胞染色强度分为4级,并分别记分:0分为阴性,细胞无显色;1分为弱阳性,细胞显色为浅黄色;2分为中度阳性,细胞显色为棕黄色;3分为强阳性,细胞显色为棕褐色。按以下公式计算IS:IS=∑[(0×F0)+(1×F1)+(2×F2)+(3×F3)],F为每级染色强度细胞数占全部视野细胞数的百分比,数字表示染色强度级别。采用流式细胞仪检测,计算细胞凋亡率。
1.4统计学分析 采用SPSS 19.0统计分析软件,计量资料以±s表示;实验组不同时间点VEGF表达及细胞凋亡率的比较、实验组各时间点不同区带细胞凋亡率的比较采用单因素方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1组织病理学改变 对照组:瘤体无明显包膜,切面呈鱼肉状改变,部分组织坏死;光镜下肿瘤细胞异型性明显,见浸润性癌巢,胞核大且深染。实验组:RFA后即刻,病灶区由内向外大致分为针道炭化区、热凝固区及消融边界区。光镜下见针道炭化区肿瘤细胞大量坏死,细胞核碎裂、固缩,1周后肿瘤细胞结构显示模糊,出现溶解液化及血栓形成,2周后液化溶解范围进一步扩大(图1A);热凝固区以肿瘤细胞坏死为主,少量肿瘤细胞残存,大量巨嗜细胞、中性粒细胞及少量凋亡细胞共存,1周后较多的炎性细胞明显浸润,3周后见部分肿瘤细胞存活;消融边界区第1天可见大量的炎性细胞,肝窦间隙红细胞交界区内伴随形态、分布较规则的肿瘤细胞,1周后可见少量胶原组织及纤维组织,2周后残存肿瘤细胞增生(图1B)。
表1 RFA术后各消融区的VEGF的表达IS值(±s)
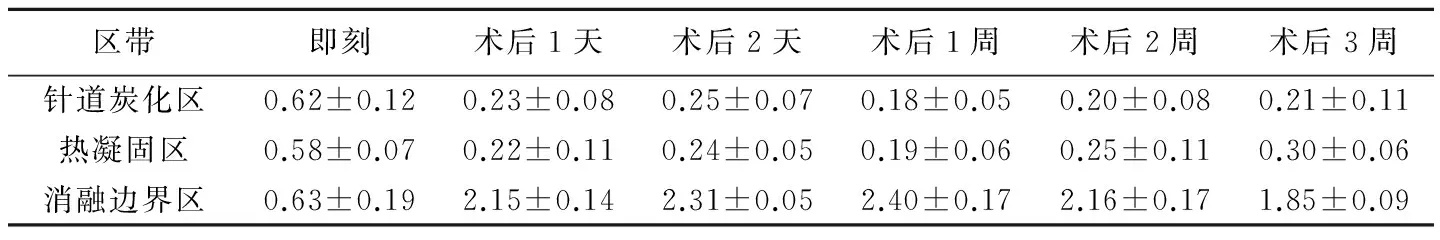
表1 RFA术后各消融区的VEGF的表达IS值(±s)
区带即刻术后1天术后2天术后1周术后2周术后3周针道炭化区0.62±0.120.23±0.080.25±0.070.18±0.050.20±0.080.21±0.11热凝固区0.58±0.070.22±0.110.24±0.050.19±0.060.25±0.110.30±0.06消融边界区0.63±0.192.15±0.142.31±0.052.40±0.172.16±0.171.85±0.09
表2 实验组RFA后不同区带肿瘤细胞凋亡率的变化(%,±s)
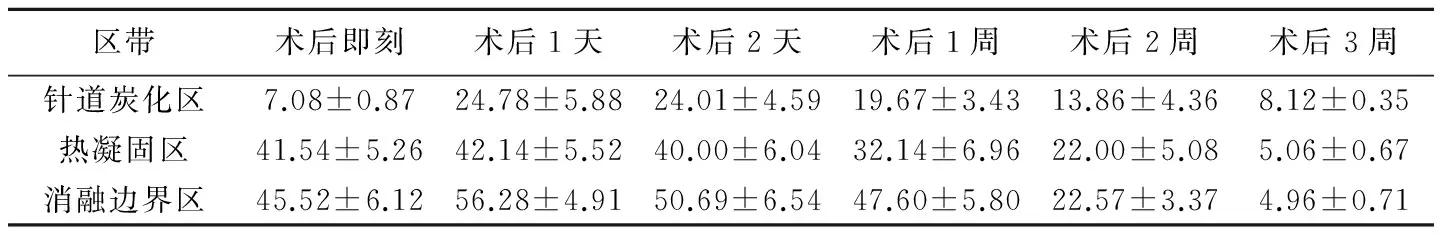
表2 实验组RFA后不同区带肿瘤细胞凋亡率的变化(%,±s)
区带术后即刻术后1天术后2天术后1周术后2周术后3周针道炭化区7.08±0.8724.78±5.8824.01±4.5919.67±3.4313.86±4.368.12±0.35热凝固区41.54±5.2642.14±5.5240.00±6.0432.14±6.9622.00±5.085.06±0.67消融边界区45.52±6.1256.28±4.9150.69±6.5447.60±5.8022.57±3.374.96±0.71
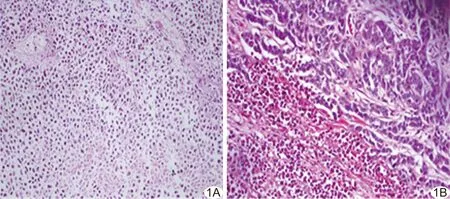
图1 RFA后2周病理改变(HE,×400) A.针道炭化区,大片肿瘤细胞溶解、坏死,炎性细胞浸润; B.消融边界区,肿瘤区与正常组织分界明显,纤维组织增生,炎性细胞浸润明显
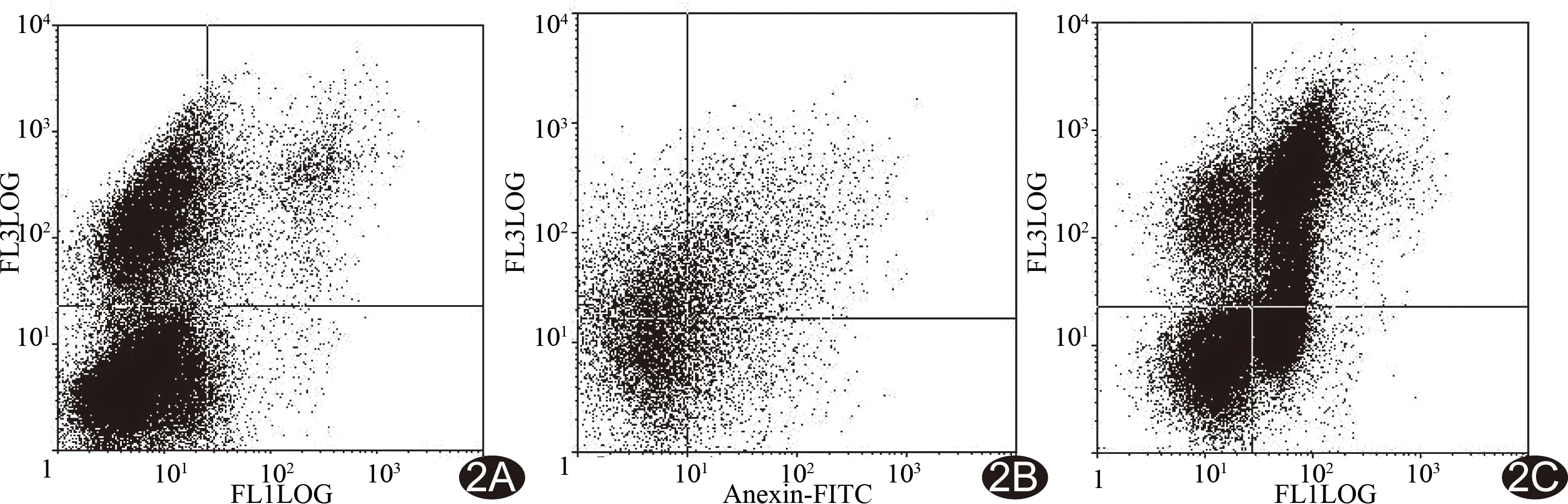
图2 RFA后1天不同区带肿瘤细胞凋亡情况 A.针道区凋亡率17.21%; B.热凝固区凋亡率43.89%; C.消融边界区凋亡率62.34%
2.2VEGF表达 实验组术后针道炭化区、热凝固区和消融边界区VEGF表达强度IS值术后各时间点的差异均有统计学意义(F=19.809、13.045和128.452,P均<0.05),针道炭化区、热凝固区及消融边界区3个区带术后即刻与其他时间点间两两比较差异均有统计学意义(P均<0.05),但术后各时间点VEGF的变化规律不同,针道炭化区及热凝固区VEGF在术后即刻达高峰,1天~2周呈下降趋势,术后2周和3周略有上升趋势,消融边界区VEGF在术后即刻到1周呈上升趋势,2周后下降。见表1。
术后即刻各区带IS值无统计学差异(F=0.305,P>0.05),术后1天~3周,各区带VEGF值差异均有统计学意义(F=318.559、2 917.230、1 317.678、599.603、757.407,P均<0.05);除术后即刻外,其余各时间点消融边界区VEGF表达均较针道炭化区及热凝固区增高,差异有统计学意义(P均<0.05),1周后VEGF值针道炭化区、热凝固区、消融边界区依次呈上升趋势。见表1。
2.3Annexin V-FITC/PI染色、荧光显微镜和流式细胞仪检测 荧光显微镜观察显示实验组凋亡早期细胞膜呈绿色改变,中晚期凋亡细胞核呈红色改变。对照组的细胞凋亡率为(4.05±0.29)%。实验组针道炭化区、热凝固区和消融边界区术后各时间点肿瘤细胞凋亡率比较,差异均有统计学意义(F=37.539、74.942、151.697,P均<0.05),3个区带各时间点细胞凋亡率两两比较,差异均有统计学意义(P均<0.05)。实验组术后各时间点不同区带的细胞凋亡率差异均有统计学意义(F=112.463、26.838、23.777、48.751、19.299、51.794,P均<0.05),术后各时间点3个区带间两两比较差异均有统计学意义(P均<0.05)。各区带细胞凋亡率均在术后1天达高峰,后呈下降趋势。术后即刻到术后2周细胞凋亡率由针道炭化区、热凝固区至消融边界区呈上升趋势,而第3周有所下降。实验组各时间点的不同区带细胞凋亡率与对照组两两比较差异均有统计学意义(P均<0.05;表2、图2)。
3 讨论
本研究通过对RFA后不同区带、不同时间窗肿瘤的病理检查发现:针道炭化区及热凝固区虽存在少量肿瘤细胞结构,但该类细胞多散在,不呈癌巢状,且3周内肿瘤细胞形态几乎无变化,可据此鉴别残癌组织。由于RFA治疗中是高温瞬间凝固作用,病灶内部分肿瘤细胞形态被固定,虽然已经失活,但细胞的形态结构保存完好,与活体组织非常相似,被称之为鬼影细胞[5],HE染色下与活体细胞难以正确区分。本组中针道炭化区可见少量的类似肿瘤细胞,实验组在2周内均可见肿瘤细胞形态,考虑为鬼影细胞,易误认为消融治疗不彻底,消融病灶仍存在残癌[6]。有研究[7]通过尼可酰胺腺嘌呤核苷酸(nicotinamide adenine dinucleotide, NADH)组织化学染色法区分鬼影细胞,发现由于残癌组织中NADH含量高,显色呈蓝紫色,而鬼影细胞中无NADH,不显色,可以据此鉴别。本研究通过观察针道炭化区及热凝固区细胞变化,认为可通过细胞分布的区带判断消融后组织为肿瘤细胞或鬼影细胞。
VEGF是由肿瘤细胞产生并分泌的一种二聚体糖蛋白,是一种最重要的调节血管生成的细胞因子[8]。血管内皮细胞及成纤维细胞表面有VEGF受体,VEGF与其受体结合后,可增加微血管通透性,促进血管内皮细胞分裂及毛细血管出芽生长,诱导新生血管产生,且可降低肿瘤细胞的同质黏附性,上调BCL-2的表达,介导癌细胞增殖,抑制其凋亡,与肿瘤预后密切相关[9]。因此RFA治疗肝癌后,VEGF蛋白表达可提示肝癌的复发及转移率的高低。本实验针道炭化区及热凝固区VEGF术后即刻达高峰,1天~2周呈下降趋势,术后2周和3周略有上升,提示RFA后可短期抑制针道炭化区及热凝固区的肿瘤血管生成,但随着时间推移肿瘤可恢复血供;而术后消融边界区的VEGF处于高表达,可能与RFA后引起局部组织缺氧,诱导VEGF转录有关[10];1周后由针道炭化区至边界区VEGF呈上升趋势,可能因RFA范围有限及热沉降效应,消融边界区的温度较针道区和坏死凝固区降低,低温亦可使VEGF表达上升,增加肿瘤转移概率。
细胞凋亡是在体内、外一些因素的作用下,触发细胞死亡程序而导致细胞主动死亡的一种方式,是细胞损伤的结果。研究[11]表明,Fas、Bax及P53等基因可以促进凋亡作用,BCL-2和BCL-XL等基因可以抑制细胞凋亡发生。本研究结果表明,在RFA术后不同时间由针道炭化区至消融边界区肿瘤细胞凋亡率与对照组比较均呈上升趋势,针道炭化区出现大量凝固性坏死,消融边界区则以肿瘤细胞凋亡为主,提示射频消融中心温度高,直接杀灭肿瘤细胞主要为细胞坏死,向外随着热效益衰减,而表现为以凋亡为主;术后即刻到术后2周细胞凋亡率由针道炭化区、热凝固区至消融边界区呈上升趋势,术后1天各区带处于凋亡高峰,可能与RFA引起的渐进性损伤有关[12],术后三个区带均比对照组凋亡率上升,说明RFA可促进细胞凋亡。但术后第3周消融边界区凋亡率接近对照组,随着时间推移,RFA由内向外,凋亡率逐渐下降,提示肿瘤细胞渐进性损伤作用随着时间推移减退,这也成为肿瘤复发的基础。
总之,本实验通过对兔VX2肝移植瘤在RFA后不同区带和不同时间段肿瘤组织的病理学改变、VEGF表达和肿瘤细胞凋亡的分析,发现RFA后肿瘤组织不同区带、不同时间的损伤情况及变化规律,可为进一步完善肝癌RFA的科学决策[13]、减少肿瘤转移和复发、提高RFA效果提供科学依据。
[1] Livraghi T, Makisalo H, Line PD. Treatment options in hepatocellular carcinoma today. Scand J Surg, 2011,100(1):22-29.
[2] 朱楠,鲁东,肖景坤,等.肝动脉化疗栓塞联合射频消融术治疗中晚期肝癌的疗效.中国介入影像与治疗学,2017,14(4):195-199.
[3] Lam VW, Ng KK,Chok KS, et al. Incomplete ablation after radiofrequency ablation of hepatocellular carcinoma: Analysis of risk factors and prognostic factors. Ann Surg Oncol, 2008,15(3):782-790.
[4] Breasalier RS, Ho SB, Schoeppner HL, et al. Enhanced sialylation of mucin-associated carbohydrate structures in human colon cancer metastasis. Gastroerology, 1996,110(5):1354-1367.
[5]Miao Y, Ni Y, Mulier S, et al. Treatment of VX2 liver tumor in rabbits with “wet” electrode mediated radiofrequency ablation. Eur Radiol, 2000,10(1):188-194.
[6] Wallace JR, Christian KK, Quiroz DW, et al. Ablation of liver metastasis: Is preoperative imaging sufficiently accurate. J Gastrointest Surg, 2001,5(1):98-107.
[7]Simon CJ, Dupuy DE, Lannitti DA, et al. Intraoperative triple antenna hepatic microwave ablation. Int Radiol, 2006,187(4):333-340.
[8] Mousa SA, Mousa SS. Current status of vascular endothelial growth factor inhibition in age-related macular degeneration. Bio Drugs, 2010,24(3):183-194.
[9] 鲁东,吕维富,高斌,等.兔VX2肝癌肝动脉栓塞术后肿瘤新生血管的变化和分析.中国介入影像与治疗学,2010,7(3):305-308.
[10] 王健琳,刘颖,范秋阳,等.兔肝VX2肿瘤RFA术后残余瘤的超声表现及新生血管研究.中国临床医学影像杂志,2013,24(9):639-643.
[11] 陈津,张松如.细胞凋亡机制概述.中华中医药学刊,2011,29(4):886-887.
[12] 张振华.射频消融干预下兔VX2肿瘤病理学与凋亡的评估.世界华人消化杂志,2013,21(17):1602-1606.
[13] 陈敏华,杨薇,严昆,等.超声造影对确定肝癌射频消融范围及治疗策略的应用价值.中华超声影像学杂志,2006,15(3):193-197.
ExpressionofVEGFandapoptosisoftumorcellsindifferentregionsofVX2tumorinrabbitliverafterradiofrequencyablation
LIUYa,LYUWeifu*,ZHUXianhai,SHIChanggao,WANGYaguang,LIUKaicai,CHENGDelei,ZHOUChunze,LUDong
(DepartmentofRadiology,AnhuiProvincialHospital,AnhuiMedicalUniversity,Hefei230001,China)
ObjectiveTo explore the expression of vascular endothelial growth factor (VEGF) and apoptosis of the tumor cells in the different regions of rabbit liver VX2 tumor after radiofrequency ablation (RFA).MethodsForty-eight experimental rabbits were implanted with VX2 tumor. After successfully established the model, the rabbits were randomly divided into control group (n=6) and RFA group (n=42). In the RFA group, 7 rabbits at each time point were killed at immediately, 1 day, 2 days, 1 week, 2 weeks, 3 weeks after RFA, and the tumor specimens were retained and performed with HE staining, VEGF, Annexin V-FITC/PI labeling, flow cytometry analysis. The changes of VEGF and apoptosis of the cells in different periods and different zones after RFA were observed.ResultsAfter the operation, the difference of the VEGF value of the needle zone, coagulation necrotic zone and junction zone had statistically significant (allP<0.05). The difference of the VEGF value in each zone between immediately and the other time points after operation by pairwise comparisons were significantly different (allP<0.05). The VEGF value of the needle zone and coagulation necrotic zone reached the peak after operation immediately, which declined from 1 day to 3 weeks after operative. And VEGF of the junction zone increased from immediately to 1 week after operation, and declined 2 weeks after operation. There were significant differences in the apoptosis rate of the three zones after RFA compared with control group (allP<0.05). The apoptosis rate in all zones were at the peak on the 1 day after operation, and then showed a downward trend.ConclusionThe reduction of VEGF and apoptosis of tumor cells in the needle zone and coagulation necrotic zone are significant, but tumor remnant remains visible in the junction zone. In the third week after RFA, the proliferation of the remaining tumor cells can be recurrent to preoperative levels, which suggests that the further treatment should be performed at this period.
Rabbits; Liver; VX2 tumor; Radiofrequeney ablation; Vascular endothelial growth factor; Apoptosis
国家卫计委医学科研专项项目(w2015xr13)、安徽省科技攻关项目(1704a0802152)。
刘亚(1982—),女,安徽合肥人,在读硕士。研究方向:介入放射学。E-mail: xiniuniu0615@126.com
吕维富,安徽医科大学附属省立医院影像科,230001。E-mail: lwf99@126.com
2017-01-24 [
] 2017-06-01
10.13929/j.1672-8475.201701038
R735.7; R-332
A
1672-8475(2017)09-0561-05
