转基因植物发根农杆菌研究的进展及应用
2017-09-16熊笙屹厍润祥张璐孟令晨于月华倪志勇
熊笙屹++厍润祥++张璐++孟令晨++于月华++倪志勇
摘 要:农杆菌转化法作为植物基因工程使用最广泛的转化方法之一,分为根癌农杆菌Ti质粒和根瘤农杆菌Ri质粒2种类型。发根农杆菌(A gmbacterium rhiz-ogenes)的Ri质粒能够诱导植物产生毛状根。本文阐述了发根农杆菌的特性及 Ri质粒的分类、结构特征和转化特点,介绍了发根农杆菌在实际生产中的应用,分析了影响发根农杆菌成功转化的因素,综述了发根农杆菌在理论研究、植物基因工程、植物品种改良、植物次生代谢产物生产和植物栽培生根等方面的应用,并指出未来领域研究的着重点。
关键词:发根农杆菌;Ri质粒;研究进展;应用
中图分类号:Q943 文献标识码:A DOI:10.11974/nyyjs.20170833061
目前,转基因植物转化的方法主要有农杆菌转化法、花粉管通道法、核显微注射法、基因枪法等,农杆菌介导的遗传转化体系是在植物基因工程中相对完整、成熟的方法之一。在转基因植物中有80%以上是由农杆菌转化的,但是其中大部分是由根癌农杆菌Ti质粒转化获得的[1]。1907年,Smith和Townsend 发现发根农杆菌(A grobacterium rhizogenes)能诱导植物形成毛状根(hairy root),1934年Hildebrand就报道了发根农杆菌(A grobacterium rhizogenes)感染苹果树能诱导产生毛状根(hairy root)[2]。1977年,Montoya等首次应用Ti质粒作为载体将T-DNA上的农杆碱基因转入烟草细胞[3],标志着遗传转化新时代的到来。植物转基因技术逐步走向成熟,并成为植物基因工程改良新品种的基础技术。1982年,Chilton 报道发根农杆菌(A grobacterium rhizogenes)能诱导植物产生发状根(Hairy root),这种发状根又被称为毛状根,是由发根农杆菌所含有的 Ri质粒(Root inducing plasmid)引起的,Ri质粒不仅是遗传转化的优良载体 ,而且可直接感染植物细胞[4]。与根癌农杆菌Ti质粒相比 ,根瘤农杆菌Ri质粒转化具有以下优点;用Ri质粒作为基因载体时,不需要通过“解除武装”(disarmed)就可以很容易地从转化来的细胞上获得再生植株,即用野生型发根农杆菌感染植物可直接再生出完整的植株;由发根农杆菌转化的植物,其产生的毛状根均来源于同一个植物细胞[5]。毛状根的每一个细胞都是转基因的,更加有利于遗传操作;根瘤农杆菌Ri质粒不含onc基因,对再生植物的染色体影响极小;由发根农杆菌Ri质粒转化所产生的毛状根分化为正常植株的分化率高,倍性稳定,遗传稳定,并且容易建成一系列能够在不同植物细胞核染色体上插入一个T-DNA拷贝的株系[6]。尽管发根培养技术的发展历史虽然较短,但Ri质粒作为植物基因工程载体已显现出其可行性与方便性。随着科学研究的逐步深入,它将会成为比Ti质粒更理想的基因转移系统。更多的次生代谢物将会通过发根培养系统来生产,并被用于难以插活植物的生根和生产外源基因产品,特别是在获得转基因植物、培育新品种等方面存在广阔前景。
1 发根农杆菌及Ri质粒特征
1.1 发根农杆菌
发根农杆菌(A grobacterium rhizogenes)属于根瘤菌科(Rhizobitaceae)农杆菌属(A grobacterium)的革兰氏阴性菌。发根农杆菌是一类宿主范围广泛土壤杆菌,在侵染植物后,能够诱导植物产生大量高度分支的不定根,通常称为发根。发根农杆菌侵染植物所产生的发根具有生长速度快、分化程度高、生理生化和遗传性稳定、易于进行操作控制等特点[7]。发根农杆菌的致根特征结构包括染色体毒性基因(Chromosomal Virulence,ChV) 和Ri质粒2个部分。ChV是发根农杆菌的染色体基因,它的活化表达与发根农杆菌在植物细胞壁的附着有关。Ri,质粒是发根农杆菌染色体外的一个具有侵入性的质粒。在自然状态下,发根农杆菌通过伤口入侵植物,Ri质粒上的T-DNA能插入植物基因组,其上所攜带的基因在宿主细胞中整合表达,使植物产生毛状根。发根农杆菌的宿主范围随菌株的不同而发生变化[8]。发根农杆菌能够感染大多数双子叶植物和少数单子叶植物以及个别裸子。到目前为止,已有160 多种植物成功诱导出了毛状根,大多数集中在茄科、菊科、十字花科、旋花科、伞形科、豆科、石竹科、蓼科等,主要是草本植物,而木本植物较少有成功的报道 [9]。
1.2 发根农杆菌 Ri质粒的分类及基本特征
1.2.1 Ri质粒的分类
根据其合成冠瘿碱的不同,可将Ri质粒分为4种类型:甘露碱型(Mannopine Type),合成甘露碱及其酸、农杆碱酸与农杆碱素A;黄瓜碱型(Cucumopin Type),合成黄瓜碱;农杆碱型(Agropine Type),合成农杆碱及其酸、甘露碱及其酸、农杆碱素A;米奇矛型(Mikimopine Type)。发根农杆菌的致根特性与Ri质粒类型有关, Petit等发现含农杆碱型Ri质粒的发根农杆菌较甘露碱型、黄瓜碱型和米奇矛型有更为广泛的宿主范围。即使对同一种农杆菌来说,致根特性又与被接种的寄主植物及接种的部位有关[10]。
1.2.2 结构和类型
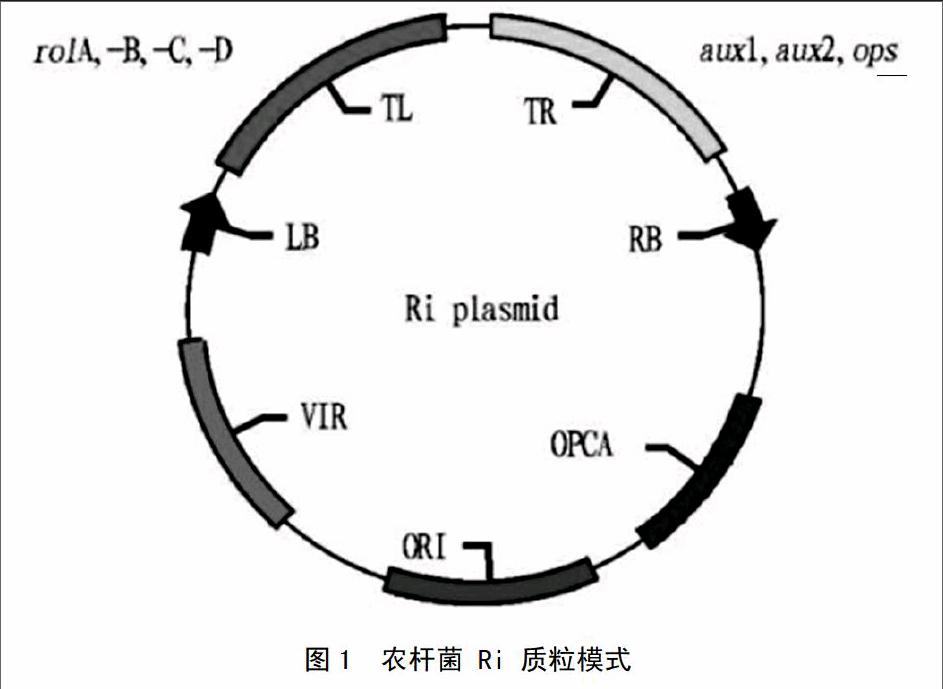
发根农杆菌 (含Ri质粒)侵染植物后会产生许多生长迅速、分枝呈毛状的不定根,称为毛状根。图1显示,Ri质粒为根诱导质粒(Root Inducing Plas mid);Ri质粒的大小为200~800kb,它含有负责发根自主性生长和冠瘿碱合成的基因,在结构上有致毒区(Vir区),转移进入植物细胞核的T-DNA区及其内部的冠瘿碱合成功能区等[11]。根据其合成冠瘿碱的不同,可将Ri质粒分为 4 种类型:甘露碱型(Mannopine Type),合成甘露碱及其酸、 农杆碱酸与农杆碱素A;黄瓜碱型(Cucumopin Type),合成黄瓜碱;农杆碱型(Agrop-ine Type),合成农杆碱及其酸、甘露碱及其酸、农杆碱素A;米奇矛型(Mikimopine Type),Petit等发现含农杆碱型Ri质粒的发根农杆菌较甘露碱型、瓜碱型和米奇矛型有更为广泛的宿主范围[12]。endprint
图1 农杆菌 Ri 质粒模式
1.2.3 Ri质粒转化特点
Ri质粒转化的优势主要表现在以下5个方面:Ri质粒可诱导植物外植体生成毛状根并由其再生成植株[13];生成的毛状根属于单克隆,可有效地避免嵌合体的形成;作为中间载体[14];Ri质粒与Ti质粒可共同构建双元载体,使Ti质粒和Ri质粒的应用范围更加广阔;毛状根在离体培养条件下具有合成原植株次生代谢产物的能力[15]。因此,Ri质粒作为植物基因工程的有效载体,可以生产出更多的次生代谢产物。近几年,发根农杆菌的应用领域已经越来越宽泛,备受国内外学者关注。
2 影响毛状根诱导的因素
2.1 菌株
目前采用的发根农杆菌主要有天然农杆碱型的A4、ATCCl5834、16834、LBA9402及1601、R1000、R1200等人工构造质粒;还有黄瓜碱型的2635、2657、2659等;以及甘露碱型的5196、TRl01、TR7等,不同菌株对不同植物或不同植株的侵染能力不同[16]。菌液浓度对毛状根的诱导也存在一定的影响。一般菌种浓度过大,细菌生长迅速,在一定程度上抑制细胞代谢过程,且不易除菌;浓度太稀,能附着在细胞的细菌太少,不足以形成足够的毛状根。
2.2 外植体
目前转化成功的植物主要是草本植物,尤以双子叶植物为多,也有为数不多的单子叶植物(如栝楼、旱墨莲、露水草)和少数木本植物(如银杏)等诱导成功。已成功诱导出毛状根的植物外植体有叶片,茎、子叶、愈伤组织、下胚轴等多种,但不同的外植体发状根的诱导率不同。受伤后酚类化合物的合成是影响植物对Ri质粒的敏感性的主要因素。外植体的选取十分关键,一般采用的都是较幼嫩的组织,因为这些细胞处于旺盛的分裂期,容易接受外源DNA。Ackrmann等首次報道了应用发根农杆菌转化高等植物之后,相继有成功的报道,而且转化植物的种类也不再仅仅局限于双子叶植物,已扩展至玉米、杨树、苹果等植物,在药用植物方面也有报道 [17]。
2.3 化学因子
植物受伤后产生的酚类物质能激活vir基因,促使Ri质粒向植物细胞转移,在转化系统中加入某种酚类物质可以促进基因转化。目前广泛使用的是AS、羟基乙酰丁香酮(OH-AS)和香草酚等酚类物质来诱导农杆菌, 并在一些转化试验中取得了好的效果,在发状根的诱导过程中,添加适当浓度的外源激素对于提高发状根的诱导频率有明显的促进作用。发根农杆菌Ri质粒的rolC生根基因的启动子活性受蔗糖浓度的调节,糖类物质可以协助乙酰丁香酮等物质诱导产生高水平的vir区基因表达,从而提高转化率[18]。
2.4 物理因子
2.4.1 光照强度、温度、pH值对毛状根的诱导有很大的影响
农杆菌与植物细胞进行共培养时,使用较低pH的培养基有利于转化频率的提高。原因可能是在偏酸的培养条件下,有利于农杆菌vir区基因的表达,但较低pH条件下,培养基的凝固状态较差.不利于试验操作,容易污染[19]。
2.4.2 超声波、微波和真空渗透处理
赵东利等在转化苦豆子时发现,采用真空7.0×10Pa渗透15min,可有效提高发根农杆菌对苦豆子的转化频率[20]。真空渗透处理在植物材料表面产生很多微损伤,抽真空后形成的负压使农杆菌更紧密地吸附于外植体伤口及伤口内细胞间隙,促进T-DNA向植物细胞导入。超声波处理也可在外植体上产生许多微小伤口,从而提高农杆菌与外植体之间的接触面积,提高转化频率。短暂微波辐射产生的热效应也有助于农杆菌T-DNA向植物细胞导入。
3 发根农杆菌的应用
3.1 用于获得转基因植物和培育作物新品种
由于发根农杆菌诱导生成的毛状根生长迅速、条件可控且遗传稳定性高,因而生成的毛状根是进行许多与植物根相关的理论研究的理想试验系统,将经过筛选的含有目的基因的毛状根转到分化培养基上诱导芽的产生,带芽组织再经生根培养即可诱导生根,成为一株完整的转基因再生植株。Ri质粒介导的转化更可以将外源功能基因导入植物根系,使其获得抗病、抗虫、抗重金属的多抗性。目前,烟草、苜蓿、豌豆、咖啡等植物都已经可以经毛状根诱导再生出完整的转基因植株。
此外,由发根农杆菌感染植物获得的毛状根所再生的后代会表现出顶端优势丧失、叶片皱缩、节间缩短、花形改变等现象[21]。这种再生植株的矮化现象在花卉矮化育种中具有特别的意义。
3.2 用于生产次生代谢产物
发根农杆菌诱导植物产生的毛状根能合成该植物的次生代谢物质,同时毛状根具有生长周期、培养条件简单、稳定性强、目的产物含量高等特点。因此, 发根培养技术是一种有效和可靠的生产合成植物次生代谢产物的有效途径,从毛状根培养物中寻找新的药用化合物具有潜在的应用价值。目前,通过毛状根培养可以生产的次生代谢物质有生物碱类(如吲哚生物碱、喹啉生物碱、茛菪烷生物碱等)、甙类(如人参皂甙、甜菜甙等)、黄酮类、醌类(如紫草宁等)、多糖类、 蛋白质(如天花粉蛋白等)和一些重要的生物酶(如超氧化物歧化酶)[22]。据不完全统计, 国内外已对23科50余种药用植物进行了毛状根诱导的研究,建立了长期的毛状根培养系统,获得了次生代谢产物[23]。
4 结语
近几年来,发根农杆菌及其Ri质粒在植物基因工程研究、植物次生代谢产物的生产、改良植物品种特性等方面,都取得了广泛的应用。但是利用发根农杆菌实际应用的研究开展的时间还比较短,理论基础还不扎实,许多潜在的问题和技术有待解决和完善。就目前的状况而言,未来该研究应注重研究以下2个方面:改善毛状根诱导的环境条件使其更加简单,降低对设备的需求,从而减少成本;次生代谢产物的合成机制,关键酶的作用机制以及收调控的核心因素。随着对发根农杆菌转化原理及次生代谢产物合成途径的逐步研究,农杆菌介导转化外源基因及表达的效率会不断提高,可转化的受体植物范围不断扩大,次生代谢产物合成的效率和产量不断提高,将为更多植物体加入新遗传特性的研究带来新的动力。同时,高效细胞培养技术的建立与不断完善,天然药物生物技术产品的商品化和产业化进程将大大加快,基于发根农杆菌介导的植物次生代谢工程将在农业、健康食品、功能食品和植物抗性等领域更好地造福人类。endprint
参考文献
[1]郑秀芳,金治平.植物遗传转化技术研究概况[J].河西学院学报,2002,10(5):66-70.
[2] Chilton M.D.,Tepfer D.A.,Petit A.,et al..A grobacterium rhizogenes insets T-DNA into the genomes of the host plant root cell[J].Nature,1982,295(5848):432-434.
[3] Montoya A.L.,Chilton M.D.,Gordon M.P.,et al..Oct opine and nopaline metabolism in a grobacterium tumefaciens and grown gall tumor cells: role of plasmid genes[J].Bacteriol,1977,129(1):101-107.
[4] Dessaux Y.,Petit A.,Tempe J.,et al..Chemistry and biochemistry of opines,chemical mediators of parasitism[J].Phytochemistry,1993,34(1):31-34.
[5]张荫麟,吕桂兰.金荞麦发状根培养的研究[J].植物学报,
1992,34(8):603-608.
[6] Petit A.,David A.,Dahl G.A.,et al..Futher extention of the opine concept:plasmids in A grobacterium rhizogenes cooperate for opine degradation[J].Mol.Gen.Genet,1983,190(2):204-214.
[7]侯萌萌,岳彩鹏,乔瑞丽,等.发根农杆菌对不同烟草品种发状根诱导和培养的影响[J].贵州农业科学,2010(11):8-11.
[8]杜旻,吴晓俊,王峥涛,等.发根农杆菌Ri质粒及其在植物基因工程中的应用[J].药物生物技术,2005,12(3):193-196.
[9]戴均贵,朱蔚华.发根培养技术在植物次生代谢物生产中的应用[J].植物生理学讯,1999,35(1):70.
[10]张毅,沈文辉.植物基因的新载体--农杆菌Ri质粒[J].生物工程学报,1989,5(3):173.
[11]陶锐,李莉,邱强,等.质粒转化药用植物的研究进展[J].农业与技术,2007,27(3):31-36.
[12] CHRISTEY M.C..Use of Ri-mediated transformation for production of transgenic plants[J]. In Vitro Cell Dev B iol Plant,2001(37):687-700.
[13]周达锋,卜学贤.发根农杆菌Ri质粒的分子生物学及其应用前景[J].植物学报,1993,10(2):24-34.
[14] SHIH-YOW H.,SHIH-NUNG C..Elucidation of the effects of nitrogen source on proliferation of transformed hairy roots and secondary metabolite productivity in a mist trickling reactor by redox potential measurement[J].Enzyme and Microbial Technology,2006,38(6):803-813.
[15]孙敏,陈安和.质粒转化及其在植物基因工程中的应用[J].渝州大学学报,1995,12(1):65-67.
[16]林丽,范海延,潘野,等.发根农杆菌Ri质粒及其在植物次生代谢物质生产中的应用[J].北方园艺,2007(11):94-97.
[17]刘琴,吴震,翁忙玲,等.发根农杆菌Ri质粒及其在植物科学中的应用[J].生物技通报,2002(5).
[18]姚春娜,王亚馥.超声波辅助的发根农杆菌对黄瓜的遗传转化[J].兰州大学学报(自然科学版),2001,37(5):77-81.
[19]王欣月.花器喷雾法接种根癌农杆菌转化矮生菜豆条件的初步探索[D].中国农业大学,2003.
[20]顾觉奋,陈光明,李淑珍,等.微生物转化法合成辅酶Q10[J].药学进展,2001,25(6):339-343.
[21]刘伟,郝建平.发根农杆菌的研究进展及其应用[J].山西农业科学,2007,35(7):13-16.
[22]王渭玲.膜荚黄芪营养特性及次生代謝调控的研究[D].西北农林科技大学,2008.
[23] SHAKYA N.M.,CHANDER S..Modelling of hillslope run off processes[J].Environmental Geology,1998,35(2):115-123.endprint
