莲草直胸跳甲热激基因sHsp21在湖南和海南两个地理种群中的差异表达分析
2017-09-16靳继苏周忠实郭建英
靳继苏,周忠实,郭建英
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
莲草直胸跳甲热激基因sHsp21在湖南和海南两个地理种群中的差异表达分析
靳继苏,周忠实,郭建英*
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
sHsp21(小热激蛋白)是小热激蛋白家族的成员,在外界环境压力下能够被诱导,热激后能够调节蛋白质的折叠和保护细胞免受外界胁迫。本文研究了入侵杂草空心莲子草Alternantheraphiloxeroides生防天敌莲草直胸跳甲的一个关键基因sHsp21,并对其进行热激诱导表达以及RACE全长扩增。获得全长cDNA 693 bp并完整的开放阅读框567 bp,共编码188个氨基酸。以30℃为对照,分别测定莲草直胸跳甲AgasicleshygrophilaSelman & Vogt长沙种群和海南种群在模拟夏季特定10 ∶00-14 ∶00时段36℃、39℃高温条件下sHsp21的表达量。连续热激 6 d,每天4 h热激后取样,实时荧光定量PCR分析显示:湖南种群高温39℃和36℃诱导下sHsp21表达量都显著高于对照组30℃;海南种群36℃诱导下的表达量与对照组30℃差异不显著,39℃诱导下的表达量显著高于对照组30℃和36℃。结果表明,sHsp21在湖南和海南两地理种群不同耐热能力上起到重要作用,并且sHsp21的高表达可能对其虫体产生副作用,为下一步深入探究其生物学功能奠定了一定的基础。
莲草直胸跳甲;小热激蛋白;荧光定量PCR;地理种群
目前,莲草直胸跳甲(AgasicleshygrophilaSelman & Vogt,1999)是控制空心莲子草最好的生防昆虫,经田间调查和室内模拟实验显示随着地理的差异,莲草直胸跳甲在湖南和海南表现出对温度的差异性,海南种群比湖南种群更耐热(未发表)。热激蛋白(Heat Shock Protein,HSPS)又称热休克蛋白或应激蛋白(Heat Stress Protein),是细胞或者生物体在一定的时间内遭受高于或者低于其正常生长温度时体内热激蛋白增加的一类蛋白质,它广泛分布于各个部位。热激蛋白是生物体在不利环境因素下(高温,低温)合成的一种进化上高度保守的蛋白质(王建义和慈忠玲,2008)。
1974年在果蝇幼虫因增加温度观察到一系列特殊的蛋白,低分子量热激蛋白(small Heat Shock Proteins,sHsps)因此而得名(夏佳音等,2007)。目前对于sHsps尚无明确的分类标准,根据已知的sHsps同源程度及分子量大小,Carper 等(1987)将各种生物体内存在的几十余种HSPs分为HSP110、HSP90、HSP70、HSP60及小分子HSP和泛素等6个家族。Morimoto等(1993)则将其分为HSP90、HSP70、HSP60、小分子HSP及泛素4个家族,认为来源不同的大分子HSPs(100 kDa以上)之间不具有相似的生物学特性,因此不能成为一个家族。但近年来研究又发现,大分子HSPs之间也拥有类似的功能,也可归为一个家族。因此,HSPs的分类是相对的,伴随着对其种类及生物活性的进一步认识和了解,其分类将会更趋合理。1982年,Ingoliademmg(Ingoliaetal.,1982)发现了果蝇的低分子量的热激蛋白与眼晶体蛋白在进化上的相关性。而几乎在100年前α晶体蛋白作为脊椎动物眼睛晶状体的主要结构蛋白已经有报道(Mrneretal.,1894)。像Hsp90,Hsp70等大部分的热激蛋白的研究已经很多了,但是对于小分子的热激蛋白研究相对较少,尤其是在鞘翅目昆虫当中。
小分子热激蛋白是组成最广泛同时也是最不保守的分子伴侣家族(Haslbecketal.,2005)。大多数生物都能表达多种小热激蛋白除了少数的真细菌不表达或者只表达一种且不同真核生物所含有的小分子热激蛋白基因数不同(Kappéetal.,2002;Narberhaus,2002)。许多研究表明,不管机体处于热激状态还是生理状态,其都会参与复杂的和重要的生物学过程。如:作为分子伴侣,阻止蛋白之间不必要的相互作用,帮助变性蛋白重新折叠(Beckmannetal.,1990),诱导生物体的耐热性(Dahlgaardetal.,1998),稳定细胞骨架,参与细胞损伤与修复,在生物体的生长、发育及进化过程中,在维持机体的生理状态以及某些疾病的病理生理过程中均发挥重要的作用。
小休克蛋白的结构也并不复杂,它们的主要结构是有N端和C端2个部分组成(Gusevetal.,2002)。由于它们N端域的存在,使得在同一个物种之间具有很强的相对保守性。在生理状态下,小休克蛋白处于低聚状态,不与其他的低聚复合物结合,维持细胞内的稳定。C端域含有一个相当保守的α晶体蛋白(α-crystallin)结构域(Horwitz,1992),该结构域是小热休克蛋白家族成员共有的结构域,在同一个物种之间它们高度保守,甚至在不同的物种之间也具有很高的的保守性。在低聚状态下能够很好的使其起着分子伴侣的功能。不同的小休克蛋白行使分子伴侣功能的状态是有所不同的。例如是sHsp20有二聚体和低聚体两种形式存在,在受到外界刺激的时候,二聚体发生变化聚合形成活性更高的低聚体复合物。又如酵母HSP26在生理温度下是二十四聚体复合物,在受到刺激(热激等)之后,二十四聚体复合物解离成具有生物活性的的二聚体复合物(Skouri-Panetetal.,2006)。
小热激蛋白在维持细胞蛋白的稳定、膜的维护、稳定细胞骨架以及在核内行使功能有着重要的意义。sHsp的主要功能是与其它蛋白质进行相互作用,从而使完成生命过程中的各种细胞蛋白保持稳定。当细胞受到外界胁迫时,会导致细胞蛋白变性,从而与sHsp结合,形sHsp-底物复合物。当外界刺激恢复正常之后,sHsp-底物复合物分离,在需要消耗能量的分子伴侣如Hsp70在ATP的帮助下重新折叠成正确的构象,行使正常功能(夏佳音,2007)。因此,sHsp能够非常有效的阻止蛋白变性,从而保护细胞免受热激、凋亡等伤害。此外,有研究显示,sHsp与膜的流动有关(Víghetal.,2007)。例如乳酸杆菌的小热激蛋白Lo18在热激的条件下与细胞膜相互作用来调节膜的流动性(Coucheneyetal.,2005)。此外,小热激蛋白对参与细胞凋亡也有一定的作用。本实验对莲草直胸跳甲小热激蛋白21(sHsp21)基因的克隆分析,通过实时荧光定量PCR检测技术,检测了莲草直胸跳甲两个地理种群雌雄虫基因组DNA中sHsp21的表达量。来进一步揭示莲草直胸跳甲耐热性的差异与热激蛋白基因拷贝数间关系,为全面了解sHsp21在莲草直胸跳甲中作用的深入研究奠定基础。
1 材料与方法
1.1 供试昆虫
湖南与海南新采集标本,在实验室饲养一代后做实验,饲养温度25℃±2℃,湿度75%-90%,光周期L ∶D=14 ∶10。
1.2 供试植物
在中国农业科学院植物保护研究所温室连续饲养的空心莲子草。
1.3 温度处理
采集刚羽化的的成虫(雌雄比1 ∶1),在恒温培养箱中进行高温处理(30℃、36℃和39℃)4 h,然后在25℃恢复,以30℃为对照,连续处理6 d,每天采集雌雄虫各6头,液氮速冻后,-80℃ 保存备用。
1.4 主要试剂和仪器
本研究所有的引物及DNA测序由生工生物工程(上海)股份有限公司完成。常用Taq酶、dNTP等试剂购自北京全式金公司。反转录试剂盒,T3载体,qPCR试剂盒等购自全式金生物公司。
1.5 总RNA提取及第一链cDNA的合成
收集刚羽化的莲草直胸跳甲20头,采集后立即用液氮处理冻存,放入-80℃冰箱保存备用或者立即进行实验。用TRIzol法分离提取总的RNA,步骤为:将冻存的莲草直胸跳甲样品放入进口的1.5 mL EP试管中,迅速加入液氮中进行研磨,研磨好后加入1 mL Trizol,用振荡器震荡3 min,室温静置5 min后加入0.2 mL氯仿充分震荡混匀15 s,室温放置5 min,4℃条件下12000 rpm,15 min离心;吸取上清液于另一个1.5 mL EP试管中,加入等体积的异丙醇震荡混匀,室温放置10 min,4℃条件下12000 rpm,15 min离心;弃上清液加入1 mL 75% 乙醇,4℃条件下12000 rpm,10 min离心;弃上清,并在超净工作台放置 5 min,加入适量的DEPC处理5 min使RNA沉淀充分溶解,-80℃保存以备用,或立即用于逆转录。用IMPLEN NanoPhotometer P-Class P330(核酸蛋白分光光度计)和琼脂糖凝胶电泳检测RNA的纯度和完整性。根据Transscript One-Step gDNA Removal and cDNA Synthesis Supermix反转录试剂盒说明,合成第一链cDNA,贮存于-20℃冰箱备用。
1.6 sHsp21中间片段以及全长获得
根据转录组测序和NCBI库比对结果,应用Primer Primer 5.0软件设计上下游的引物(表1)对序列进行扩增,扩增体积为20 μL。PCR的反应体系为:10×PCR buffer 2.5 μL、dNTP (2.5 Mm)0.5 μL、引物(10 uM/μL)0.5 μL、Taq酶(2.5 U/μL)0.25 μL、模版DNA 2 μL、ddH2O 18.75 μL。反应程序为:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,35循环;72℃延伸10 min。PCR扩增产物用1%琼脂糖凝胶电泳,将PCR产物胶回收纯化后,连接至PEASY-T3载体,然后转化到大肠杆菌感受态细胞,在选择性的培养基上进行培养,然后进行PCR筛选阳性克隆后测序。根据得到的中间片段设计两对特异性引物(GSP)(表1)反应程序和体系根据SMARTer RACE 5′/3′ Kit试剂盒,阳性克隆后测序进行剪切拼接获得全长。

表1 小热激蛋白21(sHsp21)基因PCR引物序列
1.7 qPCR检测目的基因sHsp21的表达水平
以上述提取的总RNA经反转录获得的cDNA为模版,以β-actin基因作为内参基因,qPCR检测莲草直胸跳甲抗逆基因sHsp21在不同温度刺激条件下的表达变化。qPCR的反应条件:95℃预变性1 min,95℃变性15 s,60℃退火30 s,72℃延伸1 min,40个循环;融解曲线为:95℃变性1 min,60℃退火30 s,95℃变性1 min,60℃退火30 s,1个循环,实时采集荧光。
2 结果与分析
2.1 sHsp21的同源性和系统发育分析
sHsp21在莲草直胸跳甲卵巢中分离鉴定出来,通过RT-PCR和RACE-PCR获得了全长693 bp的cDNA,其中完整的开放阅读框(ORF)567 bp,共编码188个氨基酸。对克隆的的基因序列用NCBI的BLASTn和BLASTx进行相似性比对,并将翻译成的氨基酸通过DANMAN软件进行同源性比对(图3)。结果显示该序列与其近缘稻水象甲的Hsp21核苷酸序列相似度很高,其相似性达到74%,并且与其它鞘翅目昆虫之间也有较高的相似性。因此,可确定克隆的序列为莲草直胸跳甲sHsp21目的基因。利用MEGA 5.0软件将8种来源不同的昆虫11种相似性较高的小热激蛋白的氨基酸序列进行比对(刘慧春等,2013),采用Neighbor-Joining法,构建Bootstrap系统发育树(图4)。结果表明,昆虫纲的4个目的下的8个物种都能够聚类分开,该聚类结果与昆虫学传统的分类是一致的,由此可以看出sHsp21是一个很保守的功能基因,能够作为昆虫系统进化分析的基因。
图1 莲草直胸跳甲sHsp21电泳图Fig.1 The electrophoretogram of Agasicles hygrophila

图2 莲草直胸跳甲sHsp21氨基酸序列及基因序列Fig.2 The acid sequence and gene sequence of the sHsp21 of Agasicles hygrophila
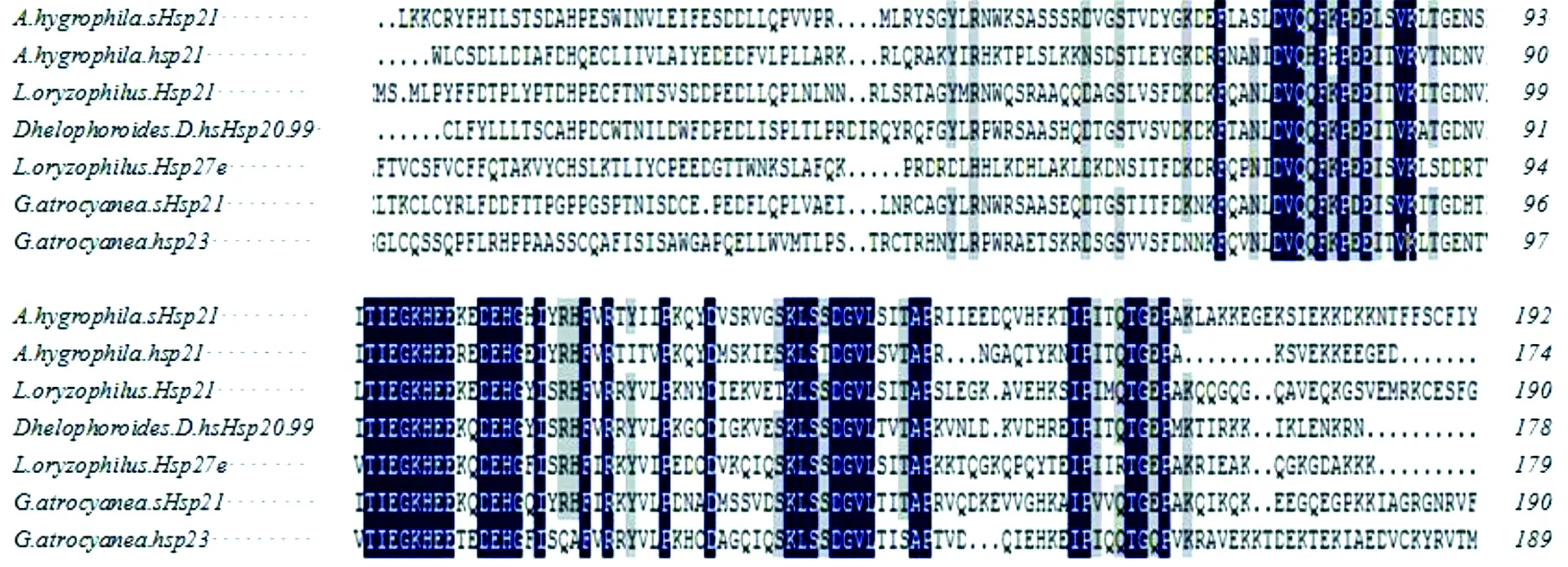
图3 莲草直胸跳甲sHsp21与其他昆虫氨基酸序列的同源性比较Fig. 3 Comparison of the amino acid sequences of sHsp21 in Agasicles hygrophila and other insects注:Agasicles hygrophila, 莲草直胸跳甲;L. oryzophilus, 稻水象甲(KC620424.1)D. helophoroides, 花绒寄甲(KU050686.1);G. atrocyanea, 酸模叶甲(AB207213.1).

图4 用MEGA5.0构建8种昆虫sHsp21的系统进化树Fig.4 Phylogenetic tree based on the amino acid sequences alignment of sHsp21 in 8 insects with MEGA
2.2 高温胁迫对sHsp21基因的表达
将海南和湖南莲草直胸跳甲sHsp21的cDNA等比例(2-1)稀释成不同的浓度(2-1~2-6)做标准曲线,其相关系数R2=0.991,扩增效率E=99.884%。内参基因相关系数R2=1,扩增效率E=96.265。两个基因的相关系数R2(0.98≦R≦1)和扩增效率E(95≦E%≦105)近似,表明可以运用相对定量的方法来评估目的基因的表达量。采用定量PCR的方法检测sHsp21在高温30℃、36℃和39℃条件下的相对表达水平,30℃为对照组。结果表明(图5,6),湖南种群高温39℃,36℃诱导下sHsp21基因的表达量显著高于对照组30℃;海南种群36℃诱导下的表达量与对照组30℃差异不显著,39℃诱导下的表达量显著高于对照组30℃和36℃。但39℃高温诱导下1-6 d之间的表达量差异不显著。由于海南地区的平均气温要高于湖南地区的平均气温,推测海南种群莲草直胸跳甲逐渐适应了高温条件,而湖南种群由于没有适应高温条件,所以短时的高温使热激蛋白升高从而影响了其寿命,繁殖力等。这也间接的说明了高温条件下海南种群比长沙种群更耐热。
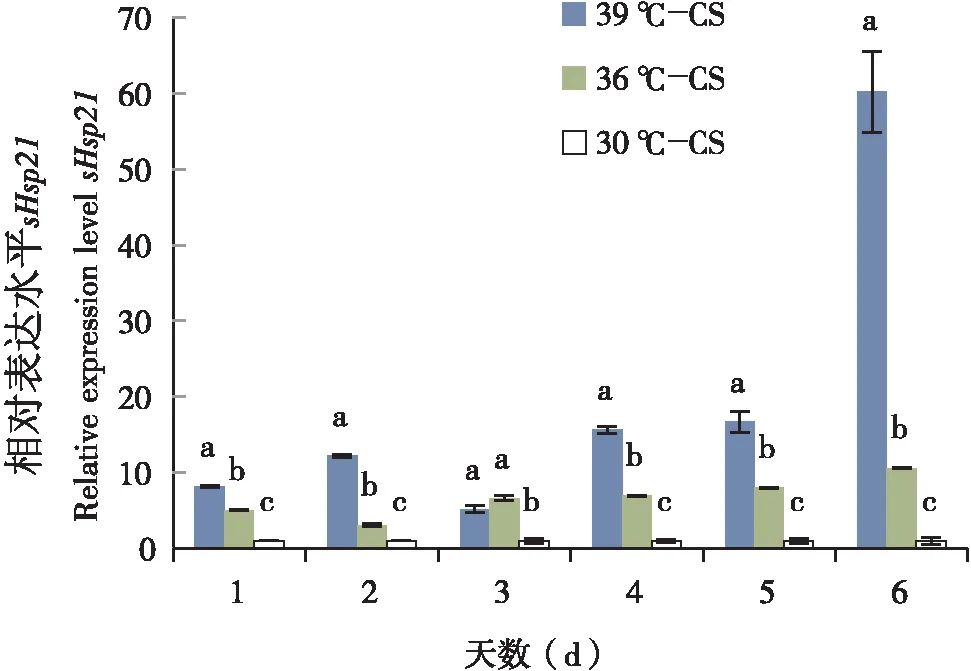
图5 湖南种群莲草直胸跳甲sHsp21在30℃,36℃和39℃下的诱导表达Fig.5 High temperature of 30℃, 36℃ and 39℃ induced expression profiles of sHsp21 in Agasicles hygrophila in Hunan
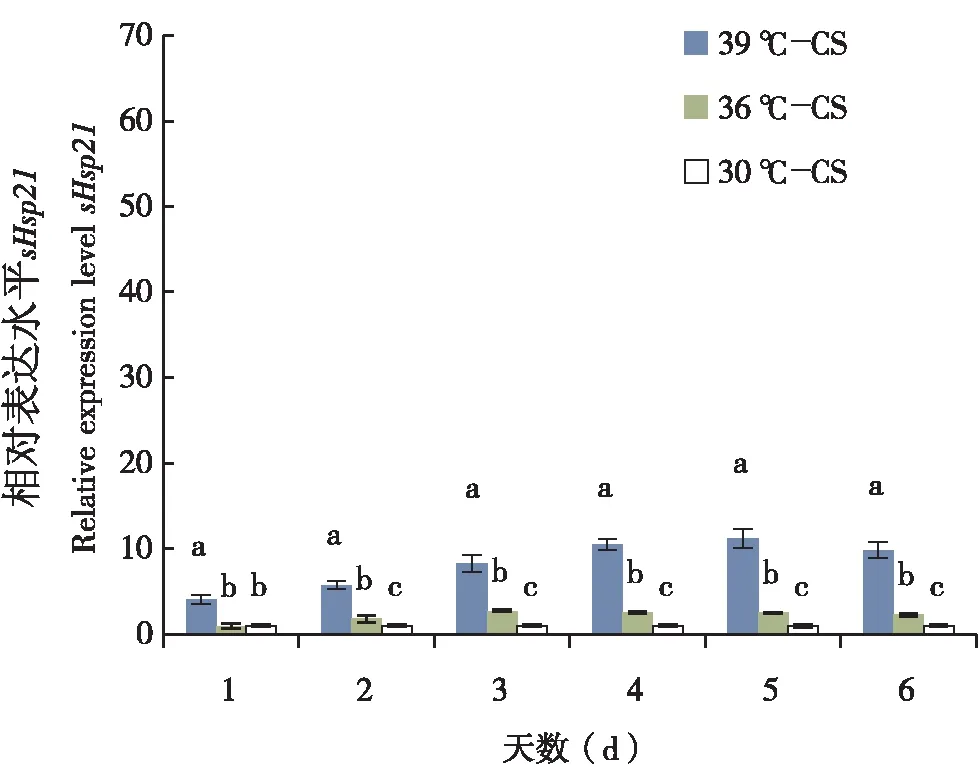
图6 海南种群莲草直胸跳甲sHsp21在30℃,36 ℃和39℃下的诱导表达Fig.6 High temperature of 30℃, 36℃ and 39℃ induced expression profiles of sHsp21 in Agasicles hygrophila in Hainan
3 结论与讨论
本研究通过克隆获得全长693 bp的cDNA,其中完整的开放阅读框(ORF)567 bp,共编码188个氨基酸。序列分析显示sHsp21是小热激蛋白家族的成员包括保守域,比如说N-氨基酸末端区域,α晶体蛋白(α-crystallin)结构域和C-氨基酸末端区域(Jongetal.,1998)。根据系统进化分析,小分子量热激蛋白和其它鞘翅目昆虫有很高的同源性,由此推测小热激蛋白基因有很长的独立进化历史。
热激处理之后通过实时荧光定量PCR检测sHsp21的表达水平来判断在湖南种群和海南种群两地的差异表达并且高于常温处理的表达水平。但是本研究没有从莲草直胸跳甲各个虫态以及各个部位进行研究,只是对全虫进行连续一周的热处理等一系列的实验,这是不同于其它文献研究。在柞蚕的研究中,小热激蛋白21在血细胞,卵巢,精巢以及中肠中都有表达,脂肪体中极少表达(Liuetal.,2013)。黑腹果蝇研究中,热激蛋白基因在雄配子中也有表达(Joanisseetal.,1998)。
在本研究中比较了湖南长沙和海南万宁的种群莲草直胸跳甲小热激蛋白sHsp21的表达量。对于长沙种群随着温度的升高小热激蛋白sHsp21的表达量升高,并且随着温度的升高长沙种群的莲草直胸跳甲的寿命、产卵量、孵化率等显著降低(赵梅婷等未发表)。而海南种群在30℃和36℃热激处理后sHsp21的表达量没有显著差异。本研究推测热激蛋白的过量表达对长沙种群产生了负效应,有研究表明每个物种的热激蛋白的过量表达,其种群都在有益和损失之间维持平衡(Sørensenetal.,2003)。比如:热激蛋白的过量表达是以显著影响其生长发育速率和生殖力作为代价(Sørensenetal.,2003)。热激蛋白的过量表达会降低成虫的寿命,产卵量等其它的生理特性,在果蝇的研究中Hsp70的过量表达显著降低了各个虫态的年龄组成,减少成熟后代的数量以及抑制卵的孵化率(Silbermannetal.,2000)。本研究结果表明sHsp21在莲草直胸跳甲高温耐受性上可能起到重要作用并且sHsp21的高表达可能对其虫体产生负作用,为下一步深入探究其生物学功能奠定了一定的基础。在本实验的研究中,长沙种群sHsp21过量表达,而海南种群则维持在一定的水平,是否sHsp21是影响长沙种群莲草直胸跳甲的寿命以及生殖力等在高温条件下显著低于海南种群的关键基因呢?需要进一步去深入研究验证。
References)
Beckmann RP, Mizzen LE, Welch WJ. Interaction of Hsp70 with newly synthesized proteins: Implications for protein folding and assembly [J].Science, 1990, 248 (4957): 850-854.
Coucheney F, Gal L, Beney L,etal. A small HSP, Lo18, interacts with the cell membrane and modulates lipid physical state under heat shock conditions in a lactic acid bacterium [J].BBA-Biomembranes, 2005, 1720 (1-2):92-98.
Cui XH, Xie M, Wan FH. Changes in expression level of heat shock protein 70 gene inBemisiatabaciB-biotype (Homoptera: Aleyrodidae)under high temperature stress [J].ActaEntomologicaSinica, 2007, 50 (11): 1087-1091. [崔旭红, 谢明, 万方浩. 高温胁迫下B型烟粉虱热激蛋白基因hsp70表达量的变化[J]. 昆虫学报, 2007, 50 (11): 1087-1091]
Dahlgaard J, Loeschcke V, Michalak P,etal. Induced thermotolerance and associated expression of the heat-shock protein Hsp70 in adultDrosophilamelanogaster[J].FunctionalEcology, 1998, 12 (5): 786-793.
De Jong WW, Caspers GJ, Leunissen JAM. Genealogy of the α-crystallin—small heat-shock protein superfamily [J].InternationalJournalofBiologicalMacromolecules, 1998, 22 (3): 151-162.
Fei YB, Huang T, Shu NH. Advances of molecular biology on heat shock proteins [J].ChineseBulletinofBotany, 1995, 12 (1): 1251. [费云标, 黄涛, 舒念红, 等. 热激蛋白的分子生物学研究进展[J]. 植物学通报, 1995, 12 (1): 1251]
Gusev NB, Bogatcheva NV, Marston SB. Structure and properties of small heat shock proteins (sHsp)and their interaction with cytoskeleton proteins [J].Biochemistry(Moscow), 2002, 67 (5): 511-519.
Haslbeck M, Franzmann T, Weinfurtner D,etal. Some like it hot: The structure and function of small heat-shock proteins [J].NatureStructural&MolecularBiology, 2005, 12 (10): 842-846.
Horwitz J. Alpha-crystallin can function as a molecular chaperone [J].ProceedingsoftheNationalAcademyofSciences, 1992, 89 (21): 10449-10453.
Ingolia TD, Craig EA. Four small Drosophila heat shock proteins are related to each other and to mammalian alpha-crystallin [J].ProceedingsoftheNationalAcademyofSciences, 1982, 79 (7): 2360-2364.
Joanisse DR, Michaud S, Inaguma Y,etal. Small heat shock proteins ofDrosophila: Developmental expression and functions [J].JournalofBiosciences, 1998, 23 (4): 369-376.
Kappé G, Leunissen JAM, de Jong WW. Evolution andDiversity of Prokaryotic Small Heat Shock Proteins [M]. // Small Stress Proteins. Springer Berlin Heidelberg, 2002: 1-17.
Liu HC, Tian DQ, Liu JX,etal. Molecular cloning and low temperature induced expression of an alternative oxidase geneAnthuriumandrawanum[J].ActaAgriculturaeNucleataeSinica, 2013, 27 (10): 1464-1472. [刘慧春, 田丹青, 刘建新, 等. 红掌交替氧化酶基因克隆及其在低温胁迫下的表达分析[J]. 核农学报, 2013, 27 (10): 1464-1472]
Liu QN, Zhu BJ, Dai LS,etal. Overexpression of small heat shock protein 21 protects the Chinese oak silkwormAntheraeapernyiagainst thermal stress [J].JournalofInsectPhysiology, 2013, 59 (8): 848-854.
Mrner CT. Untersuchung der Protensubstanzen in den leichtbrechenden Medien des Auges I [J].ZeitschriftfürPhysiologischeChemie, 1894, 18 (1): 61-106.
Narberhaus F. α-Crystallin-type heat shock proteins:Socializing minichaperones in the context of a multichaperone network [J].MicrobiologyandMolecularBiologyReviews, 2002, 66 (1): 64-93.
Silbermann R, Tatar M. Reproductive costs of heat shock protein in transgenicDrosophilamelanogaster[J].Evolution, 2000, 54 (6): 2038-2045.
Skouri-Panet F, Quevillon-Cheruel S, Michiel M,etal. sHSPs under temperature and pressure: The opposite behaviour of lens alpha-crystallins and yeast HSP26 [J].BiochimicaetBiophysicaActa(BBA)-ProteinsandProteomics, 2006, 1764 (3): 372-383.
Sørensen JG, Kristensen TN, Loeschcke V. The evolutionary and ecological role of heat shock proteins [J].EcologyLetters, 2003, 6 (11): 1025-1037.
Vígh L, Trk Z, Balogh G,etal. Membrane-regulated stress response: A theoretical and practical approach [J].AdvancesinExperimentalMedicine&Biology, 2007, 594 (1): 114-131.
Wang JY, Ci ZL. Advances in study of heat shock protein [J].ShanxiForestryScienceAndTechnology, 2008, 1: 27-32. [王建义, 慈忠玲. 热激蛋白的研究进展[J]. 山西林业科技, 2008, 1: 27-32]
Xia JY, Zhang YZ, Structure and function of small heat shock proteins [J].ChineseJournalofBiochemistryandMolecularBiology, 2007, 23 (11): 911-915. [夏佳音, 张耀洲. 小热休克蛋白的结构和功能[J]. 中国生物化学与分子生物学报, 2007, 23 (11): 911-915]
ThedifferentialexpressionanalysisofthesHsp21geneofHunanandHainantwogeographicpopulationsofAgasicleshygrophilaSelman&Vogt(Coleoptera:Cheysomelidae)
JIN Ji-Su, ZHOU Zhong-Shi, GUO Jian-Ying*
(State Key Laboratory for Biology of Plant Diseases and Insect Pests/Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
As a member of the family of small heat shock proteins, it is possible that thesHsp21 can be induced under certain circumstances, for example, under the pressure from external environment. As the heat shock is able to adjust the folding of protein and protect cells from damage of the outside stress. Focusing on thesHsp21, this paper mainly studied the relevant genes ofAgasicleshygrophilaSelman & Vogt, which is a promising biological control agent for invasiveAlternantheraphiloxeroidesand carries on the expression of heat shock induced, as well as total length of amplification by RACE. The full length we observed of cDNA is 693 bp while it contains a complete set of open reading frame of 567 bp, encoding 188 amino acids. Using constant temperature 30℃ as control. We manged to measure thesHsp21 expressive quantity of Hunan population and Hainan population under the simulative high-temperature period (10 ∶00-14 ∶00)of summer at 36℃、39℃ respectively. The consistant heat shocking lasted six consecutive days and sampling is arranged to be done 4 hours afterwards. The result of Real-time fluorescent quantitative PCR analysis suggests that: Hunan population under the 39℃, 36℃ high temperature inducedsHsp21 gene expressive quantity is significantly higher than the control group 30℃; Hainan population 36℃ under the high temperature induced thesHsp21 expression of the quantity is of no significant difference to the control group 30℃. Meanwhile, under the 39℃ high temperaturesHsp21 gene expressive quantity is significantly higher than the 36℃ and 30℃. Which leads to the conclusion thatsHsp21 onAgasicleshygrophilahigh temperature tolerance may play an important role as well as the high expression ofsHsp21 may cause negative effect to the insect (on its own), therefore provided us a certain foundation as we delve one step closer into the biological function ofsHsp21.
Agasicleshygrophila; small Heat Shock Protein (sHsp); RT-PCR; geographic populations
国家自然科学基金(31572068,31272107)
靳继苏,1991年生,硕士研究生,E-mail: jinjisu9110@163.com
*通信作者Author for correspondence, E-mail: Guojianying@caas.cn
Received: 2017-05-24; 接受日期Accepted: 2017-07-21
Q963;S433.5
:A
1674-0858(2017)04-0898-07
靳继苏,周忠实,郭建英.莲草直胸跳甲热激基因sHsp21在湖南和海南两个地理种群中的差异表达分析[J].环境昆虫学报,2017,39(4):898-904.
