利用深黄伞形霉生产油脂的研究进展
2017-09-15张建国
冯 豪, 张建国
(上海理工大学 医疗器械与食品学院,上海 200093)
利用深黄伞形霉生产油脂的研究进展
冯 豪, 张建国
(上海理工大学 医疗器械与食品学院,上海 200093)
总结了深黄伞型霉的不饱和脂肪酸含量高、品种多、易培养的优点.介绍了运用化学诱变和基因工程技术对深黄伞形霉菌种的选育和改造,以及深黄伞形霉产油脂的培养工艺和提取工艺的研究成果.研究表明,深黄伞型霉是产生油脂的优良菌种,为深黄伞形霉生产油脂和不饱和脂肪酸提供基础.
深黄伞形霉; 不饱和脂肪酸; 油脂; 菌种选育; 培养; 提取
油脂是人类生活和生产活动中不可缺少的物质,油脂中的不饱和脂肪酸对人体健康有重要作用[1].研究表明,不饱和脂肪酸能预防心血管疾病、高血压、II型糖尿病、骨质疏松、癌症、炎症、免疫缺陷症等[2].但是,我国油脂供应处于短缺的现状,据统计,2014年我国食用油消费量达3 167.4万t,人均食用油消费量为23.2 kg,但自给率不足40 %[3].为了解决油脂匮乏的问题,微生物油脂已经作为油脂供应的新来源引起了人们的重视.微生物油脂是指利用富油微生物积累的油脂.通常,微生物细胞体内合成和贮存油脂超过细胞干重20 %的微生物被称为富油微生物.人们利用富油微生物以生物质为原料积累油脂,进行生物质材料的循环利用.微生物油脂也被当作一种重要的可再生能源被广泛重视.微生物积累油脂的主要优点有:a.微生物可以常年培养,不受季节限制,代增周期为20 min到2 d.而植物的生长受到气候的影响,一年内的生长周期受到严格限制[4];b.微生物可以进行液体的深层培养,不受场地的限制,大大节约了土地的使用;c.微生物可以多种糖为原料,甚至可以直接利用生物质原料,促进了生物质废物的循环利用,变废为宝[5];d.微生物油脂的含量和组成可以根据条件进行控制,有利于满足对油脂品质的要求[6];e.微生物的种类多,细菌、酵母、霉菌和藻类中都有产油菌株,但霉菌类真核产油微生物积累的油脂成分与常规植物油更接近[7].微生物油脂也有亟待改进的方面:a.目前富油微生物的品种繁多,富油微生物存在于原核生物、真核生物中,研究也比较分散;b.市场上对微生物油脂的认可度还有待于提高.
深黄伞形霉(Umbelopsisisabellina),曾被命名为深黄被孢霉(Mortierelaisabellina)属于毛霉目,是一种丝状真菌,菌丝形态可以根据培养条件而改变,是一种著名的富油微生物种类.2003年Meyers等利用限制性片段长度差异性(RFLP)和 转录空间序列分析技术(ITS1)鉴定深黄伞形霉不属于被孢霉[8].这个结果也在2014年深黄伞形霉基因组测序之后被证实.曾经命名为深黄被孢霉的著名富油菌株NBRC7884的基因组中76.1%蛋白质和拉曼伞形霉(Umbelopsisramanniana)同源[9].深黄伞形霉的含油量可高达86%[10].深黄伞形霉的积累油脂工艺和机制已被很多学者关注、优化、解释.深黄伞形霉作为一种富油微生物,菌丝油脂含量较高,能在5~35 ℃的温度范围内生长.低温能引起深黄伞形霉中合成多不饱和脂肪酸相关基因的mRNA转录水平的变化,并且增强Δ6-脂肪酸脱氢以及碳链延长的作用,促进不饱和脂肪酸的合成[11].毒力研究表明,深黄伞形霉发酵生产油脂是安全的.日本、欧洲已有利用深黄伞形霉生产脂肪酸产品上市.迄今,国内外已有大量深黄伞形霉的研究,采用压榨和化学提取的方法生产油脂,存在污染环境、有害杂质含量多、易变质等问题.绿色提取技术也是现代生物技术的必要组成部分.本文总结了深黄伞形霉积累油脂的研究进展,分析了深黄伞形霉作为食用油脂来源的壁垒,展望了深黄伞形霉生产食用油脂的前景.
1 深黄伞形霉的特点
1.1 富含不饱和脂肪酸
深黄伞形霉积累的油脂主要的脂肪酸组分为C18和C16脂肪酸,而且不饱和脂肪含量高,主要有油酸、亚油酸、亚麻酸.深黄伞形霉的不饱和脂肪酸组成受到培养条件的影响,不饱和脂肪酸含量可达50%~90%.表1总结了深黄伞形霉中脂肪酸组成成分.C18∶1是深黄伞形霉不饱和脂肪酸中的一个重要组分.多数条件下C18∶1的比例为51.64%~56.2%[12].利用预处理后的花旗松为原料培养深黄伞形霉中C18∶1的比例可高达63.4%[13].固态培养时C18∶1的比例为20%左右[14].以蔗糖为底物时,比例低至1.24%[15].不同培养方式中不饱和脂肪酸种类的比例也发生变化,但是,不饱和脂肪酸的总比例依然高达50%~90%.深黄伞形霉也含有花生三烯酸(C20∶3,6)、花生四烯酸(C20∶4,6)、二十二碳六烯酸(C22∶3,3)[16].
1.2 优良菌种众多
目前已经报道很多种深黄伞形霉可以积累高含量的油脂.比较突出的是Suzuki报道的NBRC7884菌株积累的油脂占细胞干重的86%[10].我国很多学者也从我国的微生物菌种库中筛选油脂含量高的深黄伞形霉.例如,中国典型微生物保藏中心的CCTCC NO:M2010195可以积累高含量的γ-亚麻酸(10%)[24].CCTCC:M 2012152的油脂包含20%~37.3% α-亚油酸、8.5%~10.3% γ-亚油酸[25].为了提高深黄伞形霉中油脂的含量,采用菌种突变进行优良菌种选育是常用而且有效的方法.表2总结了目前对深黄被孢霉富油菌突变和菌种改造的结果.紫外线诱变是使用最多的突变方法.而且紫外线与其他化学试剂联合诱变的研究较多[26-28].突变后油脂含量可高达61.47%.硫酸二乙酯和Co60也可以对深黄伞形霉进行诱变[29].文献[30]以Co60辐射诱变深黄伞形霉,筛选得到的突变菌株经过优化培养后,生物量为51.31 g/L,含油率为39.547%,不饱和脂肪酸含量占85.71%.γ-亚麻酸是人和动物食物中重要的多烯不饱和脂肪酸.大多数油料作物种子中不含有γ-亚麻酸,因此,高产γ-亚麻酸的深黄伞形霉菌株一直是筛选的目标.李明春等对深黄伞形霉原生质体紫外线诱变.紫外线(UV)照射45 s后获得高产突变株HM23,比对照组M6-22菌的γ-亚麻酸产量提高了70.7%[31].通过紫外线和氯化锂联合诱变得到γ-亚麻酸含量高达6.39%的SHFU-13菌株[32].紫外线和硫酸二乙酯联合突变得到γ-亚麻酸含量高达10.97%的H3.3410-5菌株[33].陈波等采用紫外线诱变,获得了深黄伞形霉突变株M80,其菌体质量浓度达25.10 g/L、γ-亚麻酸产量达771.88 mg/L[34].郝冉等[35]和刘胜男等[36]分别采用突变育种得到的高产深黄伞型霉菌株产量分别能达到889 mg/L和1 236 mg/L.
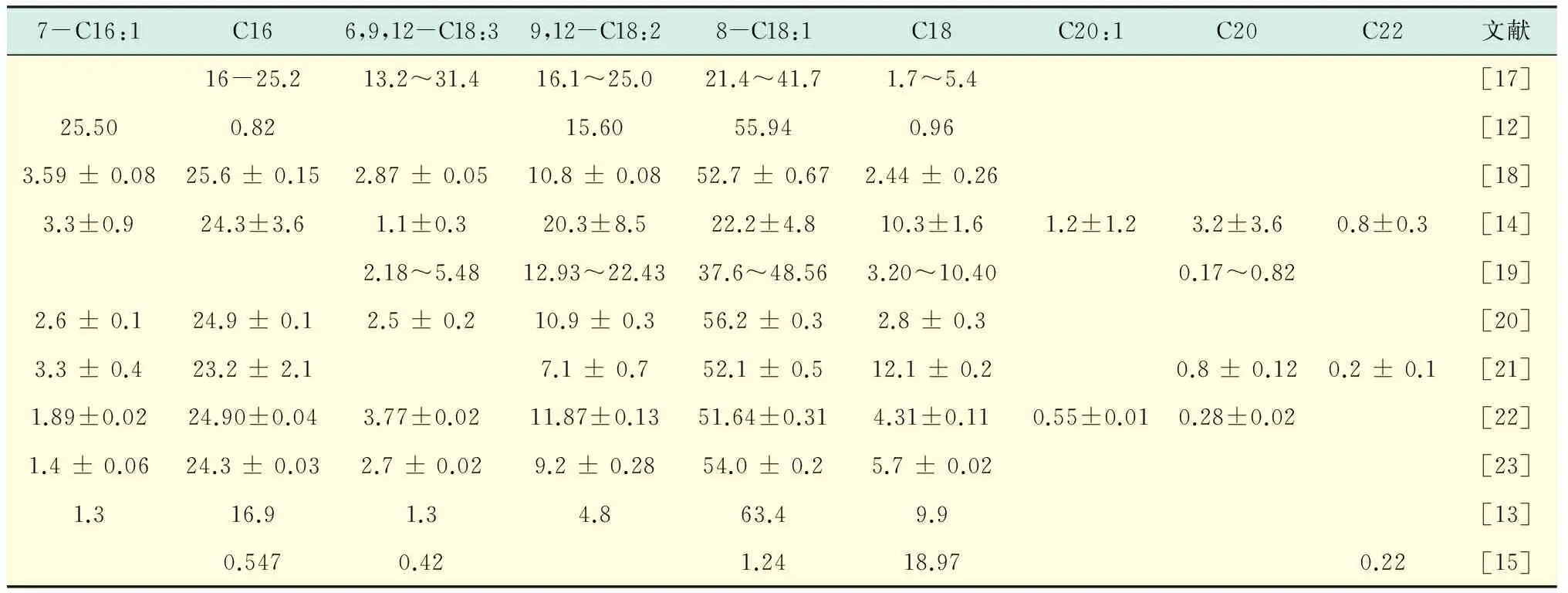
表1 目前报道的深黄伞形霉油脂组分分布Tab.1 Lipid profiles of different Umbelopsis isabellina strains %
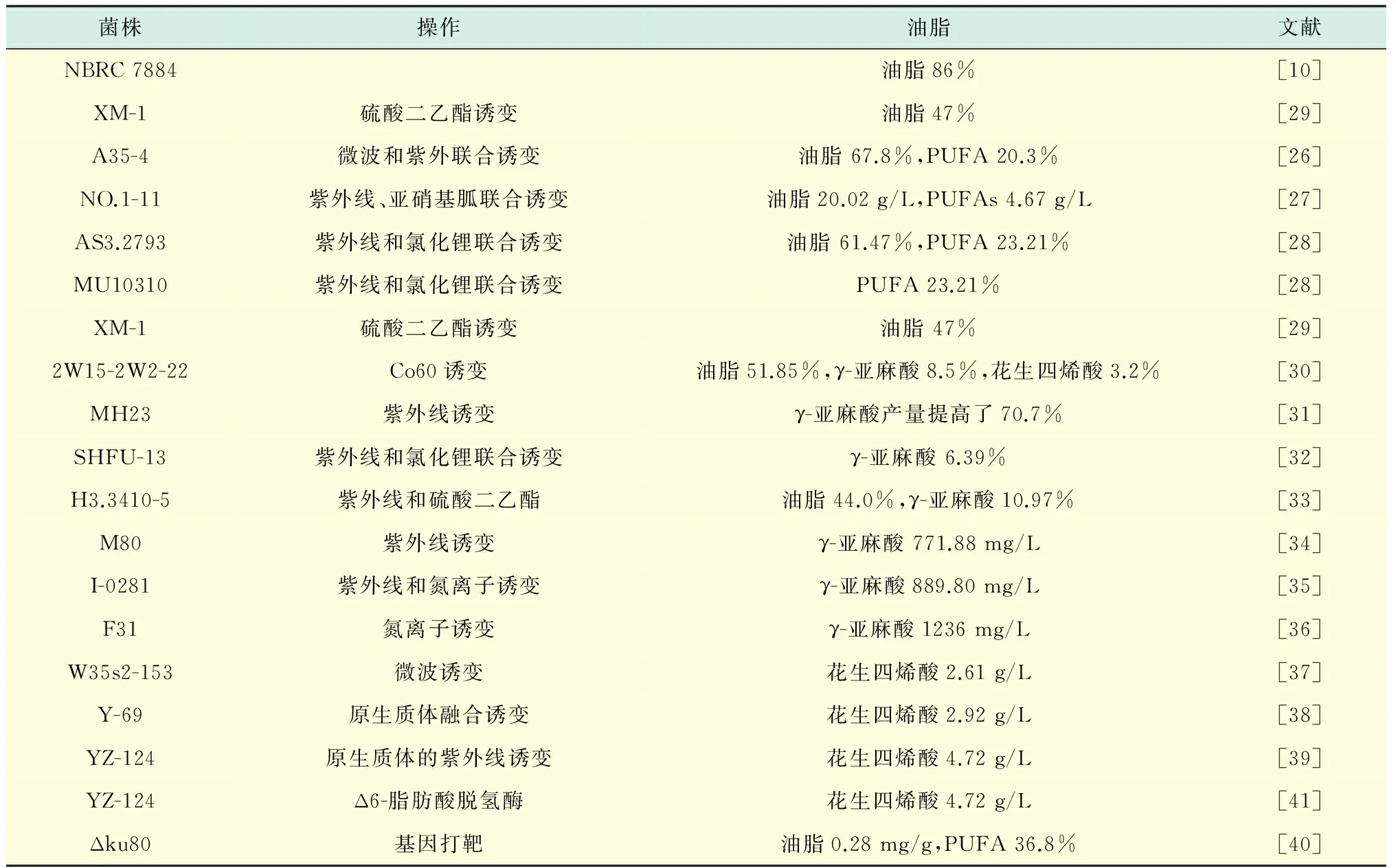
表2 深黄伞形酶菌株育种的总结Tab.2 Summary of the strain breeding of Umbelopsis isabellina
花生四烯酸是人体大脑和视神经发育的重要物质,对提高智力和增强视敏度具有重要作用.文献[14]对野生型深黄伞形霉3410孢子进行紫外线诱变,筛选得到高产花生四烯酸MS-1菌株,产量比原菌株提高了2倍多[14].化学诱变深黄伞形霉后得到突变菌株W35s2-153,Y-69,YZ-124、Δku80.它们的花生四烯酸的产量分别为2.61[37],2.92[38],4.72[39],0.26 mg/g[40].
1.3 易培养且用途多
首先,深黄伞形霉可以利用多种多样的碳源,所以,深黄伞形霉的底物来源就比较广泛[42].邢大辉等分别以葡糖糖、木糖、果糖和阿拉伯糖作为唯一糖源时,深黄伞形霉都能够生长并进行油脂的积累[43].Ruan等还以葡萄糖和木糖混合糖作为碳源,深黄伞形霉也能生长[18].另外,Ruan等以葡萄糖和木糖混合糖为碳源时,不同的混合比例对脂肪酸成分影响不大,糖浓度与油脂的积累呈正相关[18].而且,Papanikolaou 研究高糖质量浓度(100 g/L)时,同样呈现良好的细胞生长[44].但是,在氮源限制的条件下,深黄伞形霉在以木糖、甘油和葡萄糖为碳源时的油脂积累过程明显不同.Ruan等通过C-13追踪实验表明,深黄伞形霉能同时利用葡萄糖和乙酸盐,乙酸盐主要参与油脂合成和TCA循环过程.而且,深黄伞形霉对葡萄糖降解能力很强,对木糖利用较弱[23].另外,以丁醇、十六醇和十八醇作为碳源添加到培养基中,证明都能被深黄伞形霉利用然后转化成油脂[45].深黄伞形霉能利用的碳源有葡萄糖、木糖、阿拉伯糖、半乳糖、甘露糖、果糖等.但是,深黄伞形霉不能利用蔗糖[46].深黄伞形霉也可以用生物质原料为底物,将粗原料转化为油脂,降低了生产成本,变废为宝.而且,深黄伞形霉可以利用未脱毒的秸秆酸水解液生长,比相同浓度下的商业碳源更有利于油脂积累.但是,深黄伞形霉没有纤维素酶,所以,不能利用纤维素.因此,需要对生物质进行预处理,然后再进行深黄伞形霉的培养并积累油脂是目前共同的策略.Harde等以酸性亚硫酸盐预处理道格拉斯冷杉(Douglas Fir),不另外添加营养物质的条件下培养深黄伞形霉积累的油脂组分与植物油的组分相似[13].Zhang等利用稀酸水解玉米秸的水解液培养深黄伞形霉,虽然水解液产生了抑制剂(0.3 g/L糠醛、1.2 g/L羟甲基糠醛和1 g/L 4-羟基苯甲酸),但是,深黄伞形霉仍然可以正常生长,将40%的糖转化为油脂.油脂产量达到6.46 g/ L[42].另外,Zhang等还利用酶水解大豆皮培养深黄伞形霉,成功地将大豆皮转化为富含76.82 %不饱和脂肪酸的油脂[47].这些研究都为今后深黄伞形霉利用生物质生产油脂提供了支持,所以,深黄伞形霉被当作生产生物柴油的潜在菌株.Meeuwse以深黄伞形霉固态发酵的方式利用生物质积累油脂[48].深黄伞形霉还可以降解生物质内的环境污染物.莠去津是广泛存在于玉米、甘蔗、草皮、阔叶树的杀虫剂.它可以影响鱼类、两栖动物、浮游植物、甚至人类的身体健康,是一种环境污染物.深黄伞形霉降解莠去津,减少生物质中污染物的积累[49].壬基苯酚(NP)、4-叔-辛基酚(4-t-OP)、4-肉桂苯酚 (4-CP)也是环境中的污染物.深黄伞形霉可以在12 h内降解90%以上的壬基苯酚和4-叔-辛基酚,6 h内降解90%的4-肉桂苯酚[50].这些研究表明,深黄伞形霉具有不受一些环境污染物的抑制积累油脂的潜力.
2 深黄伞形霉基因工程技术
基因工程技术是一种非常有潜力的提高深黄伞形霉性能的手段.相对于化学诱变,基因工程技术更具有目的性和操控性.Wei等以潮霉素B磷酸酶基因建立了一种高效转化方法,得到了重组深黄伞形霉[51].张学炜等用潮霉素B抗性的PD4 质粒转化到深黄伞形霉M6-22-4 原生质体中,31.6%转化子表现出不同的潮霉素B抗性.通过PCR和DNA印迹证明PD4质粒已经整合到深黄伞形霉的基因组中[52].改造深黄伞形霉的多不饱和脂肪酸积累途径也是研究热点,Zhang等通过同源重组的方式敲除深黄伞形霉的Δ6-脂肪酸脱氢酶基因,证明了Δ6-脂肪酸脱氢酶是深黄伞形霉积累亚麻酸的必要基因[53].深黄伞形霉中的脂肪酸代谢基因也被逐渐鉴定和利用.刘莉等将深黄伞形霉的Δ6-脂肪酸脱氢酶基因重组到酿酒酵母菌株中,利用酿酒酵母成功合成亚麻酸[54].李明春等将深黄伞形霉的Δ6-脂肪酸脱氢酶基因转入到大豆中,在RNA水平上证明了Δ6-脂肪酸脱氢酶基因成功表达,积累了高达27.07% γ-亚麻酸的脂肪酸[55].Li等将深黄伞形霉的Δ12-脂肪酸脱氢酶基因转化到大肠杆菌和酿酒酵母中,成功积累了亚麻酸[56].随着深黄伞形霉在分子水平上研究的深入,对其众多基因的功能进行了鉴定.这些研究一方面为利用深黄伞形霉积累油脂提供有力的理论依据;另一方面也能为利用深黄伞形霉积累油脂提供科学的指导.
3 深黄伞形霉的油脂积累过程
深黄伞形霉的生长和油脂合成、积累过程有着自己的规律.建立深黄伞形霉生长模型能帮助人们预测它的生长状态,了解油脂的合成和积累的情况.Meeuwse等建立了深黄伞形霉固态发酵产油的动力学模型.氧的限制使菌体呈线性生长[57],Meeuwse等还建立了深黄伞形霉在液态培养基中生长和油脂积累的模型.模型显示,深黄伞形霉的生长在碳源和氮源充足时为指数生长期,当氮源耗尽时促进油脂的合成[48].Papanikolaou等发现,在培养基氮源耗尽后,添加Fe3+、酵母提取液或Mg2+更能促进油脂的积累.葡萄糖耗尽时脂肪酸会降解.添加一些营养物和离子能降低油脂的降解.油脂积累期,菌体内的异柠檬酸脱氢酶活性较低.碳源过量时,只有在细胞中没有异柠檬酸脱氢酶和辅酶时才积累脂肪酸[58].深黄伞形霉所积累油脂成分会随菌龄不同而发生变化.Fakas等发现未成熟的菌丝含有丰富极性脂肪(糖脂加鞘脂类和鞘脂类),极性脂肪中多不饱和脂肪酸占40%.成熟菌丝的中性脂肪中多不饱和脂肪酸含量降低到30%以下[59].另外,Gao等通过加入不同浓度的硅酸镁颗粒获得了不同深黄伞形霉的形态结构(不同粒径大小的深黄伞形霉颗粒、游离分散的菌丝体、破碎的菌丝片段),发现在不同的颗粒/菌丝聚集体中油脂也呈现出不同的空间分布,游离分散的菌丝体中有着较高的油脂含量.这些研究结果为推测其形态发育过程中油脂生物合成的分子机制提供了依据[22].
4 深黄伞形霉油脂的提取
提取是油脂生产过程中的重要环节,但是,由于工艺和技术等条件限制,往往存在着出油率不高、污染环境、溶剂残留等问题.因此,油脂提取的方法和相关工艺技术的优化是非常有必要的.Hussain等比较了己烷-异丙醇、二氯甲烷-甲醇、Bligh-Dyer法、己烷法对油脂提取的效果,表明Bligh-Dyer法提取脂质效果最好[21].Bligh-Dyer法成为目前常用的油脂提取方法.Wu等通过正交试验优化了反应时间、提取温度、KOH浓度、固液比例,明显提高了提取效率[60].环境友好的油脂提取方法是现代工业可持续发展的重要组成部分.薛冬桦等以硫酸辅助搅拌和加热得到脱酸油脂,进而加入氢氧化钾进行分离,油脂产率达到71.57%~93.20%[61].这种提取方法对环境友好、简单易控、反应条件温和、经济性好.其他辅助措施也会增加油脂的提取效果.鲍传稳等利用微波(420 W,2 min)提升了细胞破碎效果,提高了油脂提取率[62].Zhou等采用超声辅助进行萃取,明显提高萃取效果,增加油脂产量[63].随着油脂提取方法的革新、技术的优化改进,提取工艺向着更加绿色环保的方向发展,为油脂提取提供更有效的方法.
5 深黄伞型霉油脂的安全性
深黄伞形霉的油脂安全性较好.陈涛等利用深黄被孢霉AS3.3410菌体,按照每千克体重给20 mg的剂量给小鼠一次性灌胃14 d.结果表明,雄性小鼠组和雌性小鼠组体重增长值均高于其相应的对照组,且未见受试小鼠死亡或有毒性反应[64].Nisha对丝状真菌的花生四烯酸进行急性和亚慢性口服毒性实验探究.急性毒实验的结果表明,LD50大于5 000 mg/kg.在13周的亚慢性研究中发现,喂食组的雌鼠的大脑、卵巢等器官相对重量指标变化显著,血红蛋白浓度降低,白细胞数升高,血清甘油三酯降低,碱性磷酸酶活性增加,没有伴随相关组织病理学改变,因此,这些油脂是安全的[65].
6 展 望
深黄伞形霉生产油脂工艺流程主要包括菌株筛选、菌体培养、菌体收集、油脂提取、油脂的后加工等.与传统油脂生产工艺相比,利用深黄伞形霉生产油脂有着明显的优势,具有重要战略意义.深黄伞形霉作为一种优秀的产油微生物,为生产微生物油脂提供了一定的选择空间.随着基因工程在微生物中应用的拓展,人们实现了通过基因操作研究深黄伞形霉特定基因功能,定向定量分析其特定基因的功能,帮助人们更加深入地认识深黄伞形霉.生物质碳源作为深黄伞形霉油脂积累过程中最重要的营养物质一定程度上降低了生产成本,所以,深黄伞形霉积累油脂非常具有应用潜力.
[1] WARUDE D,JOSHI K,HARSULKAR A. Polyunsaturated fatty acids: biotechnology[J].Critical Reviews in Biotechnology,2006,26(2):83-93.
[2] SIMOPOULOS A P.Essential fatty acids in health and chronic disease[J].The American Journal of Clinical Nutrition,1999,70(3):560-569.
[3] 农业部市场预警专家委员会.中国农业展望报告:2015—2024[M].北京:中国农业科学技术出版社,2015.
[4] BHARATHIRAJA B,SRIDHARAN S,SOWMYA V,et al.Microbial oil-a plausible alternate resource for food and fuel application[J].Bioresource Technology,2017,233:423-432
[5] JIN M J,SLININGER P J,DIEN B S,et al.Microbial lipid-based lignocellulosic biorefinery:feasibility and challenges[J].Trends in Biotechnology,2015,33(1):43-54.
[6] RATLEDGE C.Regulation of lipid accumulation in oleaginous micro-organisms[J].Biochemical Society Transactions,2002,30(6):1047-1050.
[7] NAKAHARA T.Microbial polyunsaturated fatty acid production[M]//HOU C T.Handbook of Industrial Biocatalysis.Boca Raton,FL:CRC Press,2005:1-8.
[8] MEYER W,GAMS W.Delimitation ofUmbelopsis(Mucorales,Umbelopsidaceaefam.nov.) based on ITS sequence and RFLP data[J].Mycological Research,2003,107(3):339-350.
[9] TAKEDA I,TAMANO K,YAMANE N,et al.Genome sequence of the mucoromycotina fungusUmbelopsisisabellina,an effective producer of lipids[J].Genome Announcements,2014,2(1):e00071.
[10] SUZUKI O.Recent trends of oleochemicals by biotechnology[C]//Proceedings of the World Conference on Oleochemicals.Kuala Lumpur.1990:221-230.
[11] 张琦,杨昭杰,赵汝丽,等.多不饱和脂肪酸与深黄被孢霉低温适应性的关系[J].昆明理工大学学报(自然科学版),2015,40(1):67-73.
[12] XIAN M,ZHEN M,KANG Y J,et al.Biosynthesis of lipid byMortierellaisabellinagrown on hexadecanol[J].Chemical Journal of Chinese Universities,2000,21(7):1108-1109.
[13] HARDE S M,WANG Z,HORNE M,et al.Microbial lipid production from SPORL-pretreated Douglas fir byMortierellaisabellina[J].Fuel,2016,175:64-74.
[14] ZHANG J G,HU B.Solid-state fermentation ofMortierellaisabellinafor lipid production from soybean hull[J].Applied Biochemistry and Biotechnology,2012,166(4):1034-1046.
[15] SALLET D,ABAIDE E,MARCUZ C,et al.Obtaining fatty acids fromMortierellaisabellinausing supercritical carbon dioxide and compressed liquefied petroleum gas[J].The Journal of Supercritical Fluids,2017,122:79-87.
[16] 张燕鹏,黄凤洪,杨湄,等.发酵法生产多不饱和脂肪酸的研究进展[J].中国生物工程杂志,2007,27(4):139-145.
[17] AMANO N,SHINMEN Y,AKIMOTO K,et al.Chemotaxonomic significance of fatty acid composition in the genusMortierella(Zygomycetes,Mortierellaceae)[J].Mycotaxon,1992,45(2):257-265.
[18] RUAN Z H,ZANOTTI M,WANG X Q,et al.Evaluation of lipid accumulation from lignocellulosic sugars byMortierellaisabellinafor biodiesel production[J].Bioresource Technology,2012,110:198-205.
[19] DEMIR M,TURHAN I,KUCUKCETIN A,et al.Oil production byMortierellaisabellinafrom whey treated with lactase[J].Bioresource Technology,2013,128:365-369.
[20] GAO D F,ZENG J J,ZHENG Y B,et al.Microbial lipid production from xylose byMortierellaisabellina[J].Bioresource Technology,2013,133:315-321.
[21] HUSSAIN J,RUAN Z H,NASCIMENTO I A,et al.Lipid profiling and corresponding biodiesel quality ofMortierellaisabellinausing different drying and extraction methods[J].Bioresource Technology,2014,169:768-772.
[22] GAO D F,ZENG J J,YU X C,et al.Improved lipid accumulation by morphology engineering of oleaginous fungusMortierellaisabellina[J].Biotechnology and Bioengineering,2014,111(9):1758-1766.
[23] RUAN Z H,HOLLINSHEAD W,ISAGUIRRE C,et al.Effects of inhibitory compounds in lignocellulosic hydrolysates onMortierellaisabellinagrowth and carbon utilization[J].Bioresource Technology,2015,183:18-24.
[24] 黄和,纪晓俊,黎志勇,等.一种深黄被孢霉及其应用:中国,CN101948759A[P].2011-01-19.
[25] 何东平,陈明锴,胡传荣,等.一种高产γ-亚麻酸的突变株及制备方法和应用:中国,CN103484382A[P].2014-01-01.
[26] 许本波,巴敏,谢伶俐,等.高产PUFAs深黄被孢霉菌株的筛选[J].遗传,2011,33(10):1147-1152.
[27] 周翠霞,朱传合,王超,等.深黄被孢霉高产多不饱和脂肪酸菌株的诱变育种[J].中国粮油学报,2013,28(11):32-36.
[28] 王啸,邱树毅,何腊平.UV,LiCl复合诱变深黄被孢霉选育多不饱和脂肪酸高产菌株[J].食品科学,2004,25(4):50-52.
[29] 成漠,康亦兼,孙岩,等.深黄被孢霉的化学诱变[J].吉林大学学报(自然科学版),2001,39(1):93-95.
[30] 马瑞雪,何东平,陈涛.Co60辐射诱变深黄被孢霉高产多不饱和脂肪酸突变株的选育[J].中国油脂,2004,29(12):48-50.
[31] 李明春,邢来君.γ-亚麻酸产生菌的原生质体诱变育种[J].微生物学通报,1998,25(1):9-12.
[32] 魏娜,李柏林,欧杰,等.UV,LiCl复合诱变深黄被孢霉选育γ-亚麻酸突变株[J].食品科学,2006,27(12):201-203.
[33] 孟晓敏,郝丽,韩建飞,等.深黄被孢霉H3,3410-5γ-亚麻酸发酵的实验研究[J].大连轻工业学院学报,2006,25(3):168-171.
[34] 陈波,张玲,贺新生,等.用抗性筛选法选育γ-亚麻酸(GLA)高产菌株[J].微生物学通报,2003,30(1):53-56.
[35] 郝冉,楚乐乐,胡申才.基于代谢控制育种技术选育深黄被孢霉γ-亚麻酸高产菌株[J].中国酿造,2016,35(4):51-55.
[36] 刘胜男,王亚洲,石林霞,等.γ-亚麻酸产生菌的低能离子束诱变选育[J].河南科技大学学报(自然科学版),2015,36(3):76-80.
[37] 李丽娜,汤华成,于长青.深黄被孢霉高产花生四烯酸菌株的微波诱变育种[J].食品与生物技术学报,2009,28(1):117-121.
[38] LINA L N,YU C Q,HAN Y X.Enhancement of arachidonic acid production byMortierellaisabellinathrough protoplast regeneration mutagenesis[J].Journal of Northeast Agricultural University (English Edition),2011,18(2):65-72.
[39] 于长青,李丽娜.深黄被孢霉高产花生四烯酸菌株的紫外诱变原生质体育种[J].微生物学报,2009,49(1):44-48.
[40] KIKUKAWA H,SAKURADANI E,NAKATANI M,et al.Gene targeting in the oil-producing fungusMortierellaalpina1S-4 and construction of a strain producing a valuable polyunsaturated fatty acid[J].Current Genetics,2015,61(4):579-589.
[41] YAO D,YU C Q,YANG J,et al.Mutagenesis of arachidonic acid-producingMortierellaisabellinaand analyses of Δ6-desaturase role by qPCR[J].Journal of Northeast Agricultural University (English Edition),2013,20(3):63-70.
[42] ZHANG J G,HU B.Microbial lipid production from corn Stover viaMortierellaisabellina[J].Applied Biochemistry and Biotechnology,2014,174(2):574-586.
[43] 邢大辉,潘安龙,薛冬桦,等.深黄被孢霉利用不同碳源产油脂比较[J].生物工程学报,2010,26(2):189-193.
[44] PAPANIKOLAOU S,KOMAITIS M,AGGELIS G.Single cell oil (SCO) production byMortierellaisabellinagrown on high-sugar content media[J].Bioresource Technology,2004,95(3):287-291.
[45] XIAN M,YAN J C,KANG Y J,et al.Biosynthesis of unsaturated fatty acids viaMortierellaisabellinacultivated in a medium containing butanol[J].Chemical Research in Chinese Universities,2002,18(3):303-306.
[46] CHATZIFRAGKOU A,FAKAS S,GALIOTOU-PANAYOTOU M,et al.Commercial sugars as substrates for lipid accumulation inCunninghamellaechinulataandMortierellaisabellinafungi[J].European Journal of Lipid Science and Technology,2010,112(9):1048-1057.
[47] ZHANG J G,HU B.Effects of external enzymes on the fermentation of soybean hulls to generate lipids byMortierellaisabellina[J].Applied Biochemistry and Biotechnology,2012,168(7):1896-1906.
[48] MEEUWSE P,AKBARI P,TRAMPER J,et al.Modeling growth,lipid accumulation and lipid turnover in submerged batch cultures ofUmbelopsisisabellina[J].Bioprocess and Biosystems Engineering,2012,35(4):591-603.
[49] MARECIK R,KRLICZAK P,CZACZYK K,et al.Atrazine degradation by aerobic microorganisms isolated from the rhizosphere of sweet flag (AcoruscalamusL)[J].Biodegradation,2008,19(2):293-301.
[51] WEI D S,ZHANG Y H,XING L J,et al.Agrobacteriumrhizogenes-mediated transformation of a high oil-producing filamentous fungusUmbelopsisisabellina[J].Journal of Applied Genetics,2010,51(2):225-232.
[52] 张学炜,王笑梅,李明春,等.以潮霉素B抗性为选择标记的深黄被孢霉原生质体转化[J].生物工程学报,2007,23(3):462-466.
[53] ZHANG X W,LI M C,WEI D S,et al.Disruption of the fatty acid Δ6-desaturase gene in the oil-producing fungusMortierellaisabellinaby homologous recombination[J].Current Microbiology,2007,55(2):128-134.
[54] 刘莉,李明春,胡国武,等.深黄被孢霉M6-22Δ6-脂肪酸脱氢酶基因在酿酒酵母中的表达[J].微生物学报,2001,41(4):397-401.
[55] 李明春,卜云萍,王广科,等.深黄被孢霉Δ6-脂肪酸脱氢酶基因在大豆中的表达[J].遗传学报,2004,31(8):858-863.
[56] LI M C,LI H,WEI D S,et al.Cloning and molecular characterization of Δ12-fatty acid desaturase gene fromMortierellaisabellina[J].World Journal of Gastroenterology,2006,12(21):3373-3379.
[57] MEEUWSE P,KLOK A J,HAEMERS S,et al.Growth and lipid production ofUmbelopsisisabellinaon a solid substrate-Mechanistic modeling and validation[J].Process Biochemistry,2012,47(8):1228-1242.
[58] PAPANIKOLAOU S,SARANTOU S,KOMAITIS M,et al.Repression of reserve lipid turnover inCunninghamellaechinulataandMortierellaisabellinacultivated in multiple-limited media[J].Journal of Applied Microbiology,2004,97(4):867-875.
[59] FAKAS S,MAKRI A,MAVROMATI M,et al.Fatty acid composition in lipid fractions lengthwise the mycelium ofMortierellaisabellinaand lipid production by solid state fermentation[J].Bioresource Technology,2009,100(23):6118-6120.
[60] WU L,GAO X L,LIU Y,et al.Optimization of process conditions for the extraction of microbial oil fromMortierellaisabellina[C]//Proceedings of the 2011 Asia-Pacific Power and Energy Engineering Conference (APPEEC).Wuhan,China:IEEE,2011:1-4.
[61] 薛冬桦,张贺,潘安龙,等.一种利用微生物油脂制备生物柴油的方法:中国,CN101974371A[P].2011-02-16.
[62] 鲍传稳,李凡正,廖盼,等.深黄被孢霉中微生物油脂的提取工艺[J].生物加工过程,2012,10(2):19-23.
[63] ZHOU C X,ZHU C H,REN Y.Optimization of ultrasound-assisted extraction of single cell oil fromMortierellaisabellina[J].Separation Science and Technology,2013,48(14):2188-2195.
[64] 陈涛,何东平,李道忠,等.产PUFA的深黄被孢霉的毒力研究[J].中国油脂,2006,31(8):42-44.
[65] NISHA A,MUTHUKUMAR S P,VENKATESWARAN G.Safety evaluation of arachidonic acid richMortierellaalpinabiomass in albino rats-a subchronic study[J].Regulatory Toxicology and Pharmacology,2009,53(3):186-194.
(编辑:石 瑛)
Review of Lipid Accumulation Utilizing Filamentous FungiUmbelopsisIsabellina
FENG Hao, ZHANG Jianguo
(SchoolofMedicalInstrumentandFoodEngineering,UniversityofShanghaiforScienceandTechnology,Shanghai200093,China)
Umbelopsisisabellinais a potential microbe for lipid accumulation.In order to figure out the situation about lipid production utilizingUmbelopsisisabellina,the advantages of high content of polyunsaturated fatty acid (PUFA),varied strains and easy cultivation forUmbelopsisisabellinawere summarized.In addition,the chemical mutation and genetic manipulation promote the strain development for even high lipid production.The optimization of cultivation process and extraction process provide a bright future ofUmbelopsisisabellinain lipid production.
Umbelopsisisabellina;polyunsaturatedfattyacid;lipid;straindevelopment;cultivation;extraction
1007-6735(2017)04-0381-08
10.13255/j.cnki.jusst.2017.04.013
2017-06-12
教育部留学回国人员科研启动基金(2013);国家自然科学基金资助项目(21306112)
冯 豪(1991-),男,硕士研究生.研究方向:微生物工程.E-mail:1983802443@qq.com
张建国(1978-),男,副教授.研究方向:微生物工程.E-mail:jgzhang@usst.edu.cn
TS 221
A
