氯化钴诱导HepG2细胞低氧应激模型的建立
2017-09-15常晓翠范威锋沈欢欢黄向月王升王媛冉伟孙可新姜楠孔凡志
常晓翠,范威锋,沈欢欢,黄向月,王升,王媛,冉伟,孙可新,姜楠,孔凡志
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.大庆市人民医院检验科)
Chang Xiaocui1,Fan Weifeng1,Shen Huanhuan1,Huang Xiangyue1,Wang Sheng1,Wang Yuan1,Ran Wei1,Sun Kexin1,Jiang Nan2,Kong Fanzhi1
(1.College of Animal Science and Veterinary Medicine,Heilongjiang Bayi Agricultural University,Daqing 163319;2.Laboratory Department,People’s Hospital of Daqing)
氯化钴诱导HepG2细胞低氧应激模型的建立
常晓翠1,范威锋1,沈欢欢1,黄向月1,王升1,王媛1,冉伟1,孙可新1,姜楠2,孔凡志1
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.大庆市人民医院检验科)
探索氯化钴(CoCl2)诱导人肝癌细胞系HepG2建立低氧应激模型的条件,并评价该模型。不同浓度氯化钴处理HepG2细胞后,PCR法检测低氧诱导因子1α(HIF-1α)、激活转录因子4(ATF4)、腺苷酸激酶4(AK4)基因的表达;细胞计数法绘制对照组细胞和氯化钴处理组细胞的增殖曲线。随着CoCl2浓度升高和处理时间的延长,HIF-1α mRNA和ATF4 mRNA表达显著升高、AK4 mRNA表达显著下降、HepG2细胞增殖速度显著下降(P<0.05)、细胞膜不完整边界不清。氯化钴化学模拟低氧过程中影响了缺氧主要调节因子HIF-1α的水平,因此以氯化钴用于构建模拟HepG2细胞缺氧诱导模型是可行的,ATF4和AK4可能在参与HepG2细胞抗低氧应激反应中起关键作用。此模型的建立为进一步研究AK4基因的生理学功能奠定了基础。
氯化钴;低氧应激;腺苷酸激酶;低氧诱导因子
应激最早是由匈牙利科学家Hans Selye在1946年提出。应激因素多种多样,可概括为环境因素和心理因素:前者又包括物理、化学以及生物等诸因素,后者主要指源于社会和生命个体的心理压力。低氧应激属于环境因素引起的应激,当应激发生时引起人们出现多种反应如头昏、心悸、气短、食欲下降等症状[1]。研究结果表明,低氧应激引发的应答反应是全身性的,最终导致细胞和分子水平的变化。低氧是恶性肿瘤微环境的特征之一。它是癌细胞快速增殖与血液供应相对滞后的结果。低氧对细胞的影响主要通过调节基因表达而实现,作为低氧环境调控的主要核转录因子-缺氧诱导因子1α(HIF-1α)[2-4],能介导多种促癌基因和抑癌基因的表达改变,从而对肿瘤细胞的增殖、转移等起到重要作用[5]。低氧应答基因腺苷酸激酶4(AK4)的表达很可能与细胞抵抗低氧应激带来的危害有关[6-8]。激活转录因子4(ATF4)可以结合在AK4基因启动子区的低氧调节原件(HRE)调控其表达。氯化钴(CoCl2)是一种化学性缺氧模拟剂,能在体外诱导神经元样PC12细胞、心肌细胞、内皮细胞等多种细胞产生缺氧性损伤[9-11]。氯化钴模拟低氧应激模型的建立,尚未见报道。因此,建立体外细胞培养的低氧应激模型为将来揭示低氧应激相关基因的表达调控机制以及最终揭示低氧应激的发生机制奠定了一定的基础。
1 材料与方法
1.1 细胞培养
人肝癌细胞株(HepG2)由哈尔滨工业大学生命科学学院李钰教授惠赠,HepG2细胞株分组孵育A:常氧组;B:300 μmol·L-1氯化钴处理组;C:400 μmol·L-1氯化钴处理组。细胞株采用含10%胎牛血清的DMEM高糖培养液,常规培养于5%CO2、95%空气、37℃孵箱中,待其2~3 d贴壁生长至70%~80%融合时,用0.25%的胰蛋白酶消化传代。
1.2 主要试剂和仪器
氯化钴(CoCl2)(31277)购自美国Sigma公司;PCR相关试剂、反转录试剂盒(639505)购自大连TAKALA公司;Trizol(15596-026)购自美国Invetrogen公司;DMEM培养基、PBS、胎牛血清(FBS)、双抗均购自美国Hyclone公司;细胞增殖检测试剂盒(C0036)购自中国碧云天公司。主要仪器:美国Thermo Forma公司CO2培养箱;德国Eppendorf公司5417R台式离心机、5415R冷冻离心机;日本OLYMPUS CK40倒置显微镜。
1.3 引物

表1 PCR反应引物Table 1Primers in PCR reaction
1.4 PCR基本过程
首先使用Trizol法提取各组细胞的总RNA,变性琼脂糖凝胶电泳检测RNA质量后,使用1 μg总RNA反转录出cDNA后进行PCR,反应体系(25 μL)入下:

表2 PCR反应体系Table 2PCR reaction system
PCR反应条件:

1.5 细胞增殖曲线的绘制
接种HepG2细胞于96孔培养板(2 000个·孔-1),将细胞分为A,B,C三组,分别培养12,24,36,48,60,72 h后加入20 μL WST-1溶液。在细胞培养箱内继续孵育1 h,待培养液颜色变化后,使用酶标仪在450 nm波长下测定吸光度。根据OD值绘制细胞增殖曲线。
2 结果与分析
2.1 不同浓度氯化钴处理HepG2细胞后HIF-1α、ATF4和AK4的表达
2.1.1 300 μmol·L-1氯化钴处理HepG2细胞后HIF-1α、ATF4和AK4的表达
图1A为300 μmol·L-1氯化钴处理HepG2细胞不同时间后,提取细胞总RNA的凝胶电泳图,N为对照组细胞(没有经过氯化钴处理),所有样品的5,18,28 s RNA条带清晰,没有降解,可以用于反转录。图1B为使用图1A中RNA反转录的cDNA进行PCR后的结果,随着氯化钴刺激时间的增加,HIF-1α表达量明显上升,ATF4和AK4表达量出现了明显下降,Nu为阴性对照组(PCR反应体系中不含模板)。
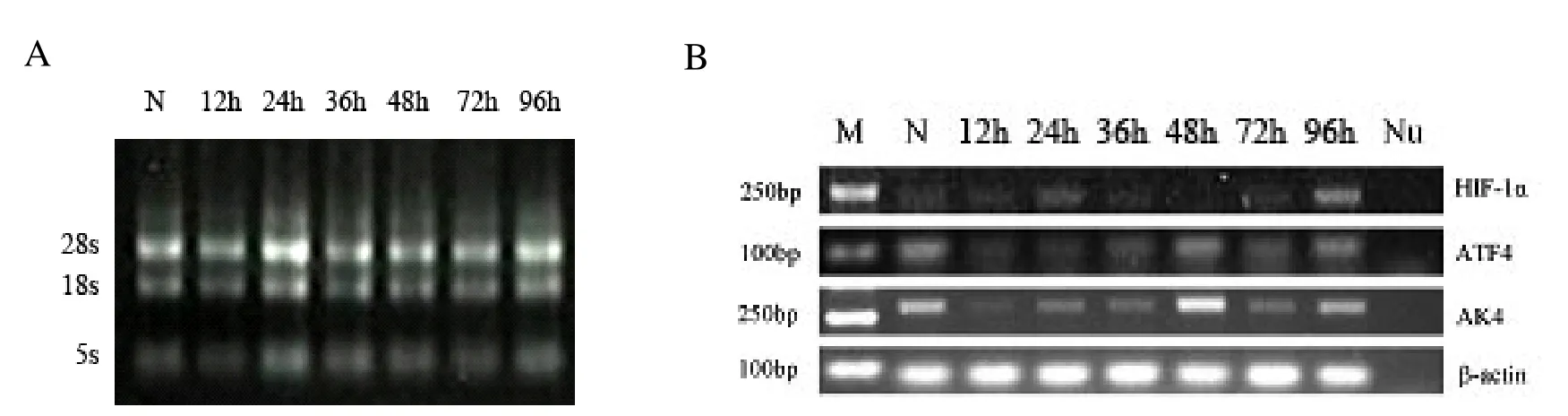
图1 A:300 μmol·L-1氯化钴处理HepG2细胞不同时间后总RNA凝胶电泳结果图;B:300 μmol·L-1氯化钴处理HepG2细胞不同时间后HIF-1α、ATF4和AK4表达变化图。Fig.1A:Total RNA from 300 μmol·L-1CoCl2treated HepG2 cells;B:Expression of HIF-1α,ATF4 and AK4 in HepG2 cells after cobalt dichloride treatment at different time point.
2.1.2 400 μmol·L-1氯化钴处理处理HepG2细胞后HIF-1 α、ATF4和AK4的表达
图2A为400 μmol·L-1氯化钴处理HepG2细胞不同时间后,提取细胞总RNA的凝胶电泳图,N为对照组细胞(没有经过氯化钴处理),所有样品的5,18, 28 s RNA条带清晰,没有降解,可以用于反转录。图2B为使用图2A中RNA反转录的cDNA进行PCR后的结果,随着氯化钴刺激时间的增加,HIF-1α表达量明显上升,ATF4和AK4表达量出现了明显下降,Nu为阴性对照组(PCR反应体系中不含模板)。
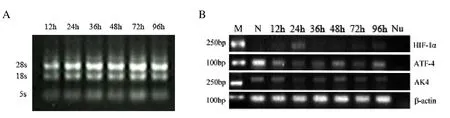
图2 A:400 μmol·L-1氯化钴处理HepG2细胞不同时间后总RNA凝胶电泳结果图;B:400 μmol·L-1氯化钴处理HepG2细胞不同时间后HIF-1α、ATF4和AK4表达变化图。Fig.2A:Total RNA from 400 μmol·L-1CoCl2treated HepG2 cells;B:Expression of HIF-1α,ATF4 and AK4 in HepG2 cells after 400 μmol·L-1CoCl2treatment at different time point.
2.2 不同浓度氯化钴处理HepG2细胞后对细胞增殖的影响
2.2.1 300 μmol·L-1氯化钴处理处理HepG2细胞后的细胞增殖情况
图3为使用WST-1试剂盒检测得到的300μmol·L-1氯化钴处理HepG2细胞后的细胞增殖结果,从氯化钴处理12小时开始,细胞增殖速度就开始降低,处理48小时后,细胞增殖速度显著降低(P<0.05),96小时后细胞增殖速度极显著降低(P<0.01)。
2.2.2 400 μmol·L-1氯化钴处理处理HepG2细胞后的细胞增殖情况
图4为使用WST-1试剂盒检测得到的400μmol·L-1氯化钴处理HepG2细胞后的细胞增殖结果,从氯化钴处理12小时开始,细胞增殖速度就开始降低,处理36小时后,细胞增殖速度显著降低(P<0.05),48、60小时后细胞增殖速度极显著降低(P<0.01),处理72小时后,细胞停止增殖并出现死亡。
2.3 不同浓度氯化钴处理HepG2细胞后对细胞形态的影响
图5为300 μmol·L-1氯化钴和400 μmol·L-1氯化钴分别处理HepG2细胞48 h后的细胞形态变化,300 μmol·L-1氯化钴处理细胞48 h后,细胞密度较对照组细胞减小,并且出现部分死亡细胞,细胞膜边界模糊、不完整。400 μmol·L-1氯化钴处理细胞48小时后,死亡细胞数量明显增多,细胞皱缩体积变小,细胞膜边界模糊、不完整。
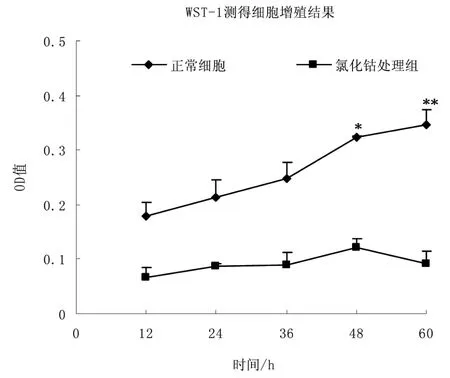
图3 300μmol·L-1氯化钴处理HepG2后的细胞增殖结果,在48 h,60 h两个时间点上氯化钴处理组细胞和正常细胞的增殖出现显著差异,*P<0.05,**P<0.01Fig.3Cell proliferation rate was significantly decreased at 48 h and 60 h of 300 μmol·L-1CoCl2treated,*P<0.05,**P<0.01
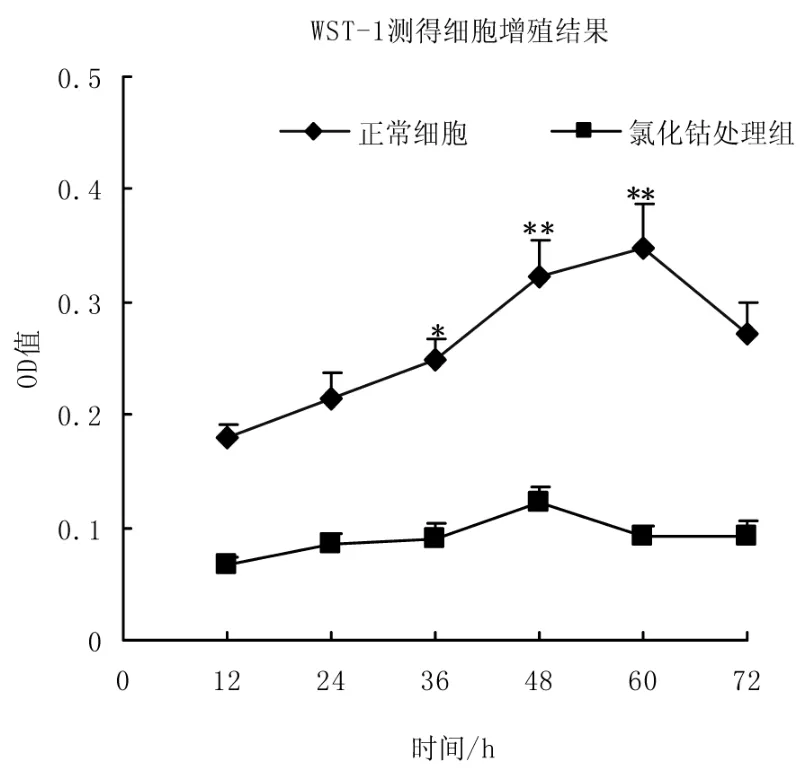
图4 400μmol·L-1氯化钴处理HepG2后的细胞增殖结果,在36 h,48 h,60 h三个时间点上氯化钴处理组细胞和正常细胞的增殖出现显著差异,*P<0.05,**P<0.01Fig.4Cell proliferation rate was significantly decreased at36 h,48 h and 60 h of 400 μmol·L-1CoCl2treated,*P<0.05,**P<0.01
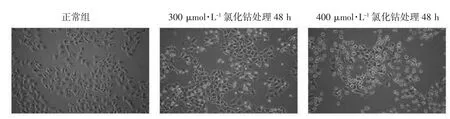
图5 不同浓度氯化钴处理HepG2细胞48 h后的形态变化(100×)Fig.5Changes of cell morphology after different concentration of CoCl2treatment over 48 hours(100×)
3 讨论
氯化钴作为化学性缺氧模拟剂,其机制是钴通过细胞内离子置换使亚铁螯合酶失活,从而抑制细胞对氧的利用,最终达到常氧下诱导细胞缺氧的效果。以往研究发现,氯化钴可诱导多种细胞产生化学性缺氧损伤,但不同细胞对氯化钴诱导缺氧的敏感性有所不同。氯化钴诱导细胞产生缺氧损伤的机制可能涉及多个方面。以往研究发现,细胞凋亡是氯化钴诱发细胞产生缺氧损伤的主要机制之一。通过荧光染色发现,氯化钴处理后,PC12细胞、肺癌A549等细胞出现细胞核固缩深染或碎片样深染凋亡小体,呈现典型凋亡特征[12-13]。因此,诱发氧化应激反应可能是氯化钴诱导细胞产生缺氧损伤的另一机制。
肿瘤细胞本身就处于缺氧的微环境中,有研究者已经检测到HIF-1α蛋白在多种肿瘤及癌前病变组织中高表达,表明HIF-1α可参与肿瘤低氧适应性反应,从而引起肿瘤细胞的生物学特性的改变[14]。目前,已发现HIF-1α约有100多种目的基因,其中与肿瘤有关的包括肿瘤干细胞维持[15]、细胞增殖与凋亡相关因子、内皮间质转换[16]、肿瘤侵袭与转移及放疗抵抗等相关基因。吴之浩[17]研究表明,低氧应激上调人肝癌HepG2细胞血管内皮生长因子、甲胎蛋白、基质金属蛋白酶基因表达,下调金属蛋白酶组织抑制剂基因表达。这些基因表达的改变使得肿瘤细胞发生恶性生物学行为改变:糖酵解途径、增殖、侵袭和转移能力增强,对化疗药物产生耐药性,对放化疗不敏感等。
在低氧时,细胞本身有一套系统会开启并高效地表达和/或激活一组相关的基因去应对这种低氧引起的应激反应。各种应激原对细胞作用后的最终靶分子是细胞内的蛋白质、脂质和DNA。细胞发生应激后的最终效应主要分为两个方面:(1)细胞能够抵抗应激原的刺激而继续存活;(2)细胞无法修复由应激原造成的损伤而最终发生凋亡。
4 结论
研究观察氯化钴对HepG2细胞HIF-1α、AK4、ATF4的表达变化,结果显示与对照组比较,经氯化钴处理的细胞中HIF-1α表达上调,而AK4和ATF4表达下调。细胞增殖速度显著下降,且细胞增殖速度均随氯化钴浓度增加和时间延长而逐渐降低。氯化钴化学模拟低氧过程中伴随着对细胞增殖和凋亡的复杂影响,也影响缺氧主要调节因子HIF-1 α水平,因此以氯化钴用于构建模拟HepG2细胞缺氧诱导模型是可行的。
[1]吕永达.高原医学与生理学[M].天津.天津科技翻译出版公司,1995.
[2]Gregg L.Hypoxia-Inducible Factor 1(HIF-1)Pathway[J]. Sci STKE,2007,407:8.
[3]Gregg L.Life with Oxygen[J].Science,2007,318(5847):62-64.
[4]Gregg L.Mitochondrial autophagy:life and breath of the cell[J].Autophagy,2008(4):534-536.
[5]Kizaka-Kondoh,Tanaka,Harada H,et al.The HIF-1-active microenvironment:an environmental target for cancer therapy[J].Adv Drug Deliv Rev,2009(61):623-632.
[6]Kong F,Binas B,Moon J,et al.Differential expression of adenylate kinase 4 in the context of disparate stress response strategies of HEK293 and HepG2 cells[J].Arch Biochem Biophys,2013,533:11-17.
[7]Liu R,Stro¨m A,Zhai J,et al.Enzymatically inactive adenylatekinase 4 interacts with mitochondrial ADP/ATP translocase[J].Int J Biochem Cell Biol,2009,41(6):1371-1380.
[8]孔凡志,沈欢欢,姜楠,等.腺苷酸激酶的研究进展[J].黑龙江八一农垦大学学报,2016,28(2):37-44.
[9]Xiao L,Lan A,Mo L,et al.Hydrogen sulfide protects PC12 cells against reactive oxygen species and extracellular signal-regulated kinase 1/2-mediated downregulation of glutamate transporter-1 expression induced by chemical hypoxia[J].Int J Mol Med,2012,30(5):1126-1132.
[10]廖新学,杨春涛,杨战利,等.硫化氢对抗化学性缺氧引起的心肌细胞损伤及其机制[J].中国药理学通报,2009,25(8):1012-1017.
[11]Ji Q,Yang L,Zhou J,et al.Protective effects of paeoniflorin against cobalt chloride-induced apoptosis of endothelial cells via HIF-1alpha pathway[J].Toxicol In Vitro,2012,26(3):455-461.
[12]陈健,仇容,毕艳丽,等.二氯化钴诱导A549细胞凋亡及机制的研究[J].医学研究杂志,2012,41(3):58-61.
[13]Chen J,Zhao T,Huang D.Protective effects of edaravone a-gainst cobalt chloride-induced apoptosis in PC12 cells[J].Neurosci Bull,2009,25(2):67-74.
[14]Ellis L,Hammers H,Pili R.Targeting tumor angiogenesis with histone deacetylase inhibitorsv[J].Cancer Lett,2009,280(2):145-153.
[15]Wang Y,Liu Y,Malek S,et al.Targeting HIF-1α eliminatescancer stem cells in hematological malignancies[J]. Cell Stem Cell,2011(4):399-411.
[16]Mark P,Leav I,Pursell B,et al.ERbeta impedes prost atecancer EMT by destabilizing HIF-1α and inhibiting VEGF mediated snail nuclear localization:implications for Gleason grading[J].Cancer Cell,2010,17(4):319-332.
[17]吴之浩.低氧应激对人肝癌细胞AFP,VEGF,TIMP-1,MMP-9表达的影响[J].温州医学院学报,2012,42(1):41-43.
Establishment of Hypoxia Stress Model Using Cobalt Dichloride in HepG2 Cells
To find a proper condition to establish hypoxia stress model using cobalt dichloride in HepG2 cells and evaluate it.After using different concentration of CoCl2to treat HepG2 cells,expression of AK4,ATF4 and HIF-1α was detected by PCR;compare cell proliferation rate by cell counting.With the increase of CoCl2,the expression of HIF-1α mRNA and ATF4 mRNA were both increased,however,AK4 mRNA were decreased significantly;cell proliferation rate was decreased significantly(P<0.05)and the membrane was broken.The expression of HIF-1α,which was the most important transcription factor in hypoxia stress,were increased in HepG2 cells during CoCl2treatment,so,it was feasible to establish hypoxia stress model by using CoCl2.ATF4 and AK4 may play an important role in protecting HepG2 cells from hypoxia stress.Establishment of this model may lay a foundation for further research on AK4 physiology function.
cobalt dichloride;hypoxia stress;adenylate kinase;hypoxia induced factor
S852.3
A
1002-2090(2017)04-0028-05
Chang Xiaocui1,Fan Weifeng1,Shen Huanhuan1,Huang Xiangyue1,Wang Sheng1,Wang Yuan1,Ran Wei1,Sun Kexin1,Jiang Nan2,Kong Fanzhi1
(1.College of Animal Science and Veterinary Medicine,Heilongjiang Bayi Agricultural University,Daqing 163319;2.Laboratory Department,People’s Hospital of Daqing)
10.3969/j.issn.1002-2090.2017.04.007
2016-07-01
黑龙江八一农垦大学大学生创新创业训练计划项目。
范威锋(1989-),男,黑龙江八一农垦大学动物科技学院动物医学系2013级本科生。
孔凡志,男,讲师,E-mail:fanzhikong110@hotmail.com。
