嘉陵江流域不同土地利用类型土壤微生物功能多样性特征
2017-09-12杨秉珣董廷旭
杨秉珣, 刘 泉, 董廷旭
(绵阳师范学院 资源环境工程学院, 四川 绵阳621000)
嘉陵江流域不同土地利用类型土壤微生物功能多样性特征
杨秉珣, 刘 泉, 董廷旭
(绵阳师范学院 资源环境工程学院, 四川 绵阳621000)
基于2013—2015年对嘉陵江流域中游(四川段)不同土地利用类型(混交林、草甸、针叶林、阔叶林、灌丛和裸地)土壤生境的调查分析数据,利用Biolog微平板法和磷脂脂肪酸甲酯法(FAMEs)系统研究了土壤微生物多样性群落特征。不同土地利用类型土壤养分和有效养分基本表现为混交林>阔叶林>针叶林>灌丛>草甸>裸地。不同土地利用类型土壤微生物群落代谢平均颜色变化率(AWCD)随培养时间延长而逐渐增加,土壤微生物群落代谢活性依次是混交林>阔叶林>针叶林>灌丛>草甸>裸地。土壤微生物对不同种类碳源的利用强度存在较大差异,碳水化合物和羧酸类碳源是不同土地利用类型土壤微生物的主要碳源,其次为氨基酸类、酚酸类和聚合物类,胺类碳源的利用率最小。土壤微生物群落的物种丰富度指数(H)、均匀度指数(E)、优势度指数(Ds)和碳源利用丰富度指数(S)总体趋势为混交林最高,针叶林和阔叶林次之,裸地最低,优势度指数在不同土地利用类型差异并不显著(p>0.05)。主成分分析结果表明,从31个因素中提取的与碳源利用相关的主成分1,主成分2分别能解释变量方差的65.154%和81.047%,在主成分分离中起主要贡献作用的是胺类和氨基酸类碳源;土壤微生物多样性指数与土壤养分之间呈正相关,与pH值呈负相关,而土壤全碳和全氮含量对土壤微生物多样性贡献较大,这是造成土壤微生物群落功能多样性差异的主要原因。H,E和S与土壤养分各指标的相关系数绝对值均高于Ds,说明了土壤养分对土壤微生物群落优势度指数的影响作用较小。
嘉陵江流域; 土地利用; 土壤微生物; 土壤养分
土壤是生态系统中的重要组成部分,作为一种重要的自然资源维持着陆地生态系统健康,在生态系统的物质循环和能量流动方面起着重要作用[1-2];土壤养分在养分的分解和转化过程中起着主导作用,影响着土壤生态系统中能量流动和物质循环,并且能够反映出土壤质量及健康状况等[3-5];土壤微生物参与土壤有机质分解、腐殖质形成、土壤养分转化和循环等过程,是土壤生物化学特征的重要组成部分,在评价土壤肥力、环境监测、土地利用等方面有广泛的作用[6-9]。近年来,碳素利用法通常用Biolog微平板来实现,其理论依据是Biolog代谢多样性类型的变化与群落组成。Biolog对功能微生物群落变化较为敏感的指标,广泛应用于评价土壤微生物群落的功能多样性,也可以用于估价土壤微生物群落代谢多样性和功能多样性的研究[10-12]。
四川嘉陵江流域地貌类型复杂多变,是我国土地利用类型多样化的重要区域,长期以来受到自然和高强度人类活动的影响,山洪暴发、泥石流灾害以及水质污染等问题日益突出,尤其是严重的水土流失使其生态系统相当脆弱[13-14]。自1998年长江特大洪水灾害以来,该流域的生态环境逐渐引起人们重视。土地利用是人类活动和自然作用相结合的过程,随着该流域人口增长和经济的发展,嘉陵江流域人口与土地矛盾越显突出,土地垦殖系数居高不下。不同土地利用类型可以改变土壤的物理、化学和生物学特性及土壤的环境状况[15-16]。合理的土地利用方式可以改善土壤结构,增强土壤对外界环境变化的抵抗力,而不合理的土地利用方式则会导致土壤质量下降,加速侵蚀,导致土壤退化[15-16]。当前了解微生物功能多样性信息对于我们明确不同环境中微生物群落的作用具有重要的意义,可以为控制和优化微生物群落结构,强化微生物群落代谢功能提供理论指导。现阶段的研究比较重视用分子生物学方法分析微生物群落的功能多样性。但是,分子生物学方法要求的劳动强度大、耗时长、技术含量较高,难以在较短的时间内分析较多的样品。而以Biolog-ECO微孔板碳源利用为基础的定量分析技术为描述微生物群落功能多样性提供了一种更为简便、快速的方法,并已被广泛应用于比较和评价不同类型的土壤微生物群落结构[9-10]。鉴于此,本文以四川嘉陵江中下游流域为研究对象,连续3 a的数据分析不同土地利用类型土壤养分和土壤微生物多样性差异,对该区域不同土地利用类型的管理提供科学理论依据,为该流域的综合治理和生态环境的监测评估提供科学依据。
1 材料与方法
1.1 研究区概况
嘉陵江(102°35′36″—109°01′08″E,29°17′30″—34°28′11″N)是长江水系中流域面积最大的支流,发源于秦岭南麓,向西南流经陕西、甘肃、四川、重庆4省,于重庆市汇入长江,全长1 120 km,流域面积1.598×105km2,属亚热带季风气候,年均降水1.494×1011m3,水土流失较为严重,侵蚀面积占到52.14%,是长江各大支流中水土流失较严重的区域,整个流域由嘉陵江干流、渠江和涪江3大水系构成。嘉陵江流域的地貌类型复杂多样,地层以中生界侏罗系红色岩层分布最广。土壤类型主要有黄壤土、紫色土、水稻土、冲积土、潮土和红壤等。流域大部分地区属亚热带湿润季风气候,四季分明,雨水充沛,年内降水主要集中在5—10月,其中7—9月降水量可占全年的50%以上,上游年降水量600~800 mm,中下游约1 000 mm,多年平均径流量约7×1010m3。由于复杂的地貌类型、充沛的降水和易侵蚀的土壤等自然环境及强烈的农业生产活动,嘉陵江中下游地区则是长江流域的重点土壤侵蚀地区和环境保护区域。
1.2 试验设计
根据嘉陵江流域特点和植被划分原则,采用《中国植被图集》的划分标准,将整个流域内的植被景观划分为针叶林、混交林、阔叶林、灌丛、草甸、裸地6类,布设6×3=18个样地(面积由植被类型决定)。数据为2013年和2015年的9月中旬连续3 a的平均值(定点采样),根据其植被划分,每个植被类型选取3个样地,每个样地布设5个样方,为了保证取样的一致性,所取样的土壤坡度均小于5°,同时保证其海拔和生境基本一致,对于草本和裸地,每个样地面积50 m×50 m,每个样地按“S”曲线设置5个1 m×1 m样方。采用四分法在每个样方内取样(保留1 kg左右),采用五点取样法,取样深度为0—20 cm混合土样(除去表层的枯落物层),充分混匀后用无菌塑料袋4℃保温箱保存,并迅速带回实验室内分析测定,所取土样分为2份,一份新鲜土样过40目筛后测定土壤酶活性,一份自然风干(20 d)去除碎片和部分根后过80目筛后测定土壤养分。
1.3 土壤养分测定
一部分土壤样品经自然风干20 d后,去除植物根系等杂物过2 mm筛。土壤pH值采用电极电位法(2.5∶1水土比浸提液);全碳和全氮含量采用元素分析仪;速效磷采用NaHCO3浸提—钼锑抗比色法;碱解氮采用NaOH—H3BO3法;有效钾和全钾采用乙酸铵浸提—火焰光度计法[17]。
1.4 土壤微生物群落功能多样性
土壤微生物群落功能多样性可以用Shannon多样性指数、McIntosh指数和Simpson指数来表征。在计算Simpson指数时,将数据扩大1 000倍,以防止出现负数。采用Biolog-Eco 温育72 h 的数据进行多样性分析。在无菌条件下,称取相当于烘干质量10 g的土壤,加入90 ml无菌0.145 mol/L的NaCl溶液,摇床震荡30 min,样品稀释1 000倍,用BIOLOG排枪取100 μl 接种于ECO板上,初次读数后,于25℃恒温培养,每隔12 h于波长590 nm的BIOLOG仪器上读数,共培养216 h。然后用0.85%NaCl无菌溶液稀释至10~3倍接种于Biolog-Eco微孔板中,在(25±1)℃暗箱培养。在温育过程中,每隔24 h用酶标仪在590 nm下读取吸光值。
Biolog-Eco微平板中31种单一碳源的反应程度,即土壤微生物对单一碳源的利用能力,采用平均每孔颜色变化率(Average well color development,AWCD)来描述。AWCD值较大表示土壤微生物具有较高的碳源利用能力和微生物丰度,AWCD的计算公式为[18-19]:
AWCD=∑[(Ci-R)/31]
式中:Ci为第i孔的吸光值;R为对照孔的吸光值。对(Ci-R)<0的孔,计算中记为0,即(Ci-R)≥0。
土壤微生物群落功能多样性分析采用Shannon-Wiener指数、Simpson指数、丰富度指数和McIntosh指数表征[18-19]。
AWCD=∑(Ci-Ri)/n
式中:Ci为每个有培养基孔的吸光值;Ri为对照孔的吸光值;n为培养基孔数,Biolog-Eco板n值为31。
H=-∑Pi(lnPi)
式中:Pi为第i孔的相对吸光值与所有整个微平板的相对吸光值总和的比值,计算公式:
Pi=(Ci-Ri)/∑(Ci-Ri)
S=被利用碳源的总数(吸光值≥0.25所有微孔的总和)
Ds=1-∑Pi
主成分分析采用培养96 h后的光密度值,提取两个主因子进而分析不同土地利用类型土壤利用碳源的结构。利用Excel 2003和SPSS 13.00软件对数据进行分析,单因素方差进行分析(One-way ANOVA),显著性分析采用LSD法。
2 结果与分析
2.1 不同土地利用类型土壤养分特征
由图1可知,嘉陵江流域不同土地利用类型土壤养分具有明显差异,不同土地利用类型土壤全碳依次表现为:混交林>阔叶林>针叶林>灌丛>草甸>裸地,混交林和阔叶林差异并不显著(p>0.05),显著高于其他植被类型(p<0.05),而裸地则显著低于其他植被类型(p<0.05);全氮依次表现为:混交林>阔叶林>针叶林>草甸>灌丛>裸地,混交林显著高于其他植被类型(p<0.05),针叶林、阔叶林、灌丛和草甸之间差异并不显著(p>0.05),而裸地则显著低于其他植被类型(p<0.05);全钾依次表现为:混交林>阔叶林>针叶林>灌丛>草甸>裸地,混交林显著高于其他植被类型(p<0.05),针叶林和阔叶林之间差异并不显著(p>0.05),而裸地则显著低于其他植被类型(p<0.05);碱解氮依次表现为:混交林>阔叶林>针叶林>灌丛>草甸>裸地,混交林、针叶林和阔叶林显著高于其他植被类型(p<0.05),而裸地则显著低于其他植被类型(p<0.05);速效磷依次表现为:阔叶林>混交林>针叶林>灌丛>草甸>裸地,混交林和阔叶林之间差异不显著(p>0.05),显著高于其他植被类型(p<0.05),而裸地则显著低于其他植被类型(p<0.05);有效钾依次表现为:混交林>阔叶林>针叶林>灌丛>草甸>裸地,混交林和阔叶林显著高于其他植被类型(p<0.05),针叶林、灌丛和草甸之间差异不显著(p>0.05),而裸地则显著低于其他植被类型(p<0.05)。
2.2 不同土地利用类型土壤微生物群落代谢平均颜色变化率
不同土地利用类型土壤开始培养后每隔24 h测定AWCD值,得到AWCD随时间的动态变化图(图2),由图可知,随着培养时间的延长,不同土地利用类型土壤微生物碳源利用总体上呈逐渐增加的趋势,培养起始的24 h内AWCD变化不明显,针叶林、混交林和阔叶林土壤微生物碳源利用在培养24~72 h内AWCD快速增长,此时微生物活性旺盛,72 h后增长缓慢,192 h后急剧增长;灌丛和草甸土壤微生物碳源利用在培养72 h后急剧增长,并且增长幅度逐渐变大;在培养48 h以前,不同土地利用类型土壤微生物碳源利用基本相一致,在48 h以后,相同时间针叶林、混交林和阔叶林土壤微生物碳源利用显著高于灌丛、草甸和裸地,而灌丛和草甸土壤微生物碳源利用基本相似;相同时间土壤微生物碳源利用大致表现为针叶林>阔叶林>混交林>灌丛>草甸>裸地,局部有所波动。
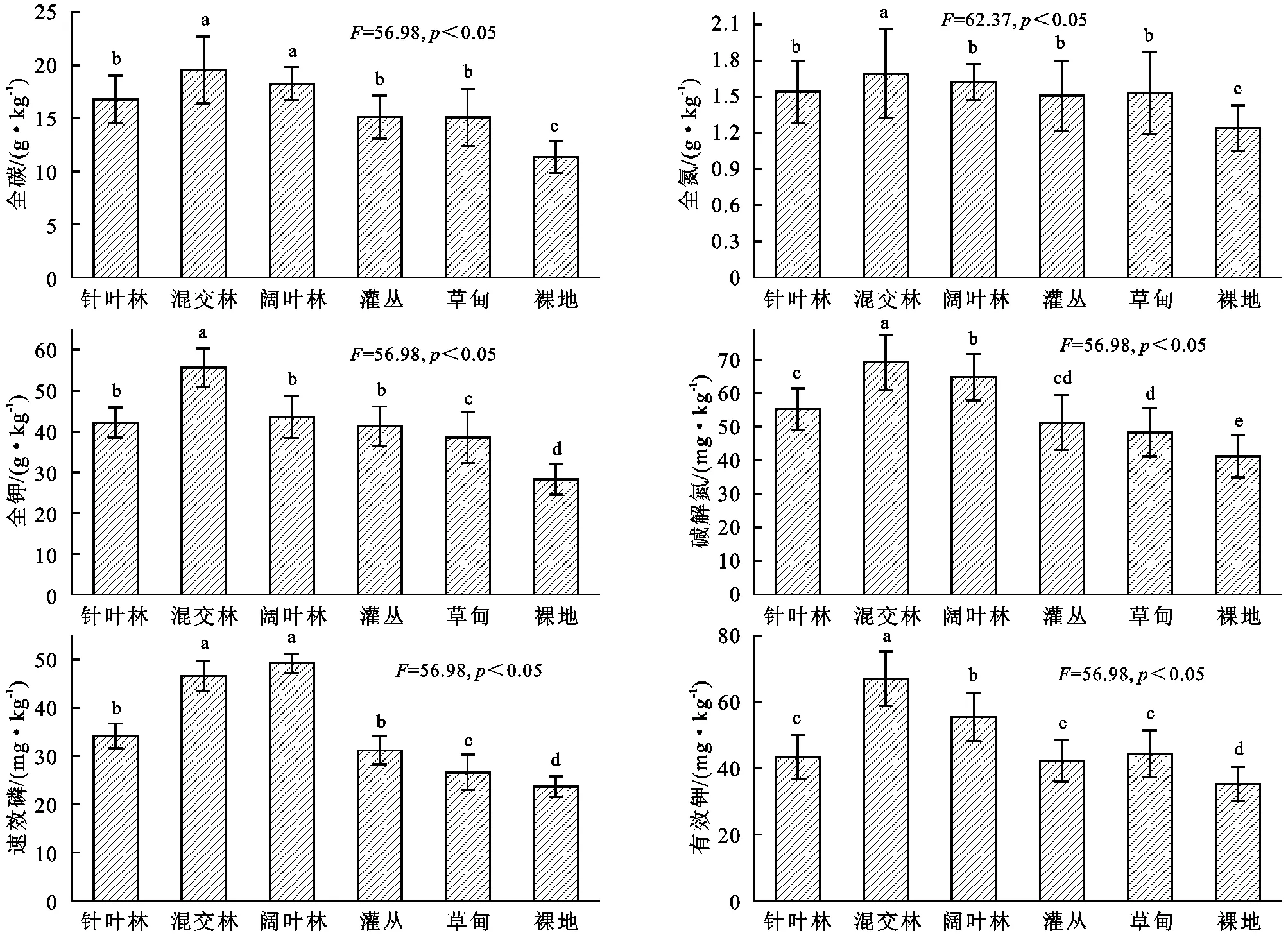
图1土地利用类型土壤养分特征

图2不同土地利用类型土壤微生物群落代谢平均颜色变化率
2.3 不同土地利用类型土壤微生物对碳源利用强度
根据不同土地利用类型土壤微生物碳源利用情况,综合考虑其变化趋势,选取光密度增加较快的120 h的AWCD值进行土壤微生物群落代谢多样性的分析,按化学基团的性质将ECO板上的31种碳源分成6类:氨基酸类、碳水化合物类、羧酸类、聚合物、胺类、酚酸类,6类碳源均呈现出随着培养时间的延长,微生物利用碳源的量逐渐增加的趋势。将每类碳源的AWCD取平均值,其结果见表2。由表2可知,土壤微生物对不同种类碳源的利用强度存在较大差异。不同土地利用类型土壤微生物对6种不同碳源的利用率表现大致相同,即混交林>阔叶林>针叶林>灌丛>草甸>裸地,混交林利用率最高,裸地利用率最低。不同土地利用类型对氨基酸类利用率变化范围为0.32~0.72,对碳水化合物类利用率变化范围为0.53~1.36,对羧酸类利用率变化范围为0.43~1.39,对聚合物类利用率变化范围为0.38~0.69,对胺类利用率变化范围为0.08~0.27,对碳水化合物类利用率变化范围为0.38~0.86。总体而言,碳水化合物和羧酸类碳源是不同土地利用类型土壤微生物的主要碳源,其次为氨基酸类、酚酸类和聚合物类,胺类碳源的利用率最小。

表1 不同土地利用类型土壤微生物对碳源利用强度
注:同列不同小写字母表示差异显著(p<0.05)。
2.4 不同土地利用类型土壤微生物群落多样性
微生物群落多样性指数可用来指示土壤微生物群落利用碳源的程度,根据培养第96 h的AWCD值计算土壤微生物群落的物种丰富度指数(H)、均匀度指数(E)、优势度指数(Ds)和碳源利用丰富度指数(S)。结果表明,不同土地利用类型土壤微生物群落功能多样性指数存在一定差异,不同土地利用类型土壤微生物物种丰富度指数(H)变化范围为1.62~3.25,依次表现为混交林>阔叶林>针叶林>灌丛>草甸>裸地,阔叶林和针叶林差异不显著(p>0.05),显著高于灌丛、草甸和裸地(p<0.05);均匀度指数(E)变化范围为0.43~0.89,依次表现为混交林>阔叶林>针叶林>灌丛>草甸>裸地,其中混交林、阔叶林和针叶林差异不显著(p>0.05),显著高于灌丛、草甸和裸地(p<0.05);优势度指数(Ds)变化范围为0.76~0.86,其中不同土地利用类型土壤微生物优势度指数(Ds)差异均不显著(p>0.05);碳源利用丰富度指数(S)变化范围为5.6~26.7,依次表现为针叶林>混交林>阔叶林>灌丛>草甸>裸地,其中针叶林和混交林差异不显著(p>0.05),其他补贴土地利用类型碳源利用丰富度指数差异均显著(p<0.05)。
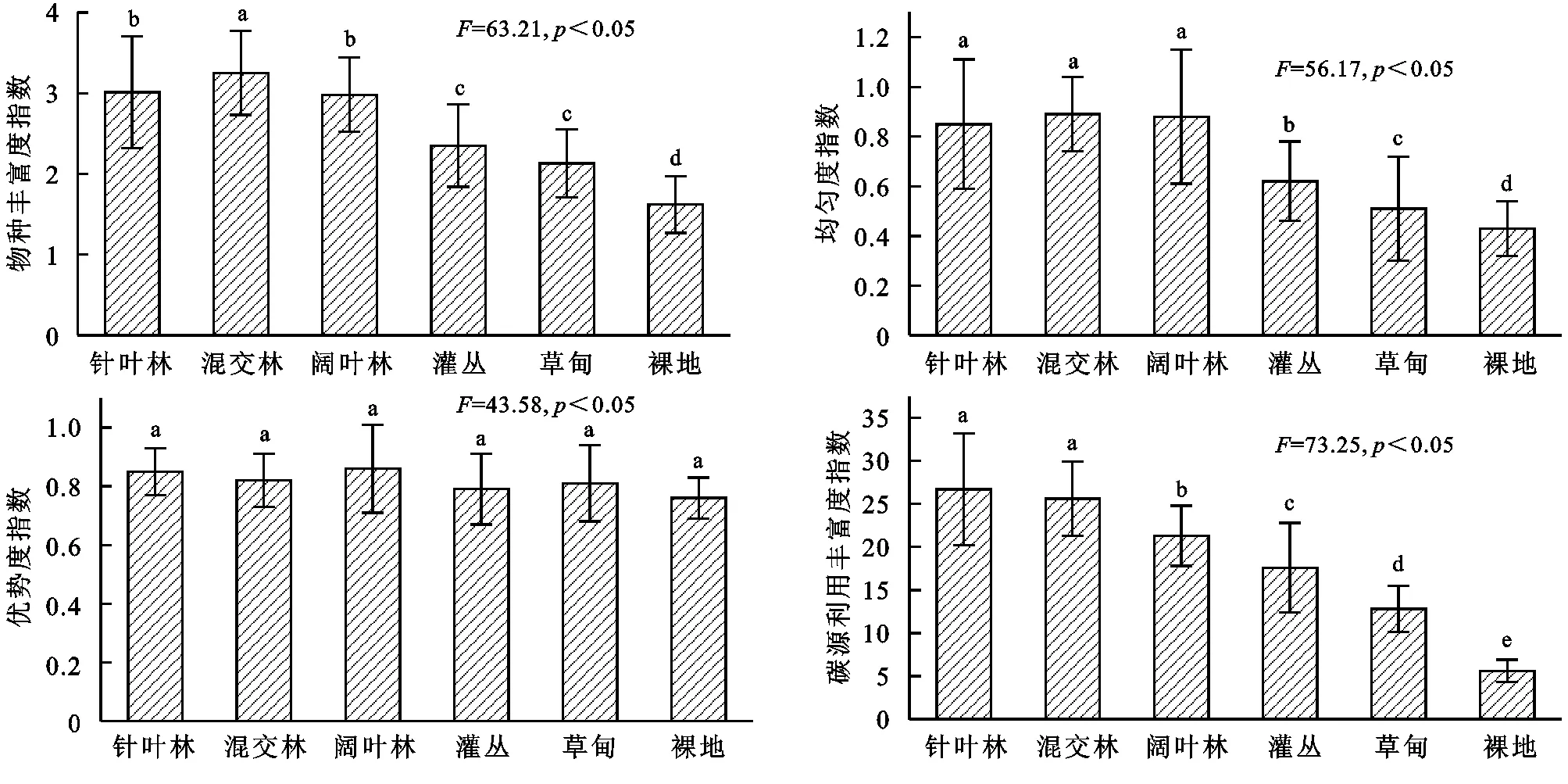
图3不同土地利用类型土壤微生物群落多样性
2.5 不同土地利用类型土壤微生物群落碳源利用类型的主成分分析
为了进一步了解不同土地利用类型根区土壤微生物群落功能的差异,对31种碳源的利用情况进行主成分(PC)分析(PCA),采用培养第120 h时间点的数据,提取出4个主成分,主成分1,主成分2分别能解释变量方差的65.154%和81.047%,前3个主成分累积贡献率达到93.841%,因此第一主成分、第二主成分和第三主成分为本文所要解释的主成分。主成分分析结果显示:31个碳源在3个主成分上的载荷值(表2),初始载荷因子反映主成分与碳源利用的相关系数,载荷因子越高表示碳源对主成分的影响越大。由表3可知与第一主成分具有较高相关性的碳源有23种,其中,羧酸类化合物有5种,多聚化合物有3种,碳水化合物有7种,芳香化合物1种,氨基酸3种,胺类化合物2种;第二主成分利用碳水化合物4种,氨基酸1种,共5种碳源;与第三主成分具有较高相关性的碳源仅有2种,碳水化合物1种,氨基酸1种;在主成分分离中起主要贡献作用的是胺类和氨基酸类碳源。
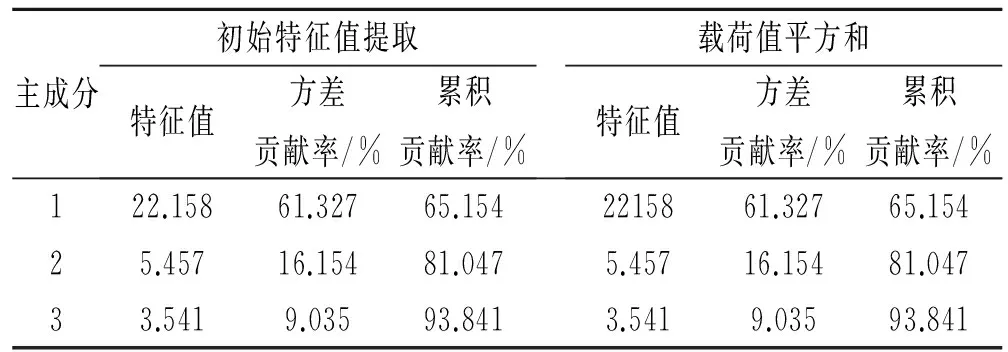
表2 方差分解主成分提取分析
2.6 土壤养分与微生物多样性之间相关性
土壤养分为土壤微生物的重要碳源和氮源,为探讨土壤养分与土壤微生物群落多样性之间的关系,进行土壤养分与微生物群落多样性相关性分析(表4)。结果表明,土壤微生物群落功能多样性各指标与土壤pH值之间存在负相关关系,与土壤养分等均呈正相关关系,其中,土壤微生物群落功能多样性各指标均与土壤有效养分呈极显著正相关(p<0.01);物种丰富度指数(H)、均匀度指数(E)和碳源利用丰富度指数(S)与土壤养分各指标的相关系数绝对值均高于优势度指数(Ds),说明土壤养分对土壤微生物群落优势度指数的影响作用较小。

表3 31种碳源的主成分载荷因子

表4 土壤养分与微生物多样性之间相关性
注:*,**分别表示在0.05,0.01水平上差异显著。
3 讨论与结论
平均颜色变化率(AWCD)是反映土壤微生物活性,即利用单一碳源能力的一个重要指标,在一定程度上反映了土壤中微生物种群的数量和结构特征[18]。AWCD值越大,表明细菌密度越大、活性越高;反之,细菌密度越小、活性越低。分析不同土地利用类型土壤微生物群落的代谢活性发现,不同土地利用类型土壤微生物活性呈现一致的变化趋势,在整个培养过程中,裸地、草甸和灌丛土壤微生物对Biolog-ECO板中碳源的代谢能力明显低于混交林、阔叶林和针叶林,分析其可能的原因是:乔木林土壤中存在着与Biolog-ECO板中碳源物质高度协调的微生物(其养分含量较高),植物残体和根系分泌物数量都很多,导致进入土壤的新鲜有机物质显著增加,这大大刺激了土壤微生物的生长和繁殖,进而代谢活性显著提高[20-21]。因此,在微生物生长的温度范围内,随着温度升高,生长速度加快,代谢活性增强。与草甸和灌丛相比,乔木是自然植被条件下长期自然选择的结果,形成了较和谐、平衡的微生态环境,而且人为干扰少,植被种类丰富,每年产生大量凋落物,丰富了微生物所需的营养物质来源,因而其土壤微生物活性明显高于灌丛、草甸和裸地。由此可见,地上部植被归还土壤有机物的多寡可能是土壤微生物群落代谢活性的影响因素之一,其土壤微生物群落代谢活性较低,碳源利用能力相对较弱[20-21]。本研究中土壤微生物对不同种类碳源的利用强度存在较大差异,混交林土壤微生物群落对6类碳源的利用率最高,灌木居中,裸地最低,不同土地利用类型土壤微生物对6类碳源的优先利用顺序虽存在差异,而土壤养分与土壤微生物多样性的变化趋势相一致。总体而言,碳水化合物和羧酸类碳源是不同土地利用类型土壤微生物的主要碳源,其次为氨基酸类、酚酸类和聚合物类,胺类碳源的利用率最小。
根据培养第96 h时的AWCD值计算土壤微生物群落的Simpson指数、Shannon-Wiener指数、丰富度指数和McIntosh指数。Shannon-Wiener指数反映了微生物群落物种变化度和差异度,较高的Shannon-Wiener指数代表微生物种类多且分布均匀,该值混交林最高,表明混交林植物的土壤微生物群落种类最多且较均匀,并且不同土地利用类型土壤微生物群落功能多样性指数存在一定的差异。
碳源利用类型的主成分分析结果表明:不同土地利用类型土壤微生物群落代谢功能多样性有显著差异,受影响最大的碳源主要是羧酸类和聚合物类,而这些碳源与根系分泌物关系密切,说明羧酸类和聚合物类的根系分泌物对微生物群落功能有较大影响。而根系分泌物起到了直接或间接的作用,这些物质对微生物和植株具有自毒作用而导致其积累[22-23]。土壤养分为土壤微生物的重要碳源和氮源,为探讨土壤养分与土壤微生物群落多样性之间的关系,进行了土壤养分与微生物群落多样性相关性分析(表4)。结果表明,土壤微生物群落功能多样性各指标与土壤pH值之间存在负相关关系,与土壤养分等均呈正相关关系,其中,土壤微生物群落功能多样性各指标均与土壤有效养分呈极显著正相关(p<0.01);物种丰富度指数(H)、均匀度指数(E)和碳源利用丰富度指数(S)与土壤养分各指标的相关系数绝对值均高于优势度指数(Ds),说明了土壤养分对土壤微生物群落优势度指数的影响作用较小。由此可知,土壤养分和土壤pH值与微生物群落功能多样性密切相关,其中土壤pH值对土壤微生物群落功能多样性贡献为负,土壤养分对土壤微生物群落功能多样性贡献为正,这是造成不同土地利用类型土壤微生物群落多样性差异的重要原因,其中有机质和全氮是土壤微生物的主要养分来源。综上所述,土壤本底因子、植物种类组成和覆盖度均影响土壤微生物活性和群落功能多样性,深入研究这些因素对土壤健康、生物肥力培育及土壤可持续利用具有重要的理论和实践意义。
[1] Westerdahl B. Biological Control of Plant-Parasitic Nematodes: Soil ecosystem management in sustainable agriculture, second edition[J]. Soil Science Society of America Journal, 2015,79(3):972.
[2] Soil ecology and ecosystem services[M]. Oxford: Oxford University Press, 2012.
[3] DeLuca T H, Gundale M J, MacKenzie M D, et al. Biochar effects on soil nutrient transformations[J]. Biochar for Environmental Management: Science, Technology And Implementation, 2015,2:421-454.
[4] Prendergast-Miller M T, Duvall M, Sohi S P. Biochar-root interactions are mediated by biochar nutrient content and impacts on soil nutrient availability[J]. European Journal of Soil Science, 2014,65(1):173-185.
[5] Mukai M, Aiba S, Kitayama K. Soil-nutrient availability and the nutrient-use efficiencies of forests along an altitudinal gradient on Yakushima Island, Japan[J]. Ecological Research, 2016,31(5):719-730.
[6] Berthrong S T, Buckley D H, Drinkwater L E. Agricultural management and labile carbon additions affect soil microbial community structure and interact with carbon and nitrogen cycling[J]. Microbial Ecology, 2013,66(1):158-170.
[7] Fierer N, Leff J W, Adams B J, et al. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes[J]. Proceedings of the National Academy of Sciences, 2012,109(52):21390-21395.
[8] Lauber C L, Ramirez K S, Aanderud Z, et al. Temporal variability in soil microbial communities across land-use types[J]. The ISME Journal, 2013,7(8):1641-1650.
[9] Barberán A, Bates S T, Casamayor E O, et al. Using network analysis to explore co-occurrence patterns in soil microbial communities[J]. The ISME Journal, 2012,6(2):343-351.
[10] Sradnick A, Murugan R, Oltmanns M, et al. Changes in functional diversity of the soil microbial community in a heterogeneous sandy soil after long-term fertilization with cattle manure and mineral fertilizer[J]. Applied Soil Ecology, 2013,63:23-28.
[11] Lange M, Habekost M, Eisenhauer N, et al. Biotic and abiotic properties mediating plant diversity effects on soil microbial communities in an experimental grassland[J]. PLoS One, 2014,9(5):e96182.
[12] Paula F S, Rodrigues J L M, Zhou J, et al. Land use change alters functional gene diversity, composition and abundance in Amazon forest soil microbial communities[J]. Molecular Ecology, 2014,23(12):2988-2999.
[13] 齐师杰,张行南,夏达忠,等.嘉陵江流域土地利用/覆被变化特征及其驱动力分析[J].长江科学院院报,2013,30(1):1-7.
[14] 许炯心,孙季.嘉陵江流域年径流量的变化及其原因[J].山地学报,2007,25(2):153-159.
[15] 仙巍,邵怀勇,周万村.嘉陵江中下游地区土地利用格局变化的动态监测与预测[J].水土保持研究,2005,12(2):61-64.
[16] 刘瑞民,杨志峰,丁晓雯,等.土地利用/覆盖变化对长江上游非点源污染影响研究[J].环境科学,2006,27(12):2407-2414.
[17] 王国梁,刘国彬.黄土丘陵区纸坊沟流域植被恢复的土壤养分效应[J].水土保持通报,2002,22(1):1-5.
[18] Fierer N, Leff J W, Adams B J, et al. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes[J]. Proceedings of the National Academy of Sciences, 2012,109(52):21390-21395.
[19] Lauber C L, Ramirez K S, Aanderud Z, et al. Temporal variability in soil microbial communities across land-use types[J]. The ISME Journal, 2013,7(8):1641-1650.
[20] Zak D R, Holmes W E, White D C, et al. Plant diversity, soil microbial communities, and ecosystem function:are there any links[J]. Ecology, 2003,84(8):2042-2050.
[21] Yao H, Jiao X, Wu F. Effects of continuous cucumber cropping and alternative rotations under protected cultivation on soil microbial community diversity[J]. Plant and Soil, 2006,284(1/2):195-203.
[22] Frey S D, Knorr M, Parrent J L, et al. Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests[J]. Forest Ecology and Management, 2004,196(1):159-171.
[23] Kennedy A C, Smith K L. Soil microbial diversity and the sustainability of agricultural soils[J]. Plant and Soil, 1995,170(1):75-86.
VariationofSoilNutrientsandMicrobialCommunityDiversityofDifferentLandUseTypesintheJialingRiver,SichuanProvince
YANG Bingxun, LIU Qua, DONG Tingxu
(SchoolofResourcesandEnvironmentalEngineering,MianyangNormalUniversity,Mianyang,Sichuan621000,China)
We present a comprehensive analysis of soil nutrients and soil microbial community diversity of different land use types in Jialing River from 2013 to 2015, based on the soil habitat, the structure and function of soil microbial community were studied by using Biolog plate and phospholipid fatty acid methyl ester (FAMEs), respectively. The results are as follows. The soil nutrients of different land use types decrease in the order: mingled forest>broad-leaved forest>coniferous forest>shrub>meadow>bare land. There were significant differences in functional diversity of microbial communities of different land use types. The average well color development (AWCD), which directly reflects microbial activity and functional diversity, increased and then decreased with the order: mingled forest>broad-leaved forest>coniferous forest>shrub>meadow>bare land. The carbon sources mostly used by soil microbes were carbohydrates and carboxylic acids, followed by amino acids, phenolic acids and polymers, the lowest was amines. The Simpson index, Shannon-Wiener index, richness index and McIntosh index of different land use types showed the sequence: mingled forest>broad-leaved forest>coniferous forest>shrub>meadow>bare land. Principal component analysis identified two factors in relation to carbon sources, they explained 65.154% and 81.047% of the variation, respectively. The carbon sources used by soil microbial communities were different among different land use types. Amino acids and amides were the two main carbon sources separating the two principal component factors. Correlation analysis showed that soil microbial diversity index was significantly or very significantly positively correlated with soil nutrients, and was negatively correlated with pH value, the soil nutrients had the more positive contribution to soil microbial diversity and soil pH value had the negative contribution, which were the reason for variation of soil microbial community diversity of different land use types in Jialing River.
Jialing River; land use types; soil microbial community diversity; soil nutrients
2016-10-01
:2016-10-18
四川省生态重点实验室开放项目“基于GIS的龙门山北段区域土地利用景观格局演变及其生态效应评价”
杨秉珣(1975—),男,四川绵阳人,讲师,研究方向:文地理与土地利用。E-mail:13990198977@163.com
董廷旭(1968—),男,四川彭州人,博士,教授,硕士生导师,研究方向:土壤学、土地利用与生态环境等。E-mail:Dong_zx@126.com
S154.3;X144
:A
:1005-3409(2017)05-0014-07
