碱性条件下电催化氧化甲醇机理分析
2017-09-03乐栋贤
梅 艳 乐栋贤
(乐山职业技术学院 四川 乐山 614000)
碱性条件下电催化氧化甲醇机理分析
梅 艳 乐栋贤
(乐山职业技术学院 四川 乐山 614000)
根据电解质的不同可以将甲醇燃料电池分为两大类:一类是以酸性物质为电解质的酸性甲醇燃料电池(PEM-DMFC);另一类是以碱性物质作为电解质的碱性甲醇燃料电池(AEM-DMFC)。本文分析了AEM-DMFC中甲醇的氧化机理。
一、AEM-DMFC工作原理分析
AEM-DMFC(阴离子膜直接甲醇燃料电池)是直接将燃料甲醇的化学能转化为电能,其工作原理如图1所示,在AEMDMFC中载流子为OH-,工作时OH-在阴极产生,经阴离子交换膜传至阳极,然后OH-在阳极和燃料甲醇发生电氧化反应进行放电,甲醇被氧化成CO2,同时释放出电子和水,阳极氧化产生的电子经外电路从阳极传到阴极供阴极氧还原使用,由此完成整个电池反应。其具体反应如下:
阳极反应:CH3OH+6OH-→ 6e-+CO2+5H2O E0=-0.81V
(1-1)
阴极反应:3/2O2+3H2O+6e-→ 6OH-E0=0.402V
(1-2)
电池反应:CH3OH+3/2O2→ CO2+2H2O E0=1.21V
(1-3)
从上述反应过程中,我们计算得电池的可逆电动势达到1.21V,但在实际工作中由于受到活化极化、欧姆极化和浓差极化的影响,电池的真实工作电压远低于此值,其中活化极化主要发生在低电流密度区,由最慢的电化学反应步骤所决定,因而提高电催化剂的催化活性显得非常重要。

图1 阴离子膜直接甲醇燃料电池原理图
二、甲醇阳极电催化氧化机理
对于在碱性条件下甲醇阳极氧化动力学的研究一般集中在铂电极上,已经有不少研究组[1-2]对在多晶体和单晶体铂上的甲醇电催化氧化机理进行了探索。综合分析来看,甲醇氧化一般按照所谓的双路径机理来进行的。即:
A.V.Tripkovic[2]等人认为路径A在塔菲尔区反应时是主反应。在碱性条件下,活性中间体向毒化物的转化与向甲酸方向氧化相比所占比例不大,其造成的毒化影响有限。
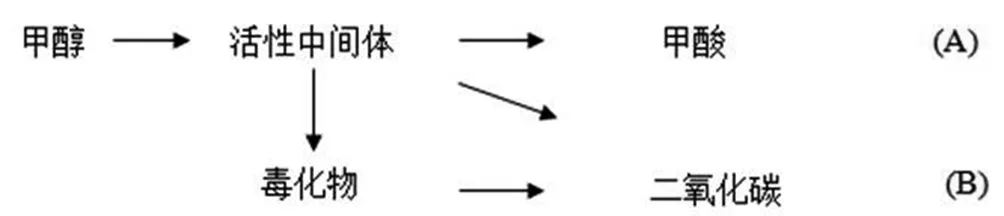
与氢做燃料相比,甲醇电氧化过程要复杂得多。从动力学角度来看,由式(1-1)可知甲醇完全氧化为CO2需要6个电子释放和6个OH-的转移,因此该反应不可能一次就能完成,必然是多步骤的反应过程,在反应过程可能产生一系列中间体和副产物。其具体反应过程可能如下[2]:

从以上甲醇的电氧化历程可看出,甲醇的电氧化过程可分解为两个部分。首先是甲醇的逐步脱氢,形成一系列含碳的反应中间体,然后含碳中间体在在含氧物种的进攻下而被氧化而生成产物,主要是甲酸盐和二氧化碳[3]等。我们知道有些反应中间体可能吸附过弱而导致脱附形成稳定的化合物,也就没有被进一步的被氧化成二氧化碳,电子释放的不完全,造成燃料利用率下降。同时另一方面,由于某些反应中间体(主要是化学吸附的COads、CHOads)在催化表面上吸附过强,难以脱附,如果其自身被氧化的速率过低就会造成过高的累积效应,进而长期霸占电极表面的活性位,进一步阻碍了甲醇及其它活性物种的吸附,降低了催化剂的利用率,导致了反应速度的降低。虽然这些物种可在高电位下被氧化,但这必然使电极极化程度加深,导致电池的工作电压下降和电池功率的降低。从动力学角度上讲,上述反应历程中应存在最慢的一步,即速控步。一般认为活性中间体CHOads的氧化是主要反应方向,其速度在此方向上与前面步骤相比是最慢的,即(6)应是速控步[2,4]。从上面分析可知,要提高电氧化甲醇的速度就需要加快CHOads的向CO2或甲酸盐方向的深度氧化速度,同时抑制向CO方向反应的速度。由此我们有以下思考:
(1)适度提高碱的浓度(即PH值)使其提供更多的含氧物种来氧化含碳中间体。
(2)通过在Pt上修饰一种或多种某些特定的金属元素来构成二元或三元甚至四元合金,一方面这些元素的加入提供了能在低电位下氧化含氧物种的活性位,另一方面掺杂元素改变了Pt表面电子状态和吸附性能,因而提高了Pt对甲醇及其中间体CHOads等的氧化能力,从而有利于找到对甲醇阳极氧化有促进作用的复合催化剂。
三、甲醇电氧化动力学影响因素分析
甲醇的电氧化过程是伴随着各种因素综合作用的过程。在这些因素的作用下,甲醇的氧化速度、催化剂活性、稳定性等都受到了影响。
(1)温度。在阿仑尼乌斯公式中,温度是在指数项上,因而温度的变化对反应速度影响很大,同时温度的变化也影响了甲醇的传质速度。文献[5]研究发现温度升高使得甲醇的电氧化速度提高得非常快,同时还使得甲醇的起始氧化电位在碱性条件下负移达125-135mV之多。另外温度的变化可能改变反应的控制步骤。A.J.Dickinson[6]等人研究认为在低温下甲醇氧化的速控步是甲醇的吸附和脱氢。
(2)时间。时间对甲醇氧化的影响主要是从稳定性角度来讲的。我们知道高分散的纳米级催化剂微粒具有较大的比表面能,很不稳定,在长期工作中,其比表面会慢慢下降,导致催化活性降低,因此寻找催化性能稳定的催化剂和能提高催化剂稳定性的载体很有必要。
(3)过电位。通过给电极施加更正的电势,可以使电子的能量降低,进而有利于溶质中比电极上更高能量的电子传递到电极上,于是氧化电流便形成了。
一般增加电极电位会使电化学反应速率提高几个数量级,但这必然导致能量转化效率的降低,在实际工作中,我们总是想获得尽可能高的反应速率,而极化电位应尽可能低。文献[12]研究发现甲醇氧化是在催化剂Pt表面吸附了OHads后开始的,这启示我们可通过添加有利于吸附OHads的金属来降低甲醇的起始氧化电位。
(4)甲醇浓度和PH值。甲醇浓度的提高使甲醇的吸附速率增加,因而有利于甲醇的氧化,但如果甲醇浓度过高则使吸附的含氧物种减少,氧化速度也因此 而下降;同样PH的增大使吸附的含氧物种增多,因而有利于甲醇的氧化,但如果PH过高也会阻碍甲醇的吸附,结果导致氧化速度的下降。因此要得到高的反应速度,应该在增加甲醇浓度或PH的同时保持合适的甲醇与OH-的比。
[1]Koji Matsuoka a,Yasutoshi Iriyama a,Takeshi Abea,et al.Electro-oxidation of methanol and ethylene glycol on platinumin alkaline solution:Poisoning effects and product analysis[J].Electrochimica Acta,2005 51:1085-1090.
[2]Eileen Hao Yu,Scott K,Robert W.A study of the anodic oxidation of methanol on Pt in alkaline solutions[J].J Electroanal Chem,2003,547:17-/24.
[3]Morall6n E,Rodes A,Vzquez J L,et al.Voltammetric and in-situ FTIR spectroscopic study of the oxidation of methanol on Pt(hkl)in alkaline media[J].J Electroanal Chem,1995391:149-157.
[4]Amalija V,Tripkovic K Dj,Popovic J D,et al.Methanol oxidation at Platinum electrodes in alkaline solution:comparison between supported catalysts and model systems[J].J Electroanal Chem,2004,572:119-128.
[5]Tripkovic A V,Popovic K D,Grgur B N.Methanol electrooxidation on supported Pt and PtRu catalysts in acid and alkaline solutions[J].Electrochimica Acta,2002 47:3707-/3714.
[6]Dickinson A J,Carrette L Pl,Collins J A,et al.Performance of methanol oxidation catalysts with varying Pt:Ru ratio as a function of temperature.J Appl Electrochem 2004,34(10):975-980.
项目编号:KY2014034 燃料电池cucorepdshell阳极催化剂性能研究;15GZD132 直接甲醇燃料电池用催化剂的制备及性能研究
梅艳(1983-),女,汉族,陕西渭南人,讲师,工学硕士,乐山职业技术学院,研究方向:能源电池材料。
