泡盛曲霉液体发酵产β-1,3-1,4-葡聚糖酶的条件优化
2017-09-03刘二伟杨绍青闫巧娟江正强
刘二伟,杨绍青,闫巧娟,江正强,*
泡盛曲霉液体发酵产β-1,3-1,4-葡聚糖酶的条件优化
刘二伟1,杨绍青2,闫巧娟3,江正强2,*
(1.河南科技大学食品与生物工程学院,河南 洛阳 471000;2.中国农业大学食品科学与营养工程学院,北京 100083;3.中国农业大学工学院,北京 100083)
从土壤样品中筛选得到一株高产β-1,3-1,4-葡聚糖酶的真菌,经鉴定为泡盛曲霉(Aspergillus awamori),命名为Aspergillus awamori CAU33。依次采用单因素试验和响应面分析法优化了其液体发酵产β-1,3-1,4-葡聚糖酶的条件,得到该菌株产酶的最适条件为:玉米芯质量浓度55 g/L、大豆蛋白胨质量浓度25 g/L、曲拉通X-114质量浓度23 g/L、初始pH 4.5、培养温度35 ℃、培养时间6 d。在此条件下β-1,3-1,4-葡聚糖酶活力达到8 447 U/mL,为优化前的17.6 倍。
β-1,3-1,4-葡聚糖酶;液体发酵;优化;泡盛曲霉
β-1,3-1,4-葡聚糖是由葡萄糖通过β-1,3和β-1,4混合的糖苷键链接而成的直链葡聚糖,主要存在于谷物的胚乳和细胞壁中[1]。β-1,3-1,4-葡聚糖酶(EC 3.2.1.73)是一类重要的水解酶,可以水解谷物中的β-1,3-1,4-葡聚糖,这一特性使其在啤酒酿造和饲料工业中具有重要的应用价值[2]。在啤酒酿造过程中,β-1,3-1,4-葡聚糖酶可通过降低麦芽汁中β-葡聚糖的含量,从而降低黏度、提高过滤速率,提升啤酒生产效率和品质[3]。在饲料生产过程中添加该酶可有效降低动物消化道食糜的黏度,提高饲料的转化率,促进动物生长[4-5]。β-1,3-1,4-葡聚糖酶主要来源于微生物,细菌中多以芽孢杆菌为主,如地衣芽孢杆菌(Bacillus licheniformis)[6]、解淀粉芽孢杆菌(B. amyloliquefacien)[7]、多黏类芽孢杆菌(Paenibacillus polymyxa)[8]和特基拉芽孢杆菌(B. tequilensis)[9]等。真菌如黑曲霉(Aspergillus niger)[10-11]、嗜热拟青霉(Paecilomyces thermophila)[12]、米黑根毛霉(Rhizomucor miehei)[13-14]、樟绒枝霉(Malbranchea cinnamomea)[15]、局限曲霉(A. restrictus)[16]、土曲霉(A. terreus)[17]、康氏木霉(Trichoderma kongingii)[18]和碎囊毛霉(Mucor petrinsularis)[19]等也报道产β-1,3-1,4-葡聚糖酶。曲霉属真菌是β-1,3-1,4-葡聚糖酶的主要来源之一,近年来曲霉β-1,3-1,4-葡聚糖酶的研究主要集中于黑曲霉(A. niger)[10-11],尚鲜有泡盛曲霉(A. awamori)产β-1,3-1,4-葡聚糖酶的研究报道。
β-1,3-1,4-葡聚糖酶是微生物生长和繁殖过程中利用葡聚糖时产生的一种胞外酶,在发酵过程中其产酶量的高低主要与该菌株相关基因的表达有关。同时β-1,3-1,4-葡聚糖酶也是一类诱导酶,通过一定外部培养条件的优化可以提高其编码基因的表达量,从而提高其酶活力。然而目前已报道野生菌发酵产β-1,3-1,4-葡聚糖酶的水平普遍较低[6,8-9,16-19],其中米黑根毛霉来源β-1,3-1,4-葡聚糖酶活力最高(6230 U/mL)[13]。本研究从自然界中筛选得到一株高产β-1,3-1,4-葡聚糖酶的真菌,对菌株进行了鉴定并优化了该菌株液体发酵产β-1,3-1,4-葡聚糖酶的发酵条件,为其后续工业化生产和应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
大麦β-葡聚糖 美国Sigma公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS) 国药集团化学试剂有限公司;其他试剂如无特殊说明均为分析纯。
1.1.2 培养基
平板初筛培养基:燕麦β-葡聚糖5 g/L、酵母提取物10 g/L、KH2PO41 g/L、MgSO4·7H2O 0.3 g/L、CaCl20.3 g/L、台盼蓝0.1 g/L、琼脂20 g/L、青霉素1 g/L、卡那霉素1 g/L。
平板分离培养基:马铃薯200 g/L、葡萄糖20 g/L、琼脂20 g/L。
摇瓶复筛培养基:燕麦粉20 g/L、酵母提取物10 g/L、胰蛋白胨10 g/L、KH2PO41 g/L、MgSO4·7H2O 0.3 g/L、CaCl20.3 g/L。
液体发酵培养基:燕麦粉20 g/L、酵母提取物10 g/L、KH2PO41 g/L、MgSO4·7H2O 0.3 g/L、CaCl20.3 g/L,自然pH值。
1.2 仪器与设备
HZQ-F160全温振荡培养箱 太仓试验设备厂;DK-S24电热恒温水浴锅 上海精宏试验设备有限公司;TU-1800PC紫外-可见分光光度计 北京普析通用仪器设备有限责任公司;BS-124S型电子分析天平 赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 β-1,3-1,4-葡聚糖酶活力及蛋白含量测定
参照Yang Shaoqing等[12]的方法测定β-1,3-1,4-葡聚糖酶活力:添加50 μL 1 g/100 mL大麦β-葡聚糖于小试管中,55 ℃预热3 min后加入150 μL用50 mmol/L乙酸-乙酸钠缓冲液(pH 5.0)适当稀释的酶液,55 ℃反应10 min,以葡萄糖作为标准,采用DNS法测定产生的还原糖量。β-1,3-1,4-葡聚糖酶活力单位(U)定义为在上述条件下每分钟水解大麦β-葡聚糖生成1 μmol葡萄糖所需要的酶量(U/mL)。
蛋白含量的测定参照Lowry等[20]方法,以牛血清白蛋白作为标准蛋白。
1.3.2 菌种筛选
取约1 g土样悬浮于1 mL无菌水中,混匀后取100 μL混合液用涂布棒涂抹均匀于初筛培养基上,30 ℃恒温培养箱中培养3~4 d。挑取菌落周围培养基呈现透明圈的菌株转接到分离培养基上培养3~4 d。从PDA培养基上切下约1 cm2有透明圈的菌块接入摇瓶复筛培养基中,30 ℃、200 r/min条件下培养4 d后取约1 mL发酵液,10 000 r/min离心10 min,取上清液测定β-1,3-1,4-葡聚糖酶活力。
1.3.3 菌种鉴定
菌种形态鉴定:观察产酶菌株在鉴定培养基上的菌落形态、产孢结构和孢子形态。
分子生物学鉴定:采用ITS基因序列鉴定,构建系统发育树。
参照Wang Long等[21]的方法提取鉴定菌株DNA。ITS基因扩增:ITS序列采用通用引物ITS1:5’-TCCGTAGGTGAACCTGCGG-3’;ITS4:5’-TCCTCCGCTTATTGATATGC-3’进行扩增。聚合酶链式反应(polymerase chain reaction,PCR)体系:5 μL 10×PCR Buffer,4 μL dNTP,上游引物和下游引物各1 μL,0.2 μL DNA模板,0.2 μL ExTaqDNA聚合酶,灭菌双蒸水定容至50 μL。PCR条件:94 ℃变性30 s、48 ℃退火30 s、72 ℃延伸60 s、30 个循环,最后72 ℃延伸10 min,4 ℃条件下保温。
DNA序列测定、序列比对和种属发育分析:将PCR产物委托北京三博远志技术服务公司测序。测得菌株ITS的序列后,在NCBI上利用BLAST程序对比,从GenBank数据库中获取有关种的标准序列数据,用ClustalX进行多序列对比分析,使用MEGA 6中的Neighbor-Joining法构建系统发育树[22],利用自展法检验各分支置信度[23]。
1.3.4 泡盛曲霉CAU33液体发酵产酶单因素试验
将大小为1 cm2的菌丝块接到装有50 mL液体发酵培养基的250 mL三角瓶中,30 ℃、200 r/min条件下振荡培养4 d。然后将发酵液于4 ℃条件下10 000 r/min离心10 min,上清液即为β-1,3-1,4-葡聚糖酶粗酶液。
采用单因素试验法优化泡盛曲霉CAU33液体发酵的产酶条件。碳源分别为可溶性淀粉、稻草、玉米杆、玉米芯、小麦麸皮、燕麦粉、葡萄糖、青稞粉,质量浓度为10~70 g/L;氮源分别为酵母提取物、胰蛋白胨、蛋白胨、牛肉蛋白胨、大豆蛋白胨、乙酸铵、(NH4)2SO4、(NH4)2HPO4,质量浓度为10~60 g/L;表面活性剂质量浓度为5~30 g/L;初始pH 2~7;培养温度20~50 ℃;发酵时间为1~8 d。每组设3 个平行,试验结果取平均值。1.3.5 响应面优化
根据单因素试验结果,选取玉米芯、大豆蛋白胨和曲拉通X-114质量浓度3 个因素为自变量,以酶活力为响应值,以单因素试验所得最适结果为响应面试验的中心,进行三因素五水平中心组合设计(central composite design,CCD)响应面试验,包括14 个分析试验和6 个中心试验,共20 组试验。试验因素与水平设计如表1所示。将试验数据进行多元回归拟合,并对回归方程进行方差分析及拟合度检验,讨论响应面特征,确定液体发酵条件的最适条件。最后以优化后的条件参数进行发酵产酶验证实验,将实验值与预测值进行比较,验证模型的有效性。

表1 CCD响应面设计的因素及水平Table 1 Factors and their corresponding levels used for CCD
2 结果与分析
2.1 产酶菌株的筛选与鉴定

图1 菌株CAU33菌落形态(A)及产孢结构(B)Fig. 1 Colony morphology (A) and conidial fructification (B) of strain CAU33
通过反复定向初筛和摇瓶复筛,筛选出200多株能够分泌β-1,3-1,4-葡聚糖酶的菌株,大部分的原始产酶水平都较低,介于5~100 U/mL之间(数据略)。其中从采集自河南的一个土壤样品中筛选出的一株丝状真菌产β-1,3-1,4-葡聚糖酶活力较高,为453.7 U/mL。因此后续对该菌株进行了形态学鉴定,该菌株在分离培养基上菌落生长迅速,30 ℃条件下培养4 d时直径达到7 cm,菌落平坦,呈暗褐黑色,无溶出液,菌落边缘为白色,菌落反面带黄色(图1A)。显微镜观察该菌的产孢结构为球形,孢子呈球状(图1B)。菌落及孢子形态呈现典型的曲霉特征[24]。
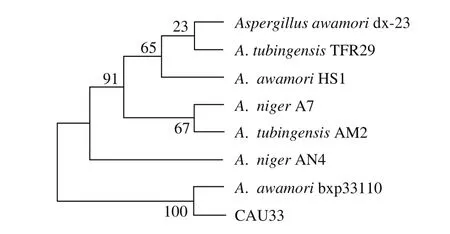
图2 菌株CAU33的ITS序列系统发育树Fig. 2 Phylogenetic tree of strain CAU33 based on ITS sequences
进一步采用分子生物学的方法鉴定菌株。提取菌株CAU33的ITS基因序列,经PCR扩增、测序后得到全长为537 bp的基因序列,选取与GenBank中相似度较高的同属菌株ITS基因序列进行比对。利用ClustaX1.83和Mega 6进行分析,用Neighbor-Joining法构建系统发育树,结果表明该菌与A. awamori bxq33110的相似度最高(图2)。结合菌落形态、孢子形态等特征进行综合分析,鉴定该菌为泡盛曲霉(A. awamori)[25],命名为泡盛曲霉CAU33。
β-1,3-1,4-葡聚糖酶在食品和饲料工业中具有重要的应用价值,近年来受到了研究者的关注[4]。目前国内外已有许多相关研究报道,但是真菌β-1,3-1,4-葡聚糖酶的研究仍相对较少[10-19]。曲霉属菌株是酶制剂工业的重要生产菌种之一,迄今已有少量曲霉属菌株产β-1,3-1,4-葡聚糖酶的研究报道,如黑曲霉[10]、局限曲霉[16]和土曲霉[17]等。泡盛曲霉主要存在于土壤、空气及各种腐败的有机物上,有文献报道泡盛曲霉能够用于发酵制备β-1,4-葡聚糖酶、木聚糖酶、阿魏酸脂酶、菊粉酶以及葡糖淀粉酶等[26-30],但是尚无该菌株发酵产β-1,3-1,4-葡聚糖酶的研究报道。
2.2 碳源对泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的影响
考察了可溶性淀粉、稻草、玉米杆、玉米芯、小麦麸皮、燕麦粉、葡萄糖、青稞粉不同碳源对泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的影响,结果表明以玉米芯为碳源时酶活力最高为755.7 U/mL,其次为青稞粉(681.1 U/mL)(表2)。玉米芯诱导高产β-1,3-1,4-葡聚糖酶可能是由于玉米芯中含有丰富的纤维素等可提供泡盛曲霉CAU33代谢利用的营养物质。因此选择玉米芯作为泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的最适碳源。

表2 不同碳源对泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的影响Table 2 Effect of carbon sources on β-1,3-1,4-glucanase production by A. awamoriCAU33U/mL
确定玉米芯为最适碳源后,进一步考察玉米芯的添加量对菌株产酶的影响。结果表明玉米芯添加量对产酶的影响较为显著,当其质量浓度由10 g/L增加到50 g/L时,酶活力逐渐升高,质量浓度为50 g/L时β-1,3-1,4-葡聚糖酶活力最高为2 146 U/mL,之后继续提高玉米芯质量浓度时,酶活力没有明显增加(图略)。此外,研究发现玉米芯的添加量增加到50 g/L以后发酵液变得非常浓稠,这可能不利于发酵液中氧的传递,进而影响到微生物的生长和代谢,导致产酶量保持稳定。因此选择50 g/L作为玉米芯的最适添加量。
2.3 氮源对泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的影响
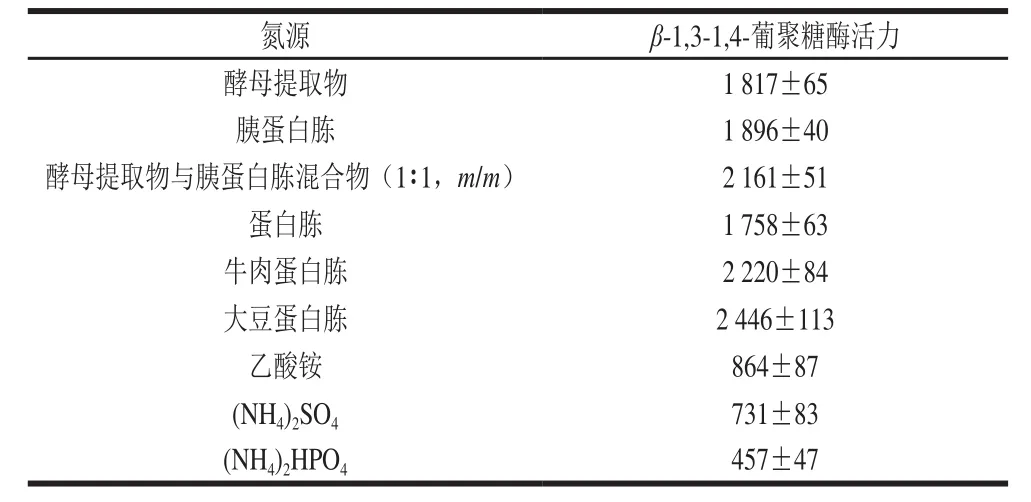
表3 不同氮源对泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的影响Table 3 Effect of nitrogen sources on β-1,3-1,4-glucanase production by A. awamoriCAU33U/mL
氮源为微生物蛋白质的合成提供着前体物质,不同的氮源会影响微生物酶的合成与分泌。考察了酵母提取物、胰蛋白胨、牛肉蛋白胨、大豆蛋白胨等有机氮源,以及硫酸铵、磷酸氢二铵等无机氮源对泡盛曲霉CAU33液体发酵产β-1,3-1,4-葡聚糖酶的影响(表3)。结果表明有机氮源比无机氮源更有利于β-1,3-1,4-葡聚糖酶的分泌,其中以大豆蛋白胨作为单一氮源时β-1,3-1,4-葡聚糖酶活力最高(2 446 U/mL),其次为牛肉蛋白胨、酵母提取物与胰蛋白胨混合物(1∶1,m/m)、胰蛋白胨和酵母提取物。
确定大豆蛋白胨为最适氮源后,进一步考察大豆蛋白胨的添加量对菌株产酶的影响。结果表明,大豆蛋白胨的添加量对泡盛曲霉CAU33产酶的影响比较显著,当其添加量为20 g/L时酶活力最高(2 478 U/mL),继续提高大豆蛋白胨质量浓度时,酶活力反而开始逐渐下降(图略)。因此选择20 g/L作为大豆蛋白胨的最适添加量。
2.4 表面活性剂对泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的影响
表面活性剂通常有助于提高微生物的细胞壁通透性,从而有利微生物胞外酶的分泌。考察了吐温20、40、60、80,曲拉通X-110、X-114不同表面活性剂(添加量5 g/L)对泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的影响。结果表明在培养基中添加吐温和曲拉通类表面活性剂均能够明显促进泡盛曲霉CAU33发酵产酶,其中添加曲拉通X-114时β-1,3-1,4-葡聚糖酶活力最高,为3 771 U/mL,其后依次为曲拉通X-110(3 629 U/mL)、吐温-80(3 269 U/mL)、吐温60(3 105 U/mL)、吐温40(2 882 U/mL)和吐温20(2 736 U/mL)(图略)。
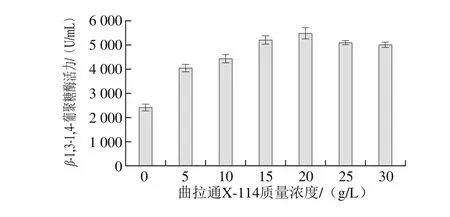
图3 曲拉通X-114质量浓度对泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的影响Fig. 3 Effect of Triton X-114 concentration on β-1,3-1,4-glucanase production by A. awamori CAU33
由图3可知,泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的量随着曲拉通X-114质量浓度的增加而逐渐升高,当添加量为20 g/L时酶活力最高(5 416 U/mL),之后继续增大其质量浓度时,酶活力反而开始缓慢下降(图3)。过高的表面活性剂浓度可能会破坏泡盛曲霉CAU33的细胞壁结构,进而导致部分细胞死亡或影响代谢。因此,选择20 g/L作为曲拉通X-114的最适添加量。
2.5 初始pH值对泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的影响
由图4可知,微酸环境适宜该菌株发酵产酶,当培养基的初始pH值在4.0~7.0时产酶量差别不大,当初始pH值为4.5时,β-1,3-1,4-葡聚糖酶活力最高,为5 637 U/mL。因此选取pH 4.5作为产酶培养基的最适初始pH值。

图4 初始pH值对泡盛曲霉CAU-33发酵产β-1,3-1,4-葡聚糖酶的影响Fig. 4 Effect of initial pH on β-1,3-1,4-glucanase production by A. awamori CAU33
2.6 发酵温度对泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的影响

图5 发酵温度对泡盛曲霉CAU33液体发酵产β-1,3-1,4-葡聚糖酶的影响Fig. 5 Effect of incubation temperature on β-1,3-1,4-glucanase production by A. awamori CAU33
由图5可知,泡盛曲霉CAU33的最适产酶培养温度为35 ℃,此时酶活力最高达到6 087 U/mL,当发酵温度过高或过低时都不利于菌株的发酵产酶。
2.7 发酵时间对泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的影响
在确定以上最适条件的基础上,最后考察了不同发酵时间对泡盛曲霉CAU33发酵产β-1,3-1,4-葡聚糖酶的影响。结果表明当培养时间为1~6 d时,β-1,3-1,4-葡聚糖酶活力几乎呈直线持续增加,在第6天时达到最高点,酶活力高达7 842 U/mL,此时发酵液中的蛋白质量浓度也达到最高值(6 mg/mL),之后随着发酵时间的持续延长,酶活力开始缓慢下降(图6A)。同时采用SDS-PAGE法和酶谱法分析了发酵过程中不同时间段发酵液中的蛋白组成变化情况及β-1,3-1,4-葡聚糖酶大致分子质量。结果表明泡盛曲霉CAU33分泌的β-1,3-1,4-葡聚糖分子质量大概为30 kD左右(图6B中第9道),为发酵液中的主要组分,且该组分蛋白的含量发酵初期随着发酵时间的延长而逐渐增加,在第6天时达到最大(图6B),与酶活力的变化趋势基本保持一致。

图6 泡盛曲霉CAU33液体发酵产酶历程(A)及粗酶液的SDS-PAGE与酶谱分析(B)Fig. 6 Time course profile of β-1,3-1,4-glucanase production (A) and SDS-PAGE and zymogram analysis of the crude enzyme (B)
2.8 响应面试验结果
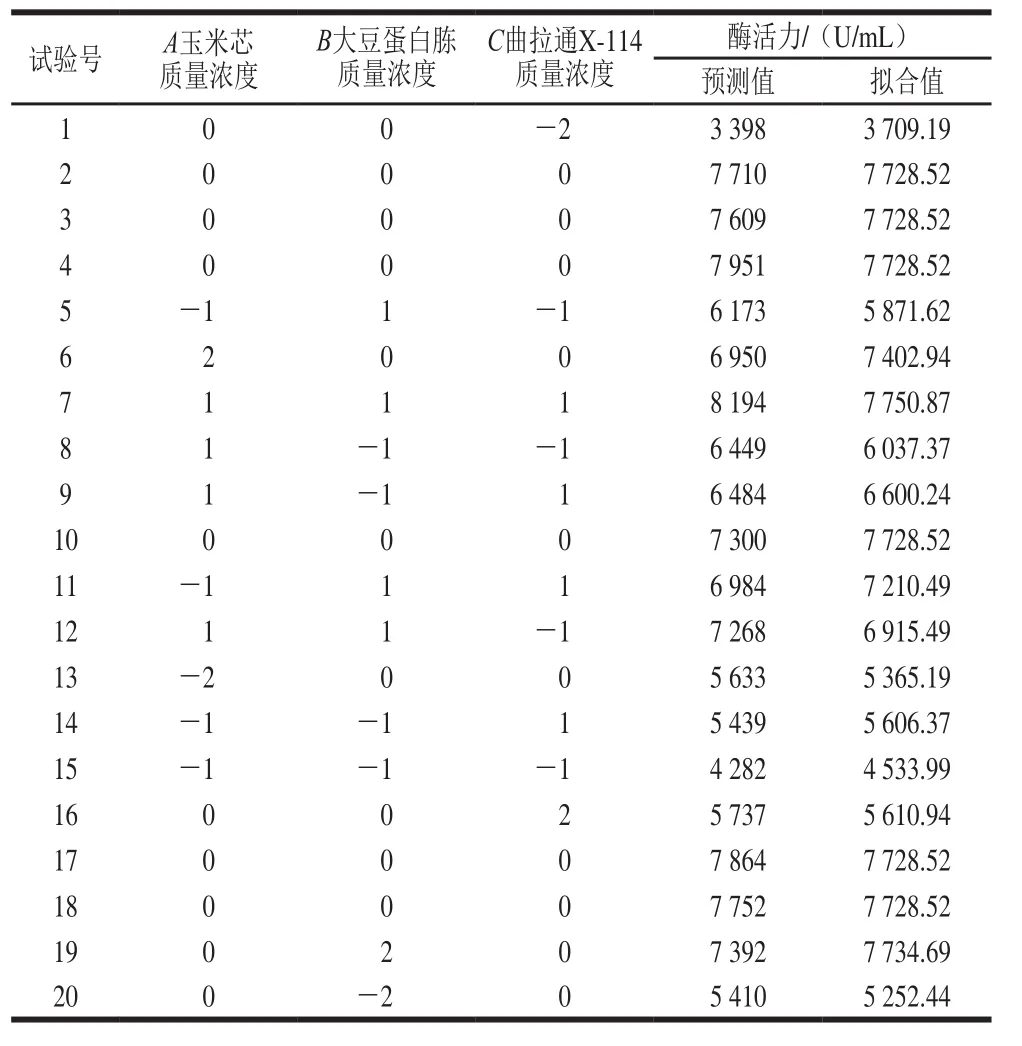
表4 CCD设计响应面试验及结果Table 4 CCD design with predicted and experimental values of β-1,3-1,4-glucanase activity
利用Design-Expert 8.0设计响应面试验结果见表4。经回归拟合后,酶活力的预测值Y可以用以下三元二次回归方程表示:
Y=7 728.52+509.44A+620.56B+475.44C-113.37AB-125.87AC+68.13BC-336.11A2-308.74B2-767.11C2
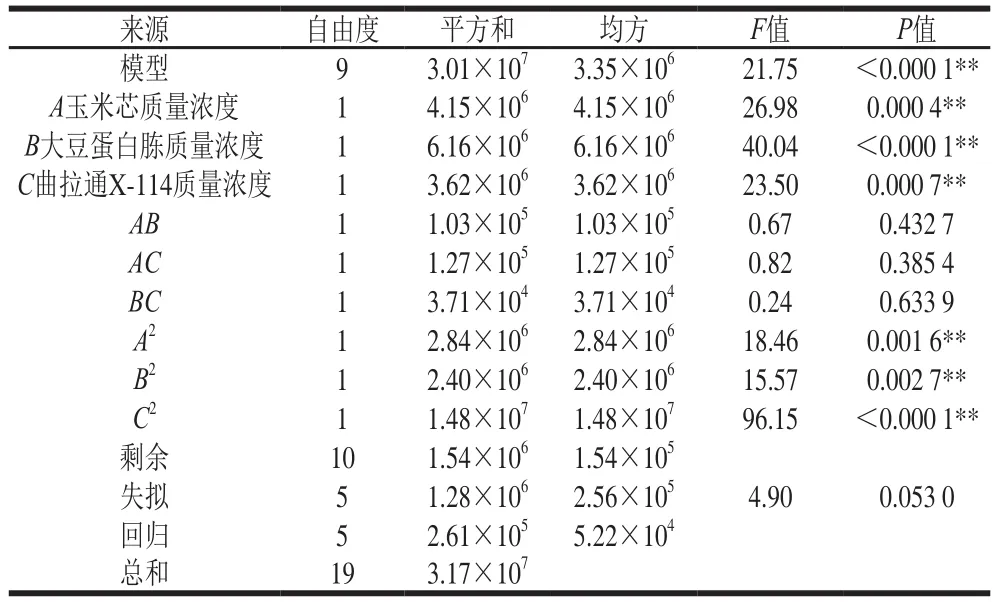
表5 各因素的估计回归系数Table 5Analysis of variance of regression model
如表5所示,模型回归系数方差分析表明方程因变量与自变量之间的线性关系明显,线性回归系数值P<0.05,表现为极显著性,说明该试验方法可行。失拟项系数值P为0.053 0(>0.05),表现为不显著,表明试验模型拟合度较好,试验的误差等偶然因素对试验的影响不显著。复相关系数R2为95.14%,二次方程的拟合度高,自变量与响应值之间线性关系显著,说明此模型预测结果比较准确。由回归方程系数显著性检验可知模型一次项A、B和C极显著,二次项A2、B2和C2均极显著,交互项AB、AC和BC均不显著。
2.9 各因素交互作用响应面分析
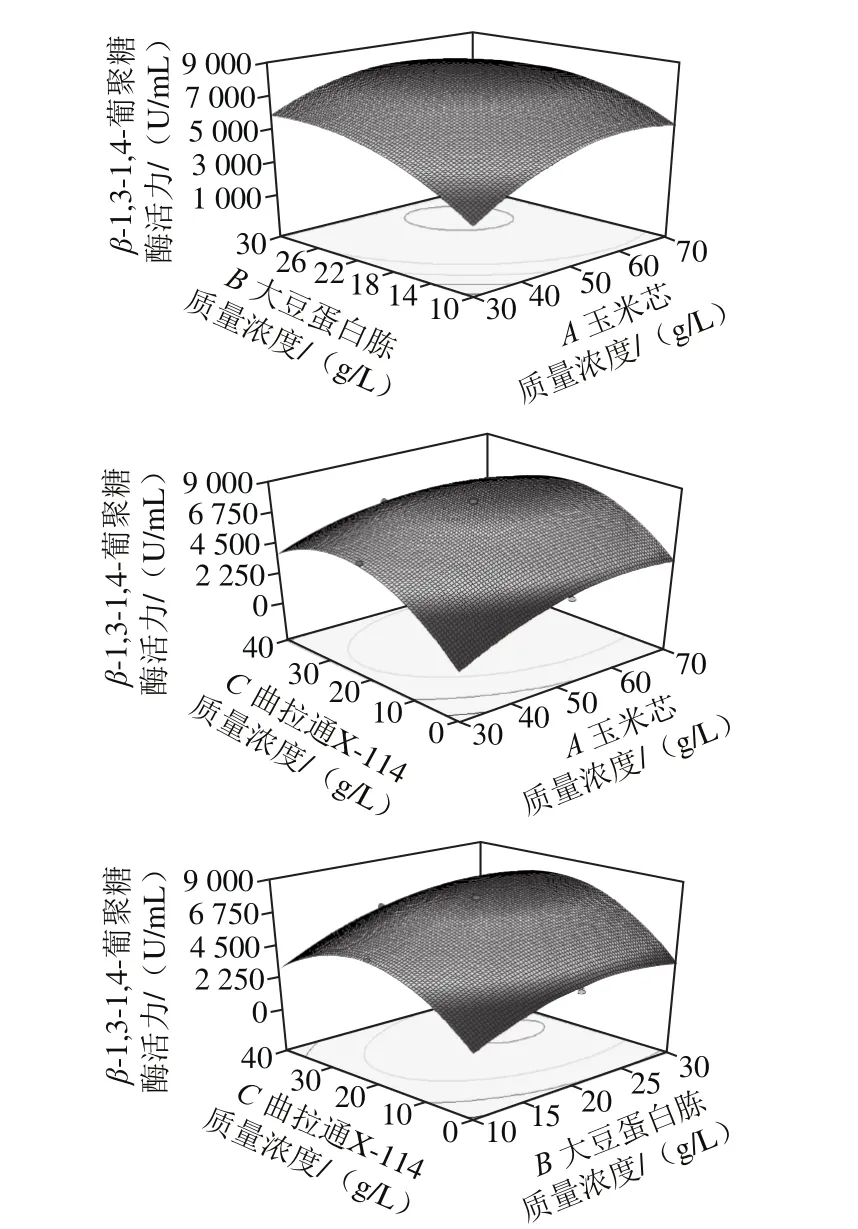
图7 各因素交互作用响应面图Fig. 7 Response surface plot showing the effect of interactions among three factors on β-1,3-1,4-glucanase activity
图7 分别反映了玉米芯质量浓度、大豆蛋白胨质量浓度、曲拉通X-114质量浓度这3 个因素的两两交互作用对响应值的影响。利用Design-Expert 8.0软件分析计算得到最适实验参数为玉米芯55.43 g/L、大豆蛋白胨24.7 g/L、曲拉通X-114 23.07 g/L,相应的酶活力为8 231 U/mL。经修正选择玉米芯55 g/L、大豆蛋白胨25 g/L和曲拉通X-114 23 g/L进行产酶验证,最后测定实际酶活力为8 447 U/mL,与预测值相近,为优化前的17.6 倍。
通过单因素及响应面试验优化液体发酵条件后β-1,3-1,4-葡聚糖酶活力达到8 447 U/mL。这一酶活力水平远远高于其他已报道野生型微生物产β-1,3-1,4-葡聚糖酶,如米黑根毛霉(6 230 U/mL)[13]、特基拉芽孢杆菌(2 978 U/mL)[9]、解淀粉芽孢杆菌(1 516 U/mL)[7]、地衣芽孢杆菌(562 U/mL)[6]、嗜热拟青霉(136 U/mL)[12]以及樟绒枝霉(100 U/mL)[15]等,为目前已报道野生型微生物液体发酵产β-1,3-1,4-葡聚糖酶的最高水平。此外,该菌株能够利用农业废弃物(玉米芯)为碳源高效发酵产β-1,3-1,4-葡聚糖酶,降低了发酵产酶的生产成本。另外,作为野生菌株该菌的发酵粗酶液中蛋白质组分相对简单,主要以β-1,3-1,4-葡聚糖酶为主,这一特征非常有利于后续酶的精制纯化。较高的产酶水平、廉价的发酵碳源和简单的粗酶液蛋白组成使泡盛曲霉β-1,3-1,4-葡聚糖酶具有潜在的工业化生产和应用价值。
3 结 论
从土壤样品中筛选得到一株高产β-1,3-1,4-葡聚糖酶的丝状真菌-泡盛曲霉(A. awamori)CAU33。采用单因素及响应面试验优化得到了菌株液体发酵产酶的最适条件,即发酵碳源玉米芯质量浓度55 g/L、氮源大豆蛋白胨质量浓度25 g/L、曲拉通X-114质量浓度23 g/L、初始pH 4.5、培养温度35 ℃、培养时间6 d。在优化后的最适条件下β-1,3-1,4-葡聚糖酶活力达到8 447 U/mL,为优化之前的17.6 倍,为迄今已报道野生型微生物β-1,3-1,4-葡聚糖酶的最高水平。
[1] WOODWARD J R, FINCHER G B, STONE B A. Water-soluble (1→3),(1→4)-β-D-glucans from barley (Hordeum vulgare) endosperm.Ⅱ.fine structure[J]. Carbohydrate Polymers, 1983, 3(3): 207-225. DOI:10.1016/0144-8617(83)90019-X.
[2] PLANAS A. Bacterial 1,3-1,4-β-glucanases: structure, function and protein engineering[J]. Biochimica et Biophysica Acta-Protein Structure and Molecular Enzymology, 2000, 1543(2): 361-382. DOI:10.1016/S0167-4838(00)00231-4.
[3] 毕静. β-葡聚糖酶在啤酒生产中的应用研究[J]. 中国酿造, 2011, 30(9): 105-106. DOI:10.3969/j.issn.0254-5071.2011.09.028.
[4] FERNANDES V O, COSTA M, RIBEIRO T, et al. 1,3-1,4-β-Glucanases and not 1,4-β-glucanases improve the nutritive value of barley-based diets for broilers[J]. Animal Feed Science and Technology, 2016, 211: 153-163. DOI:10.1016/j.anifeedsci.2015.11.007.
[5] 刘德海, 王红云, 刘金娥. 饲用β-葡聚糖酶的研究及应用进展[J]. 饲料工业, 2011(增刊1): 37-39. DOI:10.3969/j.issn.1001-991X.2011. z1.009.
[6] GAO Z. Purification and characterization of a novel lichenase from Bacillus licheniformis GZ-2[J]. Biotechnology and Applied Biochemistry, 2016, 63(2): 249-256. DOI:10.1002/bab.1206.
[7] 陈玉娟, 沈微, 陈献忠, 等. 解淀粉芽孢杆菌β-1,3-1,4-葡聚糖酶的高效表达[J]. 生物技术, 2011, 21(2): 22-26. DOI:10.3969/j.issn.1004-311X.2011.02.039.
[8] 文凤云, 廖富蘋, 林健荣, 等. 多黏类芽孢杆菌CP7 β-1,3-1,4-葡聚糖酶基因的克隆、表达及应用[J]. 中国农业科学, 2010, 43(22): 4614-4623. DOI:10.3864/j.issn.0578-1752.2010.22.008.
[9] 刘晓玲, 王金晶, 李永仙, 等. 特基拉芽孢杆菌来源β-1,3-1,4-葡聚糖酶重组菌发酵培养基的优化[J]. 食品与发酵工业, 2013, 39(2): 80-85. DOI:10.13995/j.cnki.11-1802/ts.2013.02.018.
[10] ELGHARBI F, HMIDA-SAYARI A, SAHNOUN M, et al. Purification and biochemical characterization of a novel thermostable lichenase from Aspergillus niger US368[J]. Carbohydrate Polymers, 2013, 98(1): 967-975. DOI:10.1016/j.carbpol.2013.07.009.
[11] 吴鹏, 王知龙, 吴秀. 黑曲霉HS-5高产β-葡聚糖酶发酵条件的优化[J]. 中国酿造, 2015, 34(3): 54-57. DOI:10.11882/ j.issn.0254-5071.2015.03.012.
[12] YANG Shaoqing, YAN Qiaojuan, JIANG Zhengqiang, et al. Biochemical characterization of a novel thermostable β-1,3-1,4-glucanase (lichenase) from Paecilomyces thermophila[J]. Journal of Agricultural and Food Chemistry, 2008, 56(13): 5345-5351. DOI:10.1021/jf800303b.
[13] TANG Yanbin, YANG Shaoqing, YAN Qiaojuan, et al. Purification and characterization of a novel β-1,3-1,4-glucanase (lichenase) from thermophilic Rhizomucor miehei with high specific activity and its gene sequence[J]. Journal of Agricultural and Food Chemistry, 2012, 60(9): 2354-2361. DOI:10.1021/jf2049799.
[14] YANG Shaoqing, XIONG Hao, YANG Hongye, et al. High-level production of β-1,3-1,4-glucanase by Rhizomucor miehei under solid-state fermentation and its potential application in the brewing industry[J]. Journal of Applied Microbiology, 2014, 118: 84-91. DOI:10.1111/jam.12694.
[15] YANG Shaoqing, XIONG Hao, YAN Qiaojuan, et al. Purification and characterization of a novel alkaline β-1,3-1,4-glucanase (lichenase) from thermophilic fungus Malbranchea cinnamomea[J]. Journal of Industrial Microbiology and Biotechnology, 2014, 41(10): 1487-1495. DOI:10.1007/s10295-014-1494-4.
[16] 孙玉英, 王瑞明, 刘庆军, 等. 局限曲霉产β-葡聚糖酶发酵培养基和发酵条件的优化[J]. 饲料工业, 2004, 25(1): 28-32. DOI:10.3969/ j.issn.1001-991X.2004.01.009.
[17] SARITHA M, SURENDER S, RAMESHWAR T, et al. Do cultural conditions induce differential protein expression: profiling of extracellular pteome of Aspergillus terreus CM20[J]. Microbiological Research, 2016, 192: 73-83. DOI:10.1016/j.micres.2016.06.006.
[18] 王金玲, 何国庆, 吕长山. 响应面法优化康氏木霉产β-葡聚糖酶的液体发酵条件[J]. 食品工业科技, 2010, 31(9): 204-207.
[19] 丁叶梅, 贠建民, 魏龙, 等. 碎囊毛霉产β-1,3-1,4-葡聚糖酶的分离纯化及其酶学性质[J]. 食品科学, 2014, 35(11): 143-148. DOI:10.7506/ spkx1002-6630-201411029.
[20] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275.
[21] WANG L, ZHUANG W. Designing primer sets for amplication of partial calmodulin genes from Penicilia[J]. Mycosystema, 2004, 23(4): 466-473. DOI:10.3969/j.issn.1672-6472.2004.04.004.
[22] WANG J, GUO M Z, XING L L. FASTJOIN, an improved neighborjoining algorithm[J]. Genetics & Molecular Research, 2012, 11(3): 1909-1922. DOI:10.4238/2012.July.19.10.
[23] FELSENSTEIN J. Confidence limits on phylogenies: an approach using the bootstrap[J]. Evolution, 1985, 39(4): 783-791. DOI:10.2307/2408678.
[24] 齐祖同, 孔华忠. 中国真菌志: 曲霉属及其相关有性型[M]. 北京: 科学出版社, 1997: 4-10.
[25] 常敏, 王娟, 田峰, 等. 红海榄根际土壤来源的泡盛曲霉(Aspergillus awamori)F12及其代谢产物的抗菌活性分析[J]. 微生物学报, 2010, 50(10): 1385-1391.
[26] NGUYEN V T, QUYEN D T. Optimizing culture conditions for the production of endo-β-1,4-glucanase by Aspergillus awamori strain vietnam type culture collection (VTCC)-F099[J]. African Journal of Biotechnology, 2010, 9(38): 6337-6344. DOI:10.5897/AJB09.1744.
[27] BOTELLA C, DE ORY I, WEBB C, et al. Hydrolytic enzyme production by Aspergillus awamori on grape pomace[J]. Biochemical Engineering Journal, 2005, 26(2/3): 100-106. DOI:10.1016/ j.bej.2005.04.020.
[28] 杜小燕, 吴晖, 赵超敏, 等. 泡盛曲霉发酵麦麸过程中酚类物质含量的变化与三种酶活性的相关性[J]. 现代食品科技, 2015, 31(4): 69-76. DOI:10.13982/j.mfst.1673-9078.2015.4.012.
[29] 鲍文琪, 朱启忠, 鲍温洁, 等. 泡盛曲霉产菊粉酶发酵条件的探究[J]. 中国酿造, 2013, 32(11): 39-42. DOI:10.3969/ j.issn.0254-5071.2013.11.009.
[30] HAYASHIDA S, NAKAHARA K, KANLAYAKRIT W, et al. Characteristics and function of raw-starch-affinity site on Aspergillus awamori var. kawachi glucoamylase Ⅰ molecule[J]. Agricultural & Biological Chemistry, 2014, 53(1): 143-149. DOI:10.1080/00021369.1 989.10869246.
Optimization of Liquid-State Fermentation Conditions for β-1,3-1,4-Glucanase (Lichenase) Production by Aspergillus awamori
LIU Erwei1, YANG Shaoqing2, YAN Qiaojuan3, JIANG Zhengqiang2,*
(1. College of Food Science and Bioengineering, Henan University of Science and Technology, Luoyang 471000, China; 2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 3. College of Engineering, China Agricultural University, Beijing 100083, China)
The liquid-state fermentation conditions for β-1,3-1,4-glucanase production by Aspergillus awamori CAU33, a fungal strain isolated from soil sample, were optimized using a combination of one-factor-at-a-time method and response surface methodology. The highest β-1,3-1,4-glucanase activity of 8 447 U/mL was achieved after 6 days of culture at 35 ℃in a medium consisting of corncob 55 g/L, soybean peptone 25 g/L, and Triton X-114 23 g/L at an initial pH of 4.5, about 17.6 times higher than before the optimization.
β-1,3-1,4-glucanase; liquid-state fermentation; optimization; Aspergillus awamori
10.7506/spkx1002-6630-201716005
TS201.3
A
1002-6630(2017)16-0029-07
刘二伟, 杨绍青, 闫巧娟, 等. 泡盛曲霉液体发酵产β-1,3-1,4-葡聚糖酶的条件优化[J]. 食品科学, 2017, 38(16): 29-35. DOI:10.7506/spkx1002-6630-201716005. http://www.spkx.net.cn
LIU Erwei, YANG Shaoqing, YAN Qiaojuan, et al. Optimization of liquid-state fermentation conditions for β-1,3-1,4-glucanase (lichenase) production by Aspergillus awamori[J]. Food Science, 2017, 38(16): 29-35. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716005. http://www.spkx.net.cn
2016-11-02
国家自然科学基金面上项目(31471688)
刘二伟(1991—),男,硕士研究生,研究方向为食品生物技术。E-mail:liuerwei3062@126.com
*通信作者:江正强(1971—),男,教授,博士,研究方向为食品生物技术。E-mail:zhqjiang@cau.edu.cn
