不同氮水平下玉米苗期根系形态和氮吸收量的QTL定位
2017-09-03王祎汤继华付延磊许恒谭金芳韩燕来
王祎,汤继华,付延磊,许恒,谭金芳,2,韩燕来*
(1河南农业大学资源与环境学院,河南郑州450002;2河南省粮食作物协同创新中心,河南郑州450002;3省部共建小麦玉米国家重点实验室,河南郑州450002)
不同氮水平下玉米苗期根系形态和氮吸收量的QTL定位
王祎1,2,3,汤继华3,付延磊1,许恒3,谭金芳1,2,韩燕来1,2,3*
(1河南农业大学资源与环境学院,河南郑州450002;2河南省粮食作物协同创新中心,河南郑州450002;3省部共建小麦玉米国家重点实验室,河南郑州450002)
【目的】玉米的根系形态与氮素吸收能力关系密切,利用单片段代换群体对玉米苗期根系形态相关性状和植株氮吸收量进行QTL定位,可为进一步精细定位并克隆控制玉米低氮下优异根系形态和氮吸收的主效QTL奠定基础。【方法】以氮效率差异显著的两亲本许178和综3构建的150个玉米单片段代换系(SSSL)群体作为研究材料,进行水培试验。以Ca(NO3)2作为氮源,设置高氮(4mmol/L NO3–)和低氮(0.05mmol/L NO3
–)两个处理,培养20d后分根、冠收获植株,测定生物量和氮含量。通过WinRHIZO根系分析系统获得根系的总根长、根表面积、根体积、根直径和根尖数等指标。根据代换系与亲本许178表型值的T-test结果,利用该群体SSR遗传连锁图谱,在P≤0.001条件下定位所调查性状的QTL。【结果】高氮条件下SSSL群体除了根直径与总根长和根尖数没有显著相关性以外,其它各性状之间均显著或极显著正相关,并且植株氮吸收量也与根系各性状呈显著或极显著正相关;低氮条件下,除了根直径以外,植株氮吸收量与其他根系性状均呈极显著正相关,并且地上部和根部氮累积量均与根表面积的相关性最大。在高氮条件下共检测到102个QTL位点,包括40个根形态相关QTL、34个植株生物量QTL和28个氮吸收量QTL;在低氮条件下共检测到85个QTL位点,包括47个根形态QTL、22个植株生物量QTL和16个氮吸收量QTL。所检测到的根形态相关QTL与生物量和氮积累量QTL成簇存在,同一QTL区间多同时检测到根形态QTL和氮吸收量QTL。高氮条件下,在代换系1428、1376、1282、1266和1473的代换区间上检测到高氮特异的QTL簇,同时包括多个根形态和氮吸收量QTL,贡献率从–43%到84%。低氮下,在代换系1419和1314的代换区间上同时检测到低氮特异的多个根形态和氮吸收量QTL,贡献率从–32%到55%。【结论】单片段代换系1419和1314所包含的代换片段bnlg182—bnlg2295和umc1013—umc2047检测到多个低氮特异的QTL,并且这两个区间在前人的研究中均有玉米氮效率相关QTL检测到,说明该区间包含有玉米根系形态和氮吸收量的主效QTL,在玉米氮高效吸收中可能起重要作用。
玉米;单片段代换系;根系形态;QTL;低氮胁迫
玉米是全球最重要的多用途作物之一,广泛应用于粮食、饲料、化工、生物能源等行业。为保证国家粮食安全,我国在《国家粮食安全中长期规划纲要》中明确提出到2020年需要新增粮食1000亿斤,其中需要新增玉米650亿斤,占全国新增粮食的65%,因此玉米在我国未来粮食生产中的地位举足轻重。我国玉米高产育种已取得了重大成就,超高产记录不断突破。不容忽视的是,目前的玉米高产记录都是高肥高水条件下获得,同样为提高玉米产量,我国农田的氮肥投入量大、氮肥利用率低,不但严重制约我国玉米产量和农业经济效益的进一步提高,而且成为导致河流和湖泊富营养化的重要因素之一[1]。因此,提高玉米的氮素利用率、培育氮高效品种,从而在适当降低施氮量的条件下维持较高产量水平,对实现农业可持续发展和环境保护意义重大[2]。
研究表明,在玉米籽粒形成中54.5%~60.6%的氮来自营养体的再运转[3]。因此,植株前期氮吸收效率对于后期提高玉米籽粒产量至关重要。植物主要通过根系从外界吸收矿质营养,有效的根系形态对培育氮吸收高效的玉米基因型、减少氮淋失非常重要[4]。许多研究表明,增加根系体积,包括根干重、根长和根密度,可以提高玉米氮吸收能力和籽粒产量[5–6]。玉米的根系形态受土壤有效氮含量的强烈影响,植株通过改变根系形态更有效地从土壤中获取氮素营养。在低氮条件下,玉米的节根数目减少、总根长增加,而在氮充足的土壤侧根易发生和伸长[7–8]。因此,可以利用玉米根系形态对土壤氮水平响应的可塑性来提高玉米的氮吸收效率。目前数量性状位点(QTL)作图已成为研究复杂性状遗传位点甚至确定候选基因的有力工具。许多与玉米氮效率相关性状的QTL已经被定位,包括氮吸收效率、氮利用效率[9]、花后氮吸收、氮再利用[1],以及氮同化、代谢等性状[9]。同样,诸多控制玉米根系形态的QTL也在不同的群体中被定位和分析[10–14]。但是,这些研究多数都是对正常生长条件下玉米根系形态相关性状进行QTL定位,对低氮胁迫下玉米根系形态相关性状的QTL定位相对缺乏。
刘宗华等[15]前期研究结果表明,在大田不施氮肥条件下,综3的产量降低了54%,而许178的产量仅降低了1.2%,表明许178对低氮胁迫不敏感,而综3对低氮胁迫表现敏感。本研究以综3为供体亲本,许178为轮回亲本构建的染色体单片段代换系(single segment substitution lines,SSSLs)[16]作为研究材料,通过营养液培养对群体在高氮和低氮条件下根系形态相关性状,以及氮吸收量的QTL进行了定位。研究分析了低氮胁迫下玉米苗期根形态与氮吸收效率之间的遗传机制,为通过分子标记辅助选择培育低氮下具有优异根系形态的玉米基因型提供参考。
1 材料与分析
1.1 供试材料
以综3为供体亲本、许178为受体亲本,经过4个世代回交和3个世代自交,结合SSR分子标记辅助选择,共获得了239份纯合的单片段代换系材料,SSSL平均代换片段长度为47.67cM,导入片段总长11394.22cM,覆盖玉米基因组67.6%[15]。利用其中的150个单片段代换系进行玉米苗期不同氮水平下根系形态QTL检测,同时结合各株系表型值及片段所在位置,对相应根系形态QTL进行初步定位。
1.2 幼苗培养
取150个单片段代换系及亲本各30粒饱满完整的种子,以10%H2O2浸泡消毒30min,蒸馏水冲洗3~4次,置于湿润的纱布上催芽,然后移入干净的石英砂中育苗,光照培养室日间温度为25℃,夜间温度为20℃。用蒸馏水培养至两叶,挑取发育健壮、长势一致的幼苗共12株,分别移入低氮和高氮营养液中培养,每个氮水平6株。幼苗定植于穿孔直径为2cm、厚0.5cm的塑料板上,用海绵固定幼苗,培养容器采用黑色方形塑料盒(38cm×28cm× 12cm),每盆培养幼苗12株,内盛营养液10L,3天更换一次营养液。营养液配方参考文献[17],具体如下:Ca(NO3)2·4H2O2mmol/L;K2SO40.75mmol/L;MgSO4·7H2O0.65mmol/L;KCl:0.1mmol/L;KH2PO40.25mmol/L;H3BO30.001mmol/L;MnSO4·H2O 0.001mmol/L;CuSO4·5H2O0.0001mmol/L;ZnSO4·7H2O0.001mmol/L;(NH4)6MoO24·4H2O5× 10–6mmol/L;FeSO4·7H2O0.1mmol/L;Na2EDTA 0.1mmol/L;CaCl22mmol/L(低氮处理时加入,用以补平Ca离子浓度)。其中低氮处理氮浓度为0.05 mmol/L,高氮水平含氮4mmol/L,共培养20天。
1.3 根系性状的测定
培养20天后,每个重复取生长一致的4株幼苗,蒸馏水冲洗干净,用剪刀剪下根系,WinRHIZO根系分析系统分别测定单株玉米的总根长(TRL,cm)、根尖数(RTN)、根体积(RV,cm3)、根表面积(RSA, cm2)、根直径(RAD,mm)。将新鲜根和茎叶分别置于105℃烘箱杀青30min,然后80℃烘干,测定地上部干重(SDW)、根干重(RDW)。
1.4 氮含量的测定
植株烘干粉碎后,采用H2SO4–H2O2进行消化,通过流动注射仪测定氮含量。植株氮累积量计算:
地上部氮累积量(SNU,mg)=地上部干重(g)×地上部氮含量(mg/g);
根氮累积量(RNU,mg)=根部干重(g)×根部氮含量(mg/g)。
1.5 QTL 定位
利用SPSS19.0软件对各染色体片段代换系和双亲本根系相关数据进行统计分析。将轮回亲本的观察值作为对照,通过方差分析和T检验比较各SSSL与许178之间的差异,以P≤0.001时,认为该代换片段上有相关QTL存在;当P>0.001时,认为在该代换片段上没有相关QTL的存在[18]。参照Eshed和Zamir的方法[19]估算各QTL的加性效应值和加性效应贡献率,加性效应值=(SSSL表型值–许178表型值)/2,加性效应贡献率=加性效应值/许178表型值×100%。
QTL命名遵循Mc Couch等[20]制定的原则,QTL名称中前面的字母为鉴定性状的英文词首的缩写,第1个数字为QTL所在染色体的编号,第2个数字为该性状在该染色体上的QTL序号。
1.6 QTL 代换作图
参照Paterson等[20]的方法,如果在含有重叠代换片段的不同染色体片段代换系中同时检测到同一性状的QTL,且遗传效应方向一致,则认为该QTL存在于代换片段的重叠区段上;如果在一个染色体片段代换系中检测到QTL的存在,而在代换片段具有重叠关系的另一个染色体片段代换系中未检测到,则认为该QTL位于这2个代换系代换片段的非重叠区段上。
1.7 数据处理
采用Microsoft Excel2010和SPSS19.0软件对数据进行整理和统计分析。

图1 高氮 (HN) 和低氮 (LN) 水平下许 178 和综 3的根系形态Fig. 1 Root morphology of Xu178 and Zong3 under high and low nitrogen conditions
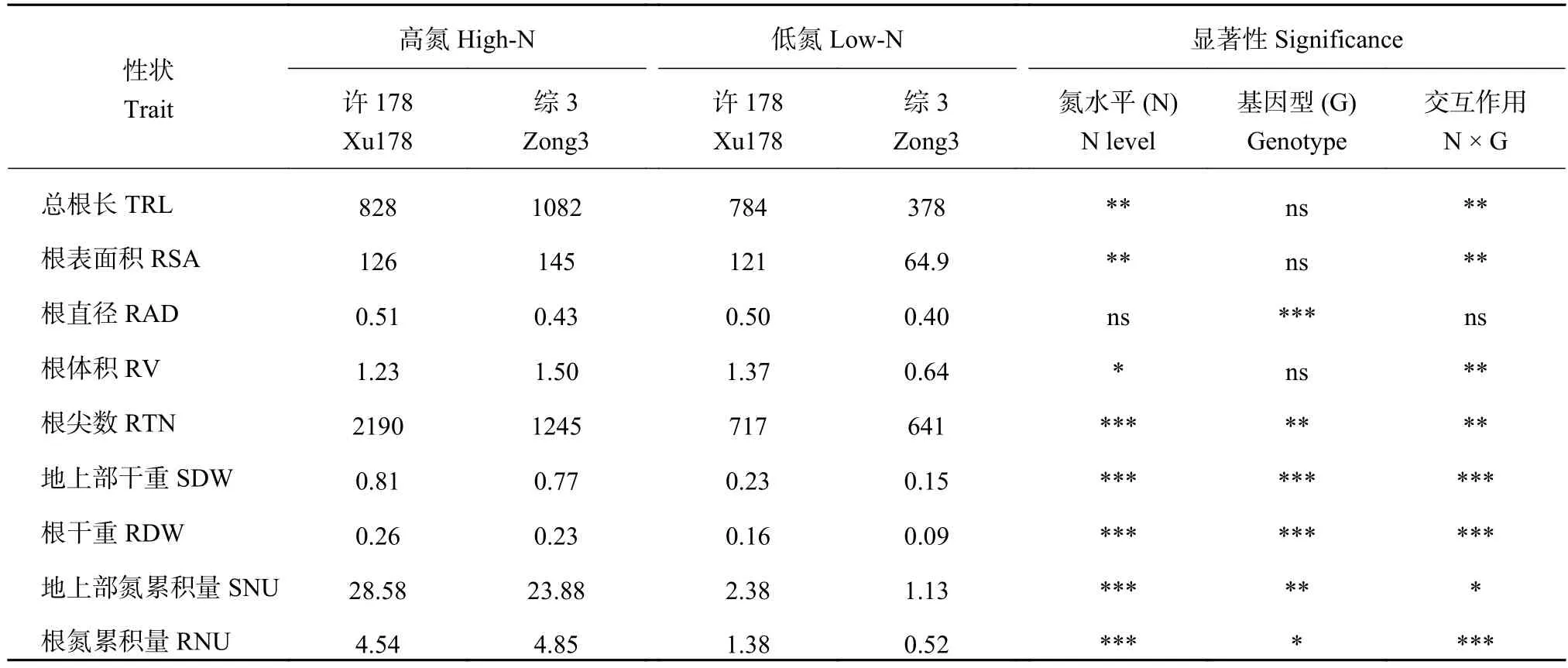
表1 不同氮水平下亲本各表型值和双因素显著性分析Table 1 Mean values and significance of two-factor ANOVA analysis for the nine traits in the parents
2 结果与分析
2.1 不同氮水平下亲本和 SSSL 群体各表型性状值分析
高氮条件下,亲本许178和综3的根系形态并没有显著差异,但是低氮胁迫显著增加了许178的根长,其根系远大于综3(图1),表明在低氮条件下许178具有明显的根系优势。
数据统计结果显示,高氮下两亲本除了根尖数有显著差异外,其他根系性状均无显著差异(表1)。低氮条件下,氮高效亲本许178的生物量显著高于综3,并且许178的根系性状(总根长、根表面积、根体积、根直径和根尖数)大于综3,最终导致许178植株总氮吸收量是综3的2.3倍。对亲本9个性状进行双因素主效应分析发现,除了根直径外,其他8个性状氮水平的主效应差异均达到显著或极显著差异,而两亲本的基因型差异在总根长、根表面积和根体积上没有达到显著水平,但是除了根直径外,氮水平和基因型的交互作用在两亲本间的差异均达到显著或极显著水平(表1)。
在两个氮水平下,SSSL群体的9个性状均表现连续变异,接近正态分布(表2)。这些性状的变异系数从5.6%~33.9%。根直径的变异系数较小,其他性状的变异系数均大于20%。在两个氮水平下,每个性状均观察到超亲现象。在SSSL群体中,基因型对9个性状的主效应作用均达到显著或极显著差异。除了根干重外,氮水平及其与基因型的交互作用对其他8个性状的作用均达到显著水平。这些结果表明,研究所选用的SSSL群体对氮胁迫敏感,并且群体基因型差异性显著,有利于我们利用该群体对根性状和氮吸收相关QTL进行定位和进一步深入分析。
2.2 不同氮水平下 SSSL 群体各表型性状的相关性分析
高氮条件下SSSL群体除了根直径与总根长和根尖数没有显著相关性以外,其它各性状之间均呈显著或极显著正相关,并且各根系性状与植株生物量均呈极显著正相关,植株氮吸收量也与根系各性状呈显著或极显著正相关(表3)。在低氮条件下,根直径与总根长、根表面积、地上部生物量之间均没有显著相关性,其他根系性状之间均显著相关。此外,低氮条件下,除了根直径,植株氮吸收量与其他根系性状均呈极显著正相关性。在两个氮水平下,均是根体积与根表面积的相关性最大(高氮条件r= 0.913,P<0.001;低氮条件r=0.927,P<0.001)。高氮条件下,地上部氮累积量与根表面积相关性最高,根系氮累积量则与根体积的相关性最高,而在低氮条件下,地上部和根系氮累积量均与根表面积的相关性最大。
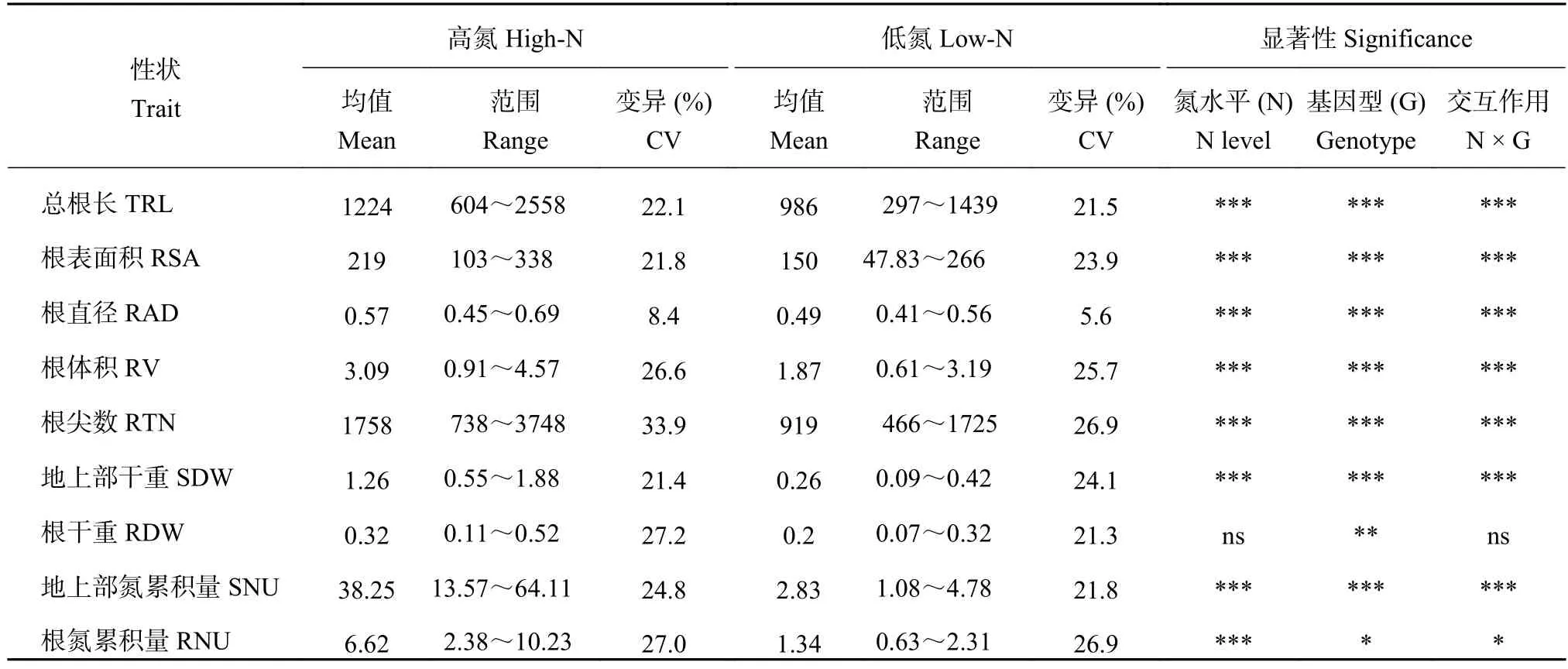
表2 不同氮水平下 SSSL 群体各表型值和双因素显著性分析Table 2 Mean values and significance of two-factor ANOVA analysis for the nine traits in the SSSL population
2.3 不同氮条件下玉米根系形态 QTL 分析
通过QTL代换作图,对SSSL群体检测到的根系形态QTL进行分析。高氮水平下,在P≤0.001条件下共检测到40个根系形态QTL,其中8个总根长QTL,7个根表面积QTL,4个根直径QTL,10个根体积QTL和11个根尖数QTL(表4)。总根长QTL主要分布在第1、3、5、7、9和10号染色体,第1染色体最多,其中qhnTRL1b表现为负向加性效应,其余均表现为正向加性效应。代换系1306包含的qhnTRL1c加性效应贡献率最大(59.8%)。检测到根表面积QTL与总根长类似,仅有一个QTL表现负向加性效应,其余均为正向,加性效应贡献率为–23.5%~83.7%。检测到的根直径QTL的数量最少,均为正向加性效应,贡献率从14.1%~17.4%。检测到的根体积的QTL均为正向加性效应,且加性效应贡献率很高,介于79.4%~125.1%,这表明在高氮水平下综3片段的导入可能有利于代换系获得更大的根系体积。与其他根系性状不同,检测到的10个根尖QTL中有9个表现负向加性效应,贡献率为–23.2%~–36.5%,只有qhnRTN7a为正向加性效应。
低氮水平下,通过QTL代换作图,在P≤0.001条件下共检测到47个根系形态QTL,其中10个总根长QTL,5个根表面积QTL,5个根直径QTL,12个根体积QTL和15个根尖数QTL(表5)。其中检测到的总根长和根表面积QTL与高氮条件类似,
多为正向加性效应,各有一个QTL为负向加性效应。与高氮条件不同,低氮下检测到的根直径QTL均为负向加性效应,加性效应贡献率为–5.0%~–8.9%。低氮下检测到的根尖数QTL多为正向加性效应,仅qlnRTN4b表现为负向加性效应,并且加性效应的贡献率低于高氮条件,这可能与低氮胁迫下植物根系的适应性反应有关。检测到的12个根体积QTL中有3个为负向加性效应,其中在第1染色体检测到5个QTL。

表3 群体各表型性状在高氮水平 (对角线上方) 和低氮水平 (对角线下方) 的 Pearson 相关系数Table 3 Pearson’s correlation coefficients between the traits under high N (above diagonal) and low N conditions (below diagonal) in the SSSL population
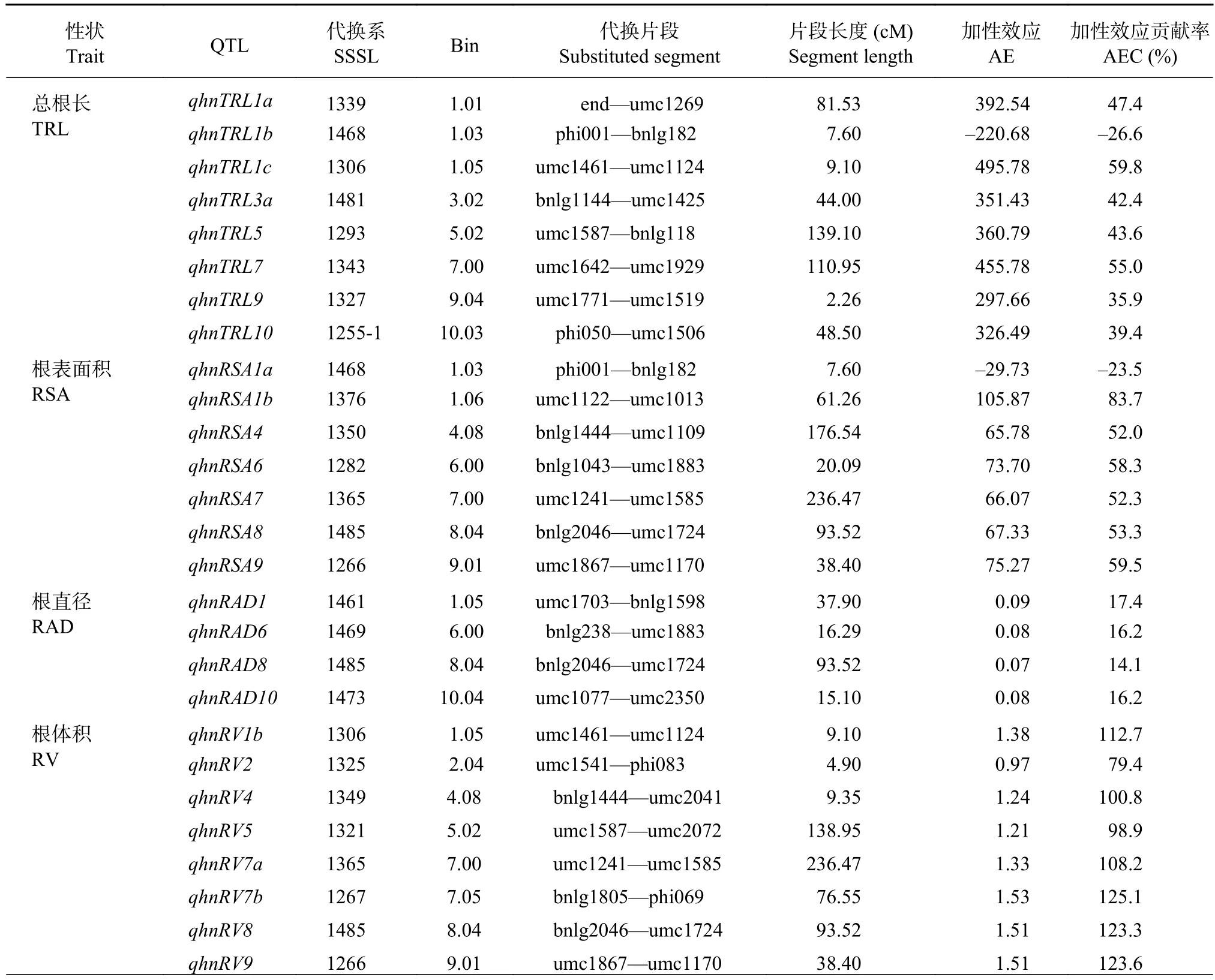
表4 高氮下玉米 SSSL 群体的根系形态 QTL 及其效应值Table 4 QTL location of the maize root morphology in the SSSL population under the high nitrogen condition

续表4Table4continued
2.4 不同氮条件下生物量 QTL 分析
高氮条件下,通过QTL代换作图在P≤0.001时,SSSL群体共检测到20个地上部干重QTL和14个根干重QTL(表6)。20个地上部干重QTL分布在除第8染色体的其余9条染色体上。其中qhnSDW1b表现为负向加性效应,其余QTL均表现为正向加性效应,单个QTL的加性效应贡献率为–40.1%~88.3%。14个根干重QTL分布在除第2、8染色体外的其他8条染色体上,其中有4个表现负向加性效应,其他10个QTL为正向加性效应。单个QTL的加性效应贡献率为–10.2%~42.8%。
低氮条件下,通过QTL代换作图,在P≤0.001条件下共检测到22个生物量QTL,地上部干重QTL和根干重QTL均为11个(表7)。其中地上部干重QTL有6个分布在第1染色体,其余分布在第3、4、5、7和10号染色体上,加性效应贡献率为–24.5%~59.9%,qlnSDW5的加性效应贡献率最高。与地上部干重QTL分布情况类似,检测到的根干重QTL也有5个分布于第1染色体,其余分布在第2、3、4、5和7号染色体上,单个QTL的加性效应贡献率为–19.2%~48.4%。
2.5 不同氮条件下植株氮累积量 QTL 分析
高氮条件下,通过QTL代换作图,在P≤0.001条件下共检测到13个地上部氮累积量QTL和15个根部氮累积量QTL(表8)。这些QTL中只有qhnSNU1b和qhnRNU1a表现为负向加性效应。除第3和第8染色体外,其余染色体均检测到地上部氮累积量QTL,单个QTL的加性效应贡献率为–42.7%~60.9%。根部氮累积量的QTL则在10条染色体上均有分布,其中第1和9染色体分别检测到3个QTL,这些QTL的加性效应贡献率为–35.5%~71.7%。
低氮条件下,共检测到6个地上部氮累积量QTL和10个根部氮累积量QTL(P≤0.001)(表9)。6个地上部氮累积量QTL均为正向加性效应,并且3个位于第1染色体上,单个QTL的贡献率为33.2%~55.2%。检测到的10个根部氮累积量QTL中有6个表现负向加性效应,4个为正向加性效应,单个QTL的贡献率为–27.3%~33.8%。
2.6 QTL 在染色体上的分布
两个氮水平下检测到的QTL在染色体上的分布如图2所示。结果显示,所检测到的根系性状和氮吸收相关QTL在玉米的10条染色体上均有分布,其中第1染色体上的QTL数目最多,第2和第8染
色体上的QTL数目最少。对低氮和高氮下分别检测到的QTL进行分析可以得到不同氮条件下的特异性QTL。有些染色体区间仅能在低氮水平下检测到QTL,例如第1染色体bnlg182—bnlg2295(代换系1419的代换区间)和umc1013—umc2047(代换系1314的代换区间)区间。包含这些染色体片段的代换系很有可能只控制低氮条件下的根系形态,有利于我们发掘低氮特异的QTL。同样,图2结果也显示在有些染色体区段仅检测到高氮条件下QTL,例如,第1染色体phi001—bnlg182(bin1.03,代换系1428的代换区间),umc1122—umc2396(bin1.06,代换系1376的代换区间),第6染色体bnlg1043—umc1883(代换系1282的代换区间),第9染色体的umc2078—umc1636(代换系1238的代换区间),以及第10染色体的umc1077—umc2350(代换系1473的代换区间)。这些代换系在低氮条件下未检测到QTL,我们将其定义为高氮特异的QTL。这两类QTL为氮环境特异性QTL,说明在不同氮条件下玉
米有不同的代谢机制。其余的QTL区间均同时检测到高氮和低氮条件下的QTL。此外,从QTL在染色体上的分布可以看出,玉米氮吸收相关的QTL区间均能检测到根系形态相关的QTL,说明玉米根系形态与其氮吸收能力密切相关(图2)。
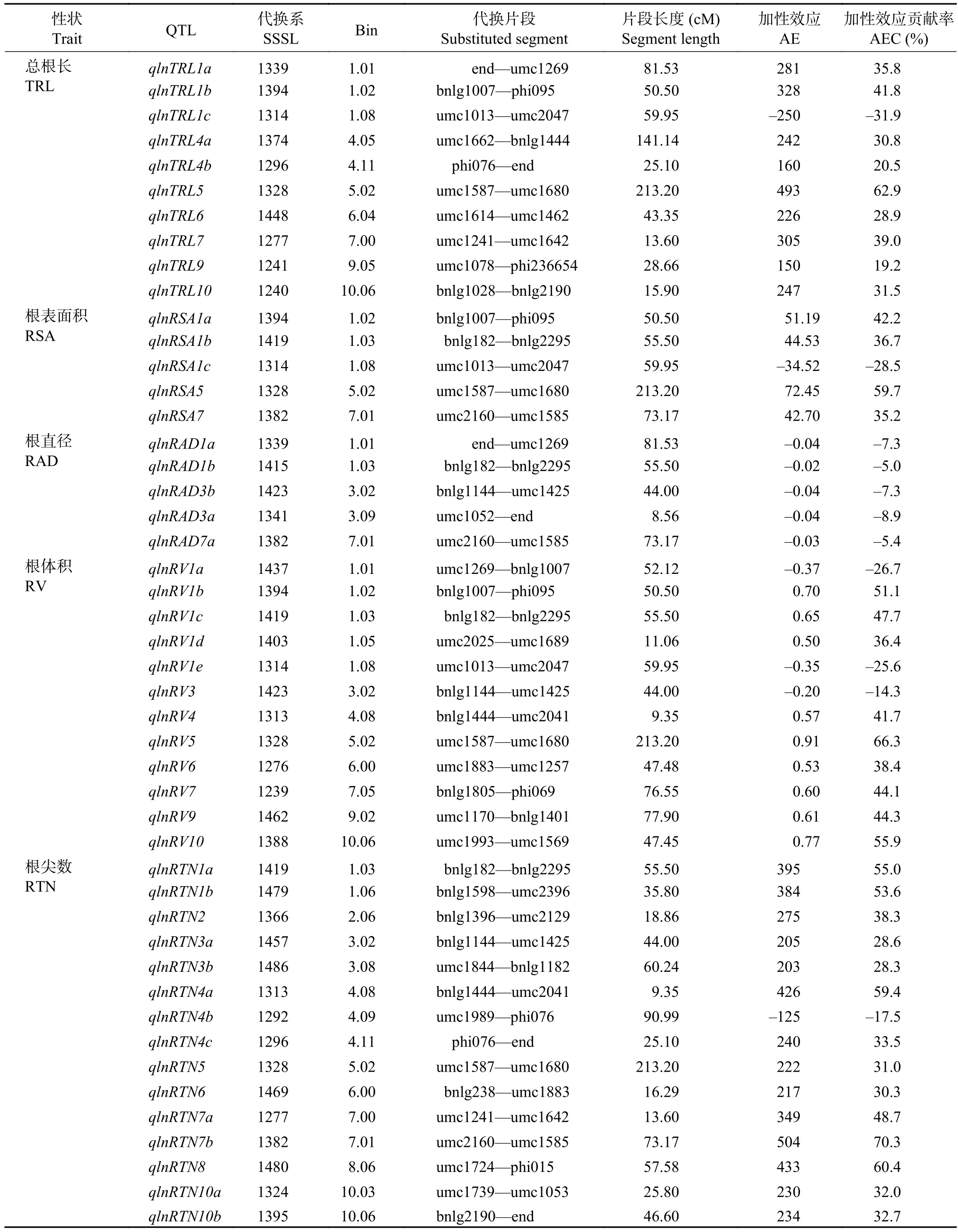
表5 低氮下玉米 SSSL 群体的根系形态 QTL 及其效应值Table 5 QTL location of the root morphology in the SSSL population under the low nitrogen condition

表6 高氮条件下玉米苗期生物量 QTL 及其效应Table 6 QTL location of plant biomass in the SSSL population under the high nitrogen condition
3 讨论
玉米已成为我国种植面积最大的农作物,但是目前其高产和超高产依赖大量的氮肥施用。如何提高玉米的氮肥利用率、减少肥料投入、保护环境已成为玉米高产高效的研究热点和亟待解决的问题。植物对土壤中氮素的获取很大程度上取决于其根系形态[22]。研究者通过对不同基因型玉米进行研究提出了玉米氮高效吸收的理想根系形态,即通过增加根体积,包括根干重、根长和根密度,提高玉米氮吸收能力和籽粒产量[8,23]。研究表明玉米的根系形态受到土壤中有效氮含量影响,在缺氮条件下玉米节根数目降低,但是总根长增加[7]。玉米通过这种根系形态的改变从土壤中获取更多的氮素,用于植株的生长发育。本研究结果也显示,在低氮条件下,代换系玉米幼苗茎叶的生物量与总根长、根表面积、根体积、根尖数呈极显著相关性,而与根直径之间的相关性未达到显著水平。并且,低氮下植株氮吸收量与总根长、根表面积、根体积和根尖数均呈极显著正相关(表3)。这些结果说明,通过对玉米根性状相关QTL的研究有利于深入认识玉米氮吸收的遗传机制。
氮吸收效率和根系形态都是复杂的性状,受基因型和环境的共同影响。目前我们对玉米氮高效和根系形态的遗传基础仍知之甚少,对于两者之间的关系认识不足,这也限制了基于根系形态来筛选氮高效材料或品种的效率。近来QTL作图已经成为确定复杂性状的遗传位点甚至候选基因的有效工具。很多氮高效相关的农艺性状已经被定位,包括生物量[25]、籽粒氮吸收量[26]、吐丝后氮吸收效率以及氮再利用效率等[5]。同时,很多调控根系形态的QTL也在不同的玉米连锁群中被定位[10–11,27–28]。例如,Burton等[27]利用三个玉米重组自交系对21个根系性状进行QTL定位,共定位到15个QTL,分布在8条染色体上(第6和10染色体上没有检测到QTL),表型变异为0.44%~13.5%。Burton等[27]对Zhu等[13]、Lebreton等[12]研究中所定位到的QTL进行元分析,发现在bin 1.03、1.04和7.03位置分别有控制初生胚根上侧根长度、节根数目和次生胚根数目的QTL。此外,Song等[11]利用营养液培养方法,对含有204个材料的重组自交系根系性状进行QTL定位,在bin1.06检测到平均侧根长度(SLL)和根冠比的QTL。本研究利用氮效率差异显著的两个玉米自交系构建的单片段代换系群体对玉米苗期的根系形态和氮吸收量进行了QTL定位分析。在高氮条件下,共检测到40个根系性状QTL,34个生物量QTL,以及28个氮吸收量QTL。对HN下的QTL进行分析发现,有些染色体区段仅特异检测到HN下的QTL,并且不同性状的QLT成簇排列(图2),这些区段检测到HN下QTL不少于5个,表明这些区段可能包含有高氮条件下控制玉米根系形态的主效QTL。本研究也在bin1.03(第1染色体phi001—bnlg182区间)和bin1.06(umc1122—umc2396区间)检测到正常氮条件下根形态QTL,与Burton等[27]和Song等[11]定位到的根形态相关QTL区间有重叠。这些结果表明在这两个QTL区间可能存在控制氮充足条件下玉米根系形态的主效QTL。目前就我国农业生产现状而言,氮肥的施用量短期内很难显著降低[29],因此,培育在正常或高肥力条件下高效吸收的品种也是提高氮效率的途径之一[30]。在高产栽培条件下,随着产量水平的提高,作物需氮量增加,施氮总量也会提高。但是,我国目前玉米农田生产中多数农民采用一次性基肥,不仅增加了硝酸盐淋失的可能性,而且过高的硝酸盐浓度也限制了根系的生长发育,进而降低氮肥的吸收效率。因此,米国华等[31]提出玉米氮高效吸收的理想根构型具有在高产氮肥投入条件下仍能维持正常的侧根生长、总根长密度高,提高整体剖面氮素有效性的特点。本研究中所定位到的高氮特异的QTL簇对研究玉米高氮条件下氮高效吸收的遗传机制和基因定位具有一定意义。
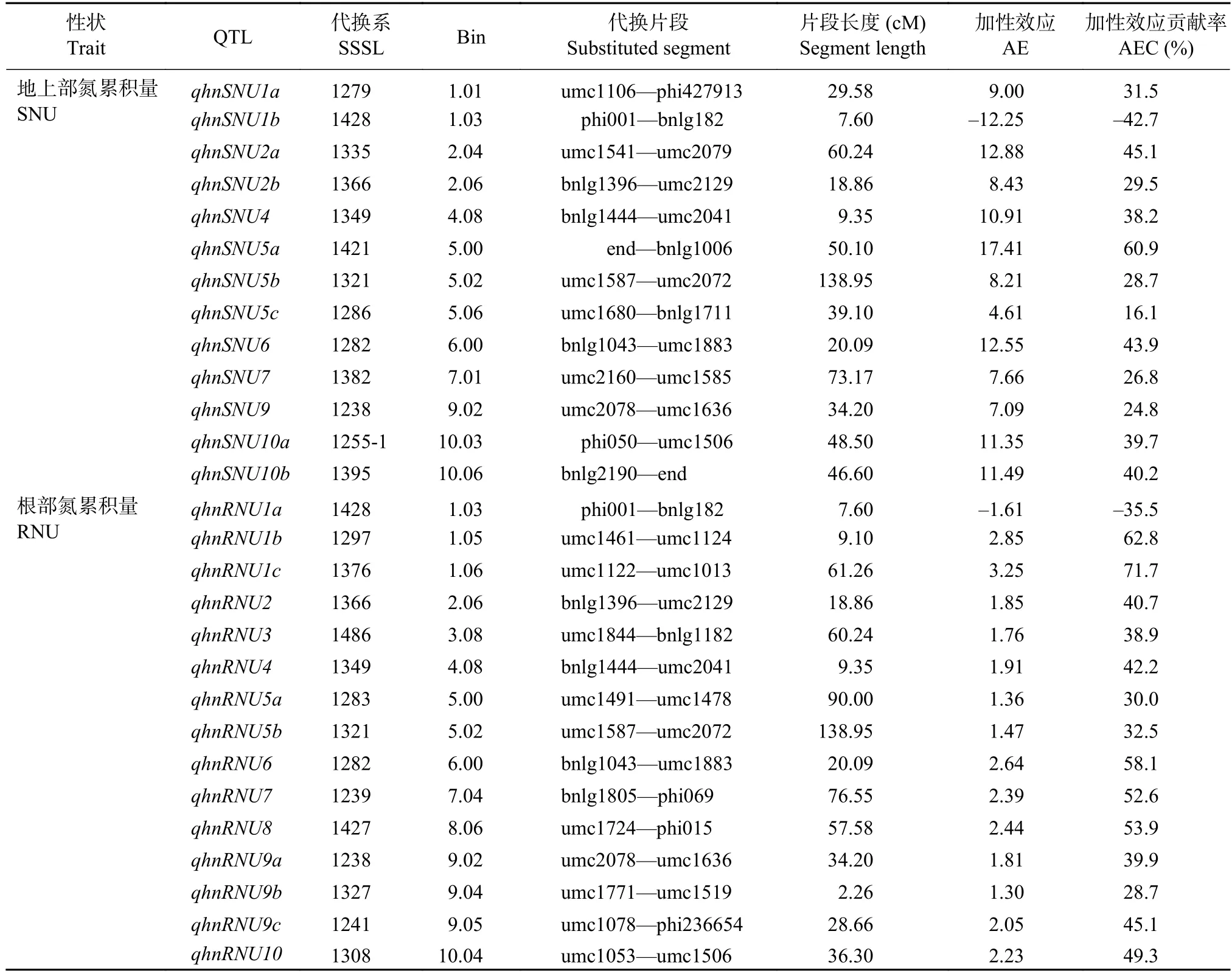
表8 高氮条件下苗期玉米植株氮累积量 QTL 分析Table 8 QTL location of the nitrogen accumulation in the SSSL population under the high nitrogen condition
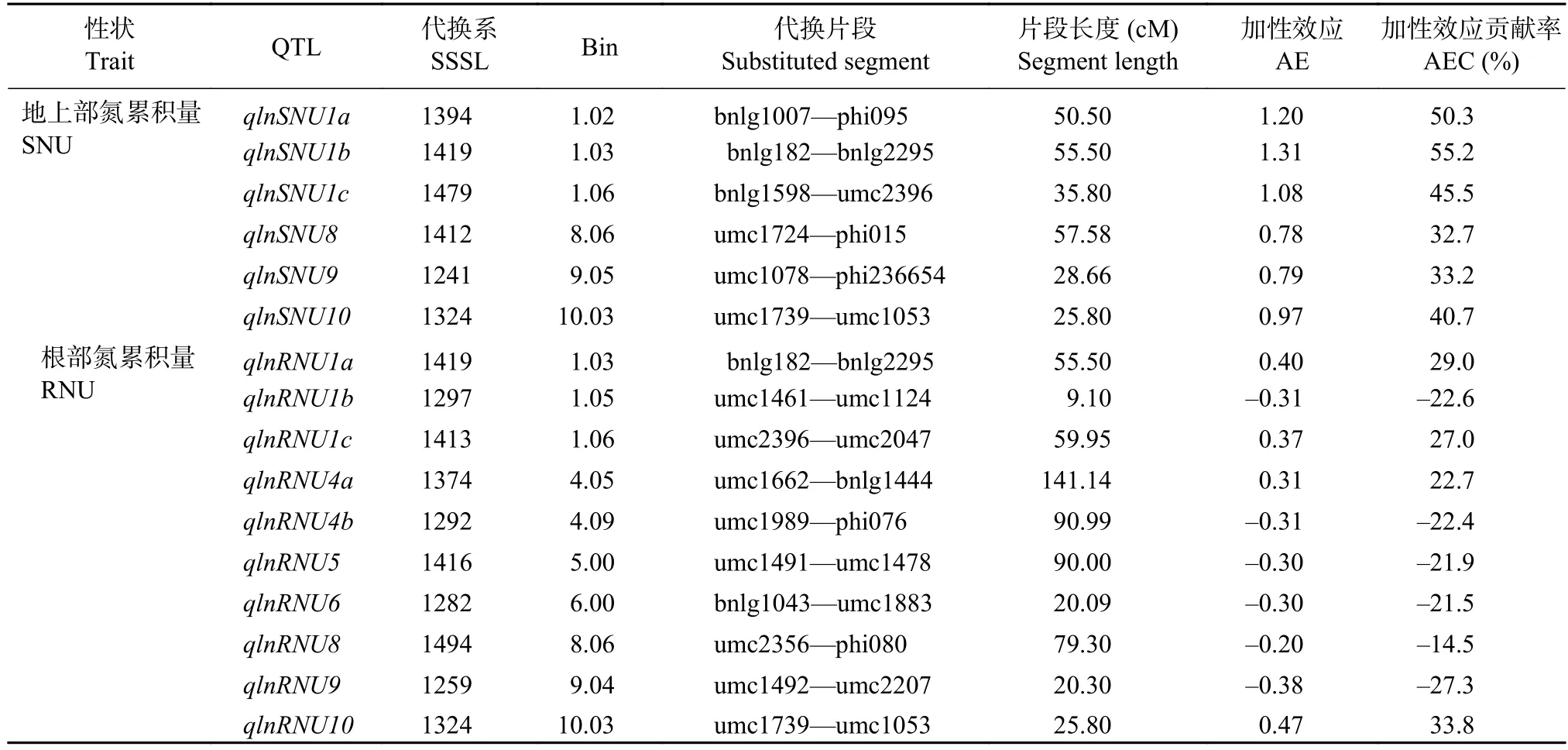
表9 低氮条件下苗期玉米植株氮累积量 QTL 分析Table 9 QTL location of the nitrogen contents in the SSSL population under the low nitrogen condition
本研究在低氮条件下共检测到85个根性状相关QTL,在第1染色体bnlg182—bnlg2295(bin1.04)和umc1013—umc2047(bin1.08)区间不仅检测到低氮下根系形态相关QTL,而且同时检测到低氮下生物量和氮吸收量的QTL,说明低氮胁迫下植株氮吸收量与根系形态紧密联系。其中,第1染色体bnlg182—bnlg2295(bin1.04)区间在Burton等[27]、Song等[11]的研究中均检测到根系形态相关QTL。Li等[14]利用重组自交系,设置高氮和低氮水平,通过大田试验和水培实验对氮利用效率(NUE)和根系构型(RSA)相关性状的QTL进行定位,共检测到331个QTL。该研究发现氮吸收效率与根系构型之间存在显著的表型相关性。研究表明大约70%的NUE相关QTL簇与根系构型QTL簇重叠,这表明根系构型与氮利用率相关性状之间有显著的遗传学关系,可以通过分子标记筛选优异的根系构型来提高玉米的氮利用效率[14]。本研究结果也显示,除了极个别的代换区间仅单独检测到氮累积量的QTL,其他绝大部分植株氮吸收量QTL都与根形态相关QTL成簇存在(图2)。此外,Li等[14]的研究发现有5个重要的QTL簇对玉米获得大的根系和更高的氮吸收效率有利,其中一个QTL簇位于染色体区间bin1.04。这一结果与我们发现的QTL簇区间bnlg182—bnlg2295(bin1.04)有重叠,并且在这个QTL区间同时检测到低氮下植株氮吸收量的QTL,表明该区间很有可能包含有控制玉米氮高效的主效QTL位点,进一步对包含该区段的代换系1419进行精细定位可能获得氮高效候选基因。Gallais等[9]通过大田和水培相结合的方法对玉米花后氮素吸收、氮再利用、籽粒产量、叶片硝酸还原酶、谷氨酰胺合成酶活性等性状进行了QTL定位,发现三个染色体位置上检测到产量QTL、氮再利用QTL、GS活性QTL和一个编码胞质GS的基因具有一致性,并且位于第5染色体的GS位点能够部分解释玉米氮利用效率的表型变异。同时,该研究定位的QTL簇有些与本研究重要QTL簇位置接近,例如,Gallais等[9]在第1染色体的顶端区间检测到茎秆氮再利用QTL、GDH和GS酶活性相关QTL,而我们的结果显示在同一区段检测到总根长、植株生物量等QTL;在位于第5染色体umc1587—umc1680(代换系1328的代换区间)的QTL簇接近的位置,Gallais等[9]定位到叶片硝酸盐含量、GS和NR活性QTL;在bin1.08位置(umc1013—umc2047区间,代换系1314)Gallais等检测到控制整株氮再利用的QTL。此外,齐欢欢等[32]研究发现第1染色体的umc2217—umc1770区段与穗长、穗位高和穗行数有关,这一区间与我们的QTL簇bnlg182—bnlg2295(代换系1419)部分重叠。这说明本研究所定位到的低氮特异QTL簇可能在玉米低氮条件下氮素高效吸收中起重要作用,与氮高效吸收密切相关。此外,在一些QTL区间同时检测到多个高氮和低氮QTL,且成簇排列,这些QTL不受氮水平特异诱导。例如第3染色体bnlg144—umc1425区间,第7染色体umc1241—umc1642区间,第8染色体umc1724—phi080区间(图2)。这些不同环境下检测到的QTL簇表明玉米在不同的氮环境下具有不同的代谢机制。高、低氮特异的QTL簇对我们研究玉米适应氮胁迫具有重要意义,有利于挖掘不同氮水平下的氮高效基因,更有针对性地开展玉米氮高效育种。

图2 不同氮水平下玉米苗期根系形态及氮累积量 QTL 在染色体上的分布Fig. 2 Position of the QTLs for maize root morphology and N uptake at the seedling stage under low and high N levels
4 结论
不同氮水平下,玉米的根系形态存在显著差异,对高、低氮条件下检测到的特异QTL进行分析有助于解析不同氮水平下玉米高效吸收氮素的遗传机制。本研究在染色体区段bnlg182—bnlg2295 (bin1.04,代换系1419)、umc1013—umc2047 (bin1.08,代换系1314)区间检测到多个低氮特异的QTL,在phi001—bnlg182(bin1.03,代换系1428)和umc1122—umc2396(bin1.06,代换系1376)等区间检测到高氮条件下特异的QTL。这些QTL区间同时包含根系形态QTL和氮吸收量QTL,并且在前人的研究中均有玉米氮效率或根系形态相关QTL检测到,说明这些区间在玉米氮高效吸收中可能起重要作用,后期会对包含该区段的代换系进行精细定位,获得候选基因。
[1]Mi G,Chen F,Zhang F.Physiological and genetic mechanisms for nitrogen use efficiency in maize[J].Journal of Crop Science Biotechnology,2007,10(2):57–63.
[2]Xu G,Fan X,Miller AJ.Plant nitrogen assimilation and use efficiency[J].Annual Review of Plant Biology,2012,63:153–182.
[3]DeBruin J,Messina CD,Munaro E,et al.N distribution in maize plant as amarker for grain yield and limits on its remobilization after flowering[J].Plant Breeding,2013,132(5):500–505.
[4]Mackay AD,Barber SA.Effect of nitrogen on root growth of two corn genotypes in the field[J].Agronomy Journal,1986,78(4): 699–708.
[5]Coque M,Martin A,Veyrieras JB,et al.Genetic variation for N-remobilization and post-silking N-uptake in aset of maize recombinant inbred lines.3.QTL detection and coincidences[J]. Theoretical and Applied Genetics,2008,117(5):729–747.
[6]Mu X,Chen F,Wu Q,et al.Genetic improvement of root growth increases maize yield via enhanced post-silking nitrogen uptake[J]. European Journal of Agronomy,2015,63:55–61.
[7]Saengwilai P,Tian X,Lynch JP.Low crown root number enhances nitrogen acquisition from low-nitrogen soils in maize[J].Plant Physiology,2014,166(2):581–589.
[8]Lynch JP.Steep,cheap and deep:an ideotype to optimize water and N acquisition by maize root systems[J].Annals of Botany,2013, 112(2):347–357.
[9]Gallais A,Hirel B.An approach to the genetics of nitrogen use efficiency in maize[J].Journal of Experimental Botany,2004, 55(396):295–306.
[10]Hochholdinger F,Tuberosa R.Genetic and genomic dissection of maize root development and architecture[J].Current Opinion of Plant Biology,2009,12(2):172–177.
[11]Song W,Wang B,Hauck AL,et al.Genetic dissection of maize seedling root system architecture traits using an ultra-high density bin-map and arecombinant inbred line population[J].Journal of Integrate Plant Biology,2016,58(3):266–279.
[12]Lebreton C,Lazić-JančićV,Steed A,et al.Identification of QTL for drought responses in maize and their use in testing causal relationships between traits[J].Journal of Experimental Botany,1995, 46:853–865.
[13]Zhu J,Kaeppler SM,Lynch JP.Mapping of QTLs for lateral root branching and length in maize(Zea mays L.)under differential phosphorus supply[J].Theoretical and Applied Genetics,2005, 111(4):688–695.
[14]Li P,Chen F,Cai H,et al.A genetic relationship between nitrogen use efficiency and seedling root traits in maize as revealed by QTL analysis[J].Journal of Experimental Botany,2015,66(11): 3175–3188.
[15]毛克举,李卫华,付志远,等.玉米自交系许178背景的综3染色体单片段代换系的构建[J].河南农业大学学报,2013,47(1):6–9,15. Mao KJ,Li WH,Fu Zh Y,et al.Development of aset of signal segment substitution lines of an elite inbred line Zong3on the genetic background Xu178in maize(Zea mays L.)[J].Journal of Henan Agriculture University,2013,47(1):6–9,15.
[16]刘宗华,王春丽,汤继华,等.氮胁迫对不同玉米自交系若干农艺性状和产量的影响[J].河南农业大学学报,2006,40(6):573–577. Liu ZH,Wang CL,Tang JH,et al.Effect of low nitrogen stress on several agronomy characters and grain yield of different maize inbreds[J].Journal of Henan Agriculture University,2006,40(6): 573–577.
[17]田秋英.根系形态在玉米高效获取氮素中的作用及其生理调节机制[D].北京:中国农业大学博士学位论文,2005. Tian QY.Role of root morphology in efficient nitrogen acquisition in maize and its physiological regulation mechanism[D].Beijing: PhD Dissertation of China Agricultural University,2005.
[18]刘冠明,李文涛,曾瑞珍,等.水稻单片段代换系代换片段的QTL鉴定[J].遗传学报,2004,12:1395–1400. Liu GM,Li WT,Zeng RZ,et al.Identification of QTLs on substituted segments in signal segment substitution lines of rice[J]. Acta Genetica Sinica,2004,12:1395–1400.
[19]Eshed Y,Zamir D.An introgression line population of Lycopersicon Pennellii in the cultivated tomato enables the identification and fine mapping of yield-associated QTL[J].Genetics,1995,141(3): 1147–1162.
[20]McCouch SR,Cho YG,Yano M.Report on QTL nomenclature[J]. Rice Genetics Newsletter,1997,14:11–13.
[21]Paterson AH,DeVerna JW,Lanini B,et al.Fine mapping of quantitative trait loci using selected overlapping recombinant chromosomes,in an interspecies cross of tomato[J].Genetics,1990, 124(3):735–742.
[22]Forde BG.Nitrogen signaling pathways shaping root system architecture:an update[J].Current Opinion of Plant Biology,2014, 21:30–36.
[23]Mi G,Chen F,Wu Q,et al.Ideotype root architecture for efficientnitrogen acquisition by maize in intensive cropping systems[J]. Science China(Life Sciences),2010,53(12):1369–1373.
[24]李卓坤,彭涛,张卫东,等.利用“永久F_2”群体进行小麦幼苗根系性状QTL分析[J].作物学报,2010,36(3):442–448. Li ZK,Peng T,Zhang WD,et al.Analysis of QTLs for root traits at seedling stage using an"Immortalized F2"population of wheat[J]. Acta Agronomic Sinica,2010,36(3):442–448.
[25]Cai H,Chu Q,Yuan L,et al.Identification of quantitative trait loci for leaf area and chlorophyll content in maize(Zea mays)under low nitrogen and low phosphorus supply[J].Molecular Breeding,2012, 30(7):251–266.
[26]Liu Q,Qin J,Li T,et al.Fine mapping and candidate gene analysis of qSTL3,a stigma length-conditioning locus in rice(Oryza sativa L.)[J].PloS One,2015,10:e0127938.
[27]Burton AL,Johnson JM,Foerster JM,et al.QTL mapping and phenotypic variation for root architectural traits in maize(Zea mays L.)[J].Theoretical and Applied Genetics,2014,127(11):2293–2311.
[28]Salvi S,Giuliani S,Ricciolini C,et al.Two major quantitative trait loci controlling the number of seminal roots in maize co-map with the root developmental genes rtcs and rum1[J].Journal of Experimental Botany,2016,67(4):1149–1159.
[29]武良,张卫峰,陈新平,等.中国农田氮肥投入和生产效率[J].中国土壤与肥料,2016,(4):76–83. Wu L,Zhang WF,Chen XP,et al.Nitrogen fertilizer input and nitrogen use efficiency in Chinese farmland[J].Soils and Fertilizers Sciences in China,2016(4):76–83.
[30]米国华,陈范骏,春亮,等.玉米氮高效品种的生物学特征[J].植物营养与肥料学报,2007,13(1):155–159. Mi GH,Chen FJ,Chun L,et al.Biological characteristics of nitrogen efficient maize genotypes[J].Plant Nutrition and Fertilizer Science,2007,13(1):155–159.
[31]米国华,陈范骏,吴秋平,等.玉米高效吸收氮素的理想根构型[J].中国科学(生命科学),2010,40(12):1112–1116. Mi GH,Chen FJ,Wu QP,et al.Ideotype root architecture for efficient nitrogen acquisition by maize in intensive cropping systems[J].Science China(Life Sciences),2010,40(12):1112–1116.
[32]齐欢欢,段利超,胡伟,等.利用导入系群体对玉米产量及产量相关性状进行定位分析[J].玉米科学,2013,21(4):24–27,32. Qi HH,Duan LC,Hu W,et al.Identification of signification loci for yield and yield-related traits in maize with introgression lines[J]. Journal of Maize Science,2013,21(4):24–27,32.
Mapping of QTLs for root morphology and nitrogen uptake of maize under different nitrogen conditions
WANG Yi1,2,3,TANG Ji-hua3,FU Yan-lei1,XU Heng3,TAN Jin-fang1,2,HAN Yan-lai1,2,3*
(1 College of Resources and Environment, Henan Agricultural University, Zhengzhou 450002, China; 2 Collaborative Innovation Center of Henan Grain Crops, Zhengzhou 450002, China; 3 State Key Laboratory of Wheat and Maize Crop Science, Zhengzhou 450002, China)
【Objectives】There is astrong relationship between maize root morphology and nitrogen uptake capacity.In this study,QTLs for maize root morphology and plant nitrogen uptake were identified using single segment substitution lines(SSSLs)to provide support for fine mapping and cloning of major QTLs controlling maize root morphology and nitrogen uptake.【Methods】150maize SSSLs derived from across between aN-efficient inbred line Xu178and aN-inefficient inbred line Zong3were used for solution culture.Ca(NO3)2was used as nitrogen source and high nitrogen level(4mmol/L NO3–)and low nitrogen level(0.05mmol/L NO3–)were supplied for each line,and each Nlevel had six seedlings.After20days culture,seedlings were harvested,and the biomass and nitrogen contents of shoots and roots were analyzed respectively.Total root length(TRL),root surface area(RSA),root volume(RV),root average diameter(RAD)and root tip numbers(RTN)were determined from the root images using WinRHIZO.According to the results of the T-test of the phenotype values of SSSL and Xu178,QTLs for each trait were mapped in the SSR genetic linkage map when Pvalue was less than 0.001.【Results】Under the high Nlevel,all root traits were significantly correlated with each other except that between RAD and either TRL or RTN,and the plant nitrogen uptake was significantly correlated with all the root morphology related traits.Under the low Nlevel,all the root morphology traits were strongly correlated with plant nitrogen uptake except for RAD,and the RSA showed the most significant correlation. Under the high Nlevel,102QTLs were detected including40QTLs for root morphology traits,34QTLs for plant biomass and28QTLs for plant nitrogen uptake.Under the low Nlevel,85QTLs were detected including 47QTLs for root morphology traits,22QTLs for plant biomass and16QTLs for plant nitrogen uptake.Most of the QTLs for Nuptake coincided in cluster with those for root morphology.Several QTLs for root morphology and nitrogen uptake were mapped in the same substituted segment region.Under the high Ncondition,five high N-specific QTLs clusters containing several root morphology traits and nitrogen uptake were detected in SSSL lines of1428,1376,1282,1266and1473.The single QTL additive effect contribution was from–43%to84%. Moreover,several QTLs for root morphology and nitrogen uptake were identified in the SSSL lines of1419and 1314under the LN condition,with the additive effect contribution from–32%to55%.【Conclusions】In the present study,several LN-specific QTLs were mapped in substituted segment of bnlg182–bnlg2295in line 1419and umc1013–umc2047in line1314,in which some QTLs related to nitrogen use efficiency of maize were detected in previous researches.It was indicated that there were some major QTLs for maize root morphology and plant nitrogen uptake located in the two regions which would play important role in maize nitrogen uptake efficiency.The present research serves as abasis for the major QTLs fine-mapping and candidate genes cloning.
maize;SSSLs;root morphology;QTL;nitrogen deficiency
2016–12–13接受日期:2017–02–11
国家自然科学基金项目(31601812);河南农业大学科技创新基金项目(KJCX2015A16)资助。
王祎(1983—),女,湖北宜城人,博士,讲师,主要从事植物营养生理和遗传研究。wangyi19830705@163.com
*通信作者E-mail:hyanlai@126.com
